需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
脂质囊泡介导的亲和层析法,使用磁性细胞分选(LIMACS):一种新的方法来分析蛋白质 - 脂质相互作用
摘要
为了测试我们使用Macs和Annexin V的共轭磁珠和目标脂质和Annexin V的具有约束力的磷脂酰丝氨酸合成脂质囊泡与目标脂质的一种蛋白质的相互作用。绑定到目标脂质蛋白质纯化和分析后,从珠洗脱。
摘要
脂蛋白质相互作用的分析是困难的,因为嵌在细胞膜的脂质,因此,无法以最净化程序。血脂作为一种替代方法,可以在平坦的表面涂层,为脂质ELISA法和等离子体共振光谱。然而,表面涂层血脂不形成微区结构,这可能是重要的脂质绑定属性。此外,这些方法不容许较大数额的蛋白结合他们的目标血脂净化。
为了克服这些限制测试脂蛋白质相互作用和净化脂质结合蛋白,我们开发了一种新的方法称为脂质囊泡介导的亲和层析法,使用磁激活细胞分选(LIMACS)。在此方法中,脂质囊泡锚脂质膜联蛋白V的Mac与目标脂质和磷脂酰准备。磷脂是一个无处不在的细胞膜磷脂,高亲和力的蛋白膜联蛋白V。使用Annexin V的共轭含有的磷脂脂质囊泡结合磁珠磁珠。当脂质囊泡与细胞培养裂解的蛋白结合的目标脂质也将受到约束珠,可以共同使用Mac纯化。这种方法也可以用来测试一个目标脂质蛋白复合物结合,如果重组蛋白重组。
我们已经用这种方法,以显示与鞘脂酰胺和合作净化前列腺凋亡反应4(4杆),蛋白结合酰胺相关aPKC非典型蛋白激酶C(aPKC)的相互作用。我们也使用这种方法,重组的重组aPKC神经酰胺与细胞极性相关的蛋白质Par6和Cdc42复杂。由于脂质囊泡可以与各种sphingo或磷脂准备,LIMACS脂质 - 蛋白相互作用密切类似于细胞膜的脂质环境提供了通用的测试。其他脂质蛋白复合物可以识别使用的脂质结合蛋白与脂质囊泡的合作纯化的蛋白质组学分析。
研究方案
1。简介
在我们的实验室开发的脂质囊泡介导的亲和层析法,使用磁激活细胞分选(LIMACS)技术隔离酰胺相关的蛋白质复合物1-3。本来,脂质囊泡酰胺和磷脂酰丝氨酸,允许使用磁粒子标记的膜联蛋白V(高度仿射磷脂酰丝氨酸)隔离囊泡及其相关蛋白的Mac。我们已经使用的LIMACS 技术,在体外再造一个酰胺相关的极性复杂,从细胞神经酰胺结合蛋白的分离裂解液3。 LIMACS可以修改囊泡(例如,糖脂specifc凝集素或脂质抗体)的隔离使用其他互动的合作伙伴。
2。实验步骤
脂质囊泡的制备和aPKCBinding分析
- 脂质囊泡获得干混合物的摩尔量的磷脂酰丝氨酸(105微克)和C16 -神经酰胺(85微克)以下程序修改为大脂质体的制备1,4-7。
- 脂质混合物,然后再悬浮和超声在100μL的50 mM的Tris /盐酸(pH值7.5)和150毫米氯化钠组成的囊泡缓冲区1小时。
- 加入300辅以0.1毫米MnCl 2囊泡缓冲液后,样品离心20分钟12,000μ 克在4 ° C
- 颗粒(大脂质囊泡)是悬浮于100μL囊泡缓冲区,并在37℃1小时Vybrant CM - DII与1 nmol孵育° C至可视化磁珠分离后的囊泡分数。 Vybrant CM - DII是一种红色荧光染料,特别纳入到脂膜。
- 洗涤剂无细胞裂解液,超声/ 300低渗缓冲离心去除膜碎片(10毫米的Tris / HCL(pH值7.0),蛋白酶和磷酸酶抑制剂)液中的细胞同质化的准备。应在1小时10 XG的离心步骤,以避免污染的细胞裂解液中含有内源性膜磷脂酰。
- 清除裂解物被添加到脂质囊泡悬挂,混合物在4 ° C孵育2 h
- 反应混合物20μL20X Annexin V的结合缓冲液和50μL含有磁珠标记Annexin V的解决方案的补充,其次是潜伏期为1小时在4 ° C
- MACS是根据制造商的协议(美天旎生物技术公司)。脂质囊泡的存在和数量是由监察Vybrant CM - DII通过流量和洗脱用酶标仪荧光读者分数荧光。
- 水泡脂量和荧光强度之间的线性相关囊泡约束Vybrant CM - DII是由高性能定量薄层色谱法(薄层)应用于膜联蛋白V的Mac脂混合物验证。
- aPKC或其他蛋白质的结合反应的特异性神经酰胺/磷脂酰丝氨酸的囊泡竞争,使用1微克的反PKCζ兔多克隆抗体孵育1 h后的细胞裂解液在4 ° C到孵化前的抗体检测验证脂质囊泡。
- SDS - PAGE电泳和免疫印迹分析蛋白结合的Mac洗脱液酰胺/磷脂酰丝氨酸的囊泡。
在体外脂质蛋白的极性复杂
- 在体外重组脂质蛋白极性复杂LIMACS程序后,在上一节所述。在简短,磷脂酰丝氨酸(420微克)和C16 -神经酰胺(107微克)是有机溶剂干燥。
- 干血脂悬浮下超声在500囊泡缓冲液(50 mM的三/盐酸,pH值7.5; 150 mM氯化钠)。
- 五μL10 mM的氯化锰,1μLVybrant CM - DII,和500PKCζ吴(重组人)和反应混合物孵育60分钟undergentle鼓动在4 ° C。
- 60分钟在4 ° C离心Vybrant CM - DII染色的磷脂酰丝氨酸/酰胺囊泡回收12000 XG
- 颗粒(粉红色),悬浮于100μLTris缓冲液,并辅以γS- GTP(100μM),国内生产总值(1毫米),GST - Par6(100毫微克),或(500纳克)GST - Cdc42的,并进一步培养3在4 h ° C( 任何其他利益的重组蛋白结合,这里可以使用) 。
- Annexin V的缓冲液(5μL20倍原液)和Annexin V的共轭磁珠(50μL)的增加和反应混合物轻轻摇动下孵育另一个30分钟,4 ° C。
- 膜联蛋白V - MACS执行以下供应商的协议,如前所述。
- 洗脱分数(1毫升)补充10微克的纯卵清蛋白沉淀援助。韦塞尔- Flugge降水集中的蛋白质和SDS-PAGE/immunoblotting如先前所描述的8分析。
- 量化Vybrant CM - DII(粉红色)在有机相(氯仿/甲醇)韦塞尔Flugge沉淀反应检测洗脱脂质囊泡的数量。分析蛋白质的量是等量的脂质囊泡归。
3。结果
LIMACSPKCζ- EGFP和神经酰胺结合域C20ζ- EGFP的净化
一个洗涤剂无裂解MDCK细胞表达全长PKCζC端与绿色荧光蛋白(FLζEGFP)基因或神经酰胺在PKCζ(C20ζ- EGFP)C -末端结合域的培养与磷脂酰丝氨酸/酰胺囊泡描述了实验步骤。 MACS柱洗脱后,用免疫印迹和PKCζ和EGFP的检测洗脱蛋白2抗体蛋白进行了分析。
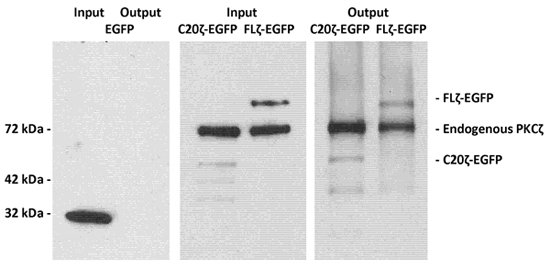
图1。LIMACS EGFP -标记PKCζ和C -末端片段C20ζ使用磷脂酰丝氨酸/酰胺囊泡。
MDCK细胞表达EGFP(作为一个不具约束力的的控制),全长PKCζ- EGFP,或神经酰胺结合,C -末端片段C20ζ- EGFP的洗涤剂裂解液孵育实验程序部分所述与磷脂酰丝氨酸/酰胺囊泡。使用LIMACS后,SDS样品缓冲液洗脱蛋白,并用SDS - PAGE分析和免疫印迹。左侧面板显示,EGFP的没有约束力的V -膜联蛋白磁珠保留水疱。中间和右边的面板显示,全长PKCζ- EGFP和C20ζ- EGFP的保留绑定酰胺。
讨论
要测试的脂质和蛋白之间的相互作用,是阻碍嵌入细胞膜的脂质。细胞膜由一些脂类和蛋白质的混合物,它是在组织脂质微区或木筏。因此,微区和蛋白质的合作,净化不能明确区分,如果一种蛋白质直接结合到脂质,或仅仅是在微区结构丰富。使用涂层表面上,如脂质酶联免疫吸附或等离子体共振光谱的定义血脂的其他方法可以检测其结合蛋白的一个特定的脂质相互作用..然而,在一个有?...
披露声明
致谢
这项工作是由美国国立卫生研究院拨款R01NS046835和R01AG034389,三月优生优育基金会授予6FY08 - 322的支持。特别感谢你致力于夫人埃莉诺布朗(美天旎生物技术,赤褐色,CA),极大地帮助她的洞察力到MACS科技。美天旎慷慨地提供实验示范使用,不需任何费用的材料。我也很感谢博士王广沪(医学院格鲁吉亚/格鲁吉亚卫生科学大学,奥古斯塔,佐治亚州)表达细胞株产生的PKCζ。也承认在格鲁吉亚/佐治亚州健康科学大学(下林美博士的董事)医学院分子医学研究所的支持。
材料
Annexin V的共轭磁珠和Macs和微观minicolumns提供了由美天旎生物技术公司(赤褐色,CA)。血脂最高纯度和阿凡提极性脂(雪花石膏,AL)获得。
参考文献
- Wang, G. Direct binding to ceramide activates protein kinase Czeta before the formation of a pro-apoptotic complex with PAR-4 in differentiating stem cells. J Biol Chem. 280, 26415-26424 (2005).
- Wang, G., Krishnamurthy, K., Umapathy, N. S., Verin, A. D., Bieberich, E. The carboxyl-terminal domain of atypical protein kinase Czeta binds to ceramide and regulates junction formation in epithelial cells. J Biol Chem. 284, 14469-14475 (2008).
- Chalfant, C. E. De novo ceramide regulates the alternative splicing of caspase 9 and Bcl-x in A549 lung adenocarcinoma cells. Dependence on protein phosphatase-1. J Biol Chem. 277, 12587-12595 (2002).
- Simon, C. G., Holloway, P. W., Gear, A. R. Exchange of C(16)-ceramide between phospholipid vesicles. Biochemistry. 38, 14676-14682 (1999).
- Goni, F. M., Contreras, F. X., Montes, L. R., Sot, J., Alonso, A. Biophysics (and sociology) of ceramides. Biochem Soc Symp. , 177-188 (2005).
- Kumagai, K. CERT mediates intermembrane transfer of various molecular species of ceramides. J Biol Chem. 280, 6488-6495 (2005).
- Wessel, D., Flugge, U. I. A method for the quantitative recovery of protein in dilute solution in the presence of detergents and lipids. Anal Biochem. 138, 141-143 (1984).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。