このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
磁気活性化細胞選別(LIMACS)を使用して、脂質小胞を介したアフィニティクロマトグラフィー:タンパク質脂質相互作用を解析する新手法
要約
そのターゲットの脂質とタンパク質の相互作用をテストするために我々は、MACSとターゲットの脂質とアネキシンV結合ホスファチジルセリンから合成されたアネキシンV -共役磁気ビーズと脂質小胞を使用。ターゲットの脂質に結合したタンパク質は、共同で精製し、ビーズから溶出した後に分析されます。
要約
脂質はほとんどの精製操作にアクセスできない、したがって、細胞膜に埋め込まれているため、脂質タンパク質の相互作用の解析は困難です。別の方法として、脂質は脂質ELISAとプラズモン共鳴分光法のために使われる平らな表面上に塗布することができる。しかし、表面コーティングの脂質は、脂質結合特性のために重要であるかもしれない、ミクロドメイン構造を形成しない。さらに、これらのメソッドは、それらの標的脂質に結合する蛋白質の大量の精製のために許可されていません。
脂質のタンパク質相互作用をテストするのこれらの限界を克服し、脂質結合タンパク質を精製するために、我々は磁気活性化細胞選別(LIMACS)を使用して、脂質小胞を介したアフィニティークロマトグラフィーと呼ばれる新しい方法を開発した。この方法では、脂質小胞は、アネキシンV MACSのためのアンカーの脂質のようなターゲットの脂質、ホスファチジルセリンを用いて調製されています。ホスファチジルセリンはタンパク質アネキシンに高い親和性を示すVのホスファチジルセリン含有脂質の小胞は、磁性ビーズに結合するアネキシンVに結合した磁気ビーズを用いたユビキタス細胞膜のリン脂質である。脂質の小胞がライセート、細胞とインキュベートされている場合、ターゲット脂質への結合タンパク質はまた、ビーズに結合され、MACSを用いて共同で精製することができる。この方法は、組換えタンパク質の再構成する場合、対象脂質に結合するタンパク質複合体をテストするために使用することができます。
我々は、スフィンゴ脂質セラミドとし、共同浄化前立腺アポトーシス応答4(PAR - 4)、セラミド関連aPKCの結合タンパク質への非定型PKC(aPKC)との相互作用を表示するには、このメソッドを使用している。我々はまた、細胞極性関連タンパク質Par6およびCdc42との組換えaPKCのセラミド関連複合体の再構築のためにこのメソッドを使用している。脂質小胞がsphingo -またはリン脂質のさまざまな準備ができるので、LIMACSはその細胞膜の酷似脂質環境における脂質 - タンパク質相互作用のための多目的なテストを提供しています。追加の脂質蛋白質複合体は、脂質結合タンパク質、脂質小胞との共精製のプロテオミクス解析を用いて同定することができる。
プロトコル
1。はじめ
磁気活性化セルソーティング(LIMACS)技法を用いて脂質小胞を媒介としたアフィニティークロマトグラフィーは、セラミド結合蛋白質複合体1-3を分離するために我々の研究室で開発されました。もともと、脂質の小胞は小胞とその関連蛋白質を分離するために磁性粒子標識アネキシンVを(ホスファチジルセリンに非常にアフィン)を使用してMACSに許可されるセラミド、ホスファチジルセリン、から成っていた。セラミド関連極性複合体と細胞のセラミド結合タンパク質の分離の in vitro再構成に 3を溶解液のために我々はLIMACS技術を使用している。 LIMACSは、小胞の分離(例えば、糖脂質- specifcレクチンまたは脂質抗体)のために他の相互作用パートナーを使用して変更することができます。
2。実験手順
脂質小胞とaPKCBindingアッセイの準備
- 脂質小胞は、ホスファチジルセリン(105μg)を、大規模なリポソーム調製1,4-7のために修飾された手順に従ってC16 -セラミド(85μg)の等モル量の乾燥混合物から得られる。
- 脂質の混合物はその後、50mMトリス/ HCl(pH7.5)及び150mMのNaClで構成される小胞のバッファー100μlの中で1時間再懸濁し、超音波処理されています。
- 0.1mMのMnCl 2を補充した小胞のバッファー300μlを添加した後、試料を4時20分、12,000μg を ℃で遠心分離されています
- ペレットは、(大脂質小胞)° C MACS分離した後、小胞の割合を視覚化する小胞のバッファー100μlに再懸濁し、37℃で1時間Vybrant CM - DII、1 nmolのでインキュベートする。 Vybrant CM - DIIは、特に脂質膜に組み込んだ赤色蛍光色素です。
- 界面活性剤を含まない細胞溶解液を遠心分離によって膜破片の除去に続いて低張緩衝液(プロテアーゼ及びホスファターゼ阻害剤との10mMトリス/ HCl(pH7.0)で)を300μlの超音波/細胞の均質化によって調製される。 1時間、100,000 × gで遠心分離工程は、ホスファチジルセリンを含む内在性の膜と細胞溶解液の汚染を避けるために追加する必要があります。
- 清澄化ライセートは、脂質のベシクル懸濁液に添加され、そして混合物を4℃で2時間インキュベートする
- 反応混合物を20倍のアネキシンV結合バッファーとアネキシンVに結合した磁気ビーズを含む溶液50μlを20μlと補足されては、4℃で1時間インキュベートした
- MACSは、製造業者の(ミルテニーバイオテク社)プロトコルに従って行われます。脂質小胞の存在と量は、マイクロプレート蛍光リーダーを用いてフロースルーと溶出分画のVybrant CM - DIIの蛍光をモニターすることによって決定されます。
- 水疱性脂質の量と小胞に結合Vybrant CM - DIIの蛍光強度との間の線形相関は、アネキシンV -ベースのMacに適用される脂質の混合物の定量的な高性能薄層クロマトグラフィー(HPTLC)によって検証されます。
- セラミド/ホスファチジルセリン小胞にaPKCまたは他のタンパク質の結合反応の特異性は、℃のインキュベーションの前に4℃で1時間細胞ライセートをインキュベートする抗PKCζウサギポリクローナル抗体1μgを用いて抗体の競合アッセイによって検証され脂質小胞。
- MACS溶出液中のセラミド/ホスファチジルセリン小胞への結合タンパク質は、SDS - PAGEとイムノブロッティングによって分析されます。
体外脂質-タンパク質極性複雑で
- 脂質-タンパク質の極性複合体の in vitro再構成の前のセクションで説明したようにLIMACSの手順に従って実行されます。簡単に言えば、ホスファチジルセリン(420μg)をとC16 -セラミドは、(107μg)を有機溶剤から乾燥させる。
- 乾燥脂質は小胞の緩衝液500μl(; 150mMのNaCl 50mMトリス/ HCl、pH7.5)に超音波処理下で再懸濁する。
- 10 mMのMnCl2、Vybrant CM - DIIを1μl、およびPKCζの500ngの(ヒト組み換え)の5μlを加え、反応混合物を4℃で60分間undergentleの攪拌をインキュベートする℃に
- Vybrant CM - DIIステンドホスファチジルセリン/セラミド小胞は4℃で60分間℃、12,000 xgで遠心分離によって回収されています
- ペレットは、(ピンク)100μlのTris緩衝液に再懸濁し、γS- GTP(100μM)を補充し、GDP(1 mM)を、GST - Par6(100 ng)を、またはGST - Cdc42と(500 ngの)と、さらに3インキュベートする4にあるh ° C( 目的の組換えタンパク質の他の組み合わせをここで使用することができます )。
- アネキシンV -バッファー(20倍ストック溶液を5μl)とアネキシンVが結合した磁気ビーズ(50μl)を加え、反応混合物を4℃でさらに30分間℃で穏やかに撹拌しながらインキュベートする。
- アネキシンV - MACSは、前述のように供給者のプロトコルに従って行われます。
- 溶出画分(1ml)を沈殿助剤としての純粋な卵白アルブミン10μgを補足されています。タンパク質は、ヴェッセル-フリューゲェ沈殿により濃縮し、以前に8を説明するようにSDS-PAGE/immunoblottingによって分析されます。
- 溶出された脂質小胞の量は、ヴェッセルフリューゲェの沈殿反応の有機(クロロホルム/メタノール)相におけるVybrant CM - DII(ピンク)の検出によって定量化される。分析されたタンパク質の量は、脂質小胞の同量で正規化されます。
3。結果
LIMACSのPKCζ- EGFPの精製とセラミド結合ドメインC20ζ- EGFP
界面活性剤を含まないPKCζC -末端に緑色蛍光タンパク質(FLζ- EGFP)またはPKCζ(C20ζ- EGFP)のC末端におけるセラミド結合ドメインにリンクされている全長を発現しているMDCK細胞のライセートは、ホスファチジルセリン/セラミド胞などと一緒にインキュベートした実験手順で説明しています。 MACSカラムの溶出後、タンパク質は、イムノブロットおよび溶出したタンパク質2の検出のためのPKCζとEGFPに対する抗体を用いて解析した。
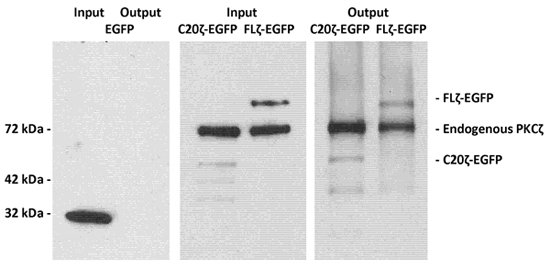
の図1。LIMACS EGFP標識PKCζとそのC -末端断片C20ζホスファチジルセリン/セラミド小胞を用いた。
実験手順の項で説明するようにEGFP(非結合制御など)、全長PKCζ- EGFP、またはセラミド結合、C -末端断片C20ζ- EGFPを発現するMDCK細胞の界面活性剤を含まない溶解物は、ホスファチジルセリン/セラミドの小胞とインキュベートした。 。 LIMACSを使用した後、タンパク質をSDSサンプルバッファーで溶出され、SDS - PAGEおよび免疫ブロッティングにより分析した。左側のパネルでは、EGFPは、アネキシンV -リンクされた磁気ビーズを保持小胞に結合していないことを示しています。真ん中と右のパネルはその完全な長さを示すPKCζ- EGFPとC20ζ- EGFPは、セラミドへの結合のために保持された。
ディスカッション
脂質とその結合タンパク質間の特異的な相互作用をテストすることは細胞膜の脂質から埋め込むことによって妨げられている。細胞膜には、いくつかの脂質とタンパク質の混合物から成り、それは、脂質ミクロドメインまたは筏で構成されています。蛋白質が直接脂質に結合するかだけミクロドメイン構造に富んでいるそのため、マイクロドメインとタンパク質の共精製は、はっきりと区別?...
開示事項
謝辞
この作品は、NIHの助成金R01NS046835とR01AG034389、そしてダイム助成6FY08 - 322の月によってサポートされていました。特別あなたがMACS技術に彼女の洞察力で大いに役立った夫人エレノアブラウン(Miltenyi Biotec社、オーバーン、カリフォルニア州)に捧げられる感謝。ミルテニーは、気前よく無料での実験のデモンストレーションのために使用される材料を提供しています。私はまた、細胞株の発現PKCζを生成博士広滬王(グルジア/グルジア健康科学大学の医科大学、オーガスタ、ジョージア州)に感謝しています。グルジア/グルジア健康科学大学(リン博士は梅の指揮下)の医科大学分子医学研究所のサポートも認められている。
資料
アネキシンV -共役磁気ビーズとMACSマイクロとminicolumnsはミルテニーバイオテク株式会社(オーバーン、カリフォルニア州)から提供された。すべての脂質は、最高純度のものであったとAvanti極性脂質(アラバスター、AL)から入手。
参考文献
- Wang, G. Direct binding to ceramide activates protein kinase Czeta before the formation of a pro-apoptotic complex with PAR-4 in differentiating stem cells. J Biol Chem. 280, 26415-26424 (2005).
- Wang, G., Krishnamurthy, K., Umapathy, N. S., Verin, A. D., Bieberich, E. The carboxyl-terminal domain of atypical protein kinase Czeta binds to ceramide and regulates junction formation in epithelial cells. J Biol Chem. 284, 14469-14475 (2008).
- Chalfant, C. E. De novo ceramide regulates the alternative splicing of caspase 9 and Bcl-x in A549 lung adenocarcinoma cells. Dependence on protein phosphatase-1. J Biol Chem. 277, 12587-12595 (2002).
- Simon, C. G., Holloway, P. W., Gear, A. R. Exchange of C(16)-ceramide between phospholipid vesicles. Biochemistry. 38, 14676-14682 (1999).
- Goni, F. M., Contreras, F. X., Montes, L. R., Sot, J., Alonso, A. Biophysics (and sociology) of ceramides. Biochem Soc Symp. , 177-188 (2005).
- Kumagai, K. CERT mediates intermembrane transfer of various molecular species of ceramides. J Biol Chem. 280, 6488-6495 (2005).
- Wessel, D., Flugge, U. I. A method for the quantitative recovery of protein in dilute solution in the presence of detergents and lipids. Anal Biochem. 138, 141-143 (1984).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved