Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Ensayo de inmunoprecipitación de la cromatina de los genes específicos de tejido utilizando etapa temprana de embriones de ratón
En este artículo
Resumen
Demostramos una inmunoprecipitación de cromatina (CHIP) para identificar las interacciones factor en genes específicos de tejido durante o después de la aparición de tejidos específicos de expresión génica en el tejido embrionario del ratón. Este protocolo debe ser ampliamente aplicable para el estudio de la activación de genes específicos de tejido, como ocurre durante el desarrollo embrionario normal.
Resumen
Inmunoprecipitación de cromatina (CHIP) es una poderosa herramienta para identificar las proteínas: las interacciones de la cromatina que se producen en el contexto de las células vivas 1-3. Esta técnica ha sido ampliamente explotada en las células de cultivo de tejidos, y en menor medida, en el tejido principal. La aplicación de chip en el tejido embrionario de roedores, especialmente en los momentos iniciales de desarrollo, se complica por la limitada cantidad de tejido y la heterogeneidad de las células y tipos de tejidos en el embrión. Aquí presentamos un método para llevar a cabo mediante un chip el día embrionario disociados 8.5 (E8.5) embrión. Cromatina esquilada de un solo embrión E8.5 se pueden dividir en un máximo de cinco alícuotas, lo que permite que el material suficiente para el investigador y controles para la investigación de proteínas específicas: las interacciones de la cromatina.
Hemos utilizado esta técnica para comenzar a documentar las proteínas: las interacciones de la cromatina durante la especificación de los tejidos específicos de los programas de expresión génica. La heterogeneidad de los tipos de células en un embrión necesariamente restringe la aplicación de esta técnica porque el resultado es la detección de proteínas: las interacciones de la cromatina sin distinguir si las interacciones ocurren en todos, un subconjunto de, o un solo tipo de células (s). Sin embargo, el análisis de genes específicos de tejido durante o después de la aparición de tejidos específicos de la expresión génica es posible por dos razones. En primer lugar, la inmunoprecipitación de los factores específicos de tejido necesariamente aislados de la cromatina del tipo de célula donde se expresa el factor. En segundo lugar, la inmunoprecipitación de coactivadores y las histonas que contiene modificaciones post-traduccionales que se asocian con la activación de genes sólo se encuentran en los genes y secuencias reguladoras de genes en el tipo de células donde el gen está siendo o ha sido activada. La técnica debe ser aplicable al estudio de la mayoría de los tejidos específicos de los eventos de activación genética.
En el ejemplo que se describe a continuación, se utilizó E8.5 y E9.5 embriones de ratón para examinar los factores de unión en un promotor del gen específico del músculo esquelético. Somitas, que son las precursoras de los tejidos que los músculos del esqueleto del tronco y las extremidades se forman, están presentes en E8.5-9,5 4,5. Myogenin es un factor de regulación necesarios para la diferenciación del músculo esquelético 6.9. Los datos demuestran que miogenina se asocia con su propio promotor en E8.5 y E9.5 embriones. Porque miogenina sólo se expresa en somitas en esta etapa de desarrollo 6,10, los datos indican que las interacciones miogenina con su propio promotor ya se han producido en las células del músculo esquelético precursor en E8.5 embriones.
Protocolo
1. Aislamiento de los embriones
Nota: Todas las operaciones con ratones se debe realizar de acuerdo con el cuidado de los animales y las políticas adecuadas de uso y protocolos
- Comprobar la presencia de un tapón de apareamiento en los ratones hembra de la mañana después del apareamiento y separar las hembras apareadas de los machos estudios, colocándolos en una jaula diferente. Del mediodía del día en que el tapón de apareamiento que se observa es considerado el día embrionario 0.5 (E0.5) de desarrollo.
- En E8.5, (o la etapa deseada, si es diferente), el sacrificio del ratón usando un protocolo aprobado.
- Humedezca la barriga del animal sacrificado con el 70% de etanol y abrir la cavidad abdominal. Los lugares de implantación, indicando la presencia de los embriones en desarrollo son vistos como un "nudo en una cuerda" disposición a lo largo de la longitud de cada cuerno uterino (Figura 1). Con la tijera, quitar los cuernos uterinos, corte cada sitio de implantación de forma individual para separar (fig. 1B) y colocarlos en una placa de Petri de 100 mm que contiene la temperatura ambiente (TA) disección (DMEM, 10% de suero fetal bovino, 20 mM HEPES pH 7,4 , 60 mg / ml de penicilina, estreptomicina 2 mM).
- Con unas pinzas, retire cada embrión y las membranas que rodean el tejido uterino (fig. 1C) y colocarlas en un medio de disección fresco.
- Aislar embriones individuales bajo un microscopio de disección con las pinzas. En esta etapa de desarrollo, los embriones están rodeados por el parietal del saco vitelino, que en contacto con el tejido deciduum, el saco vitelino visceral y el amnios. El amnios es una membrana transparente que está en contacto directo con el embrión. La visceral del saco vitelino se encuentra entre el amnios y el saco vitelino parietal y se distingue fácilmente en E8.5-E9.5 embriones por la presencia de vasos sanguíneos importantes que nutren al embrión. Retire cada embrión a partir de las membranas que rodean su transferencia y de forma individual en una nueva placa que contiene los medios de comunicación la disección para eliminar el exceso de sangre. La etapa de desarrollo puede variar de un embrión a embrión y entre camadas, representante E8.5 embriones y embriones representante E9.5 se muestran en la Figura 1D.
- La transferencia de cada embrión en un tubo eppendorf de 1,5 ml que contiene 200 l de los medios de comunicación la disección (que se describe en el paso 4).
2. Homogeneización de los embriones aislados
- Agregar 20 unidades de colagenasa tipo II en un volumen de 200 ul (diluida en 1X Dubbecco fosfato de solución salina tamponada; DPBS) a cada tubo eppendorf.
- Agite con cuidado las muestras en un agitador de 37 ° C a 100 rpm durante 20 min.
- Resuspender bien mediante pipeteo para interrumpir grupos de células.
- Solicitar la suspensión de células en la parte superior del filtro de células estériles (40 micras de malla) colocado en un tubo eppendorf de 1,5 ml.
- Aplicar de inmediato 600 l de la temperatura ambiente 1X DPBS en la parte superior de las células colador para completar la separación. Deseche el filtro.
- Centrifugar las muestras a 4 ° C a 4000 xg durante 5 min.
- Eliminar el sobrenadante.
- Resuspender el precipitado en 1 ml de DPBS RT 1X.
- Centrifugar las muestras a 4000 xg durante 1 min a temperatura ambiente.
- Eliminar el sobrenadante.
- Resuspender el precipitado en 200 ul de los medios de comunicación disección RT.
- Contar con las células embrionarias. Hay un promedio de 3.5 x 10 6 cells/E8.5 embrión.
3. Reticulación de la cromatina
- Añadir 5,6 l de formaldehído al 37% de las 200 muestras l para una concentración final de 1% de formaldehído.
- Incubar las muestras durante 10 minutos a temperatura ambiente.
- Centrifugar las muestras a 4 ° C a 4000 xg durante 3 min.
- Eliminar el sobrenadante.
- Resuspender las células de frío 1X DPBS que contiene 80 l / ml de cóctel inhibidor de la proteasa (PIC).
- Centrifugar las muestras a 4 ° C a 4000 xg durante 3 min.
- Eliminar el sobrenadante. En este paso, las muestras pueden ser congeladas a -80 ° C. Las muestras congeladas, reticulado son estables por varios meses.
4. Sonicación
- Resuspender el botón celular en 100 l de RT lisis SDS buffer (50 mM Tris-HCl (pH 8.1), 10 mM EDTA y 1% SDS con PIC recién añadido a un volumen total PIC/800 l l). Cuando volvieron a suspender, agregar un adicional de 100 ul de buffer de lisis SDS RT para promover la resuspensión. Mezclar bien con la pipeta y la inversión.
- Incubar la suspensión de células en hielo durante 10 min.
- Sonicar células lisadas con el ADN de corte de entre 200 y 500 pares de bases con un Bioruptor Diagenode ™ UCD200 (5 min x 8 veces: ajuste de amplitud de 30 seg seg on/30 de lo alto (320 vatios) de potencia). Las muestras deben estar rodeados por una suspensión de hielo. No permita que las muestras se caliente por encima de 4 ° C o congelar. Hay muchos tipos de sonicadores disponibles. Condiciones sonicación deben ser optimizados para cada baño de ultrasonidos a consecuencia de cizalladura del ADN reticulado con una longitud de aproximadamente 500 pb.
- Centrifugar las muestras de ultrasonidos a 4 ° C a 14000 xg durante 10 min.
- Ttransferencia se entiende el sobrenadante a un tubo eppendorf pre-enfriado en hielo.
- Dividir la muestra sonica en un máximo de 5 alícuotas. Hemos determinado empíricamente que un embrión E8.5 se pueden dividir en alícuotas de 5. Menor o mayor tamaño de la muestra se pueden ampliar en consecuencia. En este paso, la muestra se puede almacenar a -80 ° C hasta su uso posterior.
- Reserva una alícuota para su uso como entrada y almacenar a -20 ° C hasta el paso 6 cuando el cross-links se invertirá. Diluir las alícuotas otras 10 veces en el tampón de dilución de chip (16,7 mM Tris-HCl (pH 8.1), 1.2 mM EDTA, 1,1% Triton X-100, 167 mM NaCl y 0,01% SDS), que contiene PIC recién añadido en un μl/800 l buffer.
5. Pre-compensación y inmunoprecipitación
- Pre-claro el sobrenadante diluido con 75 l de ADN de esperma de salmón / proteína A o G lechada de agarosa-50% a los 4 ° C, con la rotación, durante 1 hora. El uso de cualquiera de las cuentas de la proteína A o proteína G debe ser determinada por el anticuerpo que se utiliza para el chip. Por ejemplo, la proteína A cuentas se recomiendan para los anticuerpos de conejo, mientras que la proteína G cuentas se recomiendan para anticuerpos de cabra o el ratón anticuerpos IgG 1. Para obtener información más detallada, consulte las recomendaciones hechas por el fabricante de cuentas.
- Se centrifuga a 4 ° C en 2500 xg durante 1 min.
- Transferir el sobrenadante a un nuevo pre-enfriado tubo eppendorf.
- Añadir anticuerpos (4 mg / muestra) de la alícuota de pre-limpiado y se incuba durante la noche a 4 ° C con rotación.
6. El lavado de la cromatina complejo de proteínas de perlas
- Añadir 60 l de ADN de esperma de salmón / proteína A o G agarosa purines en cada vial e incubar a 4 ° C con rotación durante 1 hora. Utilice el mismo tipo de cuentas utilizadas para pre-limpieza en el paso 3.
- Se centrifuga a 4 ° C a 1000 xg durante 1 min.
- Retire con cuidado el sobrenadante y desecharlo. Mantener el complejo ADN-proteína de perlas en el hielo.
- Resuspender el precipitado y lavar como se indica a continuación con una tampones de lavado, 2, 3 y 4. Lavado de buffers 1.3 deben ser refrigerados a 4 ° C y se lava con estos buffers se debe realizar a 4 ° C. El tampón de lavado 4 debe estar a temperatura ambiente y se lava con el tampón debe llevarse a cabo a temperatura ambiente. Cada lavado es de 5 minutos con rotación a la temperatura adecuada. Después de cada lavado, centrifugar a 4 ° C (temperatura ambiente de tampón de lavado 4 lavados) a 1000 xg durante 1 minuto, luego, con cuidado aspirar o eliminar el sobrenadante.
Tampón 1: tampón de lavado de baja de sal (20 mM Tris-HCl (pH 8.1), 2 mM EDTA, 1% Triton X-100,
150 mM NaCl y 0,1% SDS), 1 ml x 2 lavados.
Tampón 2: tampón de lavado de alta sal (20 mM Tris-HCl (pH 8.1), 2 mM EDTA, 1% Triton X-100,
500 mM NaCl y 0,1% SDS), 1 ml x 2 lavados.
Tampón 3: sal LiCl tampón de lavado (10 mM Tris-HCl (pH 8.1), 1 mM EDTA, 1% IGEPAL-CA630,
0,25 M LiCl y 1% de ácido desoxicólico (sal de sodio)), 1 x 1 ml de lavado.
Buffer 4: buffer TE (10 mM Tris-HCl (pH 8.1), 1 mM EDTA), 1 ml x 2 lavados.
7. Elución del complejo de la cromatina-anticuerpo
- Volver a suspender el lavado de la cromatina-proteínas de cuentas complejas en 250 l de tampón de elución recién preparada (1% SDS, 0,1 M NaHCO 3). Vigorosamente vórtice de la muestra durante 5 segundos, y luego se incuban a temperatura ambiente durante 15 minutos con la rotación.
- Centrifugar a 2500 xg durante 1 minuto a temperatura ambiente y la transferencia del eluido en un tubo eppendorf nuevo.
- Repita los pasos 1 y 2, y combinar los eluidos en el mismo tubo eppendorf. Los eluidos se deben mantener a temperatura ambiente. Una vez finalizado este paso, los eluidos se pueden almacenar a -20 ° C hasta su uso posterior.
8. Inversa de la Cruz-link y recuperar el ADN
- Añadir 20 l de NaCl 5 M 500 eluido l (40 l / ml para el control de entrada).
- Calentar el eluidos a 65 ° C en un baño de agua durante 4 horas o toda la noche.
- 10 l de cada muestra (incluyendo el control de entrada) se puede ejecutar en un 2% en gel de agarosa al lado de los marcadores de tamaño que abarca desde 0,1 hasta 1 Kbp para comprobar el tamaño de los fragmentos de ADN. El ADN aparece como una mancha y no una banda fuerte. El resto de las muestras se puede dejar a 65 ° C, mientras que el gel se está ejecutando.
- Recuperar el ADN de cada muestra mediante un QIAquick Gel Extraction Kit (Qiagen). Añadir 600 buffer QG l (suministrado en el kit) para optimizar la absorción de ADN con la membrana de sílice en una columna de centrifugación QIAquick y 200 l de isopropanol en una muestra de l 500. Tenga en cuenta que el buffer QG contiene un indicador de pH que permite determinar fácilmente el pH de la muestra. Si el color de la muestra cambia de amarillo a violeta (pH> 7,5) después de la mezcla, añadir 10 l de 3 NaAcetate M (pH 5,2) a la muestra y mezclar. Esto reduce el pH de la mezcla para maximizar la unión del ADN a las cuentas de la columna.
- Antes de cargar la columna, compruebe que la mezcla para determinar si cualquier precipitado SDS está presente. Si SDS precipitaciones se ha producido, la muestra debe ser calentada en un42 ° C baño de agua hasta que el precipitado desaparece.
- De carga 700 l de la mezcla en la columna de centrifugación QIAquick (columna de color púrpura en el kit) y se centrifuga a temperatura ambiente a 14000 xg durante 1 min. Deseche el flujo a través de la columna antes de continuar y repetir este paso con el resto de la muestra.
- Añadir 500 buffer QG l para lavar la columna. Centrifugar a 14.000 xg a RT durante 2 min. Deseche el flujo a través de la columna antes de proceder.
- Lavar la columna con 700 l de tampón de lavado PE (suministrado en el kit) para que el etanol se ha añadido a las instrucciones del fabricante. Centrifugar a 14.000 xg a RT durante 1 min. Deseche el flujo a través de la columna antes de proceder.
- Repita el paso de centrifugación para eliminar por completo el resto de la memoria intermedia de educación física de la columna. Deseche el flujo a través y el tubo de recogida.
- Eluir el ADN de la columna a un tubo eppendorf mediante la adición de tampón EB 60 l (tampón de elución suministrado en el kit).
- Se centrifuga a temperatura ambiente a 14.000 xg durante 1 min. El ADN eluido se puede almacenar a -20 ° C hasta la detección. A 260 lecturas de los materiales recuperados suelen indicar las concentraciones de 90 a 120 ng / ul, para una recuperación total de ~ 6.7 ug por alícuota. Sin embargo, la proporción de 260/280 A estas muestras es normalmente> 1,8, lo que sugiere que el ARN está presente en la muestra. Así, la cantidad exacta de ADN recuperado puede ser inferior.
9. El análisis del ADN recuperado
- SDS puede interferir con la actividad de la Taq polimerasa PCR. SDS se debe quitar por completo antes de realizar el PCR. Incubar el ADN en el hielo para precipitar cualquier residuo de SDS y se centrifuga a 4 ° C a 14000 xg durante 1 min. Transferir el sobrenadante a un nuevo paso eppendorf tube.This es muy recomendable.
- Los eluidos de ADN puede ser detectada por PCR convencional o cuantitativa en tiempo real PCR (Q-PCR) con cebadores específicos para cada secuencia a analizar. L 5-10 de eluido total de ADN puede ser utilizado para un PCR o reacción de Q-PCR. PCR con el control de entrada se puede realizar con una dilución de 5.10 veces del ADN en comparación con la cantidad de otras muestras. PCR y las condiciones de Q-PCR puede variar, sin embargo, la limitada cantidad de material de partida se necesitan más ciclos de PCR. Para la detección por PCR convencional, se recomienda iniciar con 40 ciclos y el ajuste según sea necesario.
10. Resultados representante
Hemos utilizado este protocolo para realizar chip de ambos E8.5 y E9.5 embriones (Figura 2). Los resultados demuestran que miogenina está presente en el promotor miogenina en E8.5 y E9.5 embriones. Chip ADN purificado se analizaron mediante PCR convencional (Figura 2A) y cuantitativa en tiempo real PCR (Figura 2B). Por el contrario, no había ninguna indicación de miogenina vinculante para el promotor miogenina en el saco vitelino, donde miogenina no se expresa. El interferón-γ (IFN), promotor, que contiene secuencias de juego del sitio de unión miogenina, fue utilizado como un control de secuencia negativa. Como era de esperar, myogenin no estaba obligado a la promotora IFN en ninguna de las muestras de tejido a prueba. En E8.5 y 9,5 embriones, myogenin se expresa específicamente en las somitas (Figura 3; 6,10), que son los precursores de los músculos esqueléticos. Así, los resultados indican que miogenina se une al promotor miogenina en las somitas en E8.5 y E9.5.
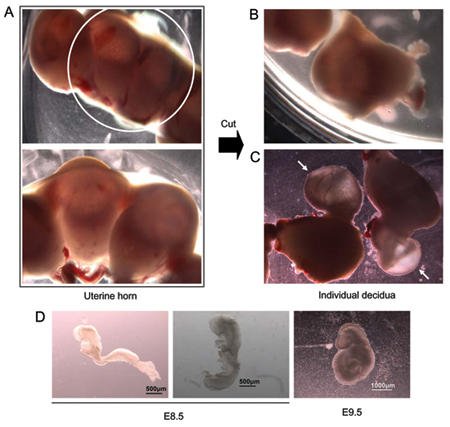
Figura 1. E8.5 disección de embriones. (A) Alejado del útero cuerno (panel superior, un mayor aumento, se muestra en la imagen inferior). (B) cuerno uterino se corta con tijeras para separar los sitios individuales de implantación que contienen embriones individuales. (C) Los embriones que sobresale de los tejidos del útero durante la disección. Las flechas señalan los embriones todavía está cubierto por extra-embrionarios de tejido. (D) Dos E8.5 embriones de la misma camada. El embrión de la izquierda no se ha iniciado el proceso de transformación. El embrión de la derecha está pasando por atrás. La extrema derecha - representante de embriones E9.5.
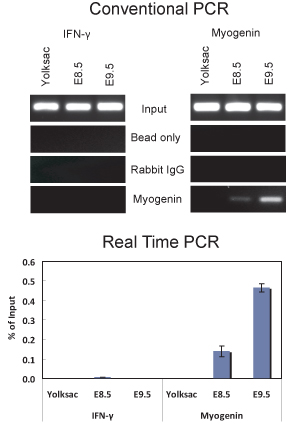
Figura 2. Chip de ensayo que demuestra miogenina vinculante para el promotor miogenina en E8.5 y E9.5 embriones. (Arriba) el análisis de PCR convencional de 5 ul de ADN purificado a partir de experimentos chip utilizando un anticuerpo miogenina o no específica de IgG se realizó con los primers que amplifican una parte de la promotora miogenina -79 a 69 en relación con el sitio de inicio de transcripción que contiene un sitio de unión miogenina situado en -12 o cebadores que amplifican una parte del promotor de IFN que contiene una secuencia de juego del sitio de unión situado miogenina ~ 1075 pb aguas arriba del sitio de inicio de transcripción. El primer secuencias IFN utilizados fueron 5'-GCT GAC AGA TCA CCC CGA GGC-3 'y 5'-TGA GGA TGG GGC AGG AGG CC-3'. (Abajo) cuantitativa en tiempo real PCR análisis de las mismas muestras utilizadas en (A). Lade datos se representan como% de la entrada de + / - desviación estándar.
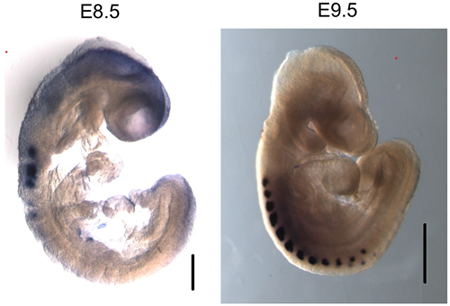
Figura 3. Myogenin se expresa específicamente en las somitas de E8.5 y E9.5 embriones. Todo el montaje hibridación in situ de miogenina muestra la expresión de ARNm específicos en los somitas. Tamaño de la barra en la imagen E8.5 - 200 micras. Tamaño de la barra en la imagen E9.5 - 500 micras.
Discusión
En el protocolo de chip se describe, se muestra que la miogenina regulador miogénico se asocia con el promotor miogenina en el tejido esquelético precursor muscular presente en un solo E8.5 y E9.5 embriones. Estudios anteriores han caracterizado ampliamente miogenina unión a la caja de E que contienen secuencias, comenzando con los primeros experimentos in vitro utilizando gel de cambio traducido in vitro o producidas por bacterias y ADN miogenina radiomarcado que codifica la porci...
Divulgaciones
Agradecimientos
Este trabajo fue apoyado por el NIH R01 GM56244 a ANI, que incluye los fondos otorgados a través de la Recuperación y Reinversión de 2009, y por el NIH R01 GM87130 a Jarp
Materiales
| Name | Company | Catalog Number | Comments |
| ChIP Assay Kit | Upstate, Millipore | 17-295 | |
| Collagenase Type II | Invitrogen | 17101015 | Dilution by 1 x PBS |
| Dulbecco’s modified eagle medium (DMEM) | GIBCO, by Life Technologies | 12100-061 | High glucose content |
| Dulbecco’s phosphate buffered saline 1X (DPBS) | GIBCO, by Life Technologies | 14190-144 | Calcium chloride free, Magnesium chloride free |
| Fetal bovine serum (FBS) | Mediatech, Inc. | 35-010-CV | |
| Gel extraction kit | QIAquick | 28704 | 50 reaction kit |
| Penicillin/streptomycin stock solution | GIBCO, by Life Technologies | 5000 μg/ml concentration | |
| Protease Inhibitor Cocktail | Sigma-Aldrich | P8340 | |
| Salmon sperm DNA /Protein A agarose | EMD Millipore | 16-157 | |
| myogenin antibody | Santa Cruz Biotechnology, Inc. | sc-576 | |
| Normal rabbit IgG | EMD Millipore | 12-370 | |
| Platinum PCR Supermix | Invitrogen | 11306-016 | |
| GoTaq Q-PCR master mix | Promega Corp. | A6001 |
Referencias
- Minard, M. E., Jain, A. K., Barton, M. C. Analysis of epigenetic alterations to chromatin during development. Genesis. 47, 559-572 (2009).
- Kuo, M. H., Allis, C. D. In vivo cross-linking and immunoprecipitation for studying dynamic Protein:DNA associations in a chromatin environment. Methods. 19, 425-433 (1999).
- Johnson, K. D., Bresnick, E. H. Dissecting long-range transcriptional mechanisms by chromatin immunoprecipitation. Methods. 26, 27-36 (2002).
- Yusuf, F., Brand-Saberi, B. The eventful somite: patterning, fate determination and cell division in the somite. Anat Embryol (Berl). 211, 21-30 (2006).
- Buckingham, M., Bajard, L., Chang, T., Daubas, P., Hadchouel, J., Meilhac, S., Montarras, D., Rocancourt, D., Relaix, F. The formation of skeletal muscle: from somite to limb. J Anat. 202, 59-68 (2003).
- Wright, W. E., Sassoon, D. A., Lin, V. K. Myogenin, a factor regulating myogenesis, has a domain homologous to MyoD. Cell. 56, 607-617 (1989).
- Edmondson, D. G., Olson, E. N. A gene with homology to the myc similarity region of MyoD1 is expressed during myogenesis and is sufficient to activate the muscle differentiation program. Genes Dev. 3, 628-640 (1989).
- Nabeshima, Y., Hanaoka, K., Hayasaka, M., Esumi, E., Li, S., Nonaka, I. Myogenin gene disruption results in perinatal lethality because of severe muscle defect. Nature. 364, 532-535 (1993).
- Hasty, P., Bradley, A., Morris, J. H., Edmondson, D. G., Venuti, J. M., Olson, E. N., Klein, W. H. Muscle deficiency and neonatal death in mice with a targeted mutation in the myogenin gene. Nature. 364, 501-506 (1993).
- Sassoon, D., Lyons, G., Wright, W. E., Lin, V., Lassar, A., Weintraub, H., Buckingham, M. Expression of two myogenic regulatory factors myogenin and MyoD1 during mouse embryogenesis. Nature. 341, 303-307 (1989).
- Brennan, T. J., Olson, E. N. Myogenin resides in the nucleus and acquires high affinity for a conserved enhancer element on heterodimerization. Genes Dev. 4, 582-595 (1990).
- Rosenthal, N., Berglund, E. B., Wentworth, B. M., Donoghue, M., Winter, B., Bober, E., Braun, T., Arnold, H. H. A highly conserved enhancer downstream of the human MLC1/3 locus is a target for multiple myogenic determination factors. Nucleic Acids Res. 18, 6239-6246 (1990).
- Braun, T., Gearing, K., Wright, W. E., Arnold, H. H. Baculovirus-expressed myogenic determination factors require E12 complex formation for binding to the myosin-light-chain enhancer. Eur J Biochem. 198, 187-193 (1991).
- Chakraborty, T., Brennan, T., Olson, E. Differential trans-activation of a muscle-specific enhancer by myogenic helix-loop-helix proteins is separable from DNA binding. J Biol Chem. 266, 2878-2882 (1991).
- French, B. A., Chow, K. L., Olson, E. N., Schwartz, R. J. Heterodimers of myogenic helix-loop-helix regulatory factors and E12 bind a complex element governing myogenic induction of the avian cardiac alpha-actin promoter. Mol Cell Biol. 11, 2439-2450 (1991).
- Brennan, T. J., Chakraborty, T., Olson, E. N. Mutagenesis of the myogenin basic region identifies an ancient protein motif critical for activation of myogenesis. Proc Natl Acad Sci U S A. 88, 5675-5679 (1991).
- Lassar, A. B., Davis, R. L., Wright, W. E., Kadesch, T., Murre, C., Voronova, A., Baltimore, D., Weintraub, H. Functional activity of myogenic HLH proteins requires hetero-oligomerization with E12/E47-like proteins in vivo. Cell. 66, 305-315 (1991).
- Chakraborty, T., Brennan, T. J., Li, L., Edmondson, D., Olson, E. N. Inefficient homooligomerization contributes to the dependence of myogenin on E2A products for efficient DNA binding. Mol Cell Biol. 11, 3633-3641 (1991).
- Cserjesi, P., Olson, E. N. Myogenin induces the myocyte-specific enhancer binding factor MEF-2 independently of other muscle-specific gene products. Mol Cell Biol. 11, 4854-4862 (1991).
- Braun, T., Arnold, H. H. The four human muscle regulatory helix-loop-helix proteins Myf3-Myf6 exhibit similar hetero-dimerization and DNA binding properties. Nucleic Acids Res. 19, 5645-5651 (1991).
- Serna, d. e. l. a., L, I., Ohkawa, Y., Berkes, C. A., Bergstrom, D. A., Dacwag, C. S., Tapscott, S. J., Imbalzano, A. N. MyoD targets chromatin remodeling complexes to the myogenin locus prior to forming a stable DNA-bound complex. Mol Cell Biol. 25, 3997-4009 (2005).
- Blais, A., Tsikitis, M., Acosta-Alvear, D., Sharan, R., Kluger, Y., Dynlacht, B. D. An initial blueprint for myogenic differentiation. Genes Dev. 19, 553-569 (2005).
- Cao, Y., Kumar, R. M., Penn, B. H., Berkes, C. A., Kooperberg, C., Boyer, L. A., Young, R. A., Tapscott, S. J. Global and gene-specific analyses show distinct roles for Myod and Myog at a common set of promoters. EMBO J. 25, 502-511 (2006).
- Ohkawa, Y., Yoshimura, S., Higashi, C., Marfella, C. G., Dacwag, C. S., Tachibana, T., Imbalzano, A. N. Myogenin and the SWI/SNF ATPase Brg1 maintain myogenic gene expression at different stages of skeletal myogenesis. J Biol Chem. 282, 6564-6570 (2007).
- Davie, J. K., Cho, J. H., Meadows, E., Flynn, J. M., Knapp, J. R., Klein, W. H. Target gene selectivity of the myogenic basic helix-loop-helix transcription factor myogenin in embryonic muscle. Dev Biol. 311, 650-664 (2007).
- Metivier, R., Penot, G., Hubner, M. R., Reid, G., Brand, H., Kos, M., Gannon, F. Estrogen receptor-alpha directs ordered, cyclical, and combinatorial recruitment of cofactors on a natural target promoter. Cell. 115, 751-763 (2003).
- Ausubel, F. M., Brent, R., Kingston, R. E., Moore, D. D., Seidman, J. G., Smith, J. A., Struhl, K. . Current Protocols in Molecular Biology. , (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados