Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Assay immunoprécipitation de la chromatine des gènes spécifiques de tissus en utilisant des embryons de souris en début de
Dans cet article
Résumé
Nous démontrons une immunoprécipitation de la chromatine (ChIP) méthode pour identifier les interactions de facteurs au tissu-spécifique des gènes pendant ou après l'apparition de tissu-spécifique l'expression des gènes dans les tissus embryonnaires de souris. Ce protocole devrait être largement applicable pour l'étude de l'activation de gènes spécifiques de tissus comme il se produit pendant le développement embryonnaire normal.
Résumé
Immunoprécipitation de la chromatine (ChIP) est un outil puissant pour identifier les protéines: les interactions chromatine qui se produisent dans le contexte de cellules vivantes 1-3. Cette technique a été largement exploitée dans les cellules de culture de tissus, et dans une moindre mesure, dans les tissus primaires. L'application de ChIP pour les tissus de rongeurs embryonnaire, surtout en période précoce du développement, est compliquée par la quantité limitée de tissu et de l'hétérogénéité des cellules et de tissus dans l'embryon. Nous présentons ici une méthode pour effectuer une puce en utilisant jours dissocié embryonnaire 8.5 (E8.5) embryon. Chromatine cisaillé à partir d'un seul embryon E8.5 peut être divisé en jusqu'à cinq aliquotes, qui permet au matériel de l'enquêteur suffisants pour les contrôles et des enquêtes de protéines spécifiques: les interactions chromatine.
Nous avons utilisé cette technique pour commencer à documenter des protéines: les interactions chromatine lors de la spécification du tissu-spécifique des programmes d'expression génique. L'hétérogénéité des types de cellules dans un embryon limite nécessairement l'application de cette technique car le résultat est la détection de protéines: les interactions chromatine sans distinguer selon que les interactions se produisent dans tous, un sous-ensemble, ou un seul type cellulaire (s). Cependant, l'examen du tissu-spécifique des gènes pendant ou après l'apparition de tissu-spécifique l'expression des gènes est possible pour deux raisons. Tout d'abord, immunoprécipitation de facteurs tissulaires spécifiques des isolats nécessairement chromatine du type cellulaire où le facteur est exprimé. Deuxièmement, immunoprécipitation de coactivateurs et les histones contenant modifications post-traductionnelles qui sont associés à l'activation des gènes ne devraient être disponibles sur les gènes et les séquences régulatrices de gènes dans le type cellulaire où le gène est ou a été activé. La technique devrait être applicable à l'étude de la plupart des tissus spécifiques événements d'activation des gènes.
Dans l'exemple décrit ci-dessous, nous avons utilisé E8.5 et E9.5 embryons de souris pour examiner les facteurs liant à un promoteur du gène spécifique du muscle squelettique. Somites, qui sont les précurseurs de tissus à partir de laquelle les muscles squelettiques du tronc et des branches vont se former, sont présents à E8.5-9.5 4,5. Myogenin est un facteur de régulation nécessaire à la différenciation du muscle squelettique 6-9. Les données démontrent que la myogénine est associée à son propre promoteur de E8.5 E9.5 et d'embryons. Parce que la myogénine est exprimé uniquement dans les somites, à ce stade de développement 6,10, les données indiquent que les interactions avec les myogénine son propre promoteur sont déjà produites dans les cellules précurseurs des muscles squelettiques dans E8.5 embryons.
Protocole
1. L'isolement des embryons
Remarque: Toutes les opérations impliquant des souris doivent être effectués en conformité avec les soins des animaux et des politiques appropriées d'utilisation et des protocoles
- Vérifier la présence d'une fiche d'accouplement chez la souris femelle le matin après l'accouplement et de séparer les femelles fécondées par des mâles haras en les plaçant dans une cage différente. Midi de la journée que la fiche d'accouplement est observé est considéré comme jour embryonnaire 0,5 (E 0,5) de développement.
- À E8.5, (ou le stade désiré, si différent), le sacrifice de la souris en utilisant un protocole approuvé.
- Mouiller le ventre de l'animal euthanasié à l'éthanol 70% et d'ouvrir la cavité abdominale. Les sites d'implantation indiquant la présence d'embryons en développement sont considérés comme un «perles sur un fil" arrangement sur toute la longueur de chaque corne utérine (figure 1A). Avec des ciseaux, enlever les deux cornes utérines, couper chaque site d'implantation individuelle de se séparer (figure 1B) et les placer dans un plat de 100 mm de Pétri contenant température ambiante (TA) moyen de dissection (DMEM, 10% de sérum de veau fœtal, HEPES 20 mM pH 7,4 , 60 pg / ml de pénicilline, la streptomycine 2 mM).
- En utilisant une pince, retirer chaque embryon et les membranes entourant le tissu utérin (figure 1C) et les placer dans un milieu de dissection douce.
- Isoler embryons individuels sous un microscope de dissection à l'aide des pinces. A ce stade de développement, les embryons sont entourés par le pariétal du sac vitellin, qui contacte le tissu deciduum, le viscéral du sac vitellin et de l'amnios. L'amnios est une membrane transparente qui est en contact direct avec l'embryon. Le sac vitellin viscéral se trouve entre l'amnios et le feuillet pariétal jaune et se distingue facilement dans E8.5 E9.5-embryons par la présence de vaisseaux sanguins importants qui nourrissent l'embryon. Retirez chaque embryon à partir de ses membranes entourant et le transfert individuellement dans une nouvelle plaque contenant les médias de dissection pour enlever l'excès de sang. Le stade de développement peut varier d'un embryon à l'embryon et entre les portées; représentant E8.5 embryons et un embryon de E9.5 représentatifs sont présentés dans la figure 1D.
- Transfert chaque embryon d'un tube eppendorf de 1,5 ml contenant 200 ul de médias dissection (décrit dans l'étape 4 ci-dessus).
2. Homogénéisation de l'embryon isolé
- Ajouter 20 unités de collagénase de type II dans un volume de 200 ul (dilué dans du phosphate 1X Dubbecco du sérum physiologique tamponné; DPBS) à chaque tube Eppendorf.
- Agitez doucement échantillons dans un shaker à 37 ° C à 100 rpm pendant 20 min.
- Resuspendre bien par pipetage pour perturber des amas de cellules.
- Appliquer la suspension de cellules sur le dessus de la crépine de cellules stériles (maillage de 40 um) placée sur un tube eppendorf de 1,5 ml.
- Appliquer immédiatement 600 pl de la température ambiante 1X DPBS sur le dessus de la crépine de cellule pour compléter la séparation. Jeter le filtre.
- Centrifuger les échantillons à 4 ° C à 4000 xg pendant 5 min.
- Jeter le surnageant.
- Reprendre le culot dans 1 ml de DPBS 1X RT.
- Centrifuger les échantillons à 4000 xg pendant 1 min à température ambiante.
- Jeter le surnageant.
- Reprendre le culot dans 200 pl de la dissection des médias RT.
- Compter les cellules embryonnaires. Il ya une moyenne 3-5 x 10 6 cells/E8.5 embryon.
3. Croix-link chromatine
- Ajouter 5,6 l de formaldéhyde à 37% des 200 échantillons ul pour une concentration finale de 1% de formaldehyde.
- Incuber les échantillons pendant 10 min à température ambiante.
- Centrifuger les échantillons à 4 ° C à 4000 xg pendant 3 min.
- Jeter le surnageant.
- Resuspendre les cellules de froid 1X DPBS contenant 80 ul / ml cocktail inhibiteur de protéase (PIC).
- Centrifuger les échantillons à 4 ° C à 4000 xg pendant 3 min.
- Jeter le surnageant. À cette étape, les échantillons peuvent être congelés à -80 ° C. Les prélèvements congelés, réticulé sont stables pendant plusieurs mois.
4. Sonication
- Reprendre le culot cellulaire dans 100 ul de tampon SDS RT lyse (50 mM Tris-HCl (pH 8,1), EDTA 10 mM et SDS à 1% avec PIC fraîchement ajoutée à 1 ul PIC/800 volume total ul). Lorsque resuspendues, ajouter un supplément de 100 ul de tampon RT lyse SDS afin de promouvoir la remise en suspension. Mélangez bien à la pipette et de l'inversion.
- Incuber la suspension cellulaire sur la glace pendant 10 min.
- Soniquer cellules lysées à l'ADN de cisaillement entre 200 et 500 paires de bases en utilisant une Bioruptor Diagenode ™ UCD200 (5 min x 8 fois: réglage de l'amplitude de 30 sec sec on/30 rabais sur élevée (320 watts) de puissance). Les échantillons doivent être entourés par un coulis de glace. Ne pas laisser les échantillons à chaud au-dessus de 4 ° C ou à congeler. Il ya de nombreux types de sonicateurs disponibles. Conditions sonication devrait être optimisé pour chaque sonicateur d'entraîner en cisaillement de l'ADN réticulé à une longueur d'environ 500 pb.
- Centrifuger les échantillons soniqué à 4 ° C à 14000 xg pendant 10 min.
- Transfert le surnageant dans un nouveau tube Eppendorf pré-refroidi sur la glace.
- Divisez l'échantillon soniqué dans un maximum de 5 aliquotes. Nous avons déterminé empiriquement que l'on E8.5 embryon peut être divisé en 5 aliquotes. Des échantillons plus petits ou plus grands peuvent être redimensionnées en conséquence. À cette étape, l'échantillon peut être conservé à -80 ° C jusqu'à utilisation ultérieure.
- Réserve une aliquote de l'utiliser comme entrée et conserver à -20 ° C jusqu'à l'étape 6 lorsque la croix-liens seront inversés. Diluer les aliquotes d'autres de 10 fois en tampon de dilution ChIP (16,7 mM Tris-HCl (pH 8,1), 1,2 mM EDTA, 1,1% de Triton X-100, 167 mM de NaCl et 0,01% SDS) contenant PIC fraîchement ajoutée à 1 μl/800 pi de tampon.
5. Pré-compensation et immunoprécipitation
- Pré-claire le surnageant dilué avec 75 ul de saumon-Sperm ADN / protéines A ou G-50 agarose coulis% à 4 ° C, avec rotation, pendant 1 heure. Utilisez soit la protéine A ou de perles protéines G devrait être déterminée par l'anticorps à utiliser pour la puce. Par exemple, billes de protéine A sont recommandés pour les anticorps de lapin, tandis que la protéine G perles sont recommandés pour les anticorps IgG de souris de chèvre ou une anticorps. Pour plus d'informations, voir les recommandations faites par le fabricant de billes.
- Centrifuger à 4 ° C à 2500 xg pendant 1 min.
- Transférer le surnageant dans un nouveau pré-refroidi tube Eppendorf.
- Ajouter anticorps (4 mg / échantillon) à l'aliquote de pré-effacé et incuber une nuit à 4 ° C avec rotation.
6. Le lavage des complexes protéines-chromatine perles
- Ajouter 60 ul de sperme de saumon ADN / protéine A ou G agarose coulis dans chaque flacon et incuber à 4 ° C avec rotation pendant 1 heure. Utiliser le même type de billes utilisées pour la pré-compensation à l'étape 3 ci-dessus.
- Centrifuger à 4 ° C à 1000 xg pendant 1 min.
- Retirer délicatement le surnageant et le jeter. Gardez le complexe ADN-protéines-billes sur la glace.
- Resuspendre et laver le culot comme indiqué ci-dessous avec une tampons de lavage, 2, 3 et 4. Lavez tampons 1-3 doivent être réfrigérés à 4 ° C et lavages avec ces tampons doivent être effectuées à 4 ° C. Tampon de lavage 4 devrait être à la température ambiante et se lave avec ce tampon devrait être effectuée à température ambiante. Chaque lavage est de 5 minutes avec une rotation à la température appropriée. Après chaque lavage, centrifuger à 4 ° C (température ambiante pendant tampon de lavage 4 lavages) à 1000 xg pendant 1 min, puis aspirer délicatement ou retirer le surnageant.
Tampon 1: Faible tampon de lavage du sel (20 mM Tris-HCl (pH 8,1), 2 mM EDTA, 1% de Triton X-100,
150 mM de NaCl et 0,1% de SDS), 1 ml x 2 lavages.
Tampon 2: High tampon de lavage du sel (20 mM Tris-HCl (pH 8,1), 2 mM EDTA, 1% de Triton X-100,
500 mM de NaCl et 0,1% de SDS), 1 ml x 2 lavages.
Tampon 3: tampon LiCl laver le sel (10 mM Tris-HCl (pH 8,1), 1 mM EDTA, 1% IGEPAL-CA630,
0,25 M de LiCl et de l'acide désoxycholique 1% (sel de sodium)), 1 ml x 1 lavage.
Tampon 4: tampon TE (10 mM Tris-HCl (pH 8,1), EDTA 1 mM), 1 ml x 2 lavages.
7. Élution du complexe chromatine-anticorps
- Reprendre le lavage de la chromatine des protéines complexes billes dans 250 ul de tampon d'élution fraîchement préparés (1% SDS, 0,1 M NaHCO 3). Vigoureusement l'échantillon de vortex pendant 5 secondes, puis incuber à température ambiante pendant 15 min avec rotation.
- Centrifuger à 2500 xg pendant 1 min à température ambiante et le transfert de l'éluat dans un tube eppendorf de nouvelles.
- Répétez les étapes 1 et 2 et de combiner les éluats dans le même tube eppendorf. Les éluats doivent être conservés à température ambiante. A l'issue de cette étape, les éluats peuvent être conservés à -20 ° C jusqu'à utilisation ultérieure.
8. Inverse de la Croix-lien et récupérer l'ADN
- Ajouter 20 ul NaCl 5 M pour 500 éluat ul (40 ug / ml pour le contrôle d'entrée).
- Chauffer les éluats à 65 ° C dans un bain d'eau pendant 4 heures à la nuit.
- 10 ul de chaque échantillon (y compris le contrôle d'entrée) peut être exécuté sur un gel agarose 2% à côté de marqueurs de taille allant de 0,1 à 1 kpb de vérifier la taille des fragments d'ADN. L'ADN apparaîtra comme un frottis et non une bande nette. Le reste des échantillons peut être laissé à 65 ° C tandis que le gel est en marche.
- Récupérer l'ADN de chaque échantillon en utilisant un kit QIAquick Gel Extraction (Qiagen). Ajouter 600 ul de tampon QG (fourni dans le kit) pour optimiser l'ADN d'adsorption avec la membrane de silice dans une colonne spin QIAquick et 200 pi d'isopropanol dans un échantillon de 500 pl. Notez que le tampon QG contient un indicateur de pH permettant de déterminer facilement le pH de l'échantillon. Si la couleur de l'échantillon vire du jaune au violet (pH> 7,5) après le mélange, ajouter 10 ul de 3 M NaAcetate (pH 5,2) à l'échantillon et mélanger. Cela réduit le pH du mélange pour maximiser liaison à l'ADN aux perles dans la colonne.
- Avant de charger la colonne, vérifier le mélange afin de déterminer si tout précipité SDS est présent. Si SDS précipitations a eu lieu, l'échantillon doit être réchauffé dans un42 ° C jusqu'à ce bain d'eau, le précipité disparaît.
- Charge 700 ul du mélange dans la colonne de centrifugation QIAquick (colonne violette dans le kit) et centrifuger à RT à 14000 xg pendant 1 min. Jeter le débit à travers de la colonne avant de procéder et répétez cette étape avec le reste de l'échantillon.
- Ajouter 500 ul de tampon QG pour laver la colonne. Centrifuger à 14000 xg RT à 2 min. Jeter le débit à travers de la colonne avant de continuer.
- Laver la colonne avec 700 ul d'un tampon de lavage PE (fourni dans le kit) à laquelle l'éthanol a été ajoutée selon les instructions du fabricant. Centrifuger à 14000 xg RT à 1 min. Jeter le débit à travers de la colonne avant de continuer.
- Répéter l'étape de centrifugation pour éliminer complètement le reste de la mémoire tampon PE de la colonne. Jeter le débit à travers le tube de collecte.
- L'ADN élue de la colonne dans un nouveau tube Eppendorf en ajoutant 60 ul de tampon EB (tampon d'élution fourni dans le kit).
- Centrifuger à température ambiante à 14 000 xg pendant 1 min. L'ADN élue peut être conservé à -20 ° C jusqu'à ce que la détection. A 260 lectures de la matière récupérée en général indiquent des concentrations de 90-120 ng / ul, pour une récupération totale de ~ 6-7 ug par aliquote. Cependant, le ratio de 260/280 Un de ces échantillons est typiquement> 1,8, ce qui suggère que l'ARN est présent dans l'échantillon. Ainsi, le montant exact de l'ADN récupéré peut être inférieur.
9. Analyse d'ADN récupéré
- SDS peut interférer avec l'activité du PCR Taq polymérase. SDD devrait être complètement éliminé avant d'effectuer la PCR. Incuber l'ADN sur la glace pour précipiter tout résidu de SDS et centrifuger à 4 ° C à 14000 xg pendant 1 min. Transférer le surnageant dans une nouvelle étape eppendorf tube.This est fortement recommandée.
- Les éluats d'ADN peuvent être détectés soit par PCR conventionnelle ou par quantitative PCR en temps réel (Q-PCR) avec des amorces spécifiques pour chaque séquence à analyser. Ul 5-10 éluat ADN total peut être utilisé pour une PCR ou Q-PCR réaction. PCR avec le contrôle d'entrée peut être réalisé avec une dilution de 50 à 10 fois de l'ADN par rapport à la quantité d'autres échantillons. PCR et Q-PCR conditions varient, cependant, la quantité limitée de matériel de départ nécessite d'autres cycles de PCR. Pour la PCR de détection classique, nous recommandons de commencer avec 40 cycles et en ajustant au besoin.
10. Les résultats représentatifs
Nous avons utilisé ce protocole pour effectuer puce de deux E8.5 E9.5 et d'embryons (Figure 2). Les résultats démontrent que la myogénine est présent sur le promoteur myogénine dans E8.5 E9.5 et d'embryons. ChIP ADN purifiés ont été analysés par PCR conventionnelle (figure 2A) et par quantitative PCR en temps réel (figure 2B). En revanche, il n'y avait aucune indication de myogénine liant au promoteur myogénine dans le sac vitellin, où myogénine n'est pas exprimé. L'interféron γ-(IFN), le promoteur qui contient des séquences correspondant du site myogénine contraignant, a été utilisé comme un contrôle de la séquence négative. Comme prévu, myogénine n'était pas lié au promoteur IFN dans aucun des échantillons de tissus testés. En E8.5 et 9,5 embryons, myogénine est spécifiquement exprimé dans les somites (figure 3; 6,10), qui sont les précurseurs du muscle squelettique. Ainsi, les résultats indiquent que la myogénine est lié au promoteur myogénine dans les somites sur E8.5 E9.5 et.
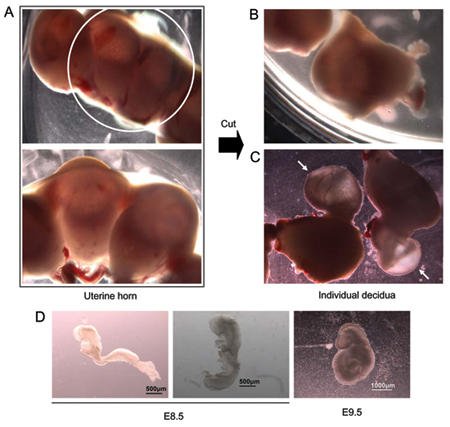
Figure 1. E8.5 dissection embryon. (A) Isolé corne utérine (panneau supérieur; plus fort grossissement indiqué dans panneau inférieur). (B) corne utérine coupé avec des ciseaux pour séparer les différents sites d'implantation des embryons contenant individuel. (C) Les embryons dépassant du tissu utérin pendant la dissection. Les flèches marquent embryons encore couverts par les tissus extra-embryonnaires. (D) Deux E8.5 embryons de la même portée. L'embryon sur la gauche n'a pas commencé le processus de transformation. L'embryon sur la droite est en train de tourner. Extrême droite - représentant l'embryon E9.5.
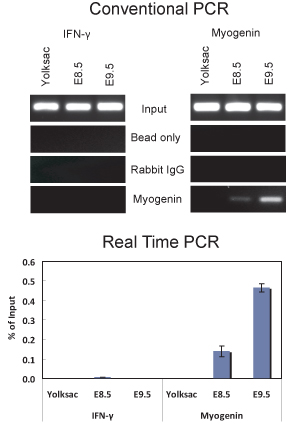
Figure 2. Dosage de ChIP démontrant myogénine liant au promoteur myogénine dans E8.5 E9.5 et d'embryons. (Haut) L'analyse PCR conventionnelle de 5 ul d'ADN purifié à partir d'expériences puce en utilisant un anticorps myogénine ou non IgG spécifiques a été réalisée avec des amorces qui amplifient une partie du promoteur myogénine -79 à 69 par rapport au site que le début de la transcription contient un site myogénine contraignante situé à -12 ou amorces qui amplifient une partie du promoteur IFN qui contient une séquence correspondant au site myogénine contraignante situé ~ 1075 pb en amont du site d'initiation de la transcription. Les séquences des amorces utilisées étaient 5'IFN-GCT GAC TCA AGA CCC CGA GGC-3 'et 5'-TGA GGA TGG AGG GGC AGG CC-3'. (Bas) quantitative en temps réel l'analyse par PCR des mêmes échantillons utilisés dans (A). L'données sont tracées en% de l'entrée + / - écart-type.
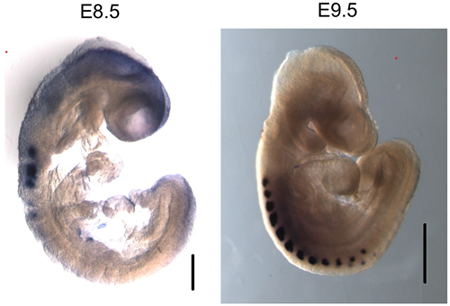
Figure 3. Myogenin est spécifiquement exprimé dans les somites et les embryons des E8.5 E9.5. Monter toute l'hybridation in situ de la myogénine montre expression de l'ARNm spécifique dans les somites. Barre de taille dans l'image E8.5 - 200 um. Barre de taille dans l'image E9.5 - 500 um.
Discussion
Dans le protocole décrit ChIP, nous montrons que le régulateur de myogénine myogénique est associé avec le promoteur myogénine dans les tissus musculaires squelettiques précurseur présent dans seule E8.5 E9.5 et d'embryons. Des études antérieures ont largement caractérisé myogénine liant à la boîte E contenant des séquences, à commencer par la première des expériences in vitro de retard sur gel en utilisant in vitro, traduits ou l'ADN des bactéries produites myogén...
Déclarations de divulgation
Remerciements
Ce travail a été soutenu par le NIH R01 GM56244 à Ani, qui inclut les fonds attribués par l'American Recovery and Reinvestment Act de 2009, et par le NIH R01 GM87130 d'Jarp
matériels
| Name | Company | Catalog Number | Comments |
| ChIP Assay Kit | Upstate, Millipore | 17-295 | |
| Collagenase Type II | Invitrogen | 17101015 | Dilution by 1 x PBS |
| Dulbecco’s modified eagle medium (DMEM) | GIBCO, by Life Technologies | 12100-061 | High glucose content |
| Dulbecco’s phosphate buffered saline 1X (DPBS) | GIBCO, by Life Technologies | 14190-144 | Calcium chloride free, Magnesium chloride free |
| Fetal bovine serum (FBS) | Mediatech, Inc. | 35-010-CV | |
| Gel extraction kit | QIAquick | 28704 | 50 reaction kit |
| Penicillin/streptomycin stock solution | GIBCO, by Life Technologies | 5000 μg/ml concentration | |
| Protease Inhibitor Cocktail | Sigma-Aldrich | P8340 | |
| Salmon sperm DNA /Protein A agarose | EMD Millipore | 16-157 | |
| myogenin antibody | Santa Cruz Biotechnology, Inc. | sc-576 | |
| Normal rabbit IgG | EMD Millipore | 12-370 | |
| Platinum PCR Supermix | Invitrogen | 11306-016 | |
| GoTaq Q-PCR master mix | Promega Corp. | A6001 |
Références
- Minard, M. E., Jain, A. K., Barton, M. C. Analysis of epigenetic alterations to chromatin during development. Genesis. 47, 559-572 (2009).
- Kuo, M. H., Allis, C. D. In vivo cross-linking and immunoprecipitation for studying dynamic Protein:DNA associations in a chromatin environment. Methods. 19, 425-433 (1999).
- Johnson, K. D., Bresnick, E. H. Dissecting long-range transcriptional mechanisms by chromatin immunoprecipitation. Methods. 26, 27-36 (2002).
- Yusuf, F., Brand-Saberi, B. The eventful somite: patterning, fate determination and cell division in the somite. Anat Embryol (Berl). 211, 21-30 (2006).
- Buckingham, M., Bajard, L., Chang, T., Daubas, P., Hadchouel, J., Meilhac, S., Montarras, D., Rocancourt, D., Relaix, F. The formation of skeletal muscle: from somite to limb. J Anat. 202, 59-68 (2003).
- Wright, W. E., Sassoon, D. A., Lin, V. K. Myogenin, a factor regulating myogenesis, has a domain homologous to MyoD. Cell. 56, 607-617 (1989).
- Edmondson, D. G., Olson, E. N. A gene with homology to the myc similarity region of MyoD1 is expressed during myogenesis and is sufficient to activate the muscle differentiation program. Genes Dev. 3, 628-640 (1989).
- Nabeshima, Y., Hanaoka, K., Hayasaka, M., Esumi, E., Li, S., Nonaka, I. Myogenin gene disruption results in perinatal lethality because of severe muscle defect. Nature. 364, 532-535 (1993).
- Hasty, P., Bradley, A., Morris, J. H., Edmondson, D. G., Venuti, J. M., Olson, E. N., Klein, W. H. Muscle deficiency and neonatal death in mice with a targeted mutation in the myogenin gene. Nature. 364, 501-506 (1993).
- Sassoon, D., Lyons, G., Wright, W. E., Lin, V., Lassar, A., Weintraub, H., Buckingham, M. Expression of two myogenic regulatory factors myogenin and MyoD1 during mouse embryogenesis. Nature. 341, 303-307 (1989).
- Brennan, T. J., Olson, E. N. Myogenin resides in the nucleus and acquires high affinity for a conserved enhancer element on heterodimerization. Genes Dev. 4, 582-595 (1990).
- Rosenthal, N., Berglund, E. B., Wentworth, B. M., Donoghue, M., Winter, B., Bober, E., Braun, T., Arnold, H. H. A highly conserved enhancer downstream of the human MLC1/3 locus is a target for multiple myogenic determination factors. Nucleic Acids Res. 18, 6239-6246 (1990).
- Braun, T., Gearing, K., Wright, W. E., Arnold, H. H. Baculovirus-expressed myogenic determination factors require E12 complex formation for binding to the myosin-light-chain enhancer. Eur J Biochem. 198, 187-193 (1991).
- Chakraborty, T., Brennan, T., Olson, E. Differential trans-activation of a muscle-specific enhancer by myogenic helix-loop-helix proteins is separable from DNA binding. J Biol Chem. 266, 2878-2882 (1991).
- French, B. A., Chow, K. L., Olson, E. N., Schwartz, R. J. Heterodimers of myogenic helix-loop-helix regulatory factors and E12 bind a complex element governing myogenic induction of the avian cardiac alpha-actin promoter. Mol Cell Biol. 11, 2439-2450 (1991).
- Brennan, T. J., Chakraborty, T., Olson, E. N. Mutagenesis of the myogenin basic region identifies an ancient protein motif critical for activation of myogenesis. Proc Natl Acad Sci U S A. 88, 5675-5679 (1991).
- Lassar, A. B., Davis, R. L., Wright, W. E., Kadesch, T., Murre, C., Voronova, A., Baltimore, D., Weintraub, H. Functional activity of myogenic HLH proteins requires hetero-oligomerization with E12/E47-like proteins in vivo. Cell. 66, 305-315 (1991).
- Chakraborty, T., Brennan, T. J., Li, L., Edmondson, D., Olson, E. N. Inefficient homooligomerization contributes to the dependence of myogenin on E2A products for efficient DNA binding. Mol Cell Biol. 11, 3633-3641 (1991).
- Cserjesi, P., Olson, E. N. Myogenin induces the myocyte-specific enhancer binding factor MEF-2 independently of other muscle-specific gene products. Mol Cell Biol. 11, 4854-4862 (1991).
- Braun, T., Arnold, H. H. The four human muscle regulatory helix-loop-helix proteins Myf3-Myf6 exhibit similar hetero-dimerization and DNA binding properties. Nucleic Acids Res. 19, 5645-5651 (1991).
- Serna, d. e. l. a., L, I., Ohkawa, Y., Berkes, C. A., Bergstrom, D. A., Dacwag, C. S., Tapscott, S. J., Imbalzano, A. N. MyoD targets chromatin remodeling complexes to the myogenin locus prior to forming a stable DNA-bound complex. Mol Cell Biol. 25, 3997-4009 (2005).
- Blais, A., Tsikitis, M., Acosta-Alvear, D., Sharan, R., Kluger, Y., Dynlacht, B. D. An initial blueprint for myogenic differentiation. Genes Dev. 19, 553-569 (2005).
- Cao, Y., Kumar, R. M., Penn, B. H., Berkes, C. A., Kooperberg, C., Boyer, L. A., Young, R. A., Tapscott, S. J. Global and gene-specific analyses show distinct roles for Myod and Myog at a common set of promoters. EMBO J. 25, 502-511 (2006).
- Ohkawa, Y., Yoshimura, S., Higashi, C., Marfella, C. G., Dacwag, C. S., Tachibana, T., Imbalzano, A. N. Myogenin and the SWI/SNF ATPase Brg1 maintain myogenic gene expression at different stages of skeletal myogenesis. J Biol Chem. 282, 6564-6570 (2007).
- Davie, J. K., Cho, J. H., Meadows, E., Flynn, J. M., Knapp, J. R., Klein, W. H. Target gene selectivity of the myogenic basic helix-loop-helix transcription factor myogenin in embryonic muscle. Dev Biol. 311, 650-664 (2007).
- Metivier, R., Penot, G., Hubner, M. R., Reid, G., Brand, H., Kos, M., Gannon, F. Estrogen receptor-alpha directs ordered, cyclical, and combinatorial recruitment of cofactors on a natural target promoter. Cell. 115, 751-763 (2003).
- Ausubel, F. M., Brent, R., Kingston, R. E., Moore, D. D., Seidman, J. G., Smith, J. A., Struhl, K. . Current Protocols in Molecular Biology. , (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon