Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Хроматин Иммунопреципитация Пробирной для тканеспецифические Гены использованием ранней стадии эмбрионы мыши
В этой статье
Резюме
Мы демонстрируем иммунопреципитации хроматина (чип) метод идентификации факторных взаимодействий в тканях специфических генов во время или после наступления тканеспецифические экспрессии генов в тканях мышей в зачаточном состоянии. Этот протокол должен быть широко применяется для изучения тканеспецифические активации генов, как это происходит во время нормального эмбрионального развития.
Аннотация
Хроматин иммунопреципитации (чип) является мощным инструментом для определения белка: хроматина взаимодействий, которые происходят в контексте живых клеток 1-3. Эта техника была широко использована в клетках тканевой культуры, и в меньшей степени, в первичных тканей. Применение чипа грызунов эмбриональной ткани, особенно на ранних времен развития, осложняется ограниченным количеством ткани и гетерогенность клеточной и тканевой типы в зародыше. Здесь мы представляем метод для выполнения чипов с помощью эмбриональных диссоциированных день 8,5 (E8.5) эмбриона. Стриженый хроматина из одного E8.5 эмбриона можно разделить на срок до пяти аликвоты, которая позволяет следователю достаточно материала для элементов управления и для исследования специфического белка: хроматина взаимодействий.
Мы использовали эту технику, чтобы начать документа белка: хроматина взаимодействий в спецификации тканеспецифические программ экспрессии генов. Неоднородность типов клеток в эмбрионе обязательно ограничивает применение этого метода, поскольку в результате обнаружения белка: хроматина взаимодействия без выделения ли взаимодействия происходят во всех, подмножество, или одного типа клеток (ы). Тем не менее, исследование тканей определенных генов во время или после начала тканеспецифические экспрессии гена возможна по двум причинам. Во-первых, иммунопреципитации ткани специфические факторы обязательно изолирует хроматина от типа клеток, где фактор выражается. Во-вторых, иммунопреципитации коактиваторов и гистонов содержащие пост-трансляционной модификации, которые связаны с активацией генов должно быть найдено только на гены и регуляторные последовательности гена в клетке типа, где ген или были активированы. Техника должна быть применима к изучению наиболее тканеспецифические события активации генов.
В примере, описанном ниже, мы использовали E8.5 и эмбрионов мыши E9.5 для изучения связывания факторов в скелетных мышцах конкретного промотора гена. Сомитов, которые предшественник ткани, из которой скелетных мышц туловища и конечностей образуют, присутствуют на E8.5-9.5 4,5. Myogenin является регулирующим фактором, необходимых для скелетных мышц дифференциации 6-9. Данные показывают, что myogenin связан с собственным промоутером в E8.5 и E9.5 эмбрионов. Потому что myogenin выражается только в сомитов на данном этапе развития 6,10, данные показывают, что myogenin взаимодействия со своими промоутером уже имели место в скелетных мышцах клеток-предшественников в E8.5 эмбрионов.
протокол
1. Выделение Эмбрионы
Примечание: Все операции, связанные с мышами должны быть выполнены в соответствии с надлежащего ухода и использования животного политику и протоколы
- Проверить наличие спаривания подключить мышь женского пола утром после спаривания и отдельных повязана самок из стада мужчин, помещая их в различные клетки. Полдень в день, что ответным штепселем наблюдается считается день эмбрионального 0,5 (E0.5) развития.
- На E8.5 (или желаемый этап, если отличается), жертвенность мыши, используя утвержденным протоколом.
- Влажные живот эвтаназии животных с 70% этанола и открытой брюшной полости. Имплантация сайты указывающих на наличие развивающиеся эмбрионы рассматриваются как "бусы на строку" договоренность по длине каждого рога матки (рис. 1А). Использование ножницы, удалить оба рога матки, разрезать каждый имплантации индивидуально для разделения (рис. 1В) и поместите их в 100 мм чашки Петри содержащие комнатной температуре (RT) рассечение среды (DMEM, 10% эмбриональной телячьей сыворотки, 20 мМ HEPES рН 7,4 , 60 мкг / мл пенициллина, стрептомицина, 2 мМ).
- Использование пинцета, извлекайте каждый эмбрион и окружающие мембраны из ткани матки (рис. 1C) и поместите их в свежую среду рассечение.
- Изоляция отдельных эмбрионов при вскрытии микроскопом использованием щипцов. На данном этапе развития, эмбрионы окружены теменной желточного мешка, который контактирует deciduum тканей, внутренних органов желточного мешка и амнион. Амниона представляет собой прозрачную мембрану, которая находится в непосредственном контакте с эмбрионом. Висцерального желточный мешок расположен между амнион и мешок теменной желток и легко отличается в E8.5-E9.5 эмбрионов на наличие известных кровеносных сосудов, которые питают эмбриона. Удалить каждый эмбрион от окружающей его оболочки и передачу индивидуально в новую пластину, содержащую вскрытия средств массовой информации, чтобы удалить лишнюю кровь. Стадии развития может варьироваться от эмбриона эмбриона, а также между пометов, представитель E8.5 эмбрионов и эмбрионов представитель E9.5 показаны на рис 1D.
- Передача каждого эмбриона 1,5 мл Eppendorf пробирку, содержащую 200 мкл рассечение СМИ (описанных в пункте 4 выше).
2. Усреднение Изолированные эмбрионов
- Добавить 20 единиц коллагеназы типа II в объеме 200 мкл (разводится в фосфат 1X Dubbecco в солевом буфере; DPBS) в каждую пробирку Эппендорф.
- Осторожно встряхните образцов в 37 ° C шейкере при 100 оборотов в минуту в течение 20 мин.
- Ресуспендируют также с помощью пипетки сорвать скопления клеток.
- Применение клеточной суспензии в верхней части стерильных сито ячейка (40 мкм размер ячейки), размещенные на 1,5 мл трубки Эппендорф.
- Сразу же применить 600 мкл комнатной температуре 1X DPBS на верхней части ячейки фильтра для завершения разделения. Отменить фильтр.
- Центрифуга образцов при 4 ° С при 4000 мкг в течение 5 мин.
- Удалите супернатант.
- Ресуспендируют гранул в 1 мл РТ DPBS 1X.
- Центрифуга образцы при 4000 мкг в течение 1 мин при комнатной температуре.
- Удалите супернатант.
- Ресуспендируют осадок в 200 мкл среды РТ рассечение.
- Граф эмбриональных клеток. Существует среднем 3-5 х 10 6 cells/E8.5 эмбриона.
3. Перекрестная ссылка хроматина
- Добавить 5,6 мкл 37% формальдегида в 200 мкл образцов для конечной концентрации 1% формальдегида.
- Инкубируйте образцы в течение 10 мин при комнатной температуре.
- Центрифуга образцов при 4 ° С при 4000 мкг в течение 3 мин.
- Удалите супернатант.
- Ресуспендируют клетки с холодной 1X DPBS содержащей 80 мкл / мл коктейля ингибитор протеазы (ПОС).
- Центрифуга образцов при 4 ° С при 4000 мкг в течение 3 мин.
- Удалите супернатант. На этом этапе образцы могут быть заморожены при температуре -80 ° C. Замороженные, сшитые образцы стабильны в течение нескольких месяцев.
4. Разрушение ультразвуком
- Ресуспендируют осадок клеток в 100 мкл RT SDS лизирующего буфера (50 мМ Трис-HCl (рН 8,1), 10 мМ ЭДТА и 1% SDS с только что добавил ПИК в 1 мкл PIC/800 мкл общего объема). Когда ресуспендировали, добавить еще 100 мкл буфера для лизиса РТ SDS содействовать ресуспендирования. Хорошо перемешать с помощью пипетки и инверсии.
- Инкубируйте клеточной суспензии на льду в течение 10 мин.
- Разрушать ультразвуком лизировали клетки сдвига ДНК, чтобы между 200 и 500 пар оснований использованием Diagenode Bioruptor ™ UCD200 (5 мин х 8 раз: амплитуда установка 30 сек on/30 сек прочь на высоком (320 Вт) мощности). Образцы должны быть окружены льду суспензии. Не допускайте, чтобы нагреть образцы выше 4 ° С или заморозить. Есть много типов sonicators доступны. Ультразвуком условия должны быть оптимизированы для каждого sonicator привести к стрижка сшитого ДНК длиной около 500 пар оснований.
- Центрифуга ультразвуком образцов при температуре 4 ° С при 14 000 мкг в течение 10 мин.
- Тransfer супернатант в новую пробирку Эппендорфа предварительно охладить на льду.
- Разделите ультразвуком образца в максимум 5 аликвоты. У нас есть эмпирически установлено, что один E8.5 эмбриона можно разделить на 5 порций. Меньший или больший размер выборки можно масштабировать соответственно. На этом этапе образцы могут храниться при температуре -80 ° C до последующего использования.
- Резервный один аликвоту для использования в качестве входных данных и хранить при температуре -20 ° С до шага 6, когда перекрестные ссылки будут обращены вспять. Развести другие аликвоты 10-кратный в чип буфера разбавления (16,7 мМ Трис-HCl (рН 8,1), 1,2 мМ ЭДТА, 1,1% Тритон Х-100, 167 мМ NaCl и 0,01% SDS), содержащий только что добавил ПИК на 1 μl/800 мкл буфера.
5. Предварительная очистка и Иммунопреципитация
- Предварительно ясно разбавленной надосадочной с 75 мкл Лосось-спермы ДНК / белка или G агарозном-50% раствора при температуре 4 ° С, с вращением, в течение 1 часа. Использование либо белков или бусы Protein G должна определяться антитела, которые будут использоваться для чип. Например, белковые гранулы рекомендуется для кролика антител, в то время как белок G бисер рекомендуется для козьих антител или мыши IgG 1 антител. Для получения более подробной информации см. рекомендации производителя шарик.
- Центрифуга при 4 ° С при 2500 мкг в течение 1 мин.
- Передача супернатант на новый, предварительно охладить пробирку Эппендорфа.
- Добавить антител (4 мкг / образец), чтобы предварительно очищен аликвоту и инкубировать в течение ночи при 4 ° С с вращением.
6. Стиральная Хроматин-белок-бусинка комплекс
- Добавить 60 мкл ДНК спермы лосося / Белок или G агарозном суспензии в каждую пробирку и инкубируют при 4 ° С с вращением в течение 1 часа. Используйте те же шарик тип используется для предварительной очистки в шаге 3 выше.
- Центрифуга при 4 ° С при 1000 мкг в течение 1 мин.
- Осторожно удалите супернатант и выбросьте. Держите ДНК-белок-бусинка комплекса на льду.
- Ресуспендируют и промыть осадок, как указано ниже промывочным буферов 1, 2, 3 и 4. Вымойте буферов 1-3 должны быть охлажденными до 4 ° C и моет эти буферы должны быть выполнены при 4 ° C. Промывочного буфера 4 следует при комнатной температуре и смывает с этого буфера должны быть выполнены при комнатной температуре. Каждая промывка в течение 5 минут с вращением при соответствующей температуре. После каждого мытья, центрифуги при 4 ° С (комнатной температуре в течение промывочного буфера 4 моет) при 1000 мкг в течение 1 мин, затем аккуратно аспирата или удалить супернатант.
Буфер 1: Низкая промывочный буфер соли (20 мМ Трис-HCl (рН 8,1), 2 мМ ЭДТА, 1% Triton X-100,
150 мМ NaCl и 0,1% SDS), 1 мл х 2 стирок.
Буфер 2: Высокое промывочный буфер соли (20 мМ Трис-HCl (рН 8,1), 2 мМ ЭДТА, 1% Triton X-100,
500 мМ NaCl и 0,1% SDS), 1 мл х 2 стирок.
Буфер 3: LiCl соль промывочного буфера (10 мМ Трис-HCl (рН 8,1), 1 мМ ЭДТА, 1% Igepal-CA630,
0,25 М LiCl и 1% deoxycholic кислотой (натриевая соль)), 1 мл х 1 стирки.
Буфер 4: ТЕ-буфера (10 мМ Трис-HCl (рН 8,1), 1 мМ ЭДТА), 1 мл х 2 стирок.
7. Элюирование Хроматин-антитело
- Ресуспендируют мыть хроматин-белок-бусинка комплекс в 250 мкл свежеприготовленного буфера элюирования (1% SDS, 0,1 М NaHCO 3). Энергично вихрь образца в течение 5 сек, то инкубировать при комнатной температуре в течение 15 мин с вращением.
- Центрифуга при 2500 мкг в течение 1 мин при комнатной температуре и передача элюата в трубку новые Эппендорф.
- Повторите шаги 1 и 2 и объединить элюатов в той же пробирке Эппендорф. Элюатов должны храниться при комнатной температуре. После завершения этого шага, элюатов могут храниться при температуре -20 ° C до последующего использования.
8. Обратный кросс-ссылки и восстановление ДНК
- Добавьте 20 мкл 5 М NaCl в течение 500 мкл элюата (40 мкл / мл для входного контроля).
- Тепло элюатов при 65 ° С на водяной бане в течение 4 часов, чтобы за одну ночь.
- 10 мкл каждого образца (в том числе входного контроля) может быть запущен на 2% агарозном геле рядом с размером маркеры охватывающей 0,1 до 1 кб, чтобы проверить размер фрагмента ДНК. ДНК будет выглядеть как мазок, а не резким группы. Остальные образцы можно оставить на 65 ° С, в то время как гель работает.
- Восстановление ДНК из каждого образца с помощью QIAquick Гель Добыча Kit (Qiagen). Добавить 600 мкл буфера QG (поставляется в комплекте) для оптимизации ДНК адсорбции с кремнеземом мембраны в колонке QIAquick спина и 200 мкл изопропанола в 500 мкл образца. Обратите внимание, что буфер содержит QG рН индикатор позволяет легко определять рН образца. Если цвет образца оказывается от желтого до фиолетового (рН> 7,5) после смешивания, добавить 10 мкл 3 NaAcetate М (рН 5,2) к образцу и перемешать. Это снижает рН смеси до максимального связывания ДНК с бисером в столбце.
- Перед загрузкой колонки, проверьте смесь определить, является ли какой-либо осадок SDS присутствует. Если SDS осадков произошло, образец должен быть нагрет в42 ° С водяной бане, пока осадок не исчезнет.
- Нагрузка 700 мкл смеси в колонке QIAquick спина (фиолетовый столбец в комплект) и центрифуги при комнатной температуре на 14 000 мкг в течение 1 мин. Откажитесь от потока через колонку с прежде чем продолжить и повторить этот шаг с остальной части образца.
- Добавить 500 мкл буфера QG мыть колонке. Центрифуга при комнатной температуре на 14 000 мкг в течение 2 мин. Откажитесь от потока через колонку с прежде чем продолжить.
- Промыть колонку с 700 мкл промывочного буфера PE (поставляется в комплекте), к которому этанола была добавлена в соответствии с инструкциями производителя. Центрифуга при комнатной температуре на 14 000 мкг в течение 1 мин. Откажитесь от потока через колонку с прежде чем продолжить.
- Повторите шаг центрифугирования, чтобы полностью удалить оставшуюся часть буфера PE из колонки. Откажитесь от потока через и пробирки.
- Элюции ДНК из колонки в новую пробирку Эппендорф, добавляя 60 мкл буфера EB (элюирование буфера поставляется в комплекте).
- Центрифуга при комнатной температуре на 14 000 мкг в течение 1 мин. Элюируют ДНК можно хранить при температуре от -20 ° C до обнаружения. 260 показания извлеченных материалов обычно указывают концентрации 90-120 нг / мкл, для полного восстановления ~ 6-7 мкг в аликвоту. Тем не менее, 260/280 соотношение этих образцов, как правило,> 1,8, предполагая, что РНК присутствуют в образце. Таким образом, точное количество восстановленных ДНК может быть ниже.
9. Анализ ДНК Восстановленные
- СДС может вмешиваться в деятельность полимеразы Taq ПЦР. ИКБ должна быть полностью удалены перед выполнением ПЦР. Инкубируйте ДНК на льду для осаждения остаточного SDS и центрифуги при 4 ° С при 14 000 мкг в течение 1 мин. Передача супернатант на новую ступень Эппендорф tube.This настоятельно рекомендуется.
- ДНК элюатов могут быть обнаружены либо обычными ПЦР или количественного ПЦР в реальном времени (Q-ПЦР) с праймерами, специфичными для каждой последовательности для анализа. 5-10 мкл элюата от общего ДНК может быть использован для одной ПЦР или Q-PCR реакции. ПЦР с входной контроль может осуществляться с 5-10 раз разведения ДНК по сравнению с количеством других образцов. ПЦР и Q-PCR условия будут меняться, однако, ограниченное количество исходного материала требует дополнительных циклов ПЦР. Для обычных обнаружения ПЦР, мы рекомендуем начать с 40 циклов и корректировки по мере необходимости.
10. Представитель Результаты
Мы использовали этот протокол для выполнения чип от обоих E8.5 и E9.5 эмбрионов (рис. 2). Результаты показывают, что myogenin присутствует на myogenin промотора в E8.5 и E9.5 эмбрионов. ChIP ДНК, очищенная анализировали с помощью обычной ПЦР (рис. 2А) и количественный ПЦР в реальном времени (рис. 2В). В отличие от этого, не было никаких признаков myogenin привязки к myogenin промотора в желточный мешок, где myogenin не выражен. Интерферона-γ (IFNγ) промоутер, который содержит последовательности, соответствующие myogenin сайт связывания, был использован в качестве отрицательного контроля последовательности. Как и ожидалось, myogenin не был связан с IFNγ промоутером в одном из образцов ткани проверены. В E8.5 и 9,5 эмбрионов, myogenin специально выражается в сомитов (рис. 3, 6,10), которые являются предшественниками скелетных мышцах. Таким образом, результаты показывают, что myogenin обязан myogenin промотора в сомитов на E8.5 и E9.5.
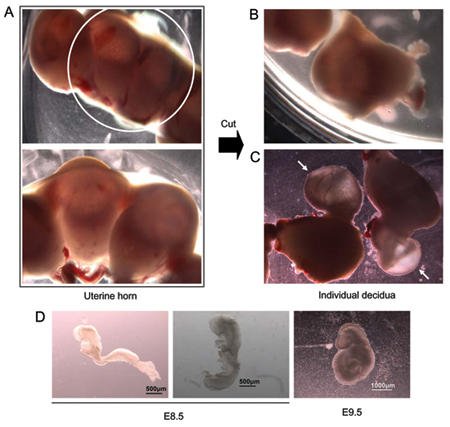
Рисунок 1. E8.5 эмбриона рассечение. (А) Изолированные рога матки (верхняя панель; большем увеличении показано на нижней панели). (B) роге матки разрезать ножницами для разделения отдельных сайтов, содержащих отдельные имплантации эмбрионов. (C) Эмбрионы торчащих из ткани матки во время вскрытия. Стрелками эмбрионов до сих пор покрыта экстра-эмбриональной ткани. (D) два E8.5 эмбрионов из одного помета. Эмбриона на левом еще не начался процесс превращения. Эмбриона на правом проходит поворот. Дальний правый - представитель эмбриона E9.5.
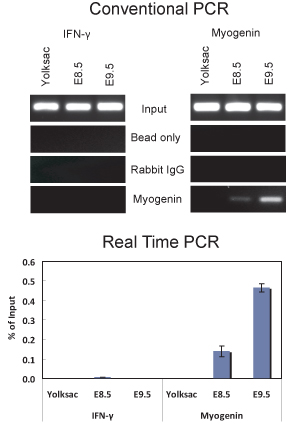
Рисунок 2. ChIP анализ демонстрирует myogenin привязки к myogenin промотора в E8.5 и E9.5 эмбрионов. (Вверху) Обычные анализ ПЦР из 5 мкл ДНК очищали от ChIP экспериментов с использованием myogenin антител или неспецифических IgG проводили с праймерами, которые усиливают часть myogenin промоутер от -79 до +69 относительно начала сайта транскрипции, что содержит myogenin сайт связывания расположен на -12 или праймеры, которые усиливают часть IFNγ промоутер, который содержит последовательность соответствующих myogenin сайт связывания расположен ~ 1075 б.п. вверх по течению от места старта транскрипции. IFNγ грунтовки последовательности были использованы 5'-GCT GAC TCA AGA CCC CGA GGC-3 'и 5'-GGA TGA TGG GGC AGG AGG CC-3'. (Внизу) Количественный ПЦР в реальном времени анализ тех же образцов, используемых в (А).Данные приведены в% от вход + / - стандартное отклонение.
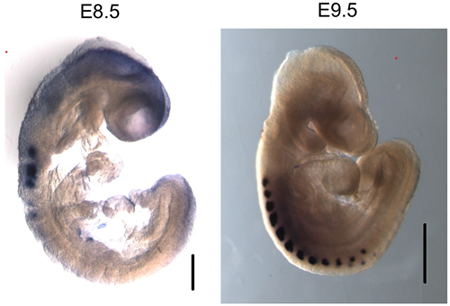
Рисунок 3. Myogenin специально выражается в сомитов из E8.5 и E9.5 эмбрионов. Всего монтировать на месте гибридизация myogenin показывает конкретное выражение мРНК в сомитов. Размер бар в E8.5 изображение - 200 мкм. Размер бар в E9.5 изображение - 500 мкм.
Обсуждение
В описанных ChIP протокол, мы покажем, что миогенной myogenin регулятор связан с myogenin промоутер в ткани скелетных мышц предшественником присутствует в одном E8.5 и E9.5 эмбрионов. До исследования широко характеризуется myogenin привязка к E коробке, содержащей последовательности, начиная с начально...
Раскрытие информации
Благодарности
Эта работа была поддержана NIH R01 GM56244 в Ани, который включает в себя средства награждены через оздоровлении американской экономики и реинвестировании 2009 года, а по НИЗ R01 GM87130 к Jarp
Материалы
| Name | Company | Catalog Number | Comments |
| ChIP Assay Kit | Upstate, Millipore | 17-295 | |
| Collagenase Type II | Invitrogen | 17101015 | Dilution by 1 x PBS |
| Dulbecco’s modified eagle medium (DMEM) | GIBCO, by Life Technologies | 12100-061 | High glucose content |
| Dulbecco’s phosphate buffered saline 1X (DPBS) | GIBCO, by Life Technologies | 14190-144 | Calcium chloride free, Magnesium chloride free |
| Fetal bovine serum (FBS) | Mediatech, Inc. | 35-010-CV | |
| Gel extraction kit | QIAquick | 28704 | 50 reaction kit |
| Penicillin/streptomycin stock solution | GIBCO, by Life Technologies | 5000 μg/ml concentration | |
| Protease Inhibitor Cocktail | Sigma-Aldrich | P8340 | |
| Salmon sperm DNA /Protein A agarose | EMD Millipore | 16-157 | |
| myogenin antibody | Santa Cruz Biotechnology, Inc. | sc-576 | |
| Normal rabbit IgG | EMD Millipore | 12-370 | |
| Platinum PCR Supermix | Invitrogen | 11306-016 | |
| GoTaq Q-PCR master mix | Promega Corp. | A6001 |
Ссылки
- Minard, M. E., Jain, A. K., Barton, M. C. Analysis of epigenetic alterations to chromatin during development. Genesis. 47, 559-572 (2009).
- Kuo, M. H., Allis, C. D. In vivo cross-linking and immunoprecipitation for studying dynamic Protein:DNA associations in a chromatin environment. Methods. 19, 425-433 (1999).
- Johnson, K. D., Bresnick, E. H. Dissecting long-range transcriptional mechanisms by chromatin immunoprecipitation. Methods. 26, 27-36 (2002).
- Yusuf, F., Brand-Saberi, B. The eventful somite: patterning, fate determination and cell division in the somite. Anat Embryol (Berl). 211, 21-30 (2006).
- Buckingham, M., Bajard, L., Chang, T., Daubas, P., Hadchouel, J., Meilhac, S., Montarras, D., Rocancourt, D., Relaix, F. The formation of skeletal muscle: from somite to limb. J Anat. 202, 59-68 (2003).
- Wright, W. E., Sassoon, D. A., Lin, V. K. Myogenin, a factor regulating myogenesis, has a domain homologous to MyoD. Cell. 56, 607-617 (1989).
- Edmondson, D. G., Olson, E. N. A gene with homology to the myc similarity region of MyoD1 is expressed during myogenesis and is sufficient to activate the muscle differentiation program. Genes Dev. 3, 628-640 (1989).
- Nabeshima, Y., Hanaoka, K., Hayasaka, M., Esumi, E., Li, S., Nonaka, I. Myogenin gene disruption results in perinatal lethality because of severe muscle defect. Nature. 364, 532-535 (1993).
- Hasty, P., Bradley, A., Morris, J. H., Edmondson, D. G., Venuti, J. M., Olson, E. N., Klein, W. H. Muscle deficiency and neonatal death in mice with a targeted mutation in the myogenin gene. Nature. 364, 501-506 (1993).
- Sassoon, D., Lyons, G., Wright, W. E., Lin, V., Lassar, A., Weintraub, H., Buckingham, M. Expression of two myogenic regulatory factors myogenin and MyoD1 during mouse embryogenesis. Nature. 341, 303-307 (1989).
- Brennan, T. J., Olson, E. N. Myogenin resides in the nucleus and acquires high affinity for a conserved enhancer element on heterodimerization. Genes Dev. 4, 582-595 (1990).
- Rosenthal, N., Berglund, E. B., Wentworth, B. M., Donoghue, M., Winter, B., Bober, E., Braun, T., Arnold, H. H. A highly conserved enhancer downstream of the human MLC1/3 locus is a target for multiple myogenic determination factors. Nucleic Acids Res. 18, 6239-6246 (1990).
- Braun, T., Gearing, K., Wright, W. E., Arnold, H. H. Baculovirus-expressed myogenic determination factors require E12 complex formation for binding to the myosin-light-chain enhancer. Eur J Biochem. 198, 187-193 (1991).
- Chakraborty, T., Brennan, T., Olson, E. Differential trans-activation of a muscle-specific enhancer by myogenic helix-loop-helix proteins is separable from DNA binding. J Biol Chem. 266, 2878-2882 (1991).
- French, B. A., Chow, K. L., Olson, E. N., Schwartz, R. J. Heterodimers of myogenic helix-loop-helix regulatory factors and E12 bind a complex element governing myogenic induction of the avian cardiac alpha-actin promoter. Mol Cell Biol. 11, 2439-2450 (1991).
- Brennan, T. J., Chakraborty, T., Olson, E. N. Mutagenesis of the myogenin basic region identifies an ancient protein motif critical for activation of myogenesis. Proc Natl Acad Sci U S A. 88, 5675-5679 (1991).
- Lassar, A. B., Davis, R. L., Wright, W. E., Kadesch, T., Murre, C., Voronova, A., Baltimore, D., Weintraub, H. Functional activity of myogenic HLH proteins requires hetero-oligomerization with E12/E47-like proteins in vivo. Cell. 66, 305-315 (1991).
- Chakraborty, T., Brennan, T. J., Li, L., Edmondson, D., Olson, E. N. Inefficient homooligomerization contributes to the dependence of myogenin on E2A products for efficient DNA binding. Mol Cell Biol. 11, 3633-3641 (1991).
- Cserjesi, P., Olson, E. N. Myogenin induces the myocyte-specific enhancer binding factor MEF-2 independently of other muscle-specific gene products. Mol Cell Biol. 11, 4854-4862 (1991).
- Braun, T., Arnold, H. H. The four human muscle regulatory helix-loop-helix proteins Myf3-Myf6 exhibit similar hetero-dimerization and DNA binding properties. Nucleic Acids Res. 19, 5645-5651 (1991).
- Serna, d. e. l. a., L, I., Ohkawa, Y., Berkes, C. A., Bergstrom, D. A., Dacwag, C. S., Tapscott, S. J., Imbalzano, A. N. MyoD targets chromatin remodeling complexes to the myogenin locus prior to forming a stable DNA-bound complex. Mol Cell Biol. 25, 3997-4009 (2005).
- Blais, A., Tsikitis, M., Acosta-Alvear, D., Sharan, R., Kluger, Y., Dynlacht, B. D. An initial blueprint for myogenic differentiation. Genes Dev. 19, 553-569 (2005).
- Cao, Y., Kumar, R. M., Penn, B. H., Berkes, C. A., Kooperberg, C., Boyer, L. A., Young, R. A., Tapscott, S. J. Global and gene-specific analyses show distinct roles for Myod and Myog at a common set of promoters. EMBO J. 25, 502-511 (2006).
- Ohkawa, Y., Yoshimura, S., Higashi, C., Marfella, C. G., Dacwag, C. S., Tachibana, T., Imbalzano, A. N. Myogenin and the SWI/SNF ATPase Brg1 maintain myogenic gene expression at different stages of skeletal myogenesis. J Biol Chem. 282, 6564-6570 (2007).
- Davie, J. K., Cho, J. H., Meadows, E., Flynn, J. M., Knapp, J. R., Klein, W. H. Target gene selectivity of the myogenic basic helix-loop-helix transcription factor myogenin in embryonic muscle. Dev Biol. 311, 650-664 (2007).
- Metivier, R., Penot, G., Hubner, M. R., Reid, G., Brand, H., Kos, M., Gannon, F. Estrogen receptor-alpha directs ordered, cyclical, and combinatorial recruitment of cofactors on a natural target promoter. Cell. 115, 751-763 (2003).
- Ausubel, F. M., Brent, R., Kingston, R. E., Moore, D. D., Seidman, J. G., Smith, J. A., Struhl, K. . Current Protocols in Molecular Biology. , (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены