Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La medición bioquímica de la hipoxia neonatal
En este artículo
Resumen
Se describe un método para medir los marcadores bioquímicos de la hipoxia-isquemia neonatal. El enfoque utiliza cromatografía líquida de alta resolución (HPLC) y cromatografía de gases espectrometría de masas (GC / MS).
Resumen
Isquemia hipoxia neonatal se caracteriza por una perfusión inadecuada de la sangre de un tejido o una sistemática falta de oxígeno. Esta condición se piensa que causa / exacerbar bien documentado trastornos neonatales entre ellas el deterioro neurológico 1-3. Disminución de la producción de trifosfato de adenosina se produce debido a la falta de fosforilación oxidativa. Para compensar este estado de energía privados moléculas que contienen enlaces de fosfato de alta energía son dos degradados. Esto lleva a mayores niveles de adenosina, que posteriormente se degrada a inosina, hipoxantina, xantina, y finalmente en ácido úrico. Los dos últimos pasos de este proceso de degradación se llevan a cabo por la xantina oxidorreductasa. Esta enzima existe en la forma de la xantina deshidrogenasa en condiciones normoxic pero se convierte en xantina oxidasa (XO) en circunstancias reperfusión hipoxia-4, 5. A diferencia de xantina deshidrogenasa, XO genera peróxido de hidrógeno como un subproducto de la degradación de purinas 4, 6. Este peróxido de hidrógeno en combinación con otras especies de oxígeno reactivo (ROS) se producen durante la hipoxia, oxida el ácido úrico a alantoína forma y reacciona con las membranas lipídicas para generar malondialdehído (MDA) 7-9. La mayoría de los mamíferos, los humanos exentos, poseen la enzima uricasa, que convierte el ácido úrico en alantoína. En los seres humanos, sin embargo, la alantoína sólo puede estar formado por ROS mediada por la oxidación del ácido úrico. Debido a esto, la alantoína se considera un marcador de estrés oxidativo en los seres humanos, pero no en los mamíferos que han uricasa.
Se describen los métodos que emplean cromatografía líquida de alta resolución (HPLC) y cromatografía de gases espectrometría de masas (GCMS) para medir los marcadores bioquímicos de isquemia hipoxia neonatal. La sangre humana se utiliza para la mayoría de las pruebas. Sangre de los animales también se puede utilizar sin dejar de reconocer el potencial de uricasa generado alantoína. Metabolitos de purinas estaban vinculados a la hipoxia en 1963 y la fiabilidad de hipoxantina, xantina y ácido úrico como indicadores bioquímicos de la hipoxia neonatal fue validada por varios investigadores 10-13. El método de HPLC utilizado para la cuantificación de los compuestos de purina es rápido, fiable y reproducible. El método de GC / MS utilizados para la cuantificación de alantoína, un marcador relativamente nuevo de estrés oxidativo, es una adaptación de Gruber et al 7. Este método evita ciertos artefactos y requiere un volumen bajo de la muestra. Los métodos utilizados para la síntesis de MMDA se describen en otros lugares 14, 15. GC / MS cuantificación base de MDA es una adaptación de Paroni et al. y Cighetti et al. 16, 17. Xantina oxidasa se midió por HPLC mediante la cuantificación de la conversión de pterina a isoxanthopterin 18. Este planteamiento resultó ser lo suficientemente sensibles y reproducibles.
Protocolo
1. Recolección y procesamiento de
- Recoja la muestra de sangre en un tubo de 6 ml EDTA K3 K3E que se mantiene en hielo.
- Menos de 2 minutos de la recolección, se centrifuga la muestra a 4 ° C a 1500 g durante 10 minutos.
- Transferir el sobrenadante (plasma) a un tubo de microcentrífuga de 1,5 ml.
- Se centrifuga a 4 ° C en 18.000 g durante 30 minutos.
- Eliminar las alícuotas de sobrenadante y transferirlas a tubos de microcentrífuga separados para las purinas (200μl), alantoína (50μl), MDA (100μl), y el análisis de XO (120μl). Tenga cuidado de no contaminar las muestras con los glóbulos rojos. Es posible que necesite ajustar los volúmenes de plasma para la MDA, XO, y purines en base al volumen total de plasma disponibles.
2. Preparación del estándar interno, 2-aminopurine (2-AP), de las purinas y Análisis de XO
- Pesar 0.01351g 2-AP y agregarlo a 8 ml de agua que ha sido acidificado con 2-5 gotas de ácido clorhídrico. Si el 2-AP, no se disuelve es necesario agregar más ácido. Ajustar el volumen final de 10 ml.
- Utilizar el espectrofotómetro UV-Vis para determinar la concentración real de sus acciones 2-AP solución. (Λmax 315, ε 4000).
- Una vez que la concentración de la población de 2-AP solución está determinada, calcular el volumen necesario para contener 1x10 -7 mol 2-AP estándar interno para las mediciones de purina y de 1x10 -8 mol 2-AP estándar interno para mediciones XO.
- Alícuota de los volúmenes calculados en tubos de microcentrífuga separados y evaporar a sequedad en un SpeedVac.
Ecuación 1: 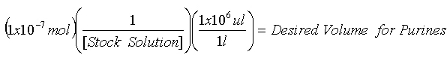
Ecuación 2: 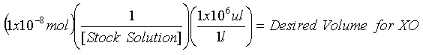
3. HPLC de medición de las purinas
- Transferencia de plasma (200μl) a un Microcon YM-10 dispositivo centrífugo de filtro y se centrifuga a 4 ° C a 14000 g durante 1,5 horas.
- Retire el filtrado y pasarlos a un tubo de microcentrífuga que contiene 1x10 -7 mol 2-AP. Asegúrese de registrar el volumen de filtrado añadido al tubo de microcentrífuga que contiene el 2-AP. Vortex las muestras durante 10-20 segundos.
- Analizar las muestras con un HPLC. Tres inyecciones de 50 l se utilizan para cada muestra. Las muestras se inyectaron en una Supelcosil LC-18-S, 15 cm x 4.6 mm, 5 m de columna equipada con un Supelguard LC-18-S de guardia de la columna. Las condiciones de gradiente en la tabla 1 se debe utilizar para obtener la separación pico adecuado: disolvente A-agua, disolvente B-metanol, solvente C-50 mM tampón formiato de amonio, pH 5,5.
| Tiempo | Flujo (ml / min) | % A | % B | % C | |
| 1 | 1.00 | 0.0 | 0.0 | 100.0 | |
| 2 | 16.00 | 1.00 | 0.0 | 0.0 | 100.0 |
| 3 | 17.00 | 1.00 | 100.0 | 0.0 | 0.0 |
| 4 | 22.00 | 1.00 | 100.0 | 0.0 | 0.0 |
| 5 | 27.00 | 1.00 | 0.0 | 100.0 | 0.0 |
| 6 | 32.00 | 1.00 | 0.0 | 100.0 | 0.0 |
| 7 | 33.00 | 1.00 | 100.0 | 0.0 | 0.0 |
| 8 | 38.00 | 1.00 | 100.0 | 0.0 | 0.0 |
| 9 | 39.00 | 1.00 | 0.0 | 0.0 | 100.0 |
| 10 | 45.00 | 1.00 | 0.0 | 0.0 | 100.0 |
Tabla 1. Cambios solvente para la medición de HPLC de los compuestos de purina.
- Determinar la concentración de purines en la muestra. Cuantificar hipoxantina, xantina y ácido úrico mediante la obtención de áreas de los picos en la retención y longitudes de onda describen en la Tabla 2. Determinar el área del pico de 2-AP. Determinar las relaciones de área de hipoxantina, xantina y ácido úrico a 2-AP y convertir las relaciones con las concentraciones μmolar con curvas de nivel.
| * El tiempo de retención | Observó max λ * | Informó λ max 19 | Informó ε max 19 | |
| ÚricoÁcido | ~ 3.5 min | 288 | 283 [2] | 11500 [2] |
| Hipoxantina | ~ 7.0 min | 248 | 248 [1] | 10.800 [1] |
| Xantina | ~ 9.5 min | 267 | 267 [2] | 10200 [2] |
| 2-aminopurine | ~ 12,5 min | 305 | 314 [2] | 4000 [2] |
Tabla 2. Los tiempos típicos de retención y un máximo de λ para los purines y el patrón interno. * Determinada en HPLC isocrático con buffer 50 mM formiato de amonio (pH 5,5) con un caudal de 1mL/min. El pH es entre [].
- Analizar todas las muestras por triplicado, pero sólo incluyen los valores de los análisis más adelante, si el coeficiente de variación es inferior al 10%.
4. GC / MS medición de la alantoína
- Añadir 50μl 10μM DL-Alantoína-5-13 C, 1 - 15 N (patrón interno) a la de plasma de 50 l de lado para el ensayo de la alantoína durante la recolección y procesamiento de muestras.
- Añadir 100 l de acetonitrilo a esta solución de plasma.
- Vortex la mezcla durante 10-20 segundos y centrifugar a 4 ° C a 20.000 g durante 10 minutos.
- Eliminar el sobrenadante, colóquelo en un vial de GC / MS y secos de N2.
- Después del secado, se añaden 50 l de derivación agente de N-tert-butildimetilsilil-N-methyltrifluoroacetamide (MTBSTFA) en piridina (1:1 vol / vol), tapa de los frascos y se incuba a 50 ° C durante 2 h. Esta derivación rendimientos consistentemente cuantificables m / z picos de 398,0 y 400,0 para la alantoína y DL-alantoína-5-13 C, 1 - 15 N, respectivamente 20.
- Analizar las muestras en el GC Agilent Technologies 6890N y MS 5973 equipado con un muestreador automático. Realizar la separación en un compuesto de Agilent 122-5532G columna capilar (25.7m de longitud, un diámetro interior de 0,25 mm). El uso de helio como gas portador, con un caudal de 1,5 ml / min. Inyectar producto derivado (1 l) en modo de pantalla dividida (split ratio de 20:1, el flujo dividido 29,4 ml / min, el flujo total de 33,8 ml / min). Ajuste la temperatura inicial de la columna a 100 ° C y mantener a esta temperatura durante 2 minutos antes de aumentarla a 180 ° C a una velocidad de 10 ° C / min. Mantener la temperatura durante 4 minutos y luego aumentar a 260 ° C a una velocidad de 20 ° C / min. Mantener esta temperatura hasta el final de la carrera. Después de cada muestra, limpiar la columna con 2 inyecciones de hexano.
- Cuantificar la alantoína con el modo de selección de monitoreo de iones, mientras que el control de la m 398,0 / z de iones de alantoína y el ion 400,0 m / z de la DL-alantoína-5-13 C, 1-15 N. Convertir las relaciones de la abundancia de iones de alantoína / (alantoína pesados) a las concentraciones micromolar de alantoína utilizando una curva estándar preparada.
- Todas las muestras se analizaron por triplicado, pero sólo los valores con un coeficiente de variación de menos del 10% se utilizan en análisis posteriores.
5. Preparación del estándar interno, metil malondialdehído (MMDA), para el análisis de la MDA
- Agregar 523μl de 3 a ethoxymethacrolein 1477μl 7M NaOH en un matraz de fondo redondo de 100 ml. Añadir un stirbar.
- Colocar el matraz en un baño de agua a 45 ° C y revuelva hasta que la reacción se ha ido hasta el final. Esto debería tomar aproximadamente 140 min. Monitorear el progreso de la reacción mediante la eliminación de una parte alícuota de 10μl del líquido periódicamente a intervalos de 10 min. Diluir cada muestra recogida en un factor de 10 5 con 50 mM tampón fosfato de potasio (pH 7) y la medición de la absorbancia con la UV-Vis. Una vez que la absorbancia a 275Nm alcanza aproximadamente 0.658 se completa la reacción. A medida que la reacción progresa, la solución se volverá amarillo y luego naranja.
- Permitir que la reacción a los avances durante 15 min.
- Añadir 5 ml de agua destilada desionizada al matraz y la transferencia de la solución a un embudo de separación. Use un adicional de 3 ml de agua para lavar el contenido del frasco en el embudo. Añadir un 2 ml adicionales de agua en el embudo.
- Extracto de la solución 3 veces con 5 ml de diclorometano. Después de cada extracción, se la capa orgánica.
- Después de la extracción de los terceros, la transferencia de la capa acuosa a un matraz de fondo redondo y rotavapor hasta sequedad.
- Resuspender el producto en etanol de 3 ml y transferir a un pre-pesado tubo cónico de 15 ml. Lavar el recipiente con una mezcla de etanol y añadir 2 ml adicionales de enjuague para el tubo cónico.
- Añadir 5 ml de benceno e incubar el tubo en agua caliente hasta que el producto se disuelve inmediatamente después colocar el tubo en hielo durante 10 min. Centrifugar por 5 min a 15000 g y eliminar el sobrenadante.
- Añadir 5 ml de etanol y 5 ml de éter isopropílico para la precipitaciónitant. Disolver el precipitado mediante la incubación de la sonda en agua caliente y la inclinación periódicamente el tubo muy suavemente. Una vez precipitado se disuelve, se coloca el tubo en hielo durante 10 min. Realizar esta recristalización dos veces más con etanol y éter isopropílico. Algunos trozos de blanco insoluble del producto puede ser formado.
- Después de la última etapa de recristalización eliminar la mayor cantidad posible de sobrenadante y secar el producto resultante en un Speedvac. Pesar el tubo cónico con el producto sintetizado.
- Añadir 5 ml de agua en el tubo y agitar y filtrar el polvo restante.
- Utilizar el espectrofotómetro UV-Vis para determinar la concentración final de MMDA. El λmax de MMDA en 50 mM tampón fosfato de potasio (pH 7) es de 274 nm con el coeficiente de extinción de 29900 M -1 cm -1 14.
6. GC / MS La medición de MDA
- Prepare una solución de 0,5 mM butilado hidroxi tolueno (BTH) en etanol mediante la adición de 0,11 g de etanol BTH 9 ml y ajustar el volumen final de 10 ml. A continuación, realizar una dilución añadiendo 10μl de la solución concentrada de etanol 990μl.
- Prepare una solución de hidracina fenil mediante la adición de 50 mM 4.92μl de hidracina fenil a 995μl de agua en un tubo de microcentrífuga oscuro. Vortex la solución.
- Añadir 5μl MMDA 10μM al plasma 100μl a un lado para el ensayo de MDA durante la recolección y procesamiento de muestras.
- A continuación, añada BTH 0,5 mM 10μl de la mezcla de MMDA / plasma seguido por la adición de citrato de sodio 1M 200μl a pH 4. Este pH es crucial para la correcta derivación de la muestra. Un pH más alto o más bajo dará como resultado sesgado los niveles de MDA.
- Diluir la mezcla final mediante la adición de agua destilada desionizada hasta un volumen final de 480μl.
- Derivatizar la solución mediante la adición de hidracina 20μl fenil 50 mM, coronando los viales y la incubación de la solución a 25 ° C durante 30 minutos en un agitador orbital.
- Añadir 1 ml de hexano y agitar durante 1 minuto y centrifugar a 3000 rpm durante 10 min.
- La transferencia de la capa orgánica a un vial de GC / MS y concentrar la solución a 100μl de corriente de N2.
- Analizar las muestras en un GC / MS con el muestreador automático. Realizar la separación en un compuesto de Agilent 122-5532G columna capilar (25,7 m de longitud, 0,25 mm de diámetro interior). El uso de helio como gas portador, con un caudal de 0,6-0,8 ml / min. Inyectar producto derivado (2 l) en modo de pantalla dividida (split ratio de 20:1, el flujo dividido 23,0 ml / min, el flujo total de 27,1 ml / min). Ajuste la temperatura inicial de la columna a 110 ° C y mantener a esta temperatura durante 1 minuto antes de aumentarla a 250 ° C a una velocidad de 40 ° C / min. Mantener esta temperatura hasta el final de la carrera. Después de cada muestra, limpiar la columna con 2 inyecciones de hexano.
- Cuantificar MDA usando el modo de selección de monitoreo de iones utilizando el m 144,00 / z de la MDA y la m 158,00 / z de MMDA. Convertir las relaciones de MDA / MMDA ion abundancia de las concentraciones micromolar utilizando una curva estándar.
- Analizar las muestras por triplicado, y sólo usar los valores con un coeficiente de variación de menos del 10%.
7. HPLC de medición de la xantina oxidasa
- La detección de la xantina oxidasa de función depende de la capacidad de medir los niveles de sensibilidad de un sustrato adecuado (pterina), así como su producto (isoxanthopterin). Plasma se incuba con el sustrato, ya sea para 0 min (control) o durante 4 horas, y el sustrato de incubación-dependiente de la conversión del producto se determina.
- Agregar 240μl 0,2 M Tris-HCl (pH 9,0) y 4.63μl 7.083x10 -3 pterina M a cada tubo (0 y 4 horas) y preincubar ellos a 37 ° C durante 5 min.
- Iniciar la reacción de la enzima mediante la adición de 60μl de plasma en cada tubo.
- Inmediatamente añadir 300μl 4% HClO 4 y el tubo de control (0 min), pero permiten la mezcla de otros para incubar durante 4 horas antes de apagar la reacción con 300μl 4% HClO 4.
- Después de la adición de HClO 4, agite vigorosamente el tubo y luego se centrifuga a 4 ° C a 15000 g durante 15 min.
- Quitar 500μl de sobrenadante y neutralizar añadiendo 20μl de 5 millones de K 2 CO 3. Agitar enérgicamente el tubo y luego se centrifuga a 4 ° C a 15000 g durante 15 min.
- Agregar 350μl de la solución neutralizada a un tubo de microcentrífuga que contiene 1x10 -8 mol 2-AP.
- Analizar las muestras en un HPLC con detector de fluorescencia de escaneo. Tres inyecciones de 50 l se utilizan para cada muestra. Las muestras se inyectaron en una Wacosil 5C-18-200 250 mm x 6,0 mm, columna 5 m equipada con un protector de columna Supelguard LC-18-S. Las condiciones isocrática siguientes deben ser utilizados para obtener la separación máxima y la identificación adecuada: 95% 20 mM KPO 4 buffer (pH 2.2) y 5% de metanol en una 1ml/min caudal. La longitud de onda de excitación para el detector de fluorescencia a 345 nm y la onda de emisiónlongitud de 410 nm.
- Determinar las relaciones de pterine y isoxanthopterine de 2-AP mediante la obtención de áreas de los picos del espectro de detector de fluorescencia. El primer pico en el espectro, ~ 5 minutos, corresponde a 2-AP. El segundo pico más grande y se pterine. Isoxanthopterine pico eluye pasado.
- Obtener la diferencia en las tasas de la zona isoxanthopterine/2-AP pico entre los 0 y los 4 puntos h tiempo de incubación. Utilice este valor para calcular la actividad de XO de las curvas de nivel.
- Analizar las muestras por triplicado, sino valores de uso sólo con un coeficiente de variación de menos del 10%.
8. Los resultados representativos:
Un ejemplo de la cuantificación por HPLC de los compuestos de purina se muestra en la Figura 1. Los tiempos de retención específicos y longitudes de onda de emisión de hipoxantina, xantina y ácido úrico permiten la cuantificación simultánea de los compuestos de purina (Tabla 2). Cuando la prueba se ejecute correctamente, los compuestos que tienen una separación adecuada y la forma del pico es clara y unimodal. Estos picos se convierten entonces en las concentraciones, los rangos mostrados en la Tabla 3, a través del uso de las curvas de nivel. Dado que el procesamiento de la muestra para este ensayo es mínima, los problemas de la muestra sólo se basa que puedan surgir sería la lisis de las células rojas de la sangre. Si los glóbulos rojos antes de lisar las muestras se centrifugan, el plasma se enfrentará a un color naranja / rojo y no se puede utilizar para evaluar la isquemia hipóxica. Las otras cuestiones que puedan surgir en la medición de las purinas consiste en el sistema HPLC y la columna (fig. 1B). Si hay burbujas de aire en el sistema HPLC los tiempos de retención se desplazará y la presión HPLC fluctúan dramáticamente. Si el cartucho de guardia debe ser cambiado, la presión aumentará y los picos se ensanchan y se vuelven bi o tri-modal.
| Hipoxantina (M) | Xantina (M) | El ácido úrico (M) | Xantina oxidasa ((producto nmol) / min) | Malondialdehído (M) | Alantoína (M) | |
| Normóxico plazo | 1.13-19.3 (64) | 0.02-3.69 (61) | 107.20-726.12 (63) | 2.47x10 -6 - 3.92x10 -3 (20) | 0.44-3.76 (53) | NA |
| Dificultad respiratoria plazo | 1.78-12.59 (27) | 0.07-11.8 (24) | 225.40-653.32 (27) | 0 - 1.03x10 -5 (8) | 0.82-2.73 (24) | NA |
| Hipóxico plazo | 0.38-31.80 (13) | 0.11-2.88 (13) | 235.65-1348.13 (13) | 1.20x10 -5 -236.44 (9) | 0.95-2.15 (7) | NA |
| Prematuro Normóxico | 1.54-4.39 (9) | 0.03-1.77 (9) | 178.92-593.49 (9) | 2.46x10 -5 a -4 5.44x10 (2) | 0.95-2.74 (8) | 2.30-5.26 (67) |
| Dificultad respiratoria prematuro | 3.04-8.04 (2) | NA | 327.56-365.11 (2) | NA | 2.40-3.46 (3) | NA |
Min-Max (n)
Tabla 3. Rangos Representante de purines, la xantina oxidasa, malondialdehído, y alantoína.
Un ejemplo de la cuantificación de GC / MS de la alantoína se muestra en la Figura 2. Debido a que la masa de la alantoína derivitized y alantoína pesados derivitized se sabe, seleccionar el modo de iones puede ser utilizado para identificar estos compuestos en el espectrómetro de masas. Si el ensayo se realiza correctamente, dos picos se observaron en el mismo tiempo de retención. Correspondiente a la alantoína una (398,00 m / z) y el otro a gran alantoína (400,00 m / z). Estos picos se convierten entonces en las concentraciones, los rangos mostrados en la Tabla 3, a través del uso de una curva patrón. Si se realiza el ensayo de forma incorrecta, y las muestras no fueron derivitized correctamente, los picos pueden no estar presentes o no ser cuantitativamente representativas. Una vez más, si los hematíes lisados el plasma no puede ser usado para evaluar el estrés oxidativo en isquemia hipoxia neonatal.
Los resultados de la cuantificación de la MDA son similares a los de la alantoína con la excepción de que los dos picos se observan en los tiempos de retención diferentes. En ~ 3.5 minutos el tiempo de retención, un 144,00 m / z pico de MDA y en el tiempo de retención ~ 4 minutos, un 158,00 m / z pico de MMDA se observa (Figura 3). Estos picos se convierten entonces en las concentraciones, los rangos mostrados en la Tabla 3, a través del uso de una curva patrón. Si se realiza el ensayo de forma incorrecta, o las muestras no son derivitized correctamente, no se pueden observar los picos de la selección de 144.00m / z y 158.00m / z. Cabe señalar quesi hay un exceso de lípidos en el plasma de bolo alimentación por vía oral o la administración intravenosa de lípidos, el plasma tendrá un aspecto lechoso y no se puede utilizar para evaluar el estrés oxidativo en isquemia hipoxia neonatal.
Un ejemplo de la cuantificación basada en HPLC de la xantina oxidasa de función se muestra en la Figura 4. Si el ensayo se ejecuta correctamente, tres picos deben ser observados con el detector de fluorescencia, una para pterina, uno para isoxanthopterin, y una de 2-AP. Estos picos se convierten entonces en las concentraciones, los rangos mostrados en la Tabla 3, a través del uso de una curva patrón. También debe haber un pico correspondiente a isoxanthopterin y AP-2 en el espectro generado por el detector PDA. Si la actividad de la enzima está ausente, el pico correspondiente al isoxanthopterin no se verá. Debido a que este ensayo mide la función enzimática, ciclos de congelación y descongelación de la muestra puede alterar esto.
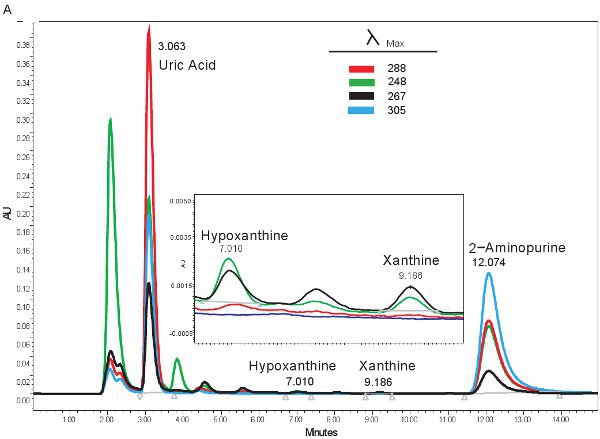
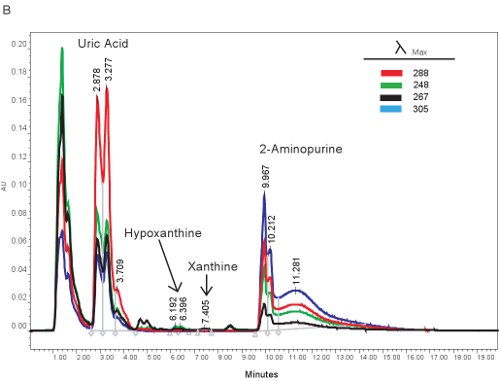
Figura 1. HPLC de espectro para la identificación de los compuestos de purina. A). Los resultados representativos si el ensayo se realizó correctamente. B). resultados representativos si hay un problema con el HPLC, columna, o un cartucho protector.
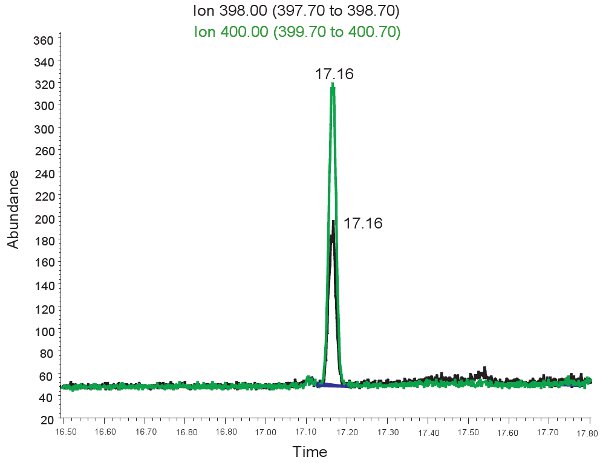
Figura 2. GC / MS espectro para la cuantificación de la alantoína. El pico de iones de 398,00 m / z corresponde a la alantoína. El pico de iones de 400,00 m / z corresponde a la alantoína pesados.
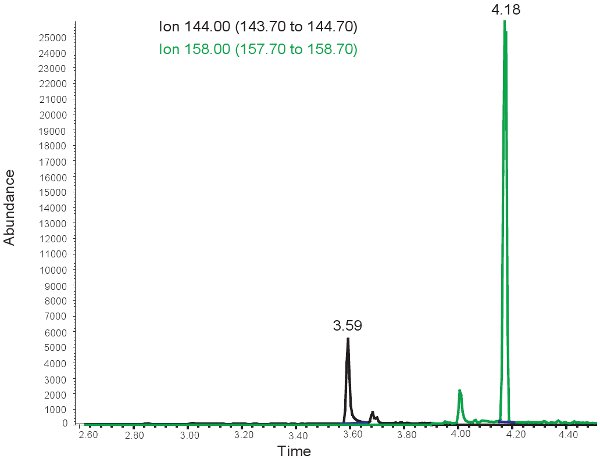
Figura 3. GC / MS espectro para la cuantificación de la MDA. El pico de iones de 144,00 m / z corresponde a la MDA. El pico de iones de 158,00 m / z corresponde a MMDA.
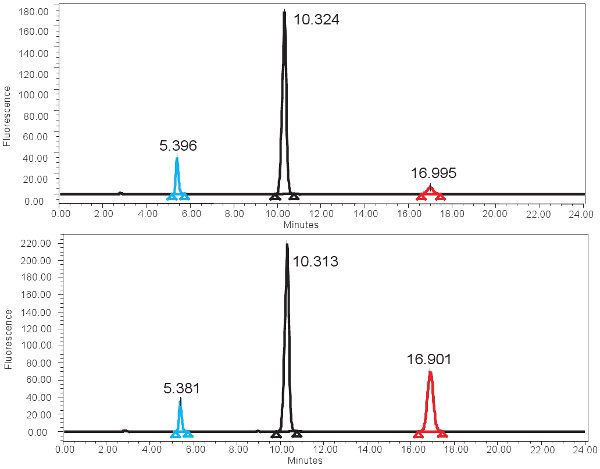
Figura 4. Espectro de HPLC para la medición de la actividad de XO. A) Los resultados representativos para el tiempo de incubación mínimo 0 y B) los resultados representativos para el tiempo de incubación de 4 horas. Tenga en cuenta el pico más alto isoxanthopterine (a ~ 17 min) para el tiempo de incubación de 4 horas. En el espectro de fluorescencia, 2-AP eluye primero en ~ eluye próximo 5 minutos y pterine en ~ 10 minutos.
Discusión
Los métodos descritos aquí permiten la evaluación de la isquemia hipoxia neonatal. Este protocolo combina las mediciones de los marcadores de la energía (ATP) la privación, el estrés oxidativo, daño oxidativo, y la actividad enzimática para obtener una visión global de la bioquímica de la presencia o el grado de isquemia hipóxica. A pesar de la utilidad de este método, existen limitaciones potenciales. En primer lugar, es de unos 1-2 ml de sangre para obtener plasma suficiente para ejecutar todos los ensayos...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo está financiado por los Institutos Nacionales de Salud NR011209 R01-03
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
|---|---|---|---|
| 6 ml EDTA K3 K3E tubo | Fisher Scientific | 2204061 | |
| Centrífuga 5702R | Fisher Scientific | 05413319 | Con 13 y el adaptador 16MM |
| Tubo de microcentrífuga de 1,5 ml | EE.UU. Científico | 1615-5599 | |
| 2-aminopurine | Sigma-Aldrich | A3509 | |
| Varian Cary 100 espectrofotómetro | Agilant Tecnologías | 0010071500 | |
| Savant SpeedVac | Thermo Scientific | SC210A-115 | |
| Micrones dispositivo centrífugo | Fisher Scientific | UFC501596 | |
| Supelcosil LC-18-S Columna | Sigma-Aldrich | 58931 | |
| Supelcosil LC-18-S Supelguard cartucho y titular | Sigma-Aldrich | 59629 | |
| HPLC | Aguas | ||
| GCMS Vial | Fisher Scientific | 03376607 | |
| DL-Alantoína-5 -13 C, 1 -15 N | CDN Isótopos | M-2307 | Lote # L340P9 |
| MTBSTFA | Thermo Scientific | 48920 | |
| Piridina | Sigma-Aldrich | 270970 | |
| 5973E GC / MSD | Agilent Technologies | G7021A | Parte # 5975E de GC / MS |
| 3-Ethoxymethacrolein | Sigma-Aldrich | 232548 | |
| Hidróxido de Sodio | Sigma-Aldrich | S5881 | |
| Diclorometano | Sigma-Aldrich | 270997 | |
| Benceno | Sigma-Aldrich | 401765 | |
| Diisopropiléter | Sigma-Aldrich | 38270 | |
| BHT | Sigma-Aldrich | B1378 | |
| Etanol | Sigma-Aldrich | 459844 | |
| Fenilhidrazina | Sigma-Aldrich | P26252 |
Referencias
- Harkness, R. A., Whitelaw, A. G., Simmonds, R. J. Intrapartum hypoxia: the association between neurological assessment of damage and abnormal excretion of ATP metabolites. J Clin Pathol. 35, 999-1007 (1982).
- Shalak, L., Perlman, J. M. Hypoxic-ischemic brain injury in the term infant-current concepts. Early Hum Dev. 80, 125-141 (2004).
- Webster, W. S., Abela, D. The effect of hypoxia in development. Birth Defects Res C Embryo Today. 81, 215-228 (2007).
- Engerson, T. D., McKelvey, T. G., Rhyne, D. B., Boggio, E. B., Snyder, S. J., Jones, H. P. Conversion of xanthine dehydrogenase to oxidase in ischemic rat tissues. J Clin Invest. 79, 1564-1570 (1987).
- Choi, E. Y., Stockert, A. L., Leimkuhler, S., Hille, R. Studies on the mechanism of action of xanthine oxidase. J Inorg Biochem. 98, 841-848 (2004).
- Godber, B. L., Schwarz, G., Mendel, R. R., Lowe, D. J., Bray, R. C., Eisenthal, R. Molecular characterization of human xanthine oxidoreductase: the enzyme is grossly deficient in molybdenum and substantially deficient in iron-sulphur centres. Biochem J. 388, 501-508 (2005).
- Gruber, J., Tang, S. Y., Jenner, A. M., Mudway, I., Blomberg, A., Behndig, A. Allantoin in human plasma, serum, and nasal-lining fluids as a biomarker of oxidative stress: avoiding artifacts and establishing real in vivo concentrations. Antioxid Redox Signal. 11, 1767-1776 (2009).
- Zitnanova, I., Korytar, P., Aruoma, O. I., Sustrova, M., Garaiova, I., Muchova, J. Uric acid and allantoin levels in Down syndrome: antioxidant and oxidative stress mechanisms?. Clin Chim Acta. 341, 139-146 (2004).
- Siciarz, A., Weinberger, B., Witz, G., Hiatt, M., Hegyi, T. Urinary thiobarbituric acid-reacting substances as potential biomarkers of intrauterine hypoxia. Arch Pediatr Adolesc Med. 155, 718-722 (2001).
- Buonocore, G., Perrone, S., Longini, M., Terzuoli, L., Bracci, R. Total hydroperoxide and advanced oxidation protein products in preterm hypoxic babies. Pediatr Res. 47, 221-224 (2000).
- Berne, R. M. Cardiac nucleotides in hypoxia: possible role in regulation of coronary blood flow. Am J Physiol. 204, 317-322 (1963).
- Harkness, R. A., Lund, R. J. Cerebrospinal fluid concentrations of hypoxanthine, xanthine, uridine and inosine: high concentrations of the ATP metabolite, hypoxanthine, after hypoxia. J Clin Pathol. 36, 1-8 (1983).
- Plank, M. S., Boskovic, D. S., Sowers, L. C., Angeles, D. M. Biochemical markers of neonatal hypoxia. Pediatric Health. 2, 485-501 (2008).
- Cighetti, G., Allevi, P., Anastasia, L., Bortone, L., Paroni, R. Use of methyl malondialdehyde as an internal standard for malondialdehyde detection: validation by isotope-dilution gas chromatography-mass spectrometry. Clin Chem. 48, 2266-2269 (2002).
- Paroni, R., Fermo, I., Cighetti, G. Validation of methyl malondialdehyde as internal standard for malondialdehyde detection by capillary electrophoresis. Anal Biochem. 307, 92-98 (2002).
- Cighetti, G., Debiasi, S., Ciuffreda, P., Allevi, P. Beta-ethoxyacrolein contamination increases malondialdehyde inhibition of milk xanthine oxidase activity. Free Radic Biol Med. 25, 818-825 (1998).
- Cighetti, G., Debiasi, S., Paroni, R., Allevi, P. Free and total malondialdehyde assessment in biological matrices by gas chromatography-mass spectrometry: what is needed for an accurate detection. Anal Biochem. 266, 222-229 (1999).
- Yamamoto, T., Moriwaki, Y., Takahashi, S., Tsutsumi, Z., Yamakita, J., Nasako, Y. Determination of human plasma xanthine oxidase activity by high-performance liquid chromatography. J Chromatogr B Biomed Appl. 681, 395-400 (1996).
- Fasman, G. . Handbook of Biochemistry and Molecular Biology. , (1988).
- Chen, X. B., Calder, A. G., Prasitkusol, P., Kyle, D. J., Jayasuriya, M. C. Determination of 15N isotopic enrichment and concentrations of allantoin and uric acid in urine by gas chromatography/mass spectrometry. J Mass Spectrom. 33, 130-137 (1998).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados