Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mesure biochimique de l'hypoxie néonatale
Dans cet article
Résumé
Une méthode est décrite pour mesurer les marqueurs biochimiques du hypoxie-ischémie néonatale. L'approche utilise la chromatographie liquide à haute pression (HPLC) et chromatographie en phase gazeuse spectrométrie de masse (GC / MS).
Résumé
L'ischémie néonatale hypoxie est caractérisée par une perfusion sanguine insuffisante d'un tissu ou un manque d'oxygène systémique. Cette condition est pensé pour causer / exacerbent bien documenté troubles néonatals, y compris des troubles neurologiques 1-3. Baisse de la production d'adénosine triphosphate est due à un manque de phosphorylation oxydative. Pour compenser cet état molécules énergétiques privés contenant de fortes liaisons phosphate de l'énergie sont deux dégradées. Cela conduit à des niveaux accrus de l'adénosine qui est ensuite dégradé en inosine, hypoxanthine, la xanthine, et enfin de l'acide urique. Les deux dernières étapes dans ce processus de dégradation sont effectuées par la xanthine oxydoréductase. Cette enzyme existe sous la forme de la xanthine déshydrogénase dans des conditions normoxique mais il est converti en xanthine oxydase (XO) sous hypoxie-reperfusion circonstances 4, 5. Contrairement déshydrogénase xanthine, XO génère du peroxyde d'hydrogène comme sous-produit de dégradation de la purine 4, 6. Ce peroxyde d'hydrogène en combinaison avec d'autres espèces d'oxygène réactif (ROS) produites pendant l'hypoxie, l'acide urique s'oxyde pour former de l'allantoïne et réagit avec des membranes lipidiques pour générer malondialdéhyde (MDA) 7-9. La plupart des mammifères, les humains exemptés, possèdent les uricase, qui convertit l'acide urique en allantoïne. Chez l'homme, cependant, l'allantoïne ne peut être formé par les ROS-oxydation médiée de l'acide urique. Pour cette raison, l'allantoïne est considéré comme un marqueur du stress oxydatif chez les humains, mais pas chez les mammifères qui ont uricase.
Nous décrivons des méthodes employant la chromatographie liquide à haute pression (HPLC) et chromatographie en phase gazeuse spectrométrie de masse (GCMS) pour mesurer les marqueurs biochimiques d'ischémie hypoxie néonatale. Le sang humain est utilisé pour la plupart des tests. Le sang des animaux peuvent également être utilisés, tout en reconnaissant le potentiel d'uricase généré allantoïne. Métabolites de purine ont été liés à l'hypoxie dès 1963 et la fiabilité de hypoxanthine, la xanthine, et l'acide urique comme des indicateurs biochimiques de l'hypoxie néonatale a été validé par plusieurs enquêteurs 10-13. La méthode HPLC utilisée pour la quantification de composés purine est rapide, fiable et reproductible. La méthode GC / MS utilisé pour la quantification de l'allantoïne, un marqueur relativement nouveau du stress oxydatif, a été adapté de Gruber et al 7. Cette méthode évite certains artefacts et nécessite de faibles volumes d'échantillon. Les méthodes utilisées pour la synthèse de MMDA ont été décrits par ailleurs 14, 15. GC / MS quantification basée sur MDA a été adapté à partir Paroni et al. et Cighetti et al. 16, 17. Xanthine oxydase a été mesurée par HPLC en quantifiant la conversion de ptérine d'isoxanthopterin 18. Cette approche s'est avérée être suffisamment sensible et reproductible.
Protocole
1. Prélèvement et traitement
- Recueillir un échantillon de sang dans un tube 6ml K3E EDTA K3 qui est conservé sur la glace.
- Dans les 2 min de la collecte, centrifuger l'échantillon à 4 ° C à 1500 g pendant 10 min.
- Transférer le surnageant (plasma) à un microtube 1.5ml.
- Centrifuger à 4 ° C à 18000 g pendant 30 min.
- Retirer le surnageant aliquotes et les transférer dans des microtubes séparés pour la purine (200 pl), allantoïne (50 pl), MDA (100 pi), et XO (120μl) d'analyse. Soyez prudent de ne pas contaminer les échantillons avec des globules rouges. Vous pouvez avoir besoin d'ajuster les volumes de plasma pour MDA, XO, et des purines basée sur le volume total de plasma disponibles.
2. Préparation étalon interne, la 2-aminopurine (2-AP), pour purine et analyse XO
- Peser 0.01351g 2-AP et l'ajouter à 8ml d'eau qui a été acidifié avec 2-5 gouttes de HCl. Si le 2-AP n'est pas dissoudre dont vous avez besoin d'ajouter plus d'acide. Ajuster le volume final à 10 ml.
- Utilisez le spectrophotomètre UV-Vis pour déterminer la concentration réelle de votre stock 2-AP solution. (Xmax 315, ε 4000).
- Une fois la concentration du stock 2-AP solution est déterminée, calculer les volumes nécessaires pour contenir 1x10 -7 mol 2-AP standard interne pour les mesures de la purine et de 1x10 -8 mol 2-AP standard interne pour les mesures de XO.
- Aliquoter les volumes calculés en microtubes séparés et évaporer à sec dans une SpeedVac.
Équation 1: 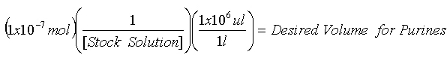
Équation 2: 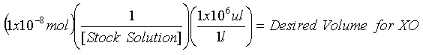
3. HPLC Mesure des purines
- Transfert du plasma (200 pl) à un Microcon YM-10 dispositif centrifuge filtre et centrifuger à 4 ° C à 14000 g pendant 1,5 heures.
- Enlever le filtrat et le transfert d'un microtube contenant 1x10 -7 mol 2-AP. Veillez à enregistrer le volume de filtrat ajouté à la microtube contenant le 2-AP. Vortex les échantillons pendant 10-20 secondes.
- Analyser les échantillons avec une HPLC. Trois injections 50 ul sont utilisés pour chaque échantillon. Les échantillons sont injectés sur une Supelcosil LC-18-S, 15 cm x 4,6 mm, 5 um colonne équipé d'un Supelguard LC-18-S colonne de garde. Les conditions de gradient décrite dans le tableau 1 doit être utilisé pour obtenir la séparation pic adéquat: solvant A-eau, solvant B-méthanol, solvant C-50mm de tampon formiate d'ammonium, pH 5,5.
| Temps | Débit (ml / min) | % A | % B | C% | |
| 1 | 1,00 | 0.0 | 0.0 | 100,0 | |
| 2 | 16,00 | 1,00 | 0.0 | 0.0 | 100,0 |
| 3 | 17,00 | 1,00 | 100,0 | 0.0 | 0.0 |
| 4 | 22,00 | 1,00 | 100,0 | 0.0 | 0.0 |
| 5 | 27,00 | 1,00 | 0.0 | 100,0 | 0.0 |
| 6 | 32,00 | 1,00 | 0.0 | 100,0 | 0.0 |
| 7 | 33,00 | 1,00 | 100,0 | 0.0 | 0.0 |
| 8 | 38,00 | 1,00 | 100,0 | 0.0 | 0.0 |
| 9 | 39,00 | 1,00 | 0.0 | 0.0 | 100,0 |
| 10 | 45,00 | 1,00 | 0.0 | 0.0 | 100,0 |
Tableau 1. Modifications de solvants pour la mesure par HPLC des composés puriques.
- Déterminer la concentration des purines dans l'échantillon. Quantifier l'hypoxanthine, la xanthine, et l'acide urique par l'obtention de surfaces de pic à la rétention et les longueurs d'onde décrites dans le Tableau 2. Déterminer l'aire du pic de la 2-AP. Déterminer les ratios de superficie de hypoxanthine, la xanthine, acide urique et de 2-AP et de convertir les ratios à des concentrations μmolar utilisant des courbes standard.
| * Temps de rétention | Observée λ max * | Rapporté λ max 19 | Rapporté ε max 19 | |
| UriqueAcide | ~ 3,5 min | 288 | 283 [2] | 11500 [2] |
| Hypoxanthine | ~ 7,0 min | 248 | 248 [1] | 10800 [1] |
| Xanthine | ~ 9,5 min | 267 | 267 [2] | 10200 [2] |
| 2-aminopurine | ~ 12,5 min | 305 | 314 [2] | 4000 [2] |
Tableau 2. Temps de rétention typique et λ max pour les purines et l'étalon interne. * Déterminé sur HPLC isocratique de tampon 50mM utilisant le formiate d'ammonium (pH 5,5) avec un débit de 1mL/min. Le pH est de [].
- Analyser tous les échantillons en trois exemplaires, mais seulement inclure des valeurs pour des analyses ultérieures si le coefficient de variation est inférieur à 10%.
4. GC / MS Mesure de l'allantoïne
- Ajouter 50 pl 10 uM DL-Allantoïne-5-13 C, 1 - 15 N (standard interne) pour le plasma 50 ul mis de côté pour le dosage de l'allantoïne lors du prélèvement et de traitement.
- Ajouter 100 ul d'acétonitrile à cette solution de plasma.
- Vortex le mélange pendant 10-20 secondes, puis centrifuger à 4 ° C à 20000 g pendant 10 min.
- Retirer le surnageant, le placer dans une fiole GC / MS et sèche sous N2.
- Après séchage, ajouter 50 ul d'agent de dérivatisation N-tert-butyldiméthylsilyle-N-methyltrifluoroacetamide (MTBSTFA) dans la pyridine (1:1 vol / vol), bouchon des flacons et de les incuber à 50 ° C pendant 2 h. Cette dérivatisation rendements constamment quantifiables m / z des pics de 398,0 et 400,0 pour l'allantoïne et DL-allantoïne-5-13 C, 1 - 15 N, respectivement 20.
- Analyser des échantillons sur le 6890N Agilent Technologies GC et MS 5973 équipé d'un échantillonneur automatique. Effectuer la séparation composé sur un Agilent 122-5532G colonne capillaire (25,7 millions de longueur, 0,25 mm de diamètre interne). Utilisez l'hélium comme gaz vecteur à un débit de 1,5 ml / min. Injecter de produits dérivés (1 pi) en mode split (split ratio de 20:1, le flux de diviser 29,4 ml / min, le débit total 33,8 ml / min). Réglez la température de la colonne initiale à 100 ° C et maintenir à cette température pendant 2 min avant de l'augmenter à 180 ° C à une vitesse de 10 ° C / min. Tenir la température pendant 4 min puis l'augmenter à 260 ° C à une vitesse de 20 ° C / min. Maintenir cette température jusqu'à la fin de la course. Après chaque échantillon, nettoyer la colonne avec 2 injections d'hexane.
- Quantifier l'allantoïne utilisant sélectionner le mode de surveillance d'ions tout en surveillant le m 398,0 / z d'ions pour l'allantoïne et l'400,0 m / z d'ions pour la DL-allantoïne-5-13 C, 1 - 15 N. Convertir les rapports d'abondances d'ions d'allantoïne / (allantoïne lourds) à des concentrations micromolaires d'allantoïne aide d'une courbe préparée standard.
- Tous les échantillons sont analysés en triple, mais seules les valeurs avec un coefficient de variation de moins de 10% sont utilisés dans des analyses plus poussées.
5. Préparation étalon interne, méthyle malondialdéhyde (MMDA), pour l'analyse de la MDA
- Ajouter 523μl 3-ethoxymethacrolein à 1477μl 7M NaOH dans un ballon de 100ml. Ajouter un barreau d'agitation.
- Placer le ballon dans un bain d'eau à 45 ° C et remuer jusqu'à ce que la réaction est allé à son terme. Cela devrait prendre environ 140 min. Surveiller les progrès de la réaction par la suppression d'un aliquote de 10 ul du liquide périodiquement à des intervalles de 10 min. Diluer chaque échantillon prélevé par un facteur de 10 5 à partir de 50 mM de tampon phosphate de potassium (pH 7) et en mesurant l'absorbance avec le UV-Vis. Une fois l'absorbance à 275nm atteint environ 0.658 la réaction est complète. Comme la réaction progresse, la solution devient jaune, puis orange.
- Laisser la réaction de progrès pour un supplément de 15 min.
- Ajouter 5 ml d'eau déminéralisée distillée dans le ballon à fond rond et transvaser la solution dans une ampoule à décanter. Utilisez un supplément de 3 ml d'eau pour laver le contenu du ballon dans l'entonnoir. Ajouter une 2ml d'eau supplémentaire à l'entonnoir.
- Extrait de la solution 3 fois avec 5 ml de dichlorométhane. Après chaque extraction, écarter la couche organique.
- Après la troisième extraction, de transfert de la couche aqueuse dans un ballon à fond rond et évaporateur rotatif à sec.
- Remettre le produit dans l'éthanol 3ml et transférer dans un tube de pré-pesés conique 15ml. Rincer la fiole avec un mélange d'éthanol supplémentaires 2ml et ajouter le rinçage pour le tube conique.
- Ajouter le benzène 5ml et incuber le tube dans l'eau tiède jusqu'à ce que le produit se dissout immédiatement placer le tube sur la glace pendant 10 min. Il Centrifuger pendant 5 min à 15000 g et retirer le surnageant.
- Ajouter 5 ml d'éthanol et 5 ml d'éther isopropylique à l'Précipitationsitant. Dissoudre le précipitant en incubant le tube dans l'eau chaude et périodiquement inclinant le tube très doucement. Une fois précipité est dissous, placer le tube sur la glace pendant 10 min. Effectuez cette recristallisation deux fois plus d'éthanol et d'éther isopropylique. Certains morceaux blanc insoluble du produit peut être formé.
- Après l'étape de recristallisation dernière enlever autant que possible le surnageant et sécher le produit obtenu dans un Speedvac. Peser le tube conique avec le produit synthétisé.
- Ajouter de l'eau dans le tube 5ml, vortex, et filtrer les matières solides restantes.
- Utilisez le spectrophotomètre UV-vis de déterminer la concentration finale de MMDA. Le Xmax pour MMDA dans 50 mM de tampon phosphate de potassium (pH 7) est de 274 nm avec le coefficient d'extinction de 29900 M -1 cm -1 14.
6. GC / MS Mesure de la MDA
- Préparer une solution de 0,5 mm butylé hydroxyle toluène (BTH) dans l'éthanol en ajoutant 0,11 g d'éthanol BTH 9ml et ajuster le volume final à 10 ml. Puis procéder à une dilution en ajoutant 10 pi de cette solution concentrée à l'éthanol 990μl.
- Préparer une solution de Phenylhydrazine 50mM en ajoutant des 4.92μl Phenylhydrazine à 995μl d'eau dans un tube à centrifuger sombre. Vortex de la solution.
- Ajouter 5uL 10 uM MMDA au plasma 100 ul mis de côté pour le dosage de la MDA lors du prélèvement et de traitement.
- Puis ajouter 10 ul BTH 0,5 mM au mélange MMDA / plasma suivie par l'ajout de citrate de sodium 200 pl 1M à pH 4. Ce pH est cruciale pour la dérivation correcte de l'échantillon. Un pH supérieur ou inférieur se traduira par des niveaux de MDA biaisée.
- Diluer le mélange final en ajoutant de l'eau distillée désionisée pour un volume final de 480μl.
- Dérivatiser la solution en ajoutant 20 pi Phenylhydrazine 50mM, couronnant les flacons et les incuber la solution à 25 ° C pendant 30 min sur un agitateur orbital.
- Ajouter 1 ml d'hexane, vortex pendant 1 min et centrifuger à 3000 rpm pendant 10 min.
- Transférer la couche organique dans une fiole GC / MS et de concentrer la solution à 100 ul par N 2 flux.
- Analyser des échantillons sur un GC / MS en utilisant l'échantillonneur automatique. Effectuer la séparation composé sur un Agilent 122-5532G colonne capillaire (25,7 m de longueur, 0,25 mm de diamètre interne). Utilisez l'hélium comme gaz vecteur à un débit de 0,6-0,8 ml / min. Injecter de produits dérivés (2 ul) en mode split (split ratio de 20:1, le flux de diviser 23,0 ml / min, le débit total 27,1 ml / min). Réglez la température de la colonne initiale à 110 ° C et maintenir à cette température pendant 1 min avant de l'augmenter à 250 ° C à une vitesse de 40 ° C / min. Maintenir cette température jusqu'à la fin de la course. Après chaque échantillon, nettoyer la colonne avec 2 injections d'hexane.
- Quantifier la MDA à l'aide de sélectionner le mode de surveillance d'ions en utilisant les m 144,00 / z pour MDA et le m 158,00 / z pour MMDA. Convertir les ratios MDA / MMDA l'abondance d'ions à des concentrations micromolaires utilisant une courbe standard.
- Analyser les échantillons en trois exemplaires et utiliser uniquement les valeurs avec un coefficient de variation de moins de 10%.
7. HPLC Mesure de la xanthine oxydase
- La détection de la xanthine oxydase à fonction dépend de la capacité à mesurer les niveaux de sensibilité d'un substrat adéquat (ptérine) ainsi que son produit (isoxanthopterin). Le plasma est incubée avec le substrat soit pour 0 min (contrôle) ou pendant 4 h, et le substrat d'incubation qui dépendent à la conversion des produits est déterminée.
- Ajouter 240μl 0,2 M Tris-HCl (pH 9,0) et 4.63μl 7.083x10 -3 M ptérine dans chaque tube (0 et 4h) et les préincuber à 37 ° C pendant 5 min.
- Initier la réaction enzymatique en ajoutant 60μl de plasma à chaque tube.
- Immédiatement ajouter 300μl 4% HClO 4 sur le tube de contrôle (0 min), mais permettre à l'autre mélange à incuber pendant 4 heures avant trempe la réaction avec 300μl 4% HClO 4.
- Après l'ajout de HClO 4, agiter vigoureusement le tube, puis centrifuger à 4 ° C à 15000 g pendant 15 min.
- Retirer 500μl de surnageant et neutralisez en ajoutant 20 pi de 5M K 2 CO 3. Secouez vigoureusement le tube, puis centrifuger à 4 ° C à 15000 g pendant 15 min.
- Ajouter 350μl de la solution neutralisée à un microtube contenant 1x10 -8 mol 2-AP.
- Analyser des échantillons sur une HPLC équipé d'un détecteur de fluorescence à balayage. Trois injections 50 ul sont utilisés pour chaque échantillon. Des échantillons seront injectés sur une Wacosil 5C-18-200 250 mm x 6,0 mm, 5 um colonne équipé d'un garde Supelguard colonne LC-18-S. Les conditions suivantes isocratique devrait être utilisé pour obtenir la séparation de pointe adéquate et d'identification: 95% 20 mM de tampon KPO 4 (pH 2,2) et 5% de méthanol à un débit 1mL/min. Régler la longueur d'onde d'excitation pour le détecteur de fluorescence à 345 nm et l'émission d'ondesà 410 nm de longueur.
- Déterminer les ratios de pterine et isoxanthopterine à 2-AP par l'obtention de surfaces de pic dans le spectre détecteur de fluorescence. Le premier pic dans le spectre, ~ 5 minutes, correspond à 2-AP. Le deuxième pic et le plus important sera pterine. Isoxanthopterine pic élue dernier.
- Obtenir la différence dans les ratios isoxanthopterine/2-AP aire de pic entre les 0 et les 4 points h temps d'incubation. Utilisez cette valeur pour calculer l'activité XO à partir des courbes standards.
- Analyser les échantillons en triple mais utiliser uniquement les valeurs avec un coefficient de variation de moins de 10%.
8. Les résultats représentatifs:
Un exemple de la quantification par CLHP des composés puriques est montré dans la figure 1A. Les temps de rétention spécifique et des longueurs d'onde d'émission de hypoxanthine, la xanthine, et l'acide urique permet la quantification simultanée de composés purine (tableau 2). Lorsque le dosage est de fonctionner correctement, les composés auront une séparation adéquate et la forme du pic sera nette et unimodale. Ces pics sont ensuite convertis en concentrations, les plages indiquées dans le tableau 3, à travers l'utilisation des courbes standard. Parce que le traitement des échantillons pour ce dosage est minime, les problèmes de l'échantillon seulement basée pouvant survenir serait la lyse des globules rouges. Si la lyse des globules rouges avant que les échantillons sont centrifugés, le plasma va prendre une couleur orange / rouge et ne peut pas être utilisé pour évaluer l'ischémie hypoxique. Les autres questions qui peuvent surgir lors de la mesure des purines implique le système HPLC et la colonne (figure 1B). S'il ya des bulles d'air dans le système HPLC temps de rétention se déplacent et la pression HPLC va fluctuer considérablement. Si la cartouche de garde doit être changé, la pression va augmenter et les pics se creuser et devenir bi ou tri-modale.
| Hypoxanthine (M) | Xanthine (M) | Acide urique (M) | Xanthine oxydase ((produit nmol) / min) | Malondialdéhyde (M) | L'allantoïne (M) | |
| Normoxique terme | 1.13-19.3 (64) | 0.02-3.69 (61) | 107.20-726.12 (63) | 2.47x10 -6 - 3.92x10 -3 (20) | 0.44-3.76 (53) | NA |
| Terme de détresse respiratoire | 1.78-12.59 (27) | 0.07-11.8 (24) | 225.40-653.32 (27) | 0 - 1.03x10 -5 (8) | 0.82-2.73 (24) | NA |
| Hypoxique terme | 0.38-31.80 (13) | 0.11-2.88 (13) | 235.65-1348.13 (13) | 1.20x10 -5 -236.44 (9) | 0.95-2.15 (7) | NA |
| Prématurés Normoxique | 1.54-4.39 (9) | 0.03-1.77 (9) | 178.92-593.49 (9) | 2.46x10 -5 - 5.44x10 -4 (2) | 0.95-2.74 (8) | 2.30-5.26 (67) |
| Prématuré de détresse respiratoire | 3.04-8.04 (2) | NA | 327.56-365.11 (2) | NA | 2.40-3.46 (3) | NA |
Min-Max (n)
Tableau 3. Gammes Représentant pour les purines, la xanthine oxydase, malondialdéhyde, et de l'allantoïne.
Un exemple de la quantification GC / MS de l'allantoïne est montré dans la figure 2. Parce que la masse de l'allantoïne et derivitized derivitized allantoïne lourds est connue, sélectionnez le mode d'ions peuvent être utilisés pour identifier ces composés sur la spectrométrie de masse. Si le dosage est effectué correctement, deux pics sera observée à la même temps de rétention. Un correspondant à l'allantoïne (398,00 m / z) et l'autre à de lourdes allantoïne (400,00 m / z). Ces pics sont ensuite convertis en concentrations, les plages indiquées dans le tableau 3, par l'utilisation d'une courbe standard. Si le dosage est correctement exécuté, et les échantillons n'ont pas été correctement derivitized, les sommets ne peuvent pas être présents ou ne peuvent pas être quantitativement représentatif. Encore une fois, si les globules rouges lysés le plasma ne peut pas être utilisé pour évaluer le stress oxydatif dans l'ischémie hypoxique néonatale.
Les résultats pour la quantification de la MDA sont semblables à ceux de l'allantoïne, à l'exception que les deux pics sont observés à des temps de rétention différents. A ~ 3,5 minutes de temps de rétention, une 144.00 m / z pointe pour MDA et au temps de rétention ~ 4 minutes, une 158.00 m / z pointe pour MMDA est observé (figure 3). Ces pics sont ensuite convertis en concentrations, les plages indiquées dans le tableau 3, par l'utilisation d'une courbe standard. Si le dosage est correctement exécuté, ou les échantillons ne sont pas derivitized correctement, pas de pics peuvent être observés lors de la sélection pour les 144.00m / z et 158.00m / z. Il convient de noter ques'il ya un excès de lipides dans le plasma des bolus alimentation orale ou l'administration intraveineuse de lipides, le plasma va prendre une apparence laiteuse et ne peuvent pas être utilisées pour évaluer le stress oxydatif dans l'ischémie hypoxique néonatale.
Un exemple de la quantification par CLHP à base de la xanthine oxydase à fonction est montré dans la figure 4. Si le dosage est de fonctionner correctement, trois pics doivent être observées avec le détecteur de fluorescence, une pour ptérine, un pour isoxanthopterin, et un pour les 2-AP. Ces pics sont ensuite convertis en concentrations, les plages indiquées dans le tableau 3, par l'utilisation d'une courbe standard. Il devrait également y avoir un pic correspondant à isoxanthopterin et 2-AP sur le spectre généré par le détecteur PDA. Si l'activité de l'enzyme est absente, le pic correspondant à isoxanthopterin ne seront pas vus. Parce que ce test mesure la fonction enzymatique, congélation et décongélation répétées de l'échantillon peut modifier cela.
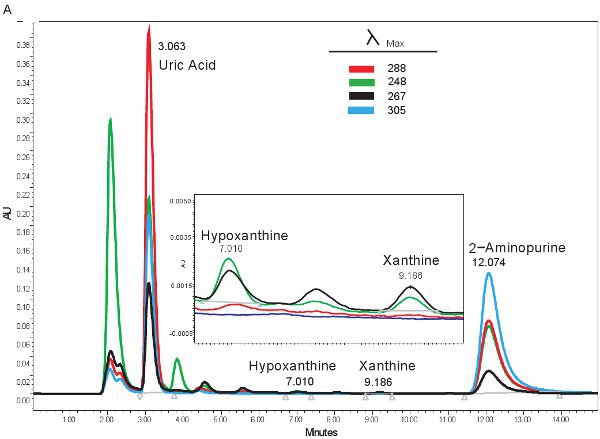
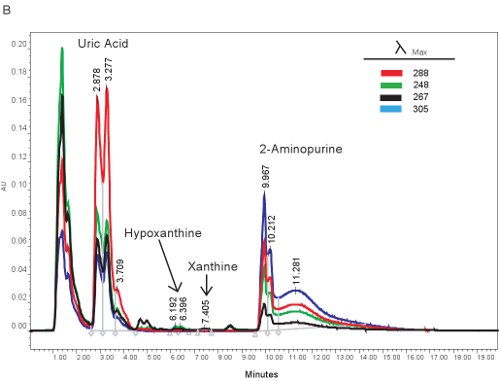
Figure 1. Spectre de CLHP pour l'identification des composés de purine. A). Les résultats représentatifs si l'essai a été exécuté correctement. B). résultats représentatifs s'il ya un problème avec la HPLC, colonne ou cartouche de protection.
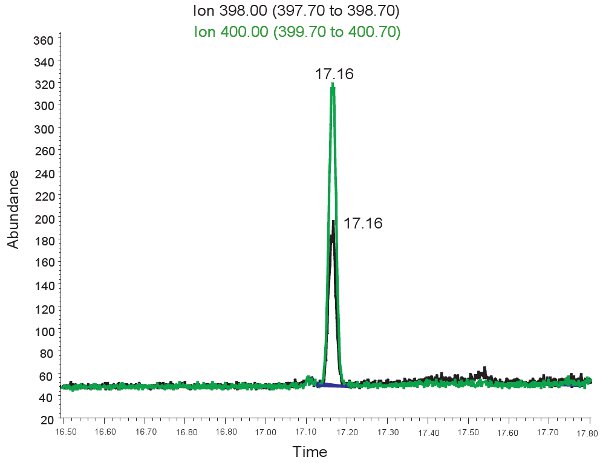
Figure 2. GC / MS de spectre pour la quantification de l'allantoïne. Le pic à 398,00 ions m / z correspond à l'allantoïne. Le pic à 400,00 ions m / z correspond à l'allantoïne lourds.
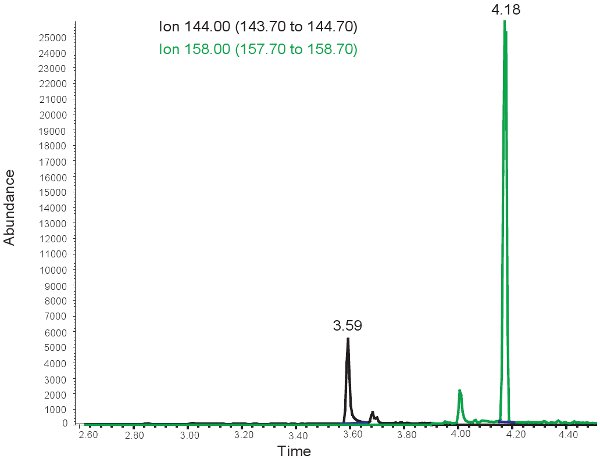
Figure 3. GC / MS de spectre pour la quantification de la MDA. Le pic à 144,00 ions m / z correspond à la MDA. Le pic à 158,00 ions m / z correspond à MMDA.
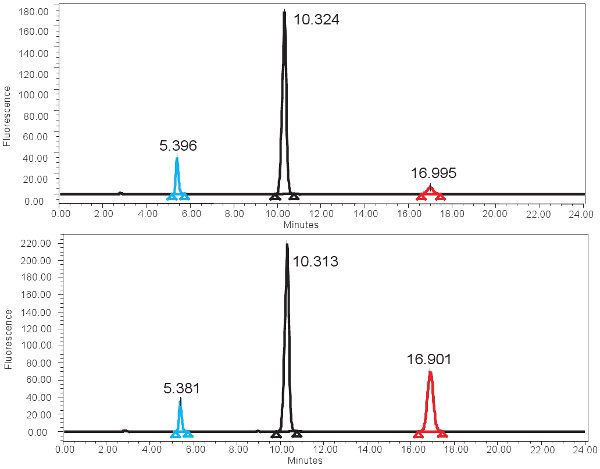
Figure 4. Spectre HPLC pour la mesure de l'activité XO. A) Les résultats représentatifs pour le temps 0 min d'incubation et des résultats représentatifs B) pour le temps d'incubation de 4 heures. Notez le pic plus élevé isoxanthopterine (à ~ 17 min) pour le temps d'incubation de 4 heures. Dans le spectre de fluorescence, 2-AP est élue première élue ~ 5min et pterine prochain à ~ 10min.
Discussion
Les méthodes décrites ici permettent l'évaluation de l'ischémie hypoxie néonatale. Ce protocole combine les mesures de marqueurs de l'énergie (ATP) la privation, le stress oxydatif, dommage oxydatif, et l'activité enzymatique de gagner une image globale biochimique de la présence ou même le degré d'ischémie hypoxique. Malgré l'utilité de cette méthode, il ya des limites potentielles. Premièrement, il faut environ 1-2 ml de sang pour recueillir suffisamment de plasma pour exécuter ...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Ce travail est financé par les Instituts nationaux de la santé R01-03 NR011209
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires (optionnel) |
|---|---|---|---|
| 6ml K3E tubes EDTA K3 | Fisher Scientific | 2204061 | |
| Centrifugeuse 5702R | Fisher Scientific | 05413319 | Avec 13 et adaptateur 16MM |
| Microtube 1.5ml | Etats-Unis scientifique | 1615-5599 | |
| 2-aminopurine | Sigma-Aldrich | A3509 | |
| Varian Cary 100 spectrophotomètre | Technologies Agilant | 0010071500 | |
| Savant SpeedVac | Thermo Scientific | SC210A-115 | |
| Micron dispositif centrifuge de filtre | Fisher Scientific | UFC501596 | |
| Supelcosil LC-18-S Colonne | Sigma-Aldrich | 58931 | |
| Supelcosil LC-18-S Supelguard cartouche et titulaire | Sigma-Aldrich | 59629 | |
| HPLC | Eaux | ||
| Vial SMGC | Fisher Scientific | 03376607 | |
| DL-Allantoïne-5 -13 ° C; 1 -15 N | CDN isotopes | M-2307 | Lot # L340P9 |
| MTBSTFA | Thermo Scientific | 48920 | |
| Pyridine | Sigma-Aldrich | 270970 | |
| 5973E CPG / MSD | Agilent Technologies | G7021A | Partie # pour 5975E GC / MS |
| 3-Ethoxymethacrolein | Sigma-Aldrich | 232548 | |
| Hydroxyde de sodium | Sigma-Aldrich | S5881 | |
| Dichlorométhane | Sigma-Aldrich | 270997 | |
| Le benzène | Sigma-Aldrich | 401765 | |
| Diisopropyléther | Sigma-Aldrich | 38270 | |
| BHT | Sigma-Aldrich | B1378 | |
| Éthanol | Sigma-Aldrich | 459844 | |
| Phénylhydrazine | Sigma-Aldrich | P26252 |
Références
- Harkness, R. A., Whitelaw, A. G., Simmonds, R. J. Intrapartum hypoxia: the association between neurological assessment of damage and abnormal excretion of ATP metabolites. J Clin Pathol. 35, 999-1007 (1982).
- Shalak, L., Perlman, J. M. Hypoxic-ischemic brain injury in the term infant-current concepts. Early Hum Dev. 80, 125-141 (2004).
- Webster, W. S., Abela, D. The effect of hypoxia in development. Birth Defects Res C Embryo Today. 81, 215-228 (2007).
- Engerson, T. D., McKelvey, T. G., Rhyne, D. B., Boggio, E. B., Snyder, S. J., Jones, H. P. Conversion of xanthine dehydrogenase to oxidase in ischemic rat tissues. J Clin Invest. 79, 1564-1570 (1987).
- Choi, E. Y., Stockert, A. L., Leimkuhler, S., Hille, R. Studies on the mechanism of action of xanthine oxidase. J Inorg Biochem. 98, 841-848 (2004).
- Godber, B. L., Schwarz, G., Mendel, R. R., Lowe, D. J., Bray, R. C., Eisenthal, R. Molecular characterization of human xanthine oxidoreductase: the enzyme is grossly deficient in molybdenum and substantially deficient in iron-sulphur centres. Biochem J. 388, 501-508 (2005).
- Gruber, J., Tang, S. Y., Jenner, A. M., Mudway, I., Blomberg, A., Behndig, A. Allantoin in human plasma, serum, and nasal-lining fluids as a biomarker of oxidative stress: avoiding artifacts and establishing real in vivo concentrations. Antioxid Redox Signal. 11, 1767-1776 (2009).
- Zitnanova, I., Korytar, P., Aruoma, O. I., Sustrova, M., Garaiova, I., Muchova, J. Uric acid and allantoin levels in Down syndrome: antioxidant and oxidative stress mechanisms?. Clin Chim Acta. 341, 139-146 (2004).
- Siciarz, A., Weinberger, B., Witz, G., Hiatt, M., Hegyi, T. Urinary thiobarbituric acid-reacting substances as potential biomarkers of intrauterine hypoxia. Arch Pediatr Adolesc Med. 155, 718-722 (2001).
- Buonocore, G., Perrone, S., Longini, M., Terzuoli, L., Bracci, R. Total hydroperoxide and advanced oxidation protein products in preterm hypoxic babies. Pediatr Res. 47, 221-224 (2000).
- Berne, R. M. Cardiac nucleotides in hypoxia: possible role in regulation of coronary blood flow. Am J Physiol. 204, 317-322 (1963).
- Harkness, R. A., Lund, R. J. Cerebrospinal fluid concentrations of hypoxanthine, xanthine, uridine and inosine: high concentrations of the ATP metabolite, hypoxanthine, after hypoxia. J Clin Pathol. 36, 1-8 (1983).
- Plank, M. S., Boskovic, D. S., Sowers, L. C., Angeles, D. M. Biochemical markers of neonatal hypoxia. Pediatric Health. 2, 485-501 (2008).
- Cighetti, G., Allevi, P., Anastasia, L., Bortone, L., Paroni, R. Use of methyl malondialdehyde as an internal standard for malondialdehyde detection: validation by isotope-dilution gas chromatography-mass spectrometry. Clin Chem. 48, 2266-2269 (2002).
- Paroni, R., Fermo, I., Cighetti, G. Validation of methyl malondialdehyde as internal standard for malondialdehyde detection by capillary electrophoresis. Anal Biochem. 307, 92-98 (2002).
- Cighetti, G., Debiasi, S., Ciuffreda, P., Allevi, P. Beta-ethoxyacrolein contamination increases malondialdehyde inhibition of milk xanthine oxidase activity. Free Radic Biol Med. 25, 818-825 (1998).
- Cighetti, G., Debiasi, S., Paroni, R., Allevi, P. Free and total malondialdehyde assessment in biological matrices by gas chromatography-mass spectrometry: what is needed for an accurate detection. Anal Biochem. 266, 222-229 (1999).
- Yamamoto, T., Moriwaki, Y., Takahashi, S., Tsutsumi, Z., Yamakita, J., Nasako, Y. Determination of human plasma xanthine oxidase activity by high-performance liquid chromatography. J Chromatogr B Biomed Appl. 681, 395-400 (1996).
- Fasman, G. . Handbook of Biochemistry and Molecular Biology. , (1988).
- Chen, X. B., Calder, A. G., Prasitkusol, P., Kyle, D. J., Jayasuriya, M. C. Determination of 15N isotopic enrichment and concentrations of allantoin and uric acid in urine by gas chromatography/mass spectrometry. J Mass Spectrom. 33, 130-137 (1998).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon