É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Medição bioquímicos da Hipóxia Neonatal
Neste Artigo
Resumo
Um método é descrito para medir marcadores bioquímicos de hipóxia-isquemia neonatal. A abordagem utiliza cromatografia líquida de alta pressão (HPLC) e Cromatografia Gasosa Espectrometria de Massa (GC / MS).
Resumo
Isquemia hipóxia neonatal é caracterizada por perfusão sangüínea inadequada de um tecido ou uma falta sistêmica de oxigênio. Esta condição é pensado para causar / agravar bem documentados distúrbios incluindo comprometimento neurológico neonatal 1-3. Trifosfato de adenosina diminuiu a produção ocorre devido à falta de fosforilação oxidativa. Para compensar essa energia moléculas estado privados contendo ligações fosfato de alta energia são duas degradadas. Isso leva a aumento dos níveis de adenosina, que é posteriormente degradado a inosina, hipoxantina, xantina e, finalmente, o ácido úrico. As duas últimas etapas deste processo de degradação são realizadas por xantina oxidoredutase. Esta enzima existe sob a forma de xantina desidrogenase em condições normóxica mas é convertida em xantina oxidase (XO), sob hipóxia-reperfusão circunstâncias 4, 5. Ao contrário de xantina desidrogenase, XO gera peróxido de hidrogênio como um subproduto da degradação da purina 4, 6. Este peróxido de hidrogênio em combinação com outras espécies reativas de oxigênio (ROS) produzidas durante a hipóxia, oxida o ácido úrico a formar alantoína e reage com membranas lipídicas para gerar malondialdeído (MDA) 7-9. A maioria dos mamíferos, os seres humanos isentos, possuem a enzima uricase, que converte ácido úrico em alantoína. Nos seres humanos, no entanto, alantoína só pode ser formado por ROS mediada oxidação do ácido úrico. Devido a isso, alantoína é considerado um marcador de estresse oxidativo em humanos, mas não os mamíferos que têm uricase.
Descrevemos os métodos empregando cromatografia líquida de alta pressão (HPLC) e cromatografia gasosa espectrometria de massa (GCMS) para medir marcadores bioquímicos de isquemia hipóxia neonatal. O sangue humano é usado para a maioria dos testes. Sangue animal também pode ser usado, reconhecendo o potencial de uricase gerado alantoína. Metabólitos de purinas estavam ligados à hipóxia já em 1963 ea confiabilidade de hipoxantina, xantina e ácido úrico como indicadores bioquímicos de hipóxia neonatal foi validada por vários pesquisadores 10-13. O método de HPLC utilizado para a quantificação de compostos de purina é rápido, confiável e reprodutível. O método de GC / MS utilizado para a quantificação de alantoína, um marcador relativamente novo de estresse oxidativo, foi adaptado de Gruber et al 7. Este método evita certos artefatos e requer baixos volumes de amostra. Métodos utilizados para a síntese de MMDA foram descritos em outros 14, 15. GC / MS com base quantificação de MDA foi adaptado a partir Paroni et al. e Cighetti et al. 16, 17. Xantina oxidase atividade foi medida por HPLC, quantificando a conversão de pterin para isoxanthopterin 18. Esta abordagem provou ser suficientemente sensível e reprodutível.
Protocolo
1. Coleta e Processamento de
- Coletar amostra de sangue em um tubo de EDTA K3E 6ml K3 que é mantido no gelo.
- Dentro de 2 min de coleta, centrifugar a amostra a 4 ° C a 1500 g por 10 min.
- Transferir o sobrenadante (plasma) para um tubo de microcentrífuga de 1,5 ml.
- Centrífuga a 4 ° C em 18.000 g por 30 min.
- Remove as alíquotas sobrenadante e transferi-los em tubos de microcentrífuga separado para purina (200μl), alantoína (50μl), MDA (100μl) e análise (120μl) XO. Tenha cuidado para não contaminar as amostras com células vermelhas do sangue. Você pode precisar de ajustar os volumes de plasma de MDA, XO e purinas baseado no volume total de plasma disponíveis.
2. Preparando padrão interno, 2 aminopurina-(2-AP), por Purina e Análise XO
- Pesar 0.01351g 2-AP e adicioná-lo 8ml de água que tenha sido acidificado com 2-5 gotas de HCl. Se o 2-AP não está se dissolvendo você precisa adicionar mais ácido. Ajustar o volume final de 10ml.
- Use o espectrofotômetro UV-Vis para determinar a concentração real de seu estoque 2-AP solução. (Λmax 315, ε 4000).
- Uma vez que a concentração do estoque 2-AP solução é determinada, calcular os volumes necessários para conter 1x10 -7 mol 2-AP padrão interno para medições de purina e 1x10 -8 mol 2-AP padrão interno para medições de XO.
- Alíquota dos volumes calculados em tubos de microcentrífuga separado e levar à secura num SpeedVac.
Equação 1: 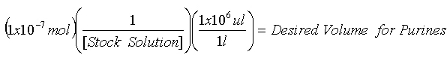
Equação 2: 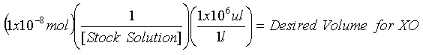
3. HPLC Medição de Purinas
- Transferência de plasma (200μl) para um microcontrolador YM-10 dispositivo de filtro centrífuga e centrifugar a 4 ° C a 14000 g durante 1,5 horas.
- Remove-se o filtrado e transferir para um tubo de microcentrífuga contendo 1x10 -7 mol 2-AP. Certifique-se de registrar o volume de filtrado adicionado ao tubo de microcentrífuga contendo o 2-AP. Vortex as amostras por 10-20 seg.
- Analisar amostras com um HPLC. Três injeções de 50 mL são usados para cada amostra. Amostras são injetadas em um Supelcosil LC-18-S, 15 cm x 4,6 mm, coluna 5 mM equipado com um LC-18-S Supelguard guarda coluna. As condições de gradiente descrito na Tabela 1 deve ser usado para obter a separação pico adequado: solvente A água, solvente B-metanol, solvente C-50 mM tampão formiato de amônia, pH 5.5.
| Tempo | Fluxo (ml / min) | % A | B% | C% | |
| 1 | 1,00 | 0,0 | 0,0 | 100,0 | |
| 2 | 16,00 | 1,00 | 0,0 | 0,0 | 100,0 |
| 3 | 17,00 | 1,00 | 100,0 | 0,0 | 0,0 |
| 4 | 22,00 | 1,00 | 100,0 | 0,0 | 0,0 |
| 5 | 27,00 | 1,00 | 0,0 | 100,0 | 0,0 |
| 6 | 32,00 | 1,00 | 0,0 | 100,0 | 0,0 |
| 7 | 33,00 | 1,00 | 100,0 | 0,0 | 0,0 |
| 8 | 38,00 | 1,00 | 100,0 | 0,0 | 0,0 |
| 9 | 39,00 | 1,00 | 0,0 | 0,0 | 100,0 |
| 10 | 45,00 | 1,00 | 0,0 | 0,0 | 100,0 |
Tabela 1. Alterações Solvente para HPLC de medição de compostos de purina.
- Determinar a concentração de purinas na amostra. Quantificar hipoxantina, xantina e ácido úrico através da obtenção de áreas de pico na retenção e comprimentos de onda estão descritas na Tabela 2. Determine a área do pico de 2-AP. Determinar as relações área de hipoxantina, xantina e ácido úrico a 2-AP e converter os rácios de concentração μmolar usando curvas padrão.
| * Tempo de Retenção | Observado λ max * | Relatado λ max 19 | Relatado ε max 19 | |
| ÚricoÁcido | ~ 3,5 min | 288 | 283 [2] | 11.500 [2] |
| Hipoxantina | ~ 7,0 min | 248 | 248 [1] | 10800 [1] |
| Xantina | ~ 9,5 min | 267 | 267 [2] | 10.200 [2] |
| 2-aminopurina | ~ 12,5 min | 305 | 314 [2] | 4000 [2] |
Tabela 2. Tempos de retenção típica e λ máximo para purinas e padrão interno. * Determinado em HPLC usando tampão formiato de amônio 50 mM isocrática (pH 5,5) com uma vazão de 1mL/min. pH é entre [].
- Analisar todas as amostras em triplicado, mas apenas incluir valores para análise posterior, se o coeficiente de variação é menos de 10%.
4. GC / MS Medição de alantoína
- Adicionar 50μl 10μM DL-Alantoína-5-13 C; 1-15 N (padrão interno) para o plasma 50 ul reservada para o ensaio de alantoína durante coleta de amostras e processamento.
- Adicionar 100 mL de acetonitrila a esta solução plasma.
- Vortex da mistura por 10-20 segundos, em seguida, centrifugar a 4 ° C a 20.000 g por 10 min.
- Remover o sobrenadante, coloque-o num frasco de GC / MS e seco sob N 2.
- Após a secagem, adicione 50 ul de derivatizing agente de N-terc-Butyldimethylsilyl-N-methyltrifluoroacetamide (MTBSTFA) em piridina (1:1 vol / vol), a tampa do frasco e incube-os a 50 ° C por 2 h. Este derivatização rendimentos consistentemente quantificáveis m / z picos de 398,0 e 400,0 para alantoína e DL-alantoína-5-13 C, 1 - 15 N, respectivamente 20.
- Analisar amostras da Agilent Technologies GC 6890N e MS 5973 equipado com um amostrador automático. Realizar separação de compostos em um Agilent 122-5532G coluna capilar (25.7m de comprimento, diâmetro interno 0,25 mm). Use o gás como o gás de arraste a uma vazão de 1,5 ml / min. Injetar produto derivatizado (1 ml) no modo split (dividir proporção de 20:1, o fluxo de dividir 29,4 ml / min de fluxo, o total de 33,8 ml / min). Regule a temperatura inicial da coluna a 100 ° C e mantenha nessa temperatura por 2 min antes de aumentar para 180 ° C a uma taxa de 10 ° C / min. Manter a temperatura de 4 min e depois aumentá-la a 260 ° C a uma taxa de 20 ° C / min. Manter esta temperatura até o final da corrida. Depois de cada amostra, limpa a coluna com duas injeções de hexano.
- Quantificar alantoína usando o modo de monitoramento selecionar ion enquanto monitora as 398,0 m / z de íons de alantoína e 400,0 m / z de íons para a DL-alantoína-5-13 C; 1-15 N. Converter os rácios abundância de íons de alantoína / (alantoína pesado) para as concentrações micromolar de alantoína usando uma curva padrão preparada.
- Todas as amostras são analisadas em triplicado, mas apenas valores com um coeficiente de variação de menos de 10% são usados em análises posteriores.
5. Preparando padrão interno, metil malondialdeído (MMDA), para análise MDA
- Adicionar 523μl 3-ethoxymethacrolein para 1477μl 7M NaOH em um frasco de 100 ml de fundo redondo. Adicionar um stirbar.
- Colocar o balão no banho-maria a 45 ° C e mexa até que a reação tem ido para a conclusão. Isso deve levar cerca de 140 min. Monitorar o progresso da reação através da remoção de uma alíquota de 10μl do líquido periodicamente em intervalos de 10 min. Diluir cada amostra coletada por um fator de 10 5 usando 50 mM tampão fosfato de potássio (pH 7) e medir a absorbância com o UV-Vis. Uma vez que a absorvância a 275nm atinge cerca de 0,658 a reação do está completa. Como a reação avança, a solução torna-amarelo, em seguida, laranja.
- Permitir que a reação ao progresso de um adicional de 15 min.
- Adicionar 5 ml de água deionizada no balão de fundo redondo e transferir a solução para um funil de separação. Use um adicional de 3 ml de água para lavar o conteúdo do frasco no funil. Adicionar um adicional de 2 ml de água para o funil.
- Extrair a solução 3 vezes com 5 ml de diclorometano. Depois de cada extração de descartar a camada orgânica.
- Após a extração em terceiro lugar, transferir a fase aquosa para um balão de fundo redondo e rotovap à secura.
- Ressuspender o produto em etanol de 3 ml e transferir para um pré-pesados tubo cônico 15ml. Lavar o balão com um adicional de etanol e adicionar 2 ml a água para o tubo cônico.
- Adicionar 5ml benzeno e incubar o tubo em água morna até que o produto se dissolve logo em seguida coloque o tubo em gelo durante 10 min. Centrifugar por 5 min a 15000 g e remover o sobrenadante.
- Adicionar 5ml de etanol e 5 ml de éter isopropílico à Preciptante. Dissolver o precipitante incubando o tubo em água morna e, periodicamente, inclinando o tubo muito delicadamente. Uma vez precipitado é dissolvido, colocar o tubo em gelo por 10 min. Executar esta recristalização 2 vezes mais com etanol e éter isopropílico. Alguns pedaços insolúveis branco de produto pode ser formado.
- Após a etapa de recristalização última remover o máximo possível sobrenadante e secar o produto resultante em um Speedvac. Pesar o tubo cônico com o produto sintetizado.
- Adicione a água 5ml no tubo vortex, e filtrar qualquer sólido remanescente.
- Use o espectrofotômetro UV-vis para determinar a concentração final de MMDA. O λmax para MMDA em tampão fosfato 50 mM de potássio (pH 7) é 274 nm com o coeficiente de extinção de 29.900 M -1 cm -1 14.
6. GC / MS Medição do MDA
- Prepare uma solução de 0,5 mM butil-tolueno hidroxila (BTH) em etanol, adicionando 0,11 g BTH ao etanol 9ml e ajustar o volume final de 10ml. Em seguida, executar uma diluição pela adição de 10μl da solução concentrada para o etanol 990μl.
- Prepare uma solução de hidrazina fenil 50mM adicionando 4.92μl de hidrazina fenil para 995μl de água em um tubo de microcentrífuga escuro. Vortex da solução.
- Adicionar 5μl 10μM MMDA ao plasma 100μl reservada para o ensaio de MDA durante a coleta de amostras e processamento.
- Em seguida, adicione BTH 0,5 mM 10μl à mistura MMDA / plasma seguido pela adição de citrato de sódio 200μl 1M com pH de 4. Este pH é fundamental para a correta derivatização da amostra. Um pH maior ou menor vai resultar em níveis distorcidos MDA.
- Diluir a mistura final por adição de água destilada deionizada para um volume final de 480μl.
- Derivatize a solução pela adição de hidrazina fenil 20μl 50mm, tampando os frascos e incubar a solução a 25 ° C por 30 min em um agitador orbital.
- Adicionar 1 ml de hexano, vortex por 1 min, e centrifugar a 3000 rpm por 10 min.
- Transferir a fase orgânica para um frasco de GC / MS e concentrar a solução para 100μl por N fluxo 2.
- Analisar amostras em um GC / MS utilizando o amostrador automático. Realizar separação de compostos em um Agilent 122-5532G coluna capilar (25,7 m de comprimento, 0,25 mm de diâmetro interno). Use o gás como o gás de arraste a uma vazão de 0,6-0,8 ml / min. Injetar produto derivatizado (2 mL) no modo split (dividir proporção de 20:1, o fluxo de dividir 23,0 ml / min, fluxo total 27,1 ml / min). Regule a temperatura inicial da coluna a 110 ° C e mantenha nessa temperatura por 1 min antes de aumentar para 250 ° C a uma taxa de 40 ° C / min. Manter esta temperatura até o final da corrida. Depois de cada amostra, limpa a coluna com duas injeções de hexano.
- Quantificar MDA usando o modo de monitoramento de íon selecionar usando o m 144,00 / z para MDA e os 158,00 m / z para MMDA. Converter o MDA / MMDA rácios abundância de íons em concentrações micromolar usando uma curva padrão.
- Analisar amostras em triplicata e usar somente os valores com um coeficiente de variação inferior a 10%.
7. HPLC de medição da xantina oxidase
- A detecção de xantina oxidase função é dependente da capacidade de sensibilidade medir os níveis de um substrato adequado (pterin), bem como seu produto (isoxanthopterin). Plasma é incubada com o substrato, quer para 0 min (controle) ou durante 4 h, e incubação o substrato-dependente de conversão do produto é determinada.
- Adicionar 240μl 0,2 M Tris-HCl (pH 9,0) e 4.63μl 7.083x10 -3 M pterin a cada tubo (0 e 4h) e Pré-incubação-los a 37 ° C por 5 min.
- Iniciar a reação enzimática adicionando 60μl de plasma a cada tubo.
- Imediatamente adicionar 300 ul 4% HClO 4 ao tubo controle (0 min), mas permitem a mistura de outros para incubar por 4 horas antes de extinguir a reação com 300 ul de 4% HClO 4.
- Após a adição de HClO 4, agite vigorosamente o tubo e, em seguida, centrifugar a 4 ° C a 15000 g por 15 min.
- Remover 500μl do sobrenadante e neutralizar adicionando 20μl de 5M K 2 CO 3. Agitar vigorosamente o tubo e, em seguida, centrifugar a 4 ° C a 15000 g por 15 min.
- Adicionar 350μl da solução neutralizada a um tubo de microcentrífuga contendo 1x10 -8 mol 2-AP.
- Analisar amostras em um HPLC equipado com detector de fluorescência de digitalização. Três injeções de 50 mL são usados para cada amostra. As amostras serão injetados em um Wacosil 5C-18-200 250 mm x 6,0 milímetros coluna M, 5 equipado com uma guarda coluna Supelguard LC-18-S. As seguintes condições isocrática deve ser usado para obter a separação e identificação pico adequado: 95% 20mM KPO 4 tampão (pH 2,2) e 5% de metanol em um 1mL/min vazão. Definir o comprimento de onda de excitação para o detector de fluorescência em 345 nm ea onda de emissãocomprimento de 410 nm.
- Determinar as relações entre pterine e isoxanthopterine a 2-AP através da obtenção de áreas dos picos do espectro de detector de fluorescência. O primeiro pico no espectro, a 5 minutos, corresponde a 2-AP. O segundo pico e maior será pterine. Isoxanthopterine pico elui passado.
- Obter a diferença nos índices de pico isoxanthopterine/2-AP área entre os 0 e os 4 pontos h tempo de incubação. Use esse valor para calcular a atividade da XO curvas padrão.
- Analisar amostras em triplicatas, mas usar os valores apenas com um coeficiente de variação de menos de 10%.
8. Resultados representativos:
Um exemplo da quantificação HPLC de compostos de purina é mostrado na Figura 1A. Os tempos de retenção específicos e comprimentos de onda de emissão de hipoxantina, xantina e ácido úrico permitir a quantificação simultânea de compostos de purina (Tabela 2). Quando o ensaio é executado corretamente, os compostos terão separação adequada ea forma de pico serão nítidas e unimodal. Esses picos são então convertidos em concentrações, os intervalos mostrados na Tabela 3, através do uso de curvas padrão. Como o processamento da amostra para este ensaio é mínima, os problemas apenas com base amostra que possam surgir seria a lise das células vermelhas do sangue. Se as células vermelhas do sangue antes de lisar as amostras são centrifugadas, o plasma vai assumir uma cor laranja / vermelho e não podem ser utilizados para avaliar isquemia hipóxica. As outras questões que podem surgir quando se mede purinas envolve o sistema HPLC ea coluna (Figura 1B). Se houver bolhas de ar no sistema de HPLC os tempos de retenção e mudará a pressão HPLC irá flutuar drasticamente. Se o cartucho de guarda precisa ser mudado, a pressão vai aumentar e os picos irá ampliar e tornar-se bi ou tri-modal.
| Hipoxantina (M) | Xantina (M) | Ácido úrico (M) | Xantina oxidase ((produto nmol) / min) | Malondialdeído (M) | Alantoína (M) | |
| Normoxic prazo | 1.13-19.3 (64) | 0.02-3.69 (61) | 107.20-726.12 (63) | 2.47x10 -6 - 3.92x10 -3 (20) | 0.44-3.76 (53) | NA |
| Angústia Respiratória prazo | 1.78-12.59 (27) | 0.07-11.8 (24) | 225.40-653.32 (27) | 0 - 1.03x10 -5 (8) | 0.82-2.73 (24) | NA |
| Hipóxico prazo | 0.38-31.80 (13) | 0.11-2.88 (13) | 235.65-1348.13 (13) | 1.20x10 -5 -236,44 (9) | 0.95-2.15 (7) | NA |
| Prematuros Normoxic | 1.54-4.39 (9) | 0.03-1.77 (9) | 178.92-593.49 (9) | 2.46x10 -5 - 5.44x10 -4 (2) | 0.95-2.74 (8) | 2.30-5.26 (67) |
| Angústia Respiratória prematuro | 3.04-8.04 (2) | NA | 327.56-365.11 (2) | NA | 2.40-3.46 (3) | NA |
Min-Max (n)
Tabela 3. Faixas de Representante para purinas, xantina oxidase, malondialdeído e alantoína.
Um exemplo da quantificação GC / MS de Alantoína é mostrado na Figura 2. Porque a massa de alantoína e ácido úrico derivitized pesados derivitized é conhecido, selecionar o modo de íons pode ser usado para identificar estes compostos na especificação de massa. Se o teste for feito corretamente, dois picos serão observados no mesmo tempo de retenção. Uma correspondendo a alantoína (398,00 m / z) ea outra para alantoína pesados (400,00 m / z). Esses picos são então convertidos em concentrações, os intervalos mostrados na Tabela 3, através do uso de uma curva padrão. Se o ensaio é executado de forma incorreta, e as amostras não foram derivitized corretamente, os picos podem não estar presentes ou não pode ser quantitativamente representativa. Mais uma vez, se as células vermelhas do sangue lisado o plasma não pode ser usado para avaliar o estresse oxidativo em isquemia hipóxica neonatal.
Os resultados para a quantificação do MDA são semelhantes aos de alantoína com a ressalva de que os dois picos são observados em diferentes tempos de retenção. Em ~ 3,5 minutos o tempo de retenção, a 144,00 m / z de pico para MDA e em ~ 4 minutos o tempo de retenção, a 158,00 m / z de pico para MMDA é observado (Figura 3). Esses picos são então convertidos em concentrações, os intervalos mostrados na Tabela 3, através do uso de uma curva padrão. Se o ensaio é executado de forma incorreta, ou amostras não são derivitized adequadamente, não picos podem ser observados na seleção de 144.00m / z e 158.00m / z. Note-se quese houver um excesso de lipídios no plasma de bolus feedings administração oral ou intravenosa de lipídios, o plasma terá uma aparência leitosa e não pode ser usado para avaliar o estresse oxidativo em isquemia hipóxica neonatal.
Um exemplo da quantificação HPLC baseado em xantina oxidase função é mostrado na Figura 4. Se o ensaio é executado corretamente, três picos devem ser observados com o detector fluorescente, um para pterin, um para isoxanthopterin, e um para 2-AP. Esses picos são então convertidos em concentrações, os intervalos mostrados na Tabela 3, através do uso de uma curva padrão. Também deve haver um pico correspondente a isoxanthopterin e 2-AP sobre o espectro gerado a partir do detector PDA. Se a atividade da enzima está ausente, o pico correspondente ao isoxanthopterin não será visto. Porque este ensaio mede a função da enzima, congelamento e descongelamento repetidos da amostra pode alterar isso.
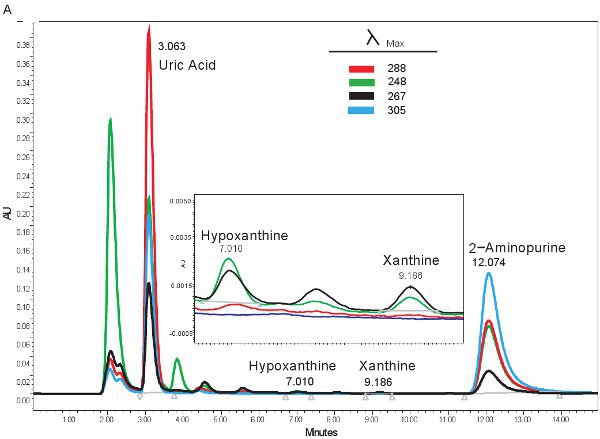
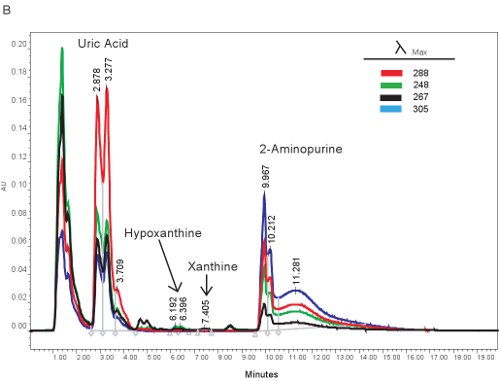
Figura 1. HPLC espectro para a identificação de compostos de purina. A). Resultados representativos se o ensaio foi executado corretamente. B). resultados representativos, se houver um problema com a HPLC, coluna ou cartucho de guarda.
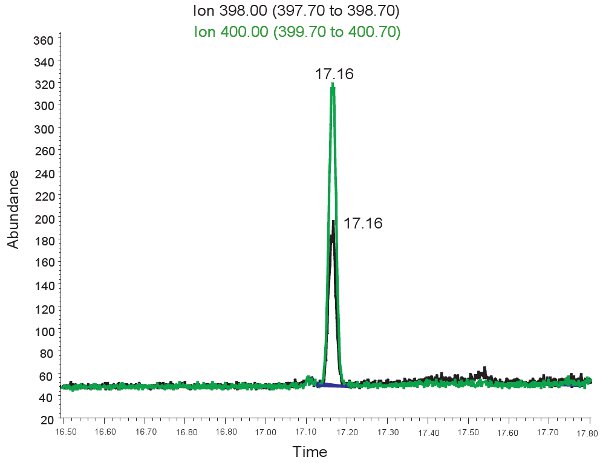
Figura 2. GC / MS espectro para a quantificação da Alantoína. O pico de íon 398,00 m / z corresponde a alantoína. O pico de íon 400,00 m z / corresponde a alantoína pesado.
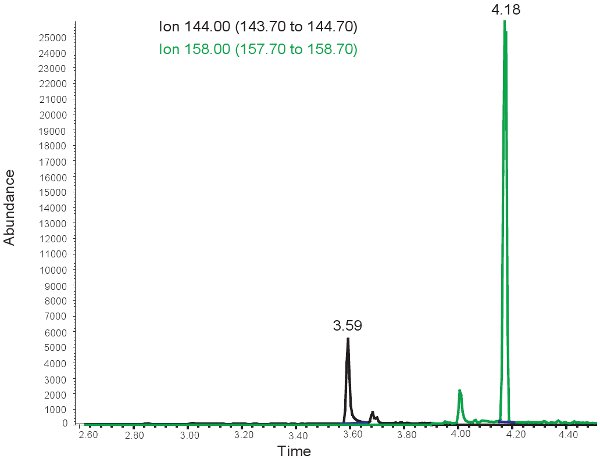
Figura 3. GC / MS espectro para a quantificação do MDA. O pico de íon 144,00 m z / corresponde ao MDA. O pico de íon 158,00 m z / corresponde a MMDA.
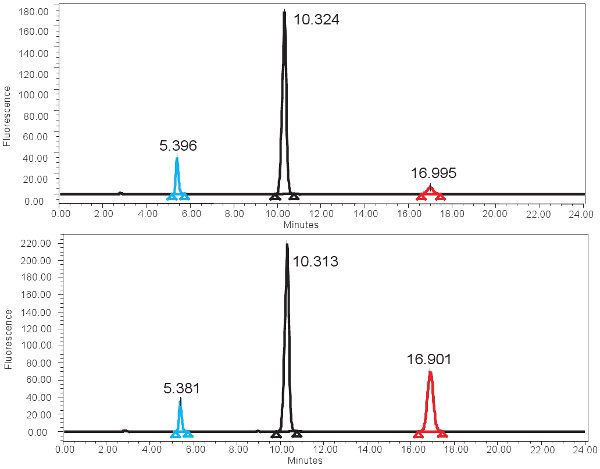
Figura 4. HPLC espectro para a medição da atividade XO. A) Os resultados representativos para o tempo de incubação 0 min e os resultados B) representante para o tempo de incubação de 4 horas. Observe o pico mais alto isoxanthopterine (at ~ min 17) para o tempo de incubação de 4 horas. No espectro de fluorescência, 2-AP elui primeiro em ~ elui 5min e pterine próxima em ~ 10min.
Discussão
Os métodos descritos aqui permitir a avaliação da isquemia hipóxia neonatal. Este protocolo combina as medições de marcadores de privação de energia (ATP), stress oxidativo, dano oxidativo e atividade de enzimas para obter uma imagem global bioquímicos da presença ou até mesmo o grau de isquemia hipóxica. Apesar da utilidade deste método, existem limitações em potencial. Em primeiro lugar, que leva cerca de 1-2 ml de sangue para coletar plasma suficiente para executar todos os ensaios. Este não será um ...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho é financiado pelo National Institutes of Health NR011209 R01-03
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários (opcional) |
|---|---|---|---|
| 6ml K3E EDTA K3 tubo | Fisher Scientific | 2204061 | |
| Centrífuga 5702R | Fisher Scientific | 05413319 | Com 13 e adaptador de 16MM |
| Tubo de microcentrífuga de 1,5 ml | EUA Scientific | 1615-5599 | |
| 2-aminopurina | Sigma-Aldrich | A3509 | |
| Varian Cary 100 espectrofotômetro | Agilant Technologies | 0010071500 | |
| Savant SpeedVac | Thermo Scientific | SC210A-115 | |
| Micron dispositivo centrífugo filtro | Fisher Scientific | UFC501596 | |
| Supelcosil Coluna LC-18-S | Sigma-Aldrich | 58931 | |
| Supelcosil LC-18-S Supelguard cartucho e titular | Sigma-Aldrich | 59629 | |
| HPLC | Águas | ||
| Vial GCMS | Fisher Scientific | 03376607 | |
| DL-Alantoína-5 -13 C; 1 -15 N | CDN Isótopos | M-2307 | Lot # L340P9 |
| MTBSTFA | Thermo Scientific | 48920 | |
| Piridina | Sigma-Aldrich | 270970 | |
| 5973E GC / MSD | Agilent Technologies | G7021A | Part # 5975E para GC / MS |
| 3-Ethoxymethacrolein | Sigma-Aldrich | 232548 | |
| Hidróxido de sódio | Sigma-Aldrich | S5881 | |
| Diclorometano | Sigma-Aldrich | 270997 | |
| Benzeno | Sigma-Aldrich | 401765 | |
| Diisopropil éter | Sigma-Aldrich | 38270 | |
| BHT | Sigma-Aldrich | B1378 | |
| Etanol | Sigma-Aldrich | 459844 | |
| Fenil | Sigma-Aldrich | P26252 |
Referências
- Harkness, R. A., Whitelaw, A. G., Simmonds, R. J. Intrapartum hypoxia: the association between neurological assessment of damage and abnormal excretion of ATP metabolites. J Clin Pathol. 35, 999-1007 (1982).
- Shalak, L., Perlman, J. M. Hypoxic-ischemic brain injury in the term infant-current concepts. Early Hum Dev. 80, 125-141 (2004).
- Webster, W. S., Abela, D. The effect of hypoxia in development. Birth Defects Res C Embryo Today. 81, 215-228 (2007).
- Engerson, T. D., McKelvey, T. G., Rhyne, D. B., Boggio, E. B., Snyder, S. J., Jones, H. P. Conversion of xanthine dehydrogenase to oxidase in ischemic rat tissues. J Clin Invest. 79, 1564-1570 (1987).
- Choi, E. Y., Stockert, A. L., Leimkuhler, S., Hille, R. Studies on the mechanism of action of xanthine oxidase. J Inorg Biochem. 98, 841-848 (2004).
- Godber, B. L., Schwarz, G., Mendel, R. R., Lowe, D. J., Bray, R. C., Eisenthal, R. Molecular characterization of human xanthine oxidoreductase: the enzyme is grossly deficient in molybdenum and substantially deficient in iron-sulphur centres. Biochem J. 388, 501-508 (2005).
- Gruber, J., Tang, S. Y., Jenner, A. M., Mudway, I., Blomberg, A., Behndig, A. Allantoin in human plasma, serum, and nasal-lining fluids as a biomarker of oxidative stress: avoiding artifacts and establishing real in vivo concentrations. Antioxid Redox Signal. 11, 1767-1776 (2009).
- Zitnanova, I., Korytar, P., Aruoma, O. I., Sustrova, M., Garaiova, I., Muchova, J. Uric acid and allantoin levels in Down syndrome: antioxidant and oxidative stress mechanisms?. Clin Chim Acta. 341, 139-146 (2004).
- Siciarz, A., Weinberger, B., Witz, G., Hiatt, M., Hegyi, T. Urinary thiobarbituric acid-reacting substances as potential biomarkers of intrauterine hypoxia. Arch Pediatr Adolesc Med. 155, 718-722 (2001).
- Buonocore, G., Perrone, S., Longini, M., Terzuoli, L., Bracci, R. Total hydroperoxide and advanced oxidation protein products in preterm hypoxic babies. Pediatr Res. 47, 221-224 (2000).
- Berne, R. M. Cardiac nucleotides in hypoxia: possible role in regulation of coronary blood flow. Am J Physiol. 204, 317-322 (1963).
- Harkness, R. A., Lund, R. J. Cerebrospinal fluid concentrations of hypoxanthine, xanthine, uridine and inosine: high concentrations of the ATP metabolite, hypoxanthine, after hypoxia. J Clin Pathol. 36, 1-8 (1983).
- Plank, M. S., Boskovic, D. S., Sowers, L. C., Angeles, D. M. Biochemical markers of neonatal hypoxia. Pediatric Health. 2, 485-501 (2008).
- Cighetti, G., Allevi, P., Anastasia, L., Bortone, L., Paroni, R. Use of methyl malondialdehyde as an internal standard for malondialdehyde detection: validation by isotope-dilution gas chromatography-mass spectrometry. Clin Chem. 48, 2266-2269 (2002).
- Paroni, R., Fermo, I., Cighetti, G. Validation of methyl malondialdehyde as internal standard for malondialdehyde detection by capillary electrophoresis. Anal Biochem. 307, 92-98 (2002).
- Cighetti, G., Debiasi, S., Ciuffreda, P., Allevi, P. Beta-ethoxyacrolein contamination increases malondialdehyde inhibition of milk xanthine oxidase activity. Free Radic Biol Med. 25, 818-825 (1998).
- Cighetti, G., Debiasi, S., Paroni, R., Allevi, P. Free and total malondialdehyde assessment in biological matrices by gas chromatography-mass spectrometry: what is needed for an accurate detection. Anal Biochem. 266, 222-229 (1999).
- Yamamoto, T., Moriwaki, Y., Takahashi, S., Tsutsumi, Z., Yamakita, J., Nasako, Y. Determination of human plasma xanthine oxidase activity by high-performance liquid chromatography. J Chromatogr B Biomed Appl. 681, 395-400 (1996).
- Fasman, G. . Handbook of Biochemistry and Molecular Biology. , (1988).
- Chen, X. B., Calder, A. G., Prasitkusol, P., Kyle, D. J., Jayasuriya, M. C. Determination of 15N isotopic enrichment and concentrations of allantoin and uric acid in urine by gas chromatography/mass spectrometry. J Mass Spectrom. 33, 130-137 (1998).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados