Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Биохимические измерения новорожденных Гипоксия
В этой статье
Резюме
Описан метод для измерения биохимических маркеров неонатальной гипоксии-ишемии. Подход использует высокого давления жидкостной хроматографии (ВЭЖХ) и газовой хроматографии-масс-спектрометрии (GC / MS).
Аннотация
Neonatal hypoxia ischemia is characterized by inadequate blood perfusion of a tissue or a systemic lack of oxygen. This condition is thought to cause/exacerbate well documented neonatal disorders including neurological impairment 1-3. Decreased adenosine triphosphate production occurs due to a lack of oxidative phosphorylation. To compensate for this energy deprived state molecules containing high energy phosphate bonds are degraded 2. This leads to increased levels of adenosine which is subsequently degraded to inosine, hypoxanthine, xanthine, and finally to uric acid. The final two steps in this degradation process are performed by xanthine oxidoreductase. This enzyme exists in the form of xanthine dehydrogenase under normoxic conditions but is converted to xanthine oxidase (XO) under hypoxia-reperfusion circumstances 4, 5. Unlike xanthine dehydrogenase, XO generates hydrogen peroxide as a byproduct of purine degradation 4, 6. This hydrogen peroxide in combination with other reactive oxygen species (ROS) produced during hypoxia, oxidizes uric acid to form allantoin and reacts with lipid membranes to generate malondialdehyde (MDA) 7-9. Most mammals, humans exempted, possess the enzyme uricase, which converts uric acid to allantoin. In humans, however, allantoin can only be formed by ROS-mediated oxidation of uric acid. Because of this, allantoin is considered to be a marker of oxidative stress in humans, but not in the mammals that have uricase.
We describe methods employing high pressure liquid chromatography (HPLC) and gas chromatography mass spectrometry (GCMS) to measure biochemical markers of neonatal hypoxia ischemia. Human blood is used for most tests. Animal blood may also be used while recognizing the potential for uricase-generated allantoin. Purine metabolites were linked to hypoxia as early as 1963 and the reliability of hypoxanthine, xanthine, and uric acid as biochemical indicators of neonatal hypoxia was validated by several investigators 10-13. The HPLC method used for the quantification of purine compounds is fast, reliable, and reproducible. The GC/MS method used for the quantification of allantoin, a relatively new marker of oxidative stress, was adapted from Gruber et al 7. This method avoids certain artifacts and requires low volumes of sample. Methods used for synthesis of MMDA were described elsewhere 14, 15. GC/MS based quantification of MDA was adapted from Paroni et al. and Cighetti et al. 16, 17. Xanthine oxidase activity was measured by HPLC by quantifying the conversion of pterin to isoxanthopterin 18. This approach proved to be sufficiently sensitive and reproducible.
протокол
1. Взятия пробы и перерабатывающей
- Сбор крови в 6 мл K3E ЭДТА K3 трубку, которая хранится на льду.
- В течение 2 мин сбора, центрифуги образцов при температуре 4 ° С в 1500 г за 10 мин.
- Передача супернатант (плазмы) в 1,5 мл трубки микроцентрифужных.
- Центрифуга при 4 ° С при 18 000 г на 30 мин.
- Удалить супернатант аликвоты и передачи их на отдельные трубы микроцентрифужных для пуринов (200 мкл), аллантоин (50 мкл), MDA (100 мкл) и XO (120μl) анализа. Будьте осторожны, чтобы не загрязнять образцы с красных кровяных телец. Возможно, вам придется скорректировать объемы плазмы для MDA, XO, и пуринов в зависимости от общего объема плазмы доступны.
2. Подготовка внутреннего стандарта, 2-аминопурин (2-AP), для пуриновых и XO Анализ
- Отвешивать 0.01351g 2-AP и добавить его в 8 мл воды, которая была подкисляют 2-5 капель соляной кислоты. Если 2-AP не растворяясь вам нужно добавить количество кислоты. Отрегулируйте окончательный объем 10 мл.
- Использование UV-VIS спектрофотометр для определения истинной концентрации ваши акции 2-AP решение. (Λmax 315, ε 4000).
- Как только концентрация акции 2-AP решения определяется, рассчитать объемы обязаны содержать 1x10 -7 моль 2-AP внутреннего стандарта для измерения и пуриновых 1x10 -8 моль 2-AP внутреннего стандарта для XO измерений.
- Алиготе рассчитанные объемы в отдельные трубы микроцентрифужных и выпаривают досуха в SpeedVac.
Уравнение 1: 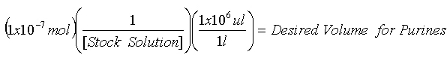
Уравнение 2: 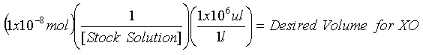
3. ВЭЖХ Измерение Пурины
- Передача плазмы (200 мкл) в микроконтроллер YM-10 центробежный фильтр устройства и центрифуги при 4 ° С на 14000 г в течение 1,5 часов.
- Удаление фильтрата и трансфер в микроцентрифужных трубки, содержащей 1x10 -7 моль 2-AP. Обязательно запишите объем фильтрата добавляется микроцентрифужных трубки, содержащей 2-AP. Vortex образцы в течение 10-20 сек.
- Анализ образцов с высокоэффективной жидкостной хроматографии. Три 50 мкл инъекции используются для каждого образца. Образцы вводятся на Supelcosil LC-18-S, 15 см х 4,6 мм, 5 мкм колонки оснащены Supelguard LC-18-S охранник колонке. Градиент условий, описанных в таблице 1, должны быть использованы для получения надлежащего разделения пиков: растворитель-вода, растворитель В-метанола, растворитель C-50 мМ формиат аммония буфере, рН 5,5.
| Время | Поток (мл / мин) | % | % B | % C | |
| 1 | 1,00 | 0,0 | 0,0 | 100,0 | |
| 2 | 16,00 | 1,00 | 0,0 | 0,0 | 100,0 |
| 3 | 17,00 | 1,00 | 100,0 | 0,0 | 0,0 |
| 4 | 22,00 | 1,00 | 100,0 | 0,0 | 0,0 |
| 5 | 27,00 | 1,00 | 0,0 | 100,0 | 0,0 |
| 6 | 32,00 | 1,00 | 0,0 | 100,0 | 0,0 |
| 7 | 33,00 | 1,00 | 100,0 | 0,0 | 0,0 |
| 8 | 38,00 | 1,00 | 100,0 | 0,0 | 0,0 |
| 9 | 39,00 | 1,00 | 0,0 | 0,0 | 100,0 |
| 10 | 45,00 | 1,00 | 0,0 | 0,0 | 100,0 |
Таблица 1. Растворитель изменения для ВЭЖХ измерения пуриновых соединений.
- Определить концентрацию пуринов в образце. Количественная гипоксантин, ксантин и мочевую кислоту, получая площади пиков на сохранение и длин волн, описанных в таблице 2. Определение площади пика 2-AP. Определить площадь отношения гипоксантин, ксантин и мочевую кислоту до 2-AP и преобразовать отношения к μmolar концентрации с использованием стандартных кривых.
| * Время хранения | Наблюдаемые λ макс * | Отмеченные λ макс 19 | Отмеченные ε макс 19 | |
| МочевойКислота | ~ 3,5 мин | 288 | 283 [2] | 11500 [2] |
| Гипоксантин | ~ 7,0 мин | 248 | 248 [1] | 10800 [1] |
| Ксантин | ~ 9,5 мин | 267 | 267 [2] | 10200 [2] |
| 2-аминопурин | ~ 12,5 мин | 305 | 314 [2] | 4000 [2] |
Таблица 2. Среднее время удержания и λ макс для пуринов и внутреннего стандарта. * Определяется на ВЭЖХ использованием изократического 50 мМ буфера формиат аммония (рН 5.5) с расходом 1mL/min. рН в [].
- Анализ всех образцов в трех экземплярах, но только включать значения для последующего анализа, если коэффициент вариации не превышает 10%.
4. ГХ / МС Измерение Аллантоин
- Добавить 50 мкл 10 мкм DL-Аллантоин-5-13 С, 1 - 15 N (внутренний стандарт) до 50 мкл плазмы, предназначенные для анализа аллантоин во время сбора образцов и обработки информации.
- Добавить 100 мкл ацетонитрила к этой плазмы решение.
- Vortex смесь в течение 10-20 секунд, то центрифуги при 4 ° С при 20 000 г в течение 10 мин.
- Удалить супернатант, поместите его в ГХ / МС флаконе и сухой под N 2.
- После высыхания, добавить 50 мкл дериватизирующего агента N-трет-бутилдиметилсилил-N-methyltrifluoroacetamide (МТБСТФА) в пиридине (1:1 об / об), крышки флакона и инкубировать их при температуре 50 ° С в течение 2 ч. Это дает производных последовательно количественно т / г пики 398,0 и 400,0 на аллантоин и DL-аллантоин-5-13 С, 1 - 15 N, соответственно, 20.
- Анализ образцов на GC 6890N Agilent Technologies и MS 5973 оснащен автоматическим пробоотборником. Выполните соединение разделения на Agilent 122-5532G капиллярной колонкой (25.7m длины, 0,25 мм внутренний диаметр). Использование гелия в качестве газа-носителя при скорости потока 1,5 мл / мин. Inject производного произведения (1 мкл) в режиме разделения (сплит соотношение 20:1, разделить поток 29,4 мл / мин, общий расход 33,8 мл / мин). Установить начальная температура колонки при 100 ° С и удерживать при этой температуре в течение 2 минут, прежде чем ее увеличение до 180 ° С со скоростью 10 ° С / мин. Держите температуре в течение 4 минут, а затем увеличить ее до 260 ° С со скоростью 20 ° С / мин. Поддерживайте эту температуру до конца перспективе. После каждой пробы, чистый колонка с 2 инъекции гексана.
- Количественная аллантоин использованием выбрать режим мониторинга ионов в процессе мониторинга 398,0 т / г иона аллантоин и 400,0 т / г иона DL-аллантоин-5-13 С, 1 - 15 Н. Преобразование ионного соотношения обилия аллантоин / (тяжелые аллантоин), чтобы микромолярных концентрации аллантоина использованием подготовленных стандартной кривой.
- Все образцы анализируются в трех экземплярах, но только значения с коэффициентом вариации менее 10% используется в дальнейшем анализе.
5. Подготовка внутренних Standard, метил малонового диальдегида (ММДА), для анализа MDA
- Добавить 523μl 3-ethoxymethacrolein к 1477μl 7М NaOH в 100 мл колбу раунде. Добавить stirbar.
- Место колбу в водяную баню с температурой 45 ° С и перемешать до реакция прошла до конца. Это должно занять примерно 140 мин. Осуществляют контроль за ходом реакции путем удаления 10 мкл аликвоты жидкости периодически в 10 минутные интервалы. Развести каждый образец, собранный на коэффициент 10 5, используя 50 мМ фосфата калия буфером (рН = 7) и измерения поглощения с UV-Vis. После абсорбции при 275nm достигает примерно 0,658 завершения реакции. Как реакция прогрессирует, решение будет желтеть, то оранжевым.
- Разрешить реакция на прогресс для еще 15 мин.
- Добавьте 5 мл дистиллированной деионизированной воды в круглодонную колбу и передачи решения в делительную воронку. Используйте дополнительные 3 мл воды, чтобы вымыть содержимое колбы в воронку. Добавить дополнительные 2 мл воды воронку.
- Извлечение раствора 3 раза по 5 мл дихлорметана. После каждой экстракции отказаться от органического слоя.
- После третьего добычи, передачи водного слоя круглодонную колбу и rotovap досуха.
- Ресуспендируют продукта в 3 мл этанола и трансфер в предварительно взвешенные 15 мл коническую трубку. Промойте колбу с дополнительными 2 мл этанола и добавляют промыть в конической трубе.
- Добавьте 5 мл бензола и инкубировать трубку в теплой воде, пока продукт растворяется сразу же месте трубки на льду в течение 10 мин. Центрифуга ее в течение 5 мин при 15000 г и удалите супернатант.
- Добавьте 5 мл этанола и 5 мл изопропилового эфира осадковitant. Растворить осадок путем инкубации трубки в теплой воде и периодически наклоняя трубку очень мягко. Как только осадок растворяют, место трубки на льду в течение 10 мин. Выполните это рекристаллизации еще 2 раза с этанолом и изопропиловый эфир. Некоторые нерастворимые белых кусков продукта может быть сформирована.
- После последнего шага рекристаллизации удалить как можно больше супернатант насколько это возможно и сухой результате продукт в Speedvac. Взвесьте коническую трубку с синтезированных продуктов.
- Добавьте 5 мл воды для трубки, вихревые, и отфильтровать все оставшиеся твердые вещества.
- Использование UV-VIS спектрофотометр для определения конечной концентрации ММДА. Λmax для ММДА в 50 мМ калий-фосфатном буфере (рН 7), 274 нм, коэффициент экстинкции 29900 М -1 см -1 14.
6. ГХ / МС Измерение MDA
- Приготовить раствор из 0,5 мм бутилированного гидроксильных толуола (BTH) в этаноле, добавляя 0,11 г BTH к 9ml этанола и корректировки конечного объема в 10 мл. Затем производят разбавление добавлением 10 мкл этого концентрированного раствора к 990μl этанола.
- Приготовьте раствор 50 мМ фенил гидразина, добавив 4.92μl фенил гидразина на 995μl воды в темном трубки микроцентрифужных. Vortex решение.
- Добавить 5 мкл 10 мкм ММДА к 100 мкл плазмы, предназначенные для анализа MDA во время сбора образцов и обработки информации.
- Затем добавить 10 мкл 0,5 BTH к ММДА / плазмы смеси с последующим добавлением по 200 мкл 1М цитрата натрия при рН 4. Это рН решающее значение для правильного дериватизации образца. Выше или ниже рН приведет перекос уровней МДА.
- Развести конечной смеси добавлением дистиллированной деионизированной водой до конечного объема 480μl.
- Derivatize решение путем добавления 20 мкл 50 мМ гидразина фенил, укупорки флаконов и инкубации раствора при 25 ° С в течение 30 мин на орбитальном шейкере.
- Добавить 1 мл гексана, вихрь в течение 1 мин, а центрифуге при 3000 оборотов в минуту в течение 10 мин.
- Передача органических слоя на ГХ / МС флакон и сосредоточиться решение по 100 мкл N 2 потока.
- Анализ образцов на ГХ / МС с помощью автоматического пробоотборника. Выполните соединение разделения на Agilent 122-5532G капиллярной колонкой (25,7 м длины, 0,25 мм внутренний диаметр). Использование гелия в качестве газа-носителя при расходе 0,6-0,8 мл / мин. Inject производного произведения (2 мкл) в режиме разделения (сплит соотношение 20:1, разделить поток 23,0 мл / мин, общий расход 27,1 мл / мин). Установить начальная температура колонки при 110 ° C и удерживайте при этой температуре в течение 1 мин, прежде чем ее увеличение до 250 ° С со скоростью 40 ° С / мин. Поддерживайте эту температуру до конца перспективе. После каждой пробы, чистый колонка с 2 инъекции гексана.
- Количественная MDA использованием выбрать режим мониторинга ионов использованием 144,00 м / г, при МДА и 158,00 т / г для ММДА. Преобразование MDA / ММДА отношения ионных изобилии микромолярных концентраций с использованием стандартной кривой.
- Анализ образцов в трех экземплярах и использовать только значения с коэффициентом вариации менее 10%.
7. ВЭЖХ Измерение оксидазы ксантин
- Обнаружение ксантиноксидазы функция зависит от способности чутко измерить уровни подходящий субстрат (pterin), а также его продукт (isoxanthopterin). Плазменные инкубируют с субстратом как для 0 мин (контроль) или в течение 4 часов, и инкубации зависит от подложки к конверсии продукта определяется.
- Добавить 240μl 0,2 М Трис-HCl буфером (рН 9,0) и 4.63μl 7.083x10 -3 М pterin в каждую пробирку (0 и 4 часа) и preincubate их при температуре 37 ° С в течение 5 мин.
- Инициировать ферментативной реакции, добавив 60μl плазмы в каждую пробирку.
- Сразу же добавить 300 мкл 4% HClO 4 до контрольную пробирку (0 мин), но разрешить другие смеси для инкубации в течение 4 часов перед закалкой реакции с 300 мкл 4% HClO 4.
- После добавления HClO 4, энергично встряхнуть трубку, а затем центрифуги при 4 ° С на 15000 г в течение 15 мин.
- Удалить 500 мкл супернатанта и нейтрализуют путем добавления 20 мкл 5М K 2 CO 3. Энергично встряхните трубки, а затем центрифуги при 4 ° С на 15000 г в течение 15 мин.
- Добавить 350μl нейтрализованного решение микроцентрифужных трубки, содержащей 1x10 -8 моль 2-AP.
- Анализ образцов на HPLC оснащен сканирование детектор флуоресценции. Три 50 мкл инъекции используются для каждого образца. Образцы будут внесены на Wacosil 5C-18-200, 250 мм х 6,0 мм, 5 мкм колонки оснащены Supelguard LC-18-S колонка охранник. Следующие изократического условия должны быть использованы для получения надлежащего разделения и идентификации пика: 95% 20 мМ КПО 4 буфером (рН 2,2) и 5% метанола при 1ml/min расхода. Установите для длины волны возбуждения флуоресценции детектора на 345 нм и волны излученияДлина при 410 нм.
- Определить отношение pterine и isoxanthopterine до 2-AP, получив площадей пиков от спектра флуоресценции детектора. Первый пик в спектре, ~ 5 минут, соответствует 2-AP. Второй и самый большой пик будет pterine. Isoxanthopterine пик элюируется в последнюю очередь.
- Получить разницу в isoxanthopterine/2-AP площади пика соотношения между 0 и 4 ч точках инкубационного периода. Используйте это значение для расчета XO деятельности от стандартных кривых.
- Анализ образцов трем образцам, но использовать только значения с коэффициентом вариации менее 10%.
8. Представитель Результаты:
Примером количественного ВЭЖХ пуриновых соединений показана на рисунке 1А. Определенное время удержания и излучения длиной волны гипоксантин, ксантин и мочевую кислоту разрешения одновременного количественного пуриновых соединений (табл. 2). Когда анализ будет работать правильно, соединения будут иметь достаточное разделение и пик формы будет четким и одним видом. Эти пики затем преобразуются в концентрациях, диапазоны приведены в таблице 3, за счет использования стандартных кривых. Поскольку обработку за этого анализа является минимальным, только образец основан проблемы, которые могут возникнуть бы лизирующего из красных кровяных телец. Если эритроциты лизируют перед образцы центрифугировали, плазму возьмет на себя оранжевый / красный цвет и не могут быть использованы для оценки гипоксических ишемии. Другие вопросы, которые могут возникнуть при измерении пуринов включает в себя системы высокоэффективной жидкостной хроматографии и колонки (рис. 1В). Если Есть пузырьков воздуха в системе ВЭЖХ время удерживания будет смещаться и давление ВЭЖХ будет колебаться резко. Если картридж охранник должен быть изменен, то давление будет возрастать, а пики будут расширяться и становиться би или три-модальным.
| Гипоксантин (мкМ) | Ксантин (мкМ) | Мочевая кислота (мкМ) | Ксантиноксидазы ((нмоль продукта) / мин) | Малонового диальдегида (мкМ) | Аллантоин (мкМ) | |
| Срок гипоксическим | 1.13-19.3 (64) | 0.02-3.69 (61) | 107.20-726.12 (63) | 2.47x10 -6 - 3.92x10 -3 (20) | 0.44-3.76 (53) | Не Доступно |
| Срок респираторный дистресс | 1.78-12.59 (27) | 0.07-11.8 (24) | 225.40-653.32 (27) | 0 - 1.03x10 -5 (8) | 0.82-2.73 (24) | Не Доступно |
| Срок Гипоксическая | 0.38-31.80 (13) | 0.11-2.88 (13) | 235.65-1348.13 (13) | 1.20x10 -5 -236,44 (9) | 0.95-2.15 (7) | Не Доступно |
| Преждевременные гипоксическим | 1.54-4.39 (9) | 0.03-1.77 (9) | 178.92-593.49 (9) | 2.46x10 -5 - 5.44x10 -4 (2) | 0.95-2.74 (8) | 2.30-5.26 (67) |
| Преждевременные респираторный дистресс | 3.04-8.04 (2) | Не Доступно | 327.56-365.11 (2) | Не Доступно | 2.40-3.46 (3) | Не Доступно |
Min-Max (п)
Таблица 3. Представителю диапазоны для пуринов, ксантиноксидазы, малонового диальдегида и аллантоин.
Примером ГХ / МС количественной Аллантоин показано на рисунке 2. Потому что масса derivitized аллантоин и derivitized тяжелых аллантоин, как известно, выберите ионный режим может быть использован для идентификации этих соединений на массу спец. Если анализ будет сделано правильно, два пика будет наблюдаться в то же время хранения. Один соответствующие аллантоин (398,00 м / г) и других тяжелых аллантоин (400,00 м / г). Эти пики затем преобразуются в концентрациях, диапазоны приведены в таблице 3, с помощью калибровочной кривой. Если анализ будет работать неправильно, и образцы не были derivitized должным образом, пики может и не быть или не быть количественно представителя. Еще раз, если красные кровяные клетки лизируются плазме не могут быть использованы для оценки окислительного стресса у новорожденных гипоксической ишемии.
Результаты количественного MDA похожи на тех, для аллантоин с тем исключением, что два пика наблюдаются в разное время хранения. В ~ 3,5 минуты времени удерживания, 144,00 т / г пик MDA и на ~ 4 минуты времени удерживания, 158,00 т / г пик ММДА не наблюдается (рис. 3). Эти пики затем преобразуются в концентрациях, диапазоны приведены в таблице 3, с помощью калибровочной кривой. Если анализ будет работать неправильно, или образцы не derivitized должным образом, нет пиков может наблюдаться при отборе для 144.00m / г и 158.00m / z. Следует отметить, чтоесли есть избыток липидов в плазме от болюсного устные кормления или внутривенного введения липидов, плазменных возьмет на молочно внешний вид и не могут быть использованы для оценки окислительного стресса у новорожденных гипоксической ишемии.
Примером ВЭЖХ основе количественного ксантиноксидазы функции изображен на рисунке 4. Если анализ будет работать правильно, три вершины должны быть соблюдены с флуоресцентным детектором, по одному для pterin, по одному для isoxanthopterin, и один для 2-AP. Эти пики затем преобразуются в концентрациях, диапазоны приведены в таблице 3, с помощью калибровочной кривой. Там также должны быть пик, соответствующий isoxanthopterin и 2-AP на спектр генерируется из КПК детектора. Если активность ферментов отсутствует, пик, соответствующий isoxanthopterin не будет видно. Поскольку этот анализ мер функции ферментов, повторное замораживание и оттаивание образца может изменить это.
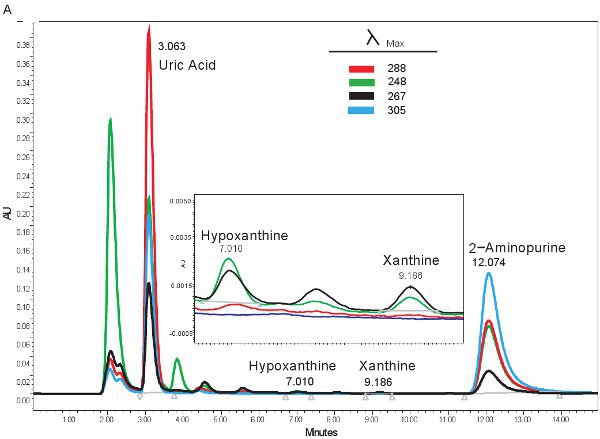
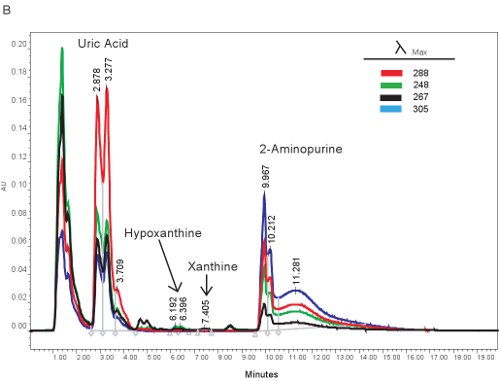
Рисунок 1. ВЭЖХ спектра для определения пуриновых соединений. А). Представитель результаты, если анализ был работать правильно. Б). репрезентативные результаты, если есть проблемы с ВЭЖХ, колонки или охранник картриджа.
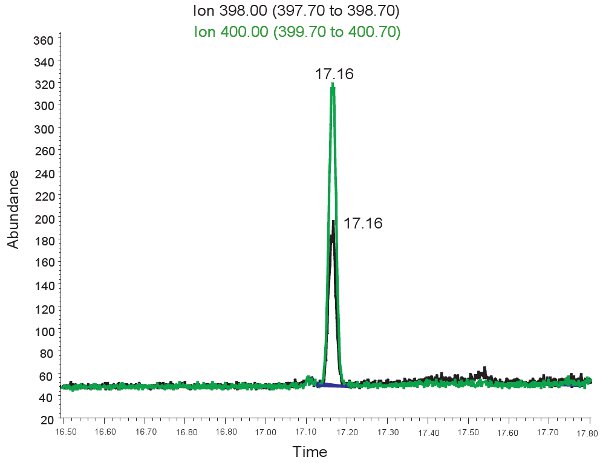
Рисунок 2. ГХ / МС спектра для количественной оценки Аллантоин. Пик иона 398,00 т / г соответствует аллантоин. Пик при ионной 400,00 т / г соответствует тяжелой аллантоин.
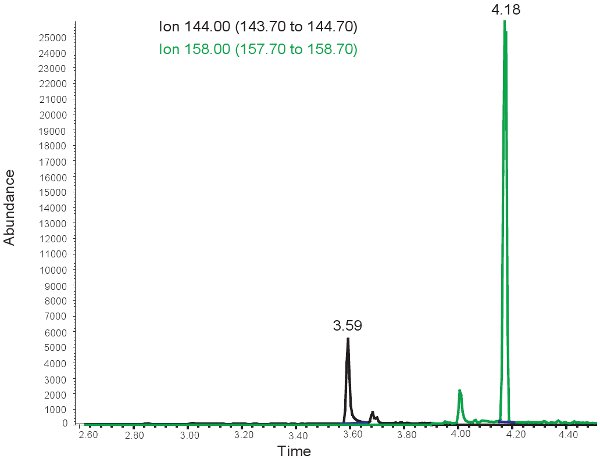
Рисунок 3. ГХ / МС спектра для количественной оценки MDA. Пик иона 144,00 т / г соответствует MDA. Пик при ионной 158,00 т / г соответствует ММДА.
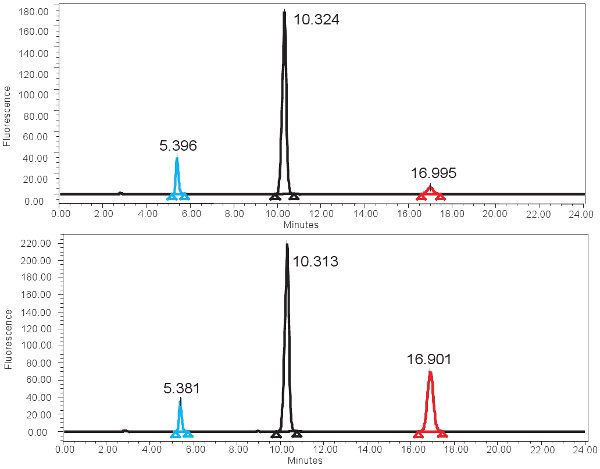
Рисунок 4. ВЭЖХ спектра для измерения XO деятельности.) Представитель результаты для 0 мин времени инкубации и Б) результаты представителем 4 часов инкубационного периода. Обратите внимание, выше isoxanthopterine пика (на ~ 17 мин) для 4-часового инкубационного периода. В спектре флуоресценции, 2-AP элюируется первым на ~ 5 минут и pterine элюируется следующий на ~ 10мин.
Обсуждение
Методы, описанные здесь разрешение оценки неонатального ишемии гипоксии. Этот протокол комбинирует измерения маркеров энергии (АТФ), лишения, окислительный стресс, окислительные повреждения, и активность ферментов, чтобы получить общую биохимическую картину наличия или даже степень ...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа финансируется Национальным институтом здоровья R01 NR011209-03
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии (необязательно) |
|---|---|---|---|
| 6 мл K3E ЭДТА K3 трубки | Fisher Scientific | 2204061 | |
| 5702R центрифуги | Fisher Scientific | 05413319 | С 13 и 16 мм адаптер |
| 1,5 мл трубки микроцентрифужных | США Научная | 1615-5599 | |
| 2-аминопурин | Sigma-Aldrich | A3509 | |
| Varian Cary 100 спектрофотометр | Agilant Технологии | 0010071500 | |
| Savant SpeedVac | Thermo Scientific | SC210A-115 | |
| Micron центробежный фильтр устройства | Fisher Scientific | UFC501596 | |
| Supelcosil LC-18-S колонка | Sigma-Aldrich | 58931 | |
| Supelcosil LC-18-S Supelguard картридж и держатель | Sigma-Aldrich | 59629 | |
| ВЭЖХ | Воды | ||
| GCMS флакон | Fisher Scientific | 03376607 | |
| DL-Аллантоин-5 -13 С; 1 -15 N | CDN Изотопы | M-2307 | Лот № L340P9 |
| МТБСТФА | Thermo Scientific | 48920 | |
| Пиридин | Sigma-Aldrich | 270970 | |
| 5973E GC / MSD | Компания Agilent Technologies | G7021A | Часть # для 5975E ГХ / МС |
| 3-Ethoxymethacrolein | Sigma-Aldrich | 232548 | |
| Едкий натр | Sigma-Aldrich | S5881 | |
| Дихлорметан | Sigma-Aldrich | 270997 | |
| Бензол | Sigma-Aldrich | 401765 | |
| Диизопропил эфир | Sigma-Aldrich | 38270 | |
| BHT | Sigma-Aldrich | B1378 | |
| Этанол | Sigma-Aldrich | 459844 | |
| Фенилгидразином | Sigma-Aldrich | P26252 |
Ссылки
- Harkness, R. A., Whitelaw, A. G., Simmonds, R. J. Intrapartum hypoxia: the association between neurological assessment of damage and abnormal excretion of ATP metabolites. J Clin Pathol. 35, 999-1007 (1982).
- Shalak, L., Perlman, J. M. Hypoxic-ischemic brain injury in the term infant-current concepts. Early Hum Dev. 80, 125-141 (2004).
- Webster, W. S., Abela, D. The effect of hypoxia in development. Birth Defects Res C Embryo Today. 81, 215-228 (2007).
- Engerson, T. D., McKelvey, T. G., Rhyne, D. B., Boggio, E. B., Snyder, S. J., Jones, H. P. Conversion of xanthine dehydrogenase to oxidase in ischemic rat tissues. J Clin Invest. 79, 1564-1570 (1987).
- Choi, E. Y., Stockert, A. L., Leimkuhler, S., Hille, R. Studies on the mechanism of action of xanthine oxidase. J Inorg Biochem. 98, 841-848 (2004).
- Godber, B. L., Schwarz, G., Mendel, R. R., Lowe, D. J., Bray, R. C., Eisenthal, R. Molecular characterization of human xanthine oxidoreductase: the enzyme is grossly deficient in molybdenum and substantially deficient in iron-sulphur centres. Biochem J. 388, 501-508 (2005).
- Gruber, J., Tang, S. Y., Jenner, A. M., Mudway, I., Blomberg, A., Behndig, A. Allantoin in human plasma, serum, and nasal-lining fluids as a biomarker of oxidative stress: avoiding artifacts and establishing real in vivo concentrations. Antioxid Redox Signal. 11, 1767-1776 (2009).
- Zitnanova, I., Korytar, P., Aruoma, O. I., Sustrova, M., Garaiova, I., Muchova, J. Uric acid and allantoin levels in Down syndrome: antioxidant and oxidative stress mechanisms?. Clin Chim Acta. 341, 139-146 (2004).
- Siciarz, A., Weinberger, B., Witz, G., Hiatt, M., Hegyi, T. Urinary thiobarbituric acid-reacting substances as potential biomarkers of intrauterine hypoxia. Arch Pediatr Adolesc Med. 155, 718-722 (2001).
- Buonocore, G., Perrone, S., Longini, M., Terzuoli, L., Bracci, R. Total hydroperoxide and advanced oxidation protein products in preterm hypoxic babies. Pediatr Res. 47, 221-224 (2000).
- Berne, R. M. Cardiac nucleotides in hypoxia: possible role in regulation of coronary blood flow. Am J Physiol. 204, 317-322 (1963).
- Harkness, R. A., Lund, R. J. Cerebrospinal fluid concentrations of hypoxanthine, xanthine, uridine and inosine: high concentrations of the ATP metabolite, hypoxanthine, after hypoxia. J Clin Pathol. 36, 1-8 (1983).
- Plank, M. S., Boskovic, D. S., Sowers, L. C., Angeles, D. M. Biochemical markers of neonatal hypoxia. Pediatric Health. 2, 485-501 (2008).
- Cighetti, G., Allevi, P., Anastasia, L., Bortone, L., Paroni, R. Use of methyl malondialdehyde as an internal standard for malondialdehyde detection: validation by isotope-dilution gas chromatography-mass spectrometry. Clin Chem. 48, 2266-2269 (2002).
- Paroni, R., Fermo, I., Cighetti, G. Validation of methyl malondialdehyde as internal standard for malondialdehyde detection by capillary electrophoresis. Anal Biochem. 307, 92-98 (2002).
- Cighetti, G., Debiasi, S., Ciuffreda, P., Allevi, P. Beta-ethoxyacrolein contamination increases malondialdehyde inhibition of milk xanthine oxidase activity. Free Radic Biol Med. 25, 818-825 (1998).
- Cighetti, G., Debiasi, S., Paroni, R., Allevi, P. Free and total malondialdehyde assessment in biological matrices by gas chromatography-mass spectrometry: what is needed for an accurate detection. Anal Biochem. 266, 222-229 (1999).
- Yamamoto, T., Moriwaki, Y., Takahashi, S., Tsutsumi, Z., Yamakita, J., Nasako, Y. Determination of human plasma xanthine oxidase activity by high-performance liquid chromatography. J Chromatogr B Biomed Appl. 681, 395-400 (1996).
- Fasman, G. . Handbook of Biochemistry and Molecular Biology. , (1988).
- Chen, X. B., Calder, A. G., Prasitkusol, P., Kyle, D. J., Jayasuriya, M. C. Determination of 15N isotopic enrichment and concentrations of allantoin and uric acid in urine by gas chromatography/mass spectrometry. J Mass Spectrom. 33, 130-137 (1998).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены