Method Article
La criopreservación de embriones de ratón por el etileno a base de glicol vitrificación
En este artículo
Resumen
Un etilenglicol basado en el método de vitrificación de embriones de ratón se describe. Es conveniente que otros métodos en su simplicidad y la toxicidad embrionaria bajo, y por lo tanto se puede aplicar ampliamente a muchas cepas de ratones, incluyendo ratones endogámicos y el gen modificado.
Resumen
La criopreservación de embriones de ratón es una base tecnológica que soporta las ciencias biomédicas, ya que muchas cepas de ratones han sido producidos por modificaciones genéticas y el número está aumentando constantemente año tras año. Su desarrollo técnico se inició con los métodos de congelación lenta en la década de 1970 1, seguido de los métodos de vitrificación desarrollada a finales de 1980 2. Por lo general, esta última técnica tiene la ventaja de su rapidez, sencillez y una alta supervivencia de los embriones recuperados. Sin embargo, el contenido crioprotectores son altamente tóxicos y pueden afectar al desarrollo posterior del embrión. Por lo tanto, la técnica no era aplicable a ciertas cepas de ratones, incluso cuando las soluciones se enfría a 4 ° C para mitigar los efectos tóxicos durante la manipulación de embriones. En el Centro RIKEN recursos biológicos, más de 5000 cepas de ratones con diferentes antecedentes genéticos y fenotipos se mantienen 3, y por lo tanto, hemos optimizado un te vitrificaciónchnique con la que podemos criopreservar los embriones de muchas cepas diferentes de ratones, con los beneficios de supervivencia de los embriones de alta después de la vitrificación y descongelación (o licuefacción, más precisamente) a la temperatura ambiente 4.
Aquí se presenta un método de vitrificación de embriones de ratón que ha sido utilizado con éxito en nuestro centro. La solución de criopreservación contiene glicol de etileno en lugar de DMSO para minimizar la toxicidad para los embriones de 5. También contiene Ficoll y sacarosa para la prevención de desvitrificación y el ajuste osmótico, respectivamente. Los embriones pueden ser manejados a temperatura ambiente y se introducen en nitrógeno líquido a menos de 5 min. Debido a que el método original fue optimizado para pajillas de plástico como envases, hemos modificado ligeramente el protocolo para criotubos, que son de más fácil acceso en los laboratorios y más resistente a daños físicos. También se describe el procedimiento de descongelación de embriones vitrificados en detalle porque se trata de un ste críticap para la recuperación eficiente de los ratones vivos. Estas metodologías sería útil para los investigadores y técnicos que necesitan la preservación de cepas de ratón para su uso posterior de una manera segura y rentable.
Protocolo
El esquema general del experimento se muestra en la fig. 1.
1. Preparación de los reactivos
- Hacer que el medio de base (en este caso en la conocida como PB1) en una botella de vidrio de 100 ml de acuerdo con la siguiente tabla a continuación:
MW mM mg/100ml NaCl 58.4 136.98 800,0 KCl 74.6 2.68 20.0 KH 2 PO 4 136,1 1.47 20.0 Na 2 HPO 4 .12 H 2 O 358.14 8.04 288,1 MgCl 2, 6H 2 O 203,3 0.49 10.0 glucosa 180,2 5.56 100,0 Na piruvato 110 0.33 3.6 CaCl 2, 2H 2 O 147 0.9 13.2 La penicilina G 6,0 (aprox) - Hacer que el Ficoll-sacarosa (FS): Se
- Añadir las siguientes sustancias químicas a 14 ml de PB1 solución en un tubo de 50 ml.
Ficoll 70 6,0 g Sacarosa 3,424 g BSA 42,0 mg - Mezcla de Ficoll 70 y sacarosa en PB1 solución y agite bien hasta que esté completamente disuelto.
- Después de comprobar la completa disolución anterior, agregue la BSA sobre la superficie de la solución y mantenerla a4 ° C hasta que se disuelva por completo BSA (> 4 horas o toda la noche).
- Añadir las siguientes sustancias químicas a 14 ml de PB1 solución en un tubo de 50 ml.
- Hacer que la solución de equilibrio (EFS20) y la solución de vitrificación (EFS40) en un tubo de 50 ml:
- EFS20: 20% (v / v) de glicol de etileno, 24% (w / v) Ficoll, y 0,4 mol / L de sacarosa en PB1 con BSA
- EFS40: 40% (v / v) de glicol de etileno, 18% (w / v) Ficoll, y 0,3 mol / L de sacarosa * en PB1 con BSA
* Para los embriones de la cepa BALB / c o ICR, aumentar la concentración de sacarosa de 0,9 mol / L de sacarosa, ya que son más sensibles a cryodamage 6.
EFS20 solución EFS40 solución Etilenglicol 1 ml 2 ml FS solución 4 ml 3 ml - Esterilizar la solución por filtración con un 0,45 micras filtranter. Hacer alícuotas en tubos de 5 ml de poliestireno y se almacenan a 4 ° C. Se pueden utilizar durante unos 6 meses.
- Preparación de la solución de descongelación de embriones que contiene 0,75 M de sacarosa (TS1)
- Disolver 7,7 g de sacarosa en PB1 (preparado en el paso 1.1) y un volumen total de 30 ml. Mezclar por agitación suave hasta que la sacarosa se disuelva por completo.
- Añadir 90 mg de BSA sobre la superficie de la solución y dejar reposar hasta que esté completamente disuelto.
- Esterilizar la solución por filtración.
- Alícuota y almacena a 4 º C. Pueden ser utilizados por cerca de un mes.
Nota: TS1 también puede ser preparado a partir de M2 disponibles en el mercado.- Disolver 7,7 g de sacarosa en la M2 y un volumen total de 30 ml.
- Mezclar por agitación suave hasta que la sacarosa se disuelva por completo.
- Esterilizar la solución por filtración.
- Alícuota y almacena a 4 ° C. Pueden ser utilizados por cerca de un mes.
- TS2 (solución de descongelaciónque contiene 0,25 M de sacarosa):
- Diluir 10 ml TS1 con un volumen de 20 ml de PB1 o M2, según el caso.
- Alícuota y almacena a 4 º C. Pueden ser utilizados por cerca de un mes.
2. La vitrificación de embriones de ratón de 2 células
- Prepare dos células de embriones de ratón en el apareamiento natural o convencional en las técnicas de fertilización in vitro.
- Alícuota de 50 l EFS40 en un criotubo. En lo sucesivo, lleve a cabo el resto del procedimiento de vitrificación en la temperatura ambiente.
- Alícuota de 50 l de EFS20 en la parte inferior de 35 mm o 60 mm plato de plástico Petri.
- De transferencia de hasta 30 embriones a EFS20 con un capilar de vidrio con sólo la cantidad mínima de medio de cultivo. Iniciar un temporizador de dos minutos.
Nota: Coloque los embriones en la parte inferior de la gota. Esto hace que la deshidratación eficiente de los embriones. Compruebe la morfología de los embriones de un microscopio estereoscópico. Embriones deshidratados muestran una morfología encogido, como se muestra en la fig. 2A.Si no está deshidratado bastante, esperar más 1 o 2 minutos. - En alrededor de 1,5 min, recoger los embriones a partir de la caída de EFS20 con sólo la cantidad mínima de la solución. Transferirlos a EFS40 en el criotubo preparado en 2,1 paso. Nota: Para obtener los mejores resultados, ajustar el tiempo de recoger los embriones a fin de que todos los embriones pueden ser transferidos a EFS40 en torno a 2 min.
- Esperar durante 1 minuto.
- Ponga el criotubo directamente en nitrógeno líquido (LN 2).
3. Descongelación vitrificados de 2 células de embriones de ratón
- Antes de descongelar, preparar un plato con 10 gotas l de medio de cultivo de embriones embriones recuperados (véase el paso 3.13). Cubra el plato con aceite y colocar en una incubadora de CO 2 hasta su uso. Nota: Aunque los medios de comunicación para el cultivo de embriones de rutina puede ser utilizado en este experimento, le recomendamos que los medios de comunicación con mayor osmolaridad, como medio de M16.
- TS1 caliente a 37 ° C.
- Ponerse una máscara de la cara y cryogloves. Abra la LN 2 tank y recuperar un criotubo con embriones.
- Abrir rápidamente la parte superior del tubo y desechar LN 2. Espere 30 segundos para evitar TS1 de la congelación en el próximo paso.
- Utilice una pipeta 1000ul añadir 850 l de TS1 (37 ° C) en el tubo y mezclar la solución de pipeteados suave (alrededor de diez veces en 25 segundos) hasta que la solución es uniformemente disuelto.
- Transferencia de la totalidad del volumen del tubo de plástico a un plato de Petri de 60 mm (o un vidrio de reloj) (Fig. 3). Nota: Los embriones deben ser manejados a temperatura ambiente (22-25 ° C) hasta que se colocan en una incubadora de CO 2 en el paso 3.14.
- Iniciar un temporizador de 3 minutos.
- Alrededor de 2 minutos en TS1, agite suavemente el plato hasta que el medio que contiene los embriones se extiende sobre la superficie de la placa (Fig. 3B). Nota: Esto ayudará a los embriones de ir hasta el fondo, ya que están flotando cerca de la superficie cuando se transfiere a TS1.
- Poner tres gotas de 50 l de TS2 en the plato (Fig. 3C).
- Después de 3 minutos en el TS1, comprobar la morfología de los embriones de un microscopio estereoscópico, sino que debe ser un poco encogido. Ver la morfología de los embriones en las primeras (Fig. 2B) y posterior (Fig. 2C) en TS1. Nota: si los embriones son todavía hinchada, mantenerlos en TS1 de 1 hasta 3 min.
- Recoger los embriones y transferirlos a la primera gota de TS2 (Fig. 3D). Iniciar un temporizador de 3 minutos
- Después de 3 minutos, la transferencia de embriones para la segunda caída y luego a la tercera gota (Fig. 3E).
- Transferir los embriones al medio de cultivo preparado en el Paso 3.1. Los embriones están en la forma que se muestra en la fig. 2D.
- Introducir la cápsula en una incubadora de CO 2. A unos 10 minutos más tarde, la transferencia de embriones a la siguiente gota de medio de cultivo para lavar la sacarosa que se ha llevado a más de TS2.
- Al cultivo en un incubador de CO2 hasta que la transferencia de embriones.
Nota: Transferencia de Embryos a los oviductos de las hembras receptoras en el día de la descongelación. La cultura a largo in vitro puede disminuir la viabilidad de los embriones en algunas cepas de ratones.
4. Los resultados representativos:
In vitro - in vivo y de desarrollo de los embriones después de la descongelación se presentan en las Tablas 1 y 2. Las ventajas de este protocolo son la alta supervivencia de los embriones después de la descongelación y su amplia aplicabilidad a diferentes cepas de ratones.
| Tensión | N º total de tubos | N º de embriones vitrificados | Recuperados (N º (%)) | Morfológicamente normales (N º (%)) | El desarrollo de los blastocistos (N º (%)) |
| C57BL/6J | 20 | 400 | 397 (99) | 394 (99) | 342 (87) |
| BALB / cA | 15 | 300 | 296 (99) | 282 (95) | 238 (84) |
| ICR | 24 | 480 | 474 (99) | 443 (93) | 398 (90) |
Tabla 1. In vitro, el desarrollo de los embriones vitrificados-descongelados en las cepas de ratón común
| Condición de los embriones | N º de hembras receptoras | N º de embriones transferidos | Los lugares de implantación (N º (%)) | Viven descendientes (N º (%)) |
| Fresco | 12 | 180 | 141 (78.3) | 110 (61.1) |
| Vitrificado | 16 | 242 | 202 (83.5) | 125 (51.7) |
Tabla 2. En vivo, el desarrollo de los embriones vitrificados-descongelados en ratones C57BL/6J.
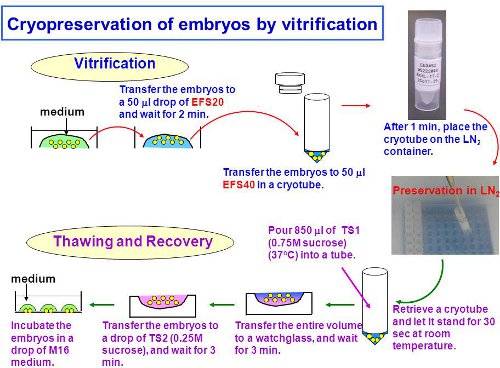
Figura 1. El esquema general del experimento, con el equilibrio, la vitrificación y descongelación de embriones.
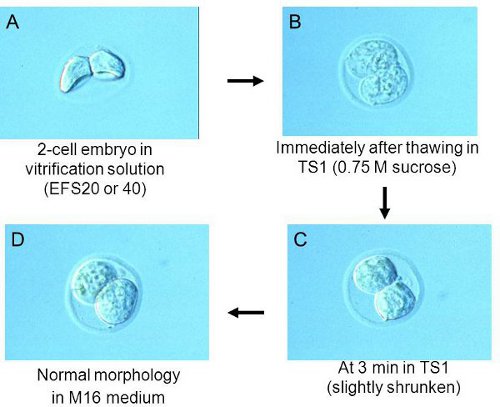
Figura 2. La morfología de los embriones en cada etapa de la descongelación.
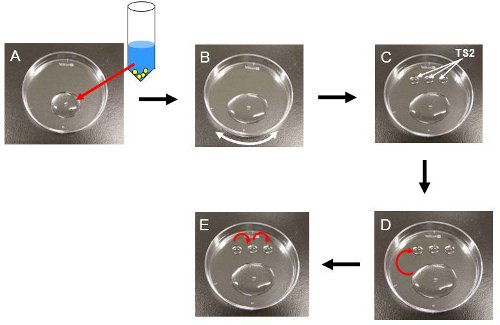
Figura 3. Descongelación de los embriones de procedimiento. Todos los procedimientos se llevan a cabo a temperatura ambiente. (A), Añadir 850 l de TS1 (37 ° C) en un criotubo y la transferencia de la totalidad del volumen de la solución en el criotubo en un plato de plástico. En este momento, los embriones vea hinchado, como se muestra en la fig. 2B. (B), se extendió la solución sobre la superficie del plato por agitación suave. (C), colocar tres gotas 50 l de TS2 en el plato de plástico. (D), de transferencia de los embriones a la primera gota de TS2. Después de 3 minutos, los embriones buscar shurunken como se muestra en la fig. 2C. (E), de transferencia de los de seriemente en el resto de TS2 gotas y luego al medio de cultivo.
Discusión
Desde el primer informe de la vitrificación de embriones de ratón por Rall y Fahy en 1985 2, varias mejoras técnicas se han hecho para aumentar la capacidad de supervivencia de los embriones después de la descongelación. Una de las modificaciones de mayor éxito se logra mediante el uso de glicol de etileno como un crioprotector, debido a su baja toxicidad y alta permeabilidad de la membrana. Estas ventajas nos permiten manejar la congelación de embriones a temperatura ambiente 4; otros métodos de vitrificación de embriones requieren entregar a temperaturas más bajas y no siempre son aplicables a algunas cepas de ratones como BALB / c 6. Vitrificación de etileno primera base de glicol fue desarrollado por Kasai et al. en 1990 5,7. Debido a que el método original fue optimizado para pajillas de plástico como envases, hemos modificado ligeramente el protocolo para criotubos, que son de más fácil acceso en los laboratorios y más resistente a daños físicos. Por lo tanto, el método de vitrificación descritos aquí pueden ser de aplicaciónlicable de muchos laboratorios con ratones como modelos de investigación. El mismo método también se puede utilizar para los embriones de ratón en la mórula y blastocisto etapas 8 y 9 embriones de rata. Sin embargo, recientemente hemos encontrado que la calidad de criotubos puede afectar las tasas de supervivencia de los embriones después de la congelación-descongelación. Por lo tanto, es esencial para examinar la superficie interna de los criotubos por su suavidad antes de la vitrificación de embriones (por ejemplo, ver en la Mesa de reactivos y equipos específicos).
Métodos de vitrificación tienen muchas ventajas sobre los métodos convencionales de congelación lenta, pero sí tienen una desventaja con respecto a la finalidad del transporte. Como embriones vitrificados deben mantenerse por debajo de -120 ° C para mantener su viabilidad, cargadores secos se utilizan generalmente para su transporte seguro. Embarcadores secos son pesados y voluminosos, y su ida y vuelta es caro, especialmente para el transporte internacional. Ahora estamos desarrollando un método de vitrificación nuevoque los embriones vitrificados pueden almacenarse a temperatura de hielo seco (alrededor de -80 ° C) durante al menos 7 días 10. Este método debe ser la vitrificación de la próxima generación.
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Este estudio se llevó a cabo en cooperación con el Proyecto Nacional de bio-recursos, el Ministerio de Educación, Cultura, Deportes, Ciencia y Tecnología, Japón.
Materiales
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
| Albúmina de suero bovino | Merck Biosciences (Calbiochem) | 12657 | |
| Etilenglicol | Wako Pure Chemical Industries | 058-00986 | |
| Ficoll 70 | GE Healthcare | 17-0310-10 | |
| Glucosa | Wako Pure Chemical Industries | 041-00595 | |
| NaCl | Wako Pure Chemical Industries | 191-01665 | |
| KCl | Wako Pure Chemical Industries | 163-03545 | |
| KH 2 PO 4 | Wako Pure Chemical Industries | 169-04245 | |
| Na 2 HPO 4 · 12H 2 S | Wako Pure Chemical Industries | 500-04195 | |
| De MgCl 2 · 6H 2 O | Wako Pure Chemical Industries | 135-00165 | |
| CaCl2 · 2H2O | Wako Pure Chemical Industries | 031-00435 | |
| La penicilina G | Sigma-Aldrich | P-4687 | |
| Piruvato de sodio | Sigma-Aldrich | P-8574 | |
| Sacarosa | Wako Pure Chemical Industries | 196-00015 | |
| M16 medio | Sigma-Aldrich | M7292 | |
| M2 medio | Sigma-Aldrich | M7167 | |
| Criotubo | Sumitomo Bakelite | MS-4501 | "Vial criogénico" |
Referencias
- Whittingham, D. G., Leibo, S. P., Mazur, P. Survival of mouse embryos frozen to -196° and -269°C. Science. 187, 411-414 (1972).
- Rall, W. F., Fahy, G. M. Ice-free cryopreservation of mouse embryos at -196°C by vitrification. Nature. 313, 573-575 (1985).
- Yoshiki, A. The mouse resources at the RIKEN BioResource center. Exp. Anim. 58, 85-96 (2009).
- Mochida, K., Ogura, A. Cryopreservation of embryos in laboratory species. J. Mamm. Ova. Res. 27, 87-92 (2010).
- Kasai, M. A simple method for mouse embryos cryopreservation in a low toxicity vitrification solution, without appreciable loss of viability. J. Reprod. Fert. 89, 91-97 (1990).
- Dinnyes, A., Wallace, G. A., Rall, W. F. Effect of genotype on the efficiency of mouse embryo cryopreservation by vitrification or slow freezing methods. Mol. Reprod. Dev. 40, 429-435 (1995).
- Kasai, M., Mukaida, T. Cryopreservation of animal and human embryos by vitrification. Reprod. Biomed. Online. 9, 164-170 (2004).
- Miyake, T. Vitrification of mouse oocytes and embryos at various stages of development in an ethylene glycol-based solution by a simple method. Theriogenology. 40, 121-134 (1993).
- Han, M. S., Niwa, K., Kasai, M. Vitrification of rat embryos at various developmental stages. Theriogenology. 59, 1851-1863 (2003).
- Jin, B. Equilibrium vitrification of mouse embryos. Biol. Reprod. 82, 444-450 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados