Method Article
エチレングリコール系ガラス化によるマウス胚の凍結保存
要約
マウスの胚のエチレングリコールベースのガラス化法が説明されています。それは、そのシンプルさと低胚毒性の他の方法に有利であるため、近交系や遺伝子改変マウスを含むマウスの多くの株、に広く適用することができます。
要約
マウス胚の凍結保存は、マウスの多くの菌株は遺伝的改変によって生成されており、数は一貫して年々増加しているため、生物医科学をサポートする技術基盤です。その技術開発は、その後1980年代後半2で開発されたガラス化法に続いて、1970年代1で緩慢凍結の方法で起動しています。一般に、後者の技法は、その迅速、シンプル、そして回収された胚の高い生存性に有利である。しかし、含まれる凍結保護剤は、非常に有毒であり、その後の胚発生に影響を及ぼす可能性があります。したがって、技術のソリューションを4に冷却されている場合でも、マウスの特定の系統に適用できませんでした° C胚の処理中に毒性影響を軽減する。理研バイオリソースセンターでは、異なる遺伝的背景と表現型と5000以上のマウス系統では3を維持しているため、我々は、ガラス化TEを最適化して我々は周囲温度4でガラス化して(またはより正確に、液化)融解後の高い胚の生存の利点と、マウスの多くの異なる株から胚を凍結保存することができるとchnique。
ここで、我々が正常に当センターで使用されているマウスの胚のガラス化法を提案する。凍結保存液は、胚を5に毒性を最小限にする代わりにDMSOのエチレングリコールが含まれています。また、それぞれ、フィコールと失透と浸透圧調整の防止のためのショ糖が含まれています。胚は、室温で処理し、5分以内に液体窒素に転送することができます。オリジナルのメソッドはコンテナとしてプラスチック製のストロー用に最適化されているので、我々は若干の研究室でより簡単にアクセスし、物理的な損害に対してより耐性があるクリオチューブ、のためのプロトコルを変更しました。それが重要なステレオなので、我々はまた、詳細にガラス化胚の融解の手順を説明生きたマウスの効率的な回収のためのp。これらの手法は、安全かつ費用効果の高い方法で後で使用するためのマウス系統の保存を必要とする研究者や技術者に参考になる。
プロトコル
実験の全体的なスキームを図に示します。 1。
1。試薬の調製
- 以下の表に応じて100mlのガラス瓶に、基本培地を(ここでPB1とも呼ばれる)を確認します。
MW mMの mg/100ml NaClを 58.4 136.98 800.0 塩化カリウム 74.6 2.68 20.0 KH 2 PO 4 136.1 1.47 20.0 のNa 2 HPO 4 0.12 H 2 O 358.14 8.04 288.1 のMgCl 2 · 6H 2 O 203.3 0.49 10.0 グルコース 180.2 5.56 100.0 Naのピルビン酸 110 0.33 3.6 のCaCl 2、2H 2 O 147 0.9 13.2 ペニシリンG 6.0(約) - フィコール - スクロース(FS)ソリューションを作成します。
- 50 mlチューブにPB1ソリューション14mlのために、以下の化学物質を追加。
フィコール70 6.0グラム スクロース 3.424グラム BSA 42.0ミリグラム - フィコール70およびPB1溶液中でのショ糖を混ぜて、完全に溶解するまでよく振る。
- 上記の完全な溶解を確認した後、溶液の表面にBSAを追加し、それを根気よく続けるBSAするまで4℃で完全に(> 4時間または一晩)に溶解する。
- 50 mlチューブにPB1ソリューション14mlのために、以下の化学物質を追加。
- 50 mlチューブで平衡化溶液(EFS20)とガラス化液(EFS40)を行います。
- EFS20:20%(v / v)のエチレングリコール、24%(w / v)のフィコール、とBSAとPB1の0.4モル/ Lのスクロース
- EFS40:40%(v / v)のエチレングリコール、18%(w / v)のフィコール、とBSAとPB1の0.3モル/ L *スクロース
彼らは6 cryodamageに敏感なので、* BALB / cまたはICR系統の胚は、0.9モル/ Lショ糖にショ糖の濃度を増加させる。
EFS20ソリューション EFS40ソリューション エチレングリコール 1ミリリットル 2ミリリットル FSのソリューション 4ミリリットル 3ミリリットル - 0.45μmのfilteを使用してろ過により溶液を滅菌R. 4℃で5ミリリットルポリスチレンチューブとストア内のアリコートを作る℃に彼らは約6ヶ月間使用することができます。
- 0.75 Mスクロース(TS1)を含む胚融解液の調製
- PB1のショ糖(ステップ1.1で調製したもの)の7.7 gを溶かし、30 mlに、総容積をもたらす。ショ糖が完全に溶解するまで穏やかに振盪して混合します。
- 表面上に溶液をBSAの90 mgを追加し、完全に溶解するまでそれはスタンドのまま。
- ろ過により溶液を滅菌する。
- 4℃で分注し店彼らは約1ヶ月間使用することができます。
注:TS1はまた市販のM2から調製することができます。- M2のショ糖の7.7 gを溶かし、30 mlに、総容積をもたらす。
- ショ糖が完全に溶解するまで穏やかに振盪して混合します。
- ろ過により溶液を滅菌する。
- 4℃で分注し店。彼らは約1ヶ月間使用することができます。
- TS2(解凍ソリューション:0.25 Mショ糖)を含む
- 必要に応じて、PB1またはM2の20mlの量で10ml TS1を希釈する。
- 4℃で分注し店彼らは約1ヶ月間使用することができます。
2。 2セルのマウス胚のガラス化
- 体外受精の技術で自然交配あるいは従来で2細胞マウス胚を準備します。
- クライオチューブに分注し50μlのEFS40を。以後、常温でガラス化の手順の残りを実行します。
- 35ミリメートル以上60ミリメートルのプラスチックペトリ皿の底にEFS20物のアリコートを50μl。
- 培地のみの最小限の量でガラスキャピラリーを使用してEFS20に30胚まで転送する。 2分間タイマーを開始します。
注:ドロップの底の上に置いて胚。これは、胚の効率的な脱水を行います。実体顕微鏡による胚の形態を確認してください。 図に示すように脱水胚は、縮小形態を示す。 2A。彼らは十分に脱水されていない場合は、1以上または2分間待つ。 - 約1.5分で、ソリューションののみ最小限のEFS20ドロップから胚を拾う。ステップ2.1で作成したクライオチューブにEFS40にそれらを転送する。注:最良の結果を得るためには、全ての胚が約2分間でEFS40に転送できるように、胚を拾うのタイミングを調整する。
- 1分間待ちます。
- 液体窒素(LN 2)に直接クライオチューブを置く。
3。ビトリファイド2セルのマウス胚を融解
- 解凍する前に、回収された胚の胚培養の培地10μlの滴(ステップ3.13を参照)で料理を準備。使用するまでCO 2インキュベーター内でオイルと場所との皿に蓋をする。注:ルーチン胚培養のためのあらゆるメディアがこの実験で使用されるかもしれませんが、我々はそのようなM16媒体として高い浸透圧でメディアをお勧めします。
- 37℃にTS1を温める
- フェイスマスクとcryoglovesに置く。 LN 2 tを開きます。ANKと胚を含むクライオチューブを取り出す。
- すぐにチューブの上部を開き、LN 2を捨てる。次のステップで凍結からTS1を防ぐために30秒間待ちます。
- チューブにTS1(37℃)850μlを加え、溶液が均一に溶解するまで穏やかpipettings(25秒で約10倍)で溶液を混合する1000ulピペットを使用してください。
- プラスチック製の60ミリメートルペトリ皿(または時計皿)( 図3A)にチューブのボリューム全体を転送する。注:彼らはステップ3.14でCO 2インキュベーター内に配置されるまで胚を室温(22〜25℃)で処理する必要があります。
- 3分間タイマーを開始します。
- 胚を含む培地をシャーレの表面( 図3B)に分散されるまで、TS1で約2分で、ゆっくりと料理を振る。注:これはTS1に転送するときに彼らは表面近くに浮遊しているので、胚が一番下まで行くのに役立つ。
- 目の上にTS2の三50μlの滴を入れてE皿( 図3C)。
- TS1の3分後、実体顕微鏡による胚の形態を確認して、彼らは少し縮んだすべきである。 TS1で以前の胚の形態( 図2B)を参照して 、後で( 図2C)。注:胚がまだ腫れている場合は、3分〜1詳しくは、TS1に保管してください。
- 胚を拾うとTS2の最初のドロップ( 図3D)に移す。 3分間タイマーを起動します。
- 3分後、3番目のドロップ( 図3E)に2番目のドロップに胚を移すと。
- ステップ3.1で調製した培地に胚を移す。胚は、 図に示すような形状になります。 2D。
- CO 2インキュベーター内での場所の皿。約10分後、TS2から引き継がれているショ糖を洗い流すための培地の横にあるドロップに胚を移す。
- 胚移植まで、CO2インキュベーターで培養を継続。
注:転送ブリー解凍の日に受取人の女性の卵管にOS。 in vitroでの長い文化は、マウスの一部の菌株における胚の生存率が低下する場合があります。
4。代表的な結果:
解凍は、表1と表2に示されており、胚の in vivo開発の後で- in vitroで 。このプロトコルの利点は、マウスの異なる系統に解凍し、その広範な適用後の胚の高い生存性があります。
| ひずみ | チューブの合計数 | ガラス化胚の数 | (番号(%))を回収 | 形態的に正常(第(%)) | 胚盤胞への開発(第(%)) |
| C57BL/6J | 20 | 400 | 397(99) | 394(99) | 342(87) |
| BALB / cAの | 15 | 300 | 296(99) | 282(95) | 238(84) |
| ICR | 24 | 480 | 474(99) | 443(93) | 398(90) |
表1。一般的なマウス系統におけるガラス化融解胚の体外開発で
| 胚の状態 | 受信者女性の数 | 転送された胚の数 | 着床部位(番号(%)) | 子孫を生きる(第(%)) |
| 新鮮な | 12 | 180 | 141(78.3) | 110(61.1) |
| ガラス固化 | 16 | 242 | 202(83.5) | 125(51.7) |
表2。C57BL/6Jマウスにおけるガラス化融解後の胚のin vivoで開発中 。
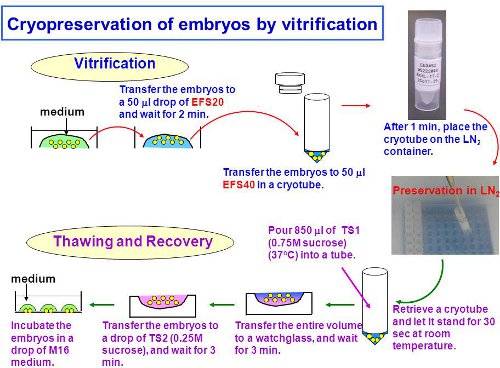
図1。胚の平衡化、ガラス化、融解を含む実験の全体的なスキーム。
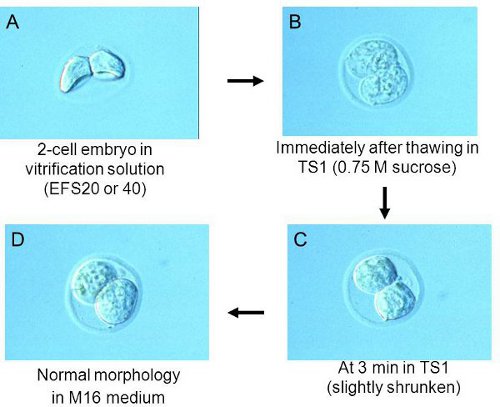
図2凍結融解の各段階で胚の形態。
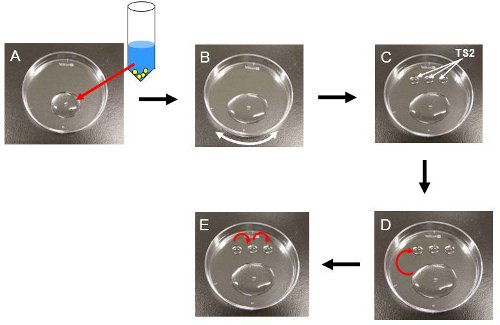
図3。胚の手順を解凍。すべての手順は室温で実施されています。 ()、クライオチューブにTS1(37℃)850μlを加え、プラスチック製の皿にクライオチューブ内の溶液のボリューム全体を転送する。この時点では、胚は、 図1のように腫れて見える。 2B。 (B)、軽く揺することで皿の表面上にソリューションを広げる。 (C)、プラスチック製の皿にTS2の三50μlの滴を入れます。 (D)、TS2の最初のドロップに胚を移す。 図に示すように3分後、胚はshurunken見える。 2C。 (E)、それらをシリアル転送残りのTS2の滴にし、培養培地にLY。
ディスカッション
1985年2におけるRallとFahyによるマウス胚のガラス化の最初の報告以来、いくつかの技術的改良が融解後の胚の生存性を高めるために行われています。最も成功した変更の一つは、その低毒性と高い膜透過性の凍結保護剤としてエチレングリコールを使用することによって達成された。このような利点は、私たちは、室温4℃凍結胚を処理することができますが、他のガラス化法は、クーラーの温度で渡す胚を必要とし、常にBALB / cの6を含むマウスのいくつかの株には適用されません。第一エチレングリコールベースのガラス化は、笠井らによって開発されました。 1990年5,7インチオリジナルのメソッドはコンテナとしてプラスチック製のストロー用に最適化されているので、我々は若干の研究室でより簡単にアクセスし、物理的な損害に対してより耐性があるクリオチューブ、のためのプロトコルを変更しました。したがって、ここで説明するガラス化法は、アプリケーション可能性があります研究のモデルとしてマウスを用いた多くの研究室にlicable。同じ方法は、桑実胚と胚盤胞の段階8およびラットの胚9時、マウスの胚にも使用できます。しかし、我々は最近、クリオチューブの質が凍結融解後の胚の生存率に影響を与える可能性があることを発見した。従って、それはガラス化胚(;特定の試薬や機器の表で参照など)の前にその滑らかさのためにクリオチューブの内側表面を調べるために不可欠です。
ガラス化法は、従来の緩慢凍結法に比べて多くの利点がありますが、それらは本質的に輸送の目的に関しての欠点を有している。ガラス固化体胚を° Cがその生存を維持するために、以下の-120で保管されるべきであるとして、ドライシッパーは、一般的にそれらの安全輸送に使用されます。特に国際輸送のために、ドライシッパーは重くてかさばるであり、その往復は高価です。我々は、現在で新しいガラス化法を開発していますそのガラス固化体の胚は少なくとも7日間10分間ドライアイス温度(-80℃程度)で保存することができる。このメソッドは、次の世代のガラス化する必要があります。
開示事項
我々は、開示することは何もない。
謝辞
この研究は、日本、スポーツ、科学技術、文化、教育省、ナショナルバイオリソースプロジェクトと協力して実施されました。
資料
| 試薬の名前 | 会社 | カタログ番号 | コメント(省略可能) |
| ウシ血清アルブミン | メルクバイオサイエンス(Calbiochem社) | 12657 | |
| エチレングリコール | 和光純薬 | 058から00986 | |
| フィコール70 | GEヘルスケア | 17-0310-10 | |
| グルコース | 和光純薬 | 041から00595 | |
| NaClを | 和光純薬 | 191から01665 | |
| 塩化カリウム | 和光純薬 | 163から03545 | |
| KH 2 PO 4 | 和光純薬 | 169から04245 | |
| のNa 2 HPO 4 · 12H 2 O | 和光純薬 | 500から04195 | |
| のMgCl 2 · 6H 2 O | 和光純薬 | 135から00165 | |
| のCaCl 2 · 2H2O | 和光純薬 | 031から00435 | |
| ペニシリンG | シグマアルドリッチ | P - 4687 | |
| ピルビン酸ナトリウム | シグマアルドリッチ | P - 8574 | |
| スクロース | 和光純薬 | 196から00015 | |
| M16培地 | シグマアルドリッチ | M7292 | |
| M2培地 | シグマアルドリッチ | M7167 | |
| クライオチューブ | 住友ベークライト | MS - 4501 | "極低温バイアル" |
参考文献
- Whittingham, D. G., Leibo, S. P., Mazur, P. Survival of mouse embryos frozen to -196° and -269°C. Science. 187, 411-414 (1972).
- Rall, W. F., Fahy, G. M. Ice-free cryopreservation of mouse embryos at -196°C by vitrification. Nature. 313, 573-575 (1985).
- Yoshiki, A. The mouse resources at the RIKEN BioResource center. Exp. Anim. 58, 85-96 (2009).
- Mochida, K., Ogura, A. Cryopreservation of embryos in laboratory species. J. Mamm. Ova. Res. 27, 87-92 (2010).
- Kasai, M. A simple method for mouse embryos cryopreservation in a low toxicity vitrification solution, without appreciable loss of viability. J. Reprod. Fert. 89, 91-97 (1990).
- Dinnyes, A., Wallace, G. A., Rall, W. F. Effect of genotype on the efficiency of mouse embryo cryopreservation by vitrification or slow freezing methods. Mol. Reprod. Dev. 40, 429-435 (1995).
- Kasai, M., Mukaida, T. Cryopreservation of animal and human embryos by vitrification. Reprod. Biomed. Online. 9, 164-170 (2004).
- Miyake, T. Vitrification of mouse oocytes and embryos at various stages of development in an ethylene glycol-based solution by a simple method. Theriogenology. 40, 121-134 (1993).
- Han, M. S., Niwa, K., Kasai, M. Vitrification of rat embryos at various developmental stages. Theriogenology. 59, 1851-1863 (2003).
- Jin, B. Equilibrium vitrification of mouse embryos. Biol. Reprod. 82, 444-450 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved