Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Una técnica simplificada para fabricar un modelo de lesión isquémica
En este artículo
Resumen
Hemos desarrollado una técnica mínimamente invasiva para crear un conejo isquémico modelo de herida del oído mediante la división de la arteria central y los nervios y el paquete vasculonervioso del cráneo. Un túnel subcutáneo y luego corta todos los tejidos subcutáneos. Este procedimiento provoca la interrupción mínima de la piel y puede usarse de manera segura en animales diabéticos.
Resumen
Uno de los principales obstáculos en la investigación actual herida diabética es la falta de un modelo de lesión isquémica que pueden usarse de manera segura en animales diabéticos. Los fármacos que funcionan bien en no isquémicas heridas pueden no funcionar en humanos, porque las heridas diabéticas vasculopatía es un factor importante que impide la curación de estas heridas. Hemos publicado un artículo en 2007 que describe un modelo de oreja de conejo lesión isquémica creado por una técnica quirúrgica mínimamente invasiva. Desde entonces, hemos simplificado aún más el procedimiento para facilitar la operación. En una oreja, tres pequeñas incisiones cutáneas se realizaron en los pedículos vasculares, de 1-2 cm de la base de la oreja. La arteria central y se ligó con corte a lo largo del nervio. El paquete del cráneo entero se cortan y se ligan, dejando sólo la rama caudal intacto. Una circunferencia túnel subcutáneo se realizó a través de las incisiones, para cortar el tejido subcutáneo, músculos, nervios y vasos pequeños. La otra oreja se utilizó como control no-isquémico. Cuatro heridas fueron hechas en la parte ventral of cada oído. Esta técnica produce 4 heridas isquémicas y no isquémicas 4 heridas en un animal de comparaciones por pares. Después de la cirugía, el oído isquémico era fresca y cianótica, y mostró movimiento reducido y una falta de pulso en la arteria de la oreja. Temperatura de la piel de la oreja isquémica fue 1.10 ° C más baja que en el oído normal y esta diferencia se mantuvo durante más de un mes. Oído tejidos de alta energía el contenido de fosfato fueron más bajos en el oído isquémica que el oído de control. Veces la cicatrización de heridas eran más largos en el oído isquémica que en el oído no-isquémico cuando el tratamiento se utilizó la misma. La técnica ha sido utilizada en más de 80 conejos en los que 23 eran diabéticos (tiempo de la diabetes que van desde 2 semanas a 2 años). No conejo solo se ha desarrollado complicaciones quirúrgicas tales como sangrado, infección o ruptura de las incisiones en la piel. El modelo tiene muchas ventajas, como la perturbación poco de piel, más tiempo isquémica, y una mayor tasa de éxito, en comparación con muchos otros modelos. CA ITn utilizarse de manera segura en animales con resistencia reducida, y también se puede modificar para cumplir diversos requisitos de ensayo.
Protocolo
1. Bases anatómicas
La oreja de conejo ha sido un material de estudio privilegiado para el cuidado de heridas desde principios del siglo 20. El oído es suministrada por tres haces vasculares (central, craneal y caudal), el núcleo central es el más grande, mientras que los buques en los paquetes craneal y caudal varían en tamaño. Ocasionalmente, la arteria caudal puede estar ausente. 1 Todas estas embarcaciones son fácilmente identificados en la cara dorsal después de la oreja se afeita (fig. 1). En el lado ventral, la piel distal no recibe suministro de sangre de los vasos proximales. Los tres paquetes de vasos en la oreja dorsal, tiene numerosas ramas que penetran a través del cartílago para proporcionar el suministro de sangre a la piel distal ventral (Fig. 2). En algunos conejos, un buque subcutánea muy pequeña se produce también en el lado ventral, que suministra sangre a no más de 1/3 de la piel ventral. En una incisión en la piel circular abierto, no es esencialcialmente no hay sangrado de una incisión ventral.
2. Procedimiento Quirúrgico
- El conejo se pesa y las orejas están afeitado, junto con la parte posterior del cuello.
- Una premedicación de buprenorfina (0,01 mg / kg) se administra IM una hora antes de la cirugía.
- La anestesia se induce por una mezcla de ketamina (50 mg / kg) y xilazina (5 mg / kg) de MI.
- El conejo está protegido con una almohadilla térmica durante la cirugía, los ojos están protegidos con ungüento, y sus signos vitales son monitoreados durante la cirugía.
- El campo quirúrgico se preparó asépticamente con un lavado quirúrgico y se cubre de modo que las dos orejas están expuestos.
- Una oreja se vuelve isquémica, mientras que el otro oído sirve como pares no isquémica de control.
- Los tres pedículos vasculares son identificados por las arterias y venas.
- Usando una cuchilla # 15, tres pequeñas incisiones verticales (1-1.5 cm) se realizan en los pedículos vasculares, alrededor de 1-2 cm de la base de la oreja.
- La vena central esaislado de los tejidos circundantes y una sutura se utiliza para rodear por retracción. La arteria central está ligado con suturas 4-0 y dividida.
- El nervio central de acompañamiento también se corta.
- El pedículo craneal conjunto se ligaron y dividido.
- El caudal del pedículo se conserva.
- Un túnel subcutáneo se realiza a través de las 3 incisiones. Esto se logra mediante disección roma con una pinza y disecciones agudas con un cuchillo y tijeras. Todos los tejidos subcutáneos, músculos, nervios y pequeñas ramas vasculares son descontinuados. Los vasculaturas pequeñas debajo de la dermis están totalmente divididos. Todos los tejidos subcutáneos se cortan a la altura del cartílago con la cuchilla.
- Además disecciones agudas y contundentes se utilizan para limpiar la base, dejando al descubierto un cartílago de 5-10 mm de ancho.
- Con este procedimiento se interrumpe todos los de las ramas vasculares subcutáneos para evitar que establecer rápidamente las garantías.
- El sangrado esmínima. Si hay alguna, es fácilmente controlada por compresión gasa, sin la necesidad de electrocauterio.
- La piel en el interior del oído no llevar el suministro de sangre mucho más y por lo tanto no es una incisión.
- Los 3 incisiones en la piel se cierra con suturas 4-0 y 5-0, y se cubre con una gasa estéril.
- Los resultados del procedimiento en 3 pequeñas incisiones cutáneas y se incurre en daños y mucho menos la piel de una cirugía abierta.
- Cuatro circulares de espesor completo heridas de la piel se crean en la parte ventral de cada oreja con un punzón de 6 mm de acero inoxidable. La distancia entre las heridas es por lo menos 20-30 mm. La piel dentro de la herida punzón se retira del cartílago. El pericondrio también se elimina, con la piel o por separado. La base sobre la que la granulación y epitelización tener lugar es el cartílago, pero el cartílago no está perforada (fig. 3).
- Cuando las heridas en ambos oídos se han completado, fármaco de prueba se aplicó a un lado de dos heridas, mientras que el control de las drogas es ApplIED a las heridas en el otro lado. Un apósito oclusivo (Tegaderm, 3M) se utiliza para cubrir el sitio de la herida. Esto evita que las heridas se conviertan en desecado.
- Las heridas en la parte inferior de la oreja normalmente curan más rápidamente que las heridas en la parte superior de la oreja. Para un estudio de comparación de cicatrización de heridas, se recomienda para comparar las dos heridas en un lado con las dos heridas en el otro lado, o para comparar la parte superior e inferior heridas por separado.
3. Cuidado Postoperatorio
- Un parche de Duragesic se adhiere a la piel hacia atrás para liberar fentanilo (25 mg / hora) durante 2-3 días para reducir el dolor posible.
- Los conejos se les permite el libre acceso a los alimentos y bebidas.
- Los cambios de apósito se realizan a diario. Los apósitos se retiran de edad y las heridas se limpian con hisopos de algodón estériles. Las fotos digitales se toman para la comparación. Apósitos se aplican nuevas, y las heridas están cubiertas de nuevo por Tegaderm. No se necesita anestesia durante el faenado chAnges.
- Temperatura de la piel se mide diariamente en cada oreja para la comparación.
- Circulación de sangre adicionales oído puede ser medido con un medidor de tensión de oxígeno transcutáneo o un medidor de flujo láser Doppler.
- Las suturas pueden ser eliminados después de una semana.
- Para animales no diabéticos, la mayoría de las heridas del oído normalmente se curan en 2-3 semanas.
4. Posibles complicaciones y cómo evitarlas
Esta cirugía mínimamente invasiva es segura y las complicaciones son raras. A excepción de una transición post-operatorio leve edema en la oreja, ninguno de nuestros conejos ha tenido complicaciones quirúrgicas graves. Sin embargo, hay varias posibles complicaciones para este procedimiento:
- Sangrado. Puede producirse una hemorragia en las incisiones si la hemostasia es incompleta o si un vaso sanguíneo más grande (tal como uno de los vasos principales pediculares) está dañado. Esto se puede evitar fácilmente mediante la disección cuidadosa. Además de los tres haces vasculares mayores, hay unvolver a muchos menores ramas vasculares subcutáneos. Cuando el túnel subcutáneo se hace, estos vasos se están reduciendo, pero no es necesario atar. La hemostasia puede lograrse simplemente con pulsar una gasa. Esto se realiza fácilmente mediante la inserción de una esquina de una gasa en el túnel durante unos minutos. Antes de cerrar la incisión, asegúrese de que no hay sangrado activo está presente.
- Infección de la incisión y la dehiscencia: Estas complicaciones pueden ocurrir si las incisiones están contaminados. Esto puede evitarse mediante el uso de una técnica aséptica estricta y ningún antibiótico que se necesita. Sin embargo, si la infección se produce, el drenaje adecuado y los cambios de apósito se necesitan.
- Edema en la oreja: Debido a la ligadura vascular y la interrupción de la circulación linfática, edema leve de oído puede presentar por unos pocos días. Sin embargo, desaparece por sí mismo y no se necesita tratamiento.
5. Los resultados representativos
Desde 2007, hemos utilizado este procedimiento en más de 70 conejos, incluyendo 23 diabéticos untrado animales seropositivos. En el grupo de diabéticos, la cirugía se llevó a cabo en momentos diferentes para diabéticos: siete conejos tenía dos semanas de tiempo de la diabetes, cuatro de ellos tenía dos meses, diez tenían 12 meses, y 2 tenían 24 meses de tiempo para la diabetes.
Inmediatamente después de la cirugía, el oído isquémica parecía fría y cianótica, con edema leve. El oído más importante arteria-la arteria central de la-tenía un pulso fuerte en el oído normal, pero este pulso no estaba presente en el oído isquémica. Oído el movimiento se redujo, pero no desapareció totalmente. La piel mostró depresiones claras sobre el túnel, pero sin isquemia o necrosis se encontró en todos los animales (fig. 4).
Las temperaturas de la piel de las orejas normales e isquémicas se midieron con un termómetro digital (Omron Omron Healthcare, Bannockburn, IL, o un Termómetro tipo K punto de infrarrojos por Fisher Scientific, Pittsburgh, PA). Las diferencias de temperatura entre el oído no isquémica y la cardiopatía isquémica fue de 1 a 10 ° C, wIth mayoría de los conejos que caen dentro del intervalo de 2-6 ° C. fig. 5 muestra las diferencias de temperatura promedio de 30 conejos. La diferencia de temperatura fue mayor en los primeros días después de la cirugía, disminuyó gradualmente después de 15 días, pero se mantuvo todavía en el extremo de un mes.
Tejido de alta energía contenido de fosfato se midieron en algunos animales después de que fueron sacrificados. Seis muestras de tejidos se tomaron de cada oreja y de alta energía contenido de fosfato se midieron mediante HPLC. Tanto la ATP y la concentración total de energía fue mayor en los oídos normales que en los oídos isquémicos. Figura. La figura 6 muestra un ejemplo de un conejo sacrificado 23 días después de la cirugía. La media de los tejidos el contenido de ATP fueron 0,349 ± 0,047 mmol / g (media ± DE) en el oído normal, frente a 0,237 ± 0,059 mmol / g en el oído isquémica (p <0,005). La media total de energía (ATP + ADP + AMP) fue de 0,882 ± 0,137 mmol / g en el oído normal frente a 0,556 ± 0,115 mmol / g en el ISCHE Micrófono de oído (p <0,001).
Tiempos de cicatrización de heridas eran siempre más larga para el oído isquémica que para el oído no isquémica en todos los grupos (no diabéticos o diabéticos). Figura. La figura 7 muestra una comparación de curación entre 26 pares de heridas en las orejas isquémica y no isquémica. Los tiempos de curación varió de 13 a 18 días (media 14,9 ± 1,6 días) en los oídos normales, frente a 17 a 27 días (media 20,5 ± 3,4 días) en las orejas isquémica (p = 0,001). Tiempos de cicatrización de heridas en conejos de edad y diabéticos eran mucho más tiempo, especialmente cuando el tiempo era diabética más de 12 meses.
En estos conejos, todas las incisiones curadas normalmente sin complicaciones, incluyendo los conejos con 24 meses de tiempo diabética. Figura 8 es una muestra que muestra la histología curado túnel subcutáneo en la que el músculo está ausente y es reemplazado por tejido fibroso. Sin embargo, la piel está intacta.
/ 3341fig1.jpg "/>
Figura 1. La oreja de conejo es suministrada por tres haces vasculares. El central es el más grande, el cráneo es más pequeño, y el paquete de caudal es el más pequeño. Estas embarcaciones son fácilmente visibles en la superficie después de la oreja se afeita.
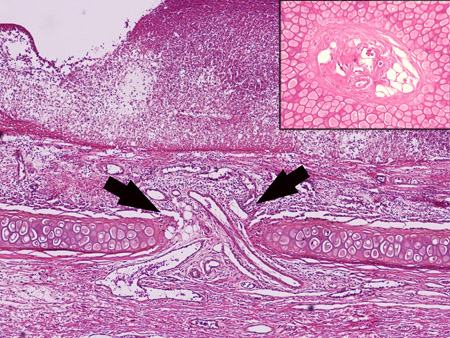
Figura 2. Los tres haces de vasos en la sangre del oído suministro dorsal no sólo a la piel dorsal, sino también a la piel ventral través de los vasos penetrantes. La flecha muestra los vasos penetrantes a través del cartílago. El recuadro muestra una sección transversal de estos vasos.

Figura 3. Cuatro 6-mm heridas se crean en el lado ventral de la oreja, y el pericondrio se elimina también. La base sobre la que la granulación y epitelización llevarse a cabo es el cartílago, pero el cartílago no está perforado. El smal 3 l incisiones cutáneas se cierran con un trastorno de piel muy poco.
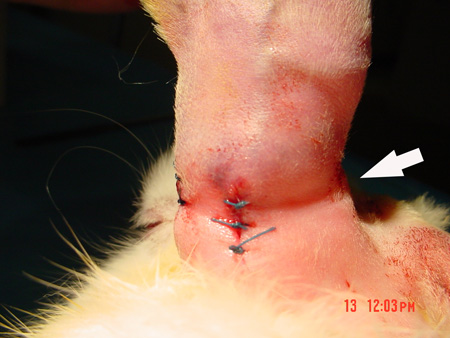
Figura 4. Después de que las incisiones en la piel se cierran, la sangría sobre el túnel subcutáneo se ve claramente.
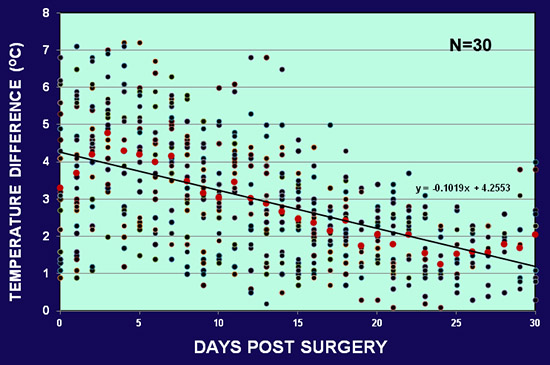
Figura 5. La diferencia promedio entre la temperatura de la piel de la oreja normal e isquémico en 30 conejos. La diferencia oscila desde los primeros 7 ° C a 10 ° C después de la cirugía. La diferencia disminuye gradualmente, pero mantiene todavía en el extremo de un mes.

Figura 6. Oído tejidos de alta energía se reduce el contenido de fosfato en el oído isquémica en comparación con los no-isquémica del oído a los 23 días después de la cirugía (p <0,001).
41/3341fig7.jpg "/>
Herida la figura 7. Tiempo de curación es más largo en los oídos isquémicos que los oídos no isquémicos (26 heridas cada uno). La curación se define como la restauración de la integridad del tejido lesionado, es decir, la reepitelización completa de sitios de la herida.
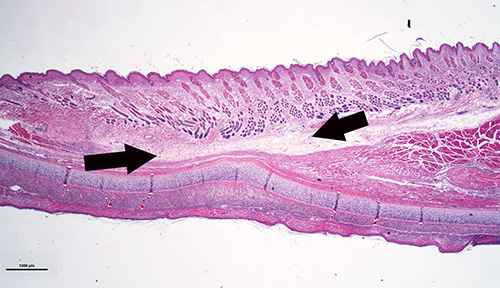
Figura 8. Muestra Histología que muestra la parte del oído que contiene túnel subcutáneo. El tejido cicatrizado es más delgado que el oído normal, el músculo esquelético original, está ausente y es reemplazado por tejido fibroso. Sin embargo, la piel está intacta.
Discusión
La diabetes afecta a 23,6 millones de personas en los EE.UU., 2,3 y 15-20% de estos pacientes desarrollan úlceras del pie en su vida, 4,5, a un costo anual de tratamiento de más de $ 25 mil millones. 3,6 Sin embargo, incluso la mejor información disponible tratamientos de lograr sólo una tasa de 50% de curación y esto es a menudo temporal, 7 con tasas de recurrencia tan altas como 66% en los diabéticos. 3,6 Cuando las úlceras se presentan en pacientes con dia...
Divulgaciones
No hay conflicto de intereses financieros implicados en este estudio.
Agradecimientos
Este estudio fue apoyado en parte por subvenciones del NIH 1RO1DK74566 y 1RO1AM52984. Los autores desean agradecer a la Sra. Jacqueline McCarty en la CRR, por su ayuda durante la cirugía, los Dres. Jianpu Wang y Sarojini Harshini por su ayuda en el cuidado postoperatorio de la cirugía y algunos conejos, el Dr. Wan Rong, por su trabajo histología, y la Sra. Li Ming de sus medidas por HPLC de fosfatos de alta energía.
Materiales
Para el control durante la cirugía
- Una almohadilla térmica para mantener la temperatura normal.
- Un monitor de oxígeno transcutáneo.
- Un monitor de temperatura.
Para la cirugía
- Un cuchillo # 3 # 15 con la cuchilla.
- Dos pares de pinzas (una para la piel y otra para otros tejidos blandos).
- 2-3 pares de pinzas pequeñas.
- Uno o dos pares de tijeras micro (para cortar los tejidos).
- Un par de pequeñas tijeras (para cortar suturas).
- El titular de una aguja.
- Un par de golpes de acero inoxidable (para la fabricación de las heridas).
Referencias
- Ninomiya, H. The vascular bed in the rabbit ear: microangiography and scanning electron microscopy of vascular corrosion casts. Anat. Histol. Embryol. 29, 301-305 (2000).
- Sen, C. K., Gordillo, G. M., Roy, S., Kirsner, R., Lambert, L., Hunt, T. K., Gottrup, F., Gurtner, G. C., Longaker, M. T. Human skin wounds: a major and snowballing threat to public health and the economy. Wound Repair. 17, 763-771 (2009).
- Boulton, A. J., Vileikyte, L., Ragnarson-Tennvall, G., Apelqvist, J. The global burden of diabetic foot disease. Lancet. 366, 1719-1724 (2005).
- Edwards, J., Stapley, S. Debridement of diabetic foot ulcers. Cochrane Database Syst. Rev. 1, 1-40 (2010).
- Werdin, F., Tennenhaus, M., Schaller, H. E., Rennekampff, H. O. Evidence-based Management Strategies for Treatment of Chronic Wounds. Eplasty. 9, 169-179 (2009).
- Wu, Y., Chen, L., Scott, P. G., Tredget, E. E. Mesenchymal stem cells enhance wound healing through differentiation and angiogenesis. Stem Cells. 25, 2648-2659 (2007).
- Bennett, J. P., Matthews, R., Faulk, W. P. Treatment of chronic ulceration of the legs with human amnion. Lancet. 1, 1153-1156 (1980).
- Gottrup, F., Agren, M. S., Karlsmark, T. Models for use in wound healing research: a survey focusing on in vitro and in vivo adult soft tissue. Wound Repair. 8, 83-96 (2000).
- Lindblad, W. J. Animal models in wound healing research: do we need more. Wound Repair. 8, 81-82 (2000).
- LoGerfo, F. W., Gibbons, G. W. Vascular disease of the lower extremities in diabetes mellitus. Endocrinol. Metab. Clin. North Am. 25, 439-445 (1996).
- Gottrup, F. Oxygen, wound healing and the development of infection. Present status. Eur. J. Surg. 168, 260-263 (2002).
- Niinikoski, J. The effect of blood and oxygen supply on the biochemistry of repair. , 56-71 (2002).
- Schaffer, M., Witte, M., Becker, H. D. Models to study ischemia in chronic wounds. Int. J. Low Extrem. Wounds. 1, 104-111 (2002).
- Niinikoski, J., Gottrup, F., Hunt, T. K. The role of oxygen in wound repair. , 165-174 (1991).
- Harding, K. G., Morris, H. L., Patel, G. K. Science, medicine and the future: healing chronic wounds. BMJ. 324, 160-163 (2002).
- Lindblad, W. J. Editorial: How should one study wound healing. Wound Repair. 14, 515-515 (2007).
- Chien, S. Ischemic rabbit ear model created by minimally invasive surgery. Wound Repair Regen. 15, 928-935 (2007).
- Joseph, J., Townsend, F. J. The healing of defects in immobile skin in rabbits. Br. J. Surg. 48, 557-564 (1961).
- James, G. A., Swogger, E., Wolcott, R., Pulcini, E., Secor, P., Sestrich, J., Costerton, J. W., Stewart, P. S. Biofilms in chronic wounds. Wound Repair Regen. 16, 37-44 (2008).
- Niitsuma, J., Yano, H., Togawa, T. Experimental study of decubitus ulcer formation in the rabbit ear lobe. J. Rehabil. Res. Dev. 40, (2003).
- Salcido, R., Popescu, A., Ahn, C. Animal models in pressure ulcer research. J. Spinal Cord Med. 30, 107-116 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados