Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La Ex vivo Preparación aislada Microvessel esquelético para la Investigación de la reactividad vascular
En este artículo
Resumen
Un Ex vivo se describe para el aislamiento de las arteriolas de resistencia del músculo gracilis más grandes para los interrogatorios tanto de las respuestas vasculares a los estímulos vasoactivos y la evaluación de las propiedades básicas estructurales a través de la mecánica de la pared pasivos.
Resumen
La preparación microvasos aislado es una preparación ex vivo, que permite el examen de las contribuciones de diferentes factores que diámetro de control del buque, y por lo tanto, la resistencia a la perfusión 1-5. Esta es una preparación clásica experimental que fue, en gran medida, descrita inicialmente por Uchida et al. 15 hace varias décadas. Esta descripción inicial sirvió de base para las técnicas que se ha modificado y mejorado ampliamente, principalmente en el laboratorio del Dr. Brian Duling en la Universidad de Virginia, 6-8, y se presenta un enfoque actual en las páginas siguientes. Esta preparación se referirá específicamente a la arteriola gracilis en una rata como la microvasos de elección, pero la preparación de base pueden aplicarse fácilmente a los buques aisladas a partir de casi cualquier otro tejido u órgano a través de especies 9-13. Mecánica (es decir, dimensiones) cambios en la microvasculatura aislado puede ser evaluado fácilmenteen respuesta a una amplia gama de fisiológico (por ejemplo, presión hipoxia, intravascular, o cizallamiento) o retos farmacológicos, y puede dar una idea de elementos mecánicos que comprenden las respuestas integradas en una intacta, aunque ex vivo, el tejido. La importancia de este método es que permite la fácil manipulación de las influencias sobre la regulación integrada del diámetro de los microvasos, mientras que también permite el control de muchas de las contribuciones de otras fuentes, incluyendo la presión intravascular (miogénica), inervación autónoma, hemodinámica ( por ejemplo, el esfuerzo cortante), estímulos endoteliales dependientes o independientes, hormonales e influencias del parénquima, para proporcionar una lista parcial. Bajo condiciones experimentales adecuadas y con objetivos adecuados, esto puede servir como una ventaja sobre in vivo o in situ tejido / órgano preparaciones, que no permiten fácilmente para el control fácil de amplios variables sistémicas.
La maJor limitación de esta preparación es básicamente la consecuencia de sus puntos fuertes. Por definición, el comportamiento de estos buques se está estudiando en condiciones en muchos de los que más contribuyen a la regulación de la resistencia vascular se han eliminado, incluso neuronales, humorales, metabólicas, etc Por lo tanto, el investigador recibe una tarjeta amarilla para evitar la sobre- interpretación y extrapolación de los datos que se recogen la utilización de esta preparación. La otra área importante de preocupación con respecto a esta preparación es que puede ser muy fácil de dañar los componentes celulares, tales como el revestimiento endotelial o el músculo liso vascular, de tal manera que la fuente variable de error puede ser introducido. Se recomienda encarecidamente que el investigador individual utilizan las medidas apropiadas para garantizar la calidad de la preparación, tanto en el inicio del experimento y periódicamente durante el curso de un protocolo.
Protocolo
1. Antes del experimento
- Antes del día experimento, los tubos capilares de vidrio de las dimensiones apropiadas para la estación se ven involucrados en micropipetas (ya sea un extractor horizontal o vertical, se puede utilizar). El diámetro de la punta puede ser fácilmente ajustado en función del vaso que se está aislado, aunque por lo general utilizar un rango de diámetro entre 50-150 micras. Estos son luego dobladas a la configuración apropiada para el calentamiento estación siguiente microvasos sobre una llama de butano. Puntas de micropipeta están físicamente roto con el diámetro aproximado (con unas pinzas finas) para el microvasos en cuestión y puede suelo o pulido para las conformaciones adecuadas, según sea necesario para la aplicación específica. Para una revisión extensa y sobresaliente en estos procedimientos, se remite al lector a Davis et al. 16. Dos micropipetas se colocan en oposición a los titulares de la pipeta para la cámara de los microvasos. Estos deben estar orientados de tal manera que las puntasestán en el mismo plano vertical y horizontal dentro de la cámara buque.
La cámara de los microvasos utilizado en este manuscrito (figuras 1 y 2) es el que está personalizado por el Sr. David Eick en el Departamento de Fisiología de la Facultad de Medicina de Wisconsin ( http://www.phys.mcw.edu/ y www . eicktech.com ). Sin embargo, varias otras configuraciones de la cámara de los microvasos están fácilmente disponibles en el mercado, con los elaborados por los sistemas vivos Instrumentación ( http://www.livingsys.com/ ) y IonOptix ( http://www.ionoptix.com/ ) es muy común. El uso de estos otros sistemas, puede ser indispensable utilizar un microscopio invertido en lugar de una una posición vertical convencional, aunque esto depende del experimento específico y las necesidades de equipo. El uso de microscopios invertidos, sería preferible para experimentación protocoles que requieren imágenes de fluorescencia o confocal. - Prepare una solución salina fisiológica (SSF, se describe a continuación) y asegurar el pH se ajusta a los niveles apropiados para las condiciones experimentales específicas (7.38-7.42 es típico y cae dentro del rango fisiológico). La solución PSS puede ser preparado de antemano y refrigerados, pero debe comprobarse a la temperatura apropiada para el pH antes de su uso. PSS puede contener albúmina si el experimentador o protocolos específicos que requiere, aunque esto no es universalmente obligatoria.
- Las pinzas de video digital utilizados para medir el diámetro del vaso debe ser calibrado usando un hemocitómetro o micrómetro platina del microscopio. Para la calibración exacta, es vital que el micrómetro ser colocado en el mismo plano que las micropipetas entrada / salida en la cámara de depósito.
- Lazos de corbata para fijar el microvasos de las pipetas deben estar preparados y ser fácilmente accesibles para su uso posterior. Estos pueden ser fácilmente preparado a partir de 8-0 o menor s oftálmicaFUTURO. El lazo solo puede ser preparado de antemano y se almacena en una caja de Petri cubierta por una pequeña tira de cinta invertida alrededor de un portaobjetos de microscopio hasta que sea necesario (esto evitar que se pierdan). (Figura 3).
2. Día del experimento
- Todo el equipo de apoyo debe estar encendido y comprobar el funcionamiento correcto. Esto incluye la tabla anti-vibration/floating y el baño de agua circulante calentada (establecido para proporcionar la temperatura apropiada en el baño de buque - comúnmente 37 ° C), todos los transductores de presión y la cámara de recipiente de la bomba de drenaje (Figura 1A y 1B). Encienda los gases de equilibrio en la cámara de buque, y de la perfusión y embalses superperfundido.
- Rellene todos los depósitos, tubos y cámaras con la solución de PSS. La línea perfundido que conduce a la pipeta entrada debe estar completamente lleno para evitar la presencia de burbujas de aire en esta línea que podría desalojar y dañar la VAscular endotelio (fig. 1C). Si es necesario, utilizar una jeringa para empujar suavemente las PSS todo el camino a través de la pipeta para asegurarse que está completamente lleno y sin ningún tipo de obstrucción que podría impedir el flujo de líquido de perfusión. La presión de entrada debe mantenerse dentro de límites razonables para no dañar los transductores de presión.
3. Microvasos cosecha
- Después de anestesiar al animal de la que el microvasos se debe tomar, el buque en cuestión deben ser aisladas de acuerdo a los procedimientos que sean más adecuadas a la vasculatura a estudiar. En algunos casos, esto puede requerir la extirpación del mismo órgano (por ejemplo, los microvasos cerebrales o coronarias), mientras que en otros, los barcos pueden ser removidos directamente por el animal anestesiado (por ejemplo, el músculo). Un ejemplo de la orientación del recipiente dentro del músculo se presentan en la Figura 4. Estimación de la longitud del vaso in vivo antes de la remoción con paraceps o pinzas pequeñas. Antes de la retirada del buque de que el animal / órgano, que puede ser muy útil para llevar a cabo una revisión final para asegurarse de que la cámara de buque está listo y funcionando correctamente (incluyendo todos los lazos de unión en su lugar).
- Retirar el recipiente del animal / órgano agarrando el lado exterior de la vasija en un extremo con unas pinzas finas y corte a lo largo de la longitud del recipiente hasta que esté libre, teniendo cuidado extremo para evitar cualquier tirón o tirando del buque. Una vez liberado, inmediatamente colocarlo en un tubo de centrífuga de 1,7 mL llena de PSS, pero no dejar de lado el vaso. Esto es para recordar la orientación, de tal manera que la dirección perfundido en el baño será idéntica a la dirección del flujo sanguíneo en el animal.
4. Canular el buque
- Colocar el recipiente en el baño de llenado y canular el extremo proximal de la pipeta entrada. Esto se puede lograr mejor con una tasa de perfusión modesto través de la cánula (~ 50 mmHg de presión) yun par de pinzas finas se utiliza para mantener cada lado de la pared del lumen proximal recipiente (es decir, un par de pinzas en cada mano). En nuestro laboratorio, utilizamos unas pinzas finas de herramientas de la ciencia Bellas http://www.finescience.com/Home.aspx ), aunque las pinzas debidamente construidos actúa de forma efectiva. Deslice el buque en las puntas de la cánula y avanzar en la embarcación en la punta hasta el punto en dos bucles de unión puede asegurar el buque.
- Elevar la presión de entrada de ~ 75 mm Hg para inflar aún más el barco y facilitar la canalización en la punta de la pipeta distal. El flujo a través del recipiente debe ser vista como una distorsión en el depósito superperfundido en la salida distal del vaso (bajo el microscopio). Canular el extremo distal de la embarcación en la pipeta de salida y fijarla con dos lazos de unión (estos bucles finales deben estar en su lugar antes de la canulación, Figura 5).
- Ajuste la cánula hasta que, en las coordenadas XYZ needed hasta que hay una distorsión mínima en el recipiente, y el recipiente se aproxima a la longitud en vivo. Elevar la presión de entrada hasta que se aproxima el porcentaje de la presión arterial media normalmente experimentado por dicho segmento de vaso (nuestro laboratorio utiliza 80% de la presión arterial media para las arteriolas de resistencia grandes del músculo gracilis 8).
- Coloque una piedra pequeña burbujeante la entrega de la mezcla de gases apropiada en el baño y la envoltura de plástico o de su lugar una cubierta de vidrio sobre la cámara para evitar salpicaduras de la lente de un microscopio. Utilizamos una piedra burbujeo que está comúnmente disponible en todo el PET / tiendas de acuarios y es de aproximadamente 1 cm de diámetro, aunque un tamaño más pequeño será eficaz también. La presencia de la piedra burbujeo asegura la disponibilidad de gas adecuado para el recipiente en todo momento y se extenderá viabilidad buque. Esta piedra ha sido removida durante todos los períodos de medición (o el flujo de aire a través de la piedra interrumpe temporalmente) para evitar la distorsión de laimagen. Soltar la pinza en la pipeta de salida y permitir el flujo a través del recipiente durante 30 minutos. Periódicamente, el flujo debe ser fijada en la tubería de salida para determinar si el recipiente está desarrollando tono en reposo. Todos los buques que se debe comprobar que no haya fugas de presión en este punto. Las fugas se hará evidente por la introducción de una presión conocida en el recipiente (que utilizan comúnmente 100-120 mmHg) y de sujeción de la salida, seguido por la entrada, las líneas. Si la presión intraluminal es estable, no hay fugas perceptibles. Sin embargo, si la presión comienza a caer, una fuga significativa está presente y debe cerrarse. Fugas en cualquiera de las entradas o pipetas de salida normalmente puede corregirse mediante la adición de un lazo adicional atada alrededor de la embarcación en la pipeta. Alternativamente, si un recipiente tiene una rama lateral pequeño que está permitiendo la fuga, esto comprometer la capacidad del recipiente para contener la presión efectiva y se puede introducir una fuente adicional de error. Si esta fuga se identifica, lo que normalmente puede estar amarrado won un solo lazo de sutura oftálmica 10-0. Por otra parte, una sola hebra bromeó 6-0 de sutura para hacer el bucle empate también es muy eficaz. Si la fuga no puede ser identificado o no pueden ser efectivamente atado (por ejemplo, no hay tronco a la rama lateral y simplemente un agujero en la pared del vaso), esto puede resultar en una terminación prematura del experimento y el uso de un buque alternativo convertido necesario (esto es generalmente el recipiente idéntico en la otra pierna - o lado contralateral, si es necesario - del animal).
El recipiente se debe permitir que se equilibre en ningún condiciones de flujo para un mínimo de 30 minutos. Todos los experimentos se llevan a cabo bajo condiciones de flujo no. Una vez que el buque ha desarrollado el tono satisfactorio y responde a los criterios de inclusión para el experimento en cuestión, el buque está listo para su posterior estudio.
Estos criterios de inclusión puede variar dependiendo del protocolo experimental específico y el investigador. En nuestro laboratorio, de manera rutinaria utilize la siguiente:- Tono activo de> 30% (calculado como Dd / D max x 100, donde Dd es el aumento de diámetro arteriolar pared interior de los valores por debajo de la presión de equilibrio en respuesta a la exposición a Ca 2 +-libre PSS y máximo D es el máximo diámetro medido a la presión de equilibrio en el Ca 2 +-libres PSS).
- Activación miogénica (mantenimiento de, o preferiblemente una reducción en, diámetro arteriolar con presión intraluminal aumentada) como un índice de un viables capa de músculo liso vascular.
- Un revestimiento endotelial viable, como lo demuestra la respuesta dilatadora a paso ligero a la acetilcolina (10 -6 M en el baño).
- Los criterios adicionales de inclusión puede ser añadido para adaptarse al protocolo experimental específico, según sea necesario, incluyendo las respuestas a constrictores agonistas adrenérgicos tales como fenilefrina (10 -7 M), las respuestas a los estímulos dilatadores adicionales tales como adenosina (10 -5 M) o hipoxia (reducción en 0% de O 2 en el gas de equilibración).
- La siguiente sección es un ejemplo de un "experimento simulado". Todas las soluciones requeridas se preparan en su caso, con la atención que se presta para tener en cuenta el factor de dilución de las PSS en la cámara de depósito. Como un ejemplo, para algunos de nuestros equipos, el volumen de la cámara de recipiente es de 20 ml. Como tal l, 20 de unos 10 -2 resultados de la solución M de stock en una concentración efectiva de 10 -5 M en el baño de la cámara de depósito. Tras la eliminación buque, la canulación, equilibración y la validación como se describió anteriormente, el experimento está listo para comenzar. Características tales como la asignación al azar el tratamiento y la eficacia son específicas de la experimentación y consumiría demasiado espacio para este esfuerzo. Como tal, estos no están incluidos en detalle.
Las respuestas iniciales de control se determinan. Por ejemplo, un estímulo fisiológico, tales como la activación miogénica (presión inducida por la constricción), intraluminal prEssure es alterado al azar en el rango deseado, y el buque se permite un período adecuado de tiempo para responder (en este caso, nos permitiría un período de 5-7 minutos). Para un ejemplo de estímulo farmacológico como desafío con la acetilcolina, el fármaco se añade a la parte posterior de las soluciones madre en un orden aleatorio. En este caso, se suele utilizar una gama de 10 -9 a 10 -5 M en el baño, con lavado se define como una restauración de diámetro equilibración. Como la acetilcolina es un agente de acción rápida, las respuestas máximas dilatador se puede lograr fácilmente en sólo unos pocos segundos. Otros agentes (tales como péptidos) puede llevar mucho más tiempo para provocar una respuesta máxima y esto mucho tenerse en cuenta, así como el período de tiempo necesario para lavado eficaz. Una vez que las respuestas de control han sido recogidos, intervenciones específicas que pueden ser impuestas en el sistema, incluyendo la incubación de la embarcación con agonistas de los receptores y antagonistas, los agentes que actúan en los canales de iones específicos, instigaciónalteraciones en la tensión intraluminal, las diferencias en los gases de equilibrado o agentes farmacológicos dirigidos a determinados sistemas enzimáticos, por nombrar algunas de las intervenciones más comunes.
Después de un tiempo apropiado para la intervención sea eficaz (que debe ser probado adecuadamente), una nueva ronda de recopilación de datos puede ser iniciada. Según el protocolo experimental específica, las intervenciones posteriores se pueden imponer sobre el buque o la primera se puede quitar (ya sea por lavado - la supresión o simple del desafío fisiológico - cuando sea posible). Una vez que el recipiente ha vuelto a su estado de equilibrio (que debe ser verificado), las intervenciones posteriores se pueden aplicar, según sea necesario con datos adicionales recogidos. Este procedimiento general se continuó hasta la terminación del experimento, o hasta que la calidad de la preparación recipiente cae por debajo del umbral previamente determinados criterios (por ejemplo, la respuesta a un agonista o la capacidad de desarrollar tono activo suficiente). En este punto, el experimento se concluyó cualquiera, o el investigador puede desear para recopilar datos que es independiente de la reactividad del recipiente aislado (por ejemplo, la mecánica de la pared del vaso, que pueden ser llevadas a cabo utilizando el procedimiento idéntico de activación miogénica, sólo con un buque carente de toda tono activo 14). - La limpieza regular de todo el equipo es esencial para la eliminación de la acumulación de sal y la prevención del crecimiento de las entidades biológicas deseadas. Al final de cada día experimento, como mínimo, todas las líneas y las cámaras están completamente descargado de PSS con cantidades copiosas de agua destilada o desionizada y se deja secar completamente. Después de cada 2-3 días de uso, un lavado con alcohol etílico se realiza también y el equipo se deja secar completamente. Al final de cada semana de uso constante, todas las líneas y las cámaras se llenan con 0,1 M de ácido clorhídrico, se dejó 'incubar' durante 30 minutos y después se lavó completamente con agua como anteriormente. Finalmente, en elfinal de 2-3 semanas de uso consecutivo, todas las secciones de tubería se sustituyen con el nuevo y la cámara de depósitos y se limpian con HCl 1,0 M seguido por un extenso lavado con agua destilada / agua desionizada. Si algún cambio de coloración de la creación visual de la tubería o un crecimiento en el tubo o cualquier otro elemento de la cámara / embalses, estas prácticas pueden ser reemplazados o limpiarse a fondo, según corresponda. Con la limpieza regular y el mantenimiento general, el sistema puede durar un tiempo muy largo. En el momento de la escritura, nuestras cámaras de los buques están en su 8 º o 9 º año de uso habitual y hemos experimentado ninguna dificultad significativa con ellos.
5. Los resultados representativos

Figura 1A. Esta figura presenta la configuración de los microvasos estación de base. Una televisión para la nave = ver; B = calibradores digitales, C = jeringa para empujar superperfundido thrpipeta ough entrada según sea necesario; D = columna hidrostática para el cambio de presión de entrada perfundido, E = microscopio, F = microvasos cámara; G = superperfundido embalse; H = monitor de la presión (se pueden añadir varias según sea necesario), I = microvasos cámara de la bomba de drenaje para superperfundido; J = gas de la mezcla de tanque de equilibrio, K = residuo que contiene (por superperfundido), L = calentador de agua circulante, M = anti-vibration/floating tabla.

Figura 1B. Esta figura presenta una vista más cercana de la configuración de la cámara de los microvasos. En esta figura, E = microscopio, F = microvasos cámara, H = monitor de presión (mientras que se muestra sólo uno por simplicidad, múltiple se puede añadir a diferentes sitios como sea necesario), I = microvasos bomba drenaje de la cámara; N = tubo unido al comienzo de la pipeta de entrada de líquido de perfusión (una continuación de 'D' en la Figura 1A); O = tubo conectado a la pipeta de salida del líquido de perfusión.

La Figura 1C. Esta figura presenta la vista más cercana de la cámara de los microvasos. En esta figura, la línea N = perfundido (es decir, la tubería conectada directamente a la pipeta afluencia perfundido); S = tubería conectada directamente a la pipeta de salida perfundido, p = localización de los controles horizontales y verticales para la pipeta entrada, Q = la superperfundido escurrir durante el baño de agua (conectado a 'I' en las figuras 1A y 1B), R = la entrada para el baño de agua procedente del depósito (conectado a 'G' en la Figura 1A).

Figura 2. Esta figura presenta una representación esquemática del flujo de fluidos y gases en el sistema. En esta figura, A = PSS entrada de línea superperfundido, B = PSS línea de perfusión a la entrada de la pipeta, C = PSS superperfundido desagüe del baño al contenedor de residuos, D = PSS salida de líquido de perfusión de la pipeta de salida, la entrada E = agua caliente en la cámara de la chaqueta, F = salida de agua caliente de la chaqueta de la cámara.
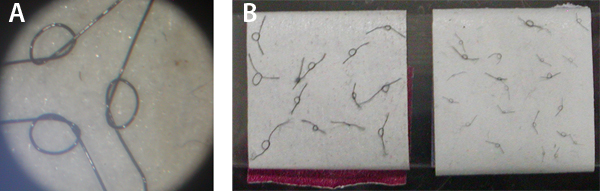
3. La figura Esta figura presenta empate persona a partir de bucles de sutura oftálmica (visto a través de un microscopio de disección con oculares 10x y un aumento 4.5x zoom ajustable, panel A) que se utilizan en la preparación y el almacenamiento de los lazos de unión múltiples 8-0 y 10-0 sutura en la cinta invertida alrededor de un portaobjetos de microscopio que se almacena en una placa de Petri cubierto (para evitar pérdida de ellos; panel B).
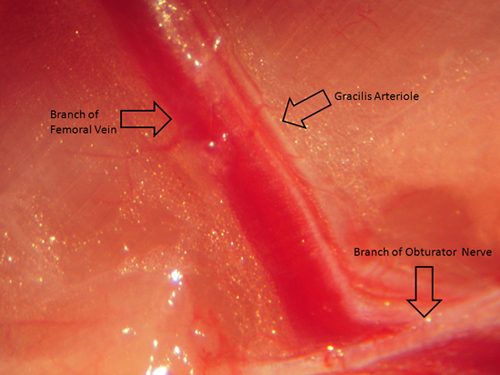
4 figura. Esta cifra proporciona una imagen (visto a través de un microscopio de disección estándar) de la arteriola resistencia gracilis músculo antes del aislamiento y la eliminación quirúrgica para permitir la orientación espacial adecuada.
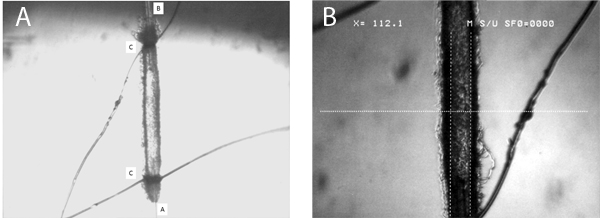
Figura 5. Esta cifra ofrece una imagen representativa de una microvasos canulado. El panel A muestra toda la longitud de la embarcación, tanto con flujo de entrada (A) y de salida (B) pipetas, así como los bucles de unión (C) se muestra. El panel B presenta una imagen en un gran aumento, que muestra claramente la determinación del diámetro arteriolar interior con los calibradores digitales (en este caso el diámetro es de 112 micras).

Figura 6. Esta cifra presenta imágenes representativas de un equilibrio de los microvasos siguiente canulado. La imagen superior es de un recipiente bajo control, sin estimular las condiciones a la presión de equilibrio, la imagen del medio es de la misma vasija después de la dilatación de desafiar con acetilcolina (10 -6 M en el baño), y la imagen es inferior a dicho buque tras constriction para desafiar con fenilefrina (10 -7 M en el baño).
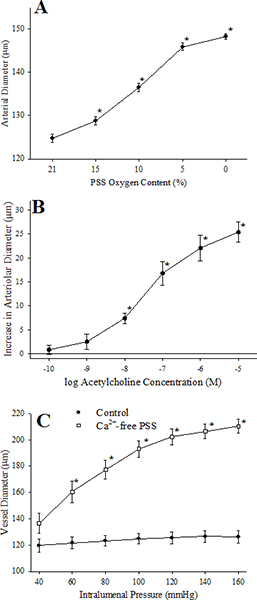
. Figura 7 Esta figura resume las respuestas de un microvasos aislada en respuesta al desafío con: hipoxia (panel A, una reducción en perfundido y superperfundido PO 2 en nuestro sistema de ~ 135 mmHg a ~ 40 mmHg), concentraciones crecientes de acetilcolina (Panel B), cambios en la presión intravascular en condiciones de control y después de la incubación de la embarcación con un PSS libre de calcio (Grupo C).
Access restricted. Please log in or start a trial to view this content.
Discusión
El protocolo presentado describe la canulación de aislamiento, la eliminación y de un doble microvasos del músculo esquelético, aunque esta técnica general puede aplicarse fácilmente a la mayoría de los tejidos. Para el manuscrito actual, el término "arteriola" ha sido utilizado por los autores para describir a un buque de la resistencia que oscila entre 70-120 micras de diámetro, bajo tono activo de reposo, que es también una importante contribución a la regulación de la resistencia a la perfusió...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue apoyado por la American Heart Association (EIA 0740129N) y NIH HL90610 T32.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Reactivos y Equipos | Empresa | Comentarios / Catálogo # | |
| Buque Cámara | Costumbre | David Eick (MCW) | |
| Baño caliente de recirculación de agua | PolyScience y Haake | Haake DC 10 | |
| Pipetas | Federico Haer & Co. | Tubo capilar de 2,0 mm x 1,0 mm de diámetro externo de identificación (27-33-1) | |
| Monitor de presión | World Precision Instruments | ||
| Camisa de agua depósito | Costumbre | ||
| Fuente de luz externa | World Precision Instruments | Novaflex | |
| Pipetear Extractor | Microdatos de Instrumentos | PMP102 Micropipeta Extractor | |
| Complementa completadesarrollo de herramientas quirúrgicas | Herramientas de Bellas Ciencia | Dumont | |
| Ultra unas pinzas finas | Herramientas de Bellas Ciencia | Inox # 5 | |
| Seda hilo de sutura | Ethilon | # 10-0 o 9-0 | |
| Microscopio estéreo | Olimpo | Olympus SZ-11 | |
| Calibres de vídeo analógico | Boeckeler | A través del controlador (Via-100) | |
| Cámara analógica de alta resolución | Panasonic | GP-MF 602 | |
| Tanque de Oxígeno | Regional | 21% el balance de nitrógeno y un 5% de CO 2 el balance de nitrógeno | |
| Tubería | Tygon | ||
| Drene la bomba | Cole Parmer Instrument Co. | ||
| Modificados PSS Rata | Ver receta a continuación | ||
| PSS Relajante van Breemen de | Ver receta a continuación |
Tabla 1. Una lista de los principales componentes de la instalación aislada estación de microvasos se presenta en las figuras.
| Rata Modificado Receta PSS | Para hacer dos litros de PSS | 20X sal para el ganado (2L) | 20X Reserva de Estabilización (2L) |
| NaCl | 278,0 g | ||
| KCl | 14,0 g | ||
| MgSO 4-7H 2 O | 11,5 g | ||
| CaCl 2-H 2 O | 9,4 g | ||
| NaHCO3 | 80,8 g | ||
| EDTA | 0,4 g | ||
| NaH 2 PO 4 | 0,28 g | ||
| Glucosa | 1,98 g | ||
| 20x sal para el ganado | 100 ml | ||
| 20x Reserva de Estabilización | 100 ml | ||
| Agua destilada | 1800 ml |
Tabla 2. Composición de la solución estándar salina fisiológica (PSS) utilizado en los protocolos microvasos aislados.
Comentarios sobre receta: Hacer 2 l de caldo de sal y 2 litros de reserva de estabilización. Estos cun ser refrigerado cuando no se utilicen, pero agite bien y con frecuencia antes de la preparación de PSS. Los ingredientes adicionales se añaden en el momento de la preparación de PSS finales.
| PSS Relajante van Breemen de | Para hacer 2 litros de PSS | 20X sal para el ganado (1 litro) | 20X Reserva de Estabilización (1L) |
| NaCl | 107,4 g | ||
| KCl | 7,0 g | ||
| MgSO 4-7H 2 O | 5,76 g | ||
| MgCl 2-6H 2 O | 81,32 g | ||
| NaHCO $ 3 | 40,4 g | ||
| EDTA | 0,2 g | ||
| EGTA | 15,22 | ||
| NaH 2 PO 4 | 0,28 g | ||
| Glucosa | 1,98 g | ||
| 20x sal para el ganado | 100 ml | ||
| 20x Reserva de Estabilización | 100 ml | ||
| Agua destilada | 1800 ml |
Tabla 3. Receta para relajante Van Breemen de solución salina fisiológica (PSS) utilizado en los protocolos microvasos aislados bajo condiciones de tono activo cero.
Comentarios sobre receta: Hacer 1 l de caldo de salº 1 L de la Reserva de Estabilización. Estos pueden ser refrigerado cuando no se utilicen, pero agite bien y con frecuencia antes de la preparación de PSS. Los ingredientes adicionales se añaden en el momento de la preparación de finales PSS relajantes.
Referencias
- Goodwill, A. G., Frisbee, S. J., Stapleton, P. A., James, M. E., Frisbee, J. C. Impact of Chronic Anticholesterol Therapy on Development of Microvascular Rarefaction in the Metabolic Syndrome. Microcirculation. , 1-18 (2009).
- Goodwill, A. G., James, M. E., Frisbee, J. C. Increased vascular thromboxane generation impairs dilation of skeletal muscle arterioles of obese Zucker rats with reduced oxygen tension. Am. J. Physiol. Heart Circ. Physiol. 295, H1522-H1528 (2008).
- Samora, J. B., Frisbee, J. C., Boegehold, M. A. Growth-dependent changes in endothelial factors regulating arteriolar tone. Am. J. Physiol. Heart Circ. Physiol. 292, H207-H214 (2007).
- Samora, J. B., Frisbee, J. C., Boegehold, M. A. Hydrogen peroxide emerges as a regulator of tone in skeletal muscle arterioles during juvenile growth. Microcirculation. 15, 151-161 (2008).
- Samora, J. B., Frisbee, J. C., Boegehold, M. A. Increased myogenic responsiveness of skeletal muscle arterioles with juvenile growth. Am. J. Physiol. Heart Circ. Physiol. 294, 2344-2351 (2008).
- Dacey, R. G., Duling, B. R. A study of rat intracerebral arterioles: methods, morphology, and reactivity. Am. J. Physiol. Heart Circ. Physiol. 243, H598-H606 (1982).
- Fredricks, K. T., Liu, Y., Lombard, J. H. Response of extraparenchymal resistance arteries of rat skeletal muscle to reduce PO2. Am. J. Physiol. 267, H706-H715 (1994).
- Durand, M. J., Raffai, G., Weinberg, B. D., Lombard, J. H. Angiotensin-(1-7) and low-dose angiotensin II infusion reverse salt-induced endothelial dysfunction via different mechanisms in rat middle cerebral arteries. Am. J. Physiol. Heart Circ. Physiol. 299, H1024-H1033 (2010).
- LeBlanc, A. J., Cumpston, J. L., Chen, B. T., Frazer, D., Castranova, V., Nurkiewicz, T. R. Nanoparticle inhalation impairs endothelium-dependent vasodilation in subepicardial arterioles. J. Toxicol. Environ. Health A. 72, 1576-1584 (2009).
- Jernigan, N. L., LaMarca, B., Speed, J., Galmiche, L., Granger, J. P., Drummond, H. A. Dietary salt enhances benzamil-sensitive component of myogenic constriction in mesenteric arteries. Am. J. Physiol. Heart Circ. Physiol. 294, H409-H420 (2008).
- Stapleton, P. A., Goodwill, A. G., James, M. E., Frisbee, J. C. Altered mechanisms of endothelium-dependent dilation in skeletal muscle arterioles with genetic hypercholesterolemia. Am. J. Physiol. Regul. Integr. Comp. Physiol. 293, R1110-R1119 (2007).
- Goodwill, A. G., Stapleton, P. A., James, M. E., d'Audiffret, A. C., Frisbee, J. C. Increased arachidonic acid-induced thromboxane generation impairs skeletal muscle arteriolar dilation with genetic dyslipidemia. Microcirculation. 15, 621-631 (2008).
- Baumbach, G. L., Hadju, M. A. Mechanics and composition of cerebral arterioles in renal and spontaneously hypertensive rats. Hypertension. 21, 816-826 (1993).
- Uchida, E., Bohr, D. F., Hoobler, S. W. A method for studying isolated resistance vessel from rabbit mesentery and brain and their responses to drugs. Circ. Res. 4, 525-536 (1967).
- Davis, M. J., Kuo, L., Chilian, W. M., Muller, J. M. I. solated Chapter 23. Isolated, perfused microvessels. In: Clinically Applied Microcirculation Research. Barker, J. H., Anderson, G. L., Menger, M. D. 32, CRC Press, Inc. 435-456 (1995).
- Lombard, J. H., Liu, Y., Fredricks, K. T., Bizub, D. M., Roman, R. J., Rusch, N. J. Electrical and mechanical responses of rat middle cerebral arterieal to reduced PO2 and prostacyclin. Am. J. Physiol. 276, H509-H516 (1994).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados