Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
La Ex vivo Préparation isolé microvaisseaux squelettique pour les enquêtes de la réactivité vasculaire
Dans cet article
Résumé
Un Ex vivo Préparation est décrite pour l'isolement des artérioles plus gracilis résistance musculaire pour interrogatoire des deux réponses à des stimuli vasoactifs vasculaires et l'évaluation des propriétés structurales par le biais de base mécanique murales passives.
Résumé
La préparation des microvaisseaux isolé est une préparation ex vivo qui permet à l'examen des différentes contributions de facteurs qui diamètre du vaisseau de contrôle, et donc, 1-5 résistance perfusion. Il s'agit d'une préparation classique expérimental qui a été, dans une large mesure, initialement décrit par Uchida et al. De 15 il ya plusieurs décennies. Cette description initiale a fourni la base pour les techniques qui a été largement modifié et amélioré, principalement dans le laboratoire du Dr Brian Duling à l'Université de Virginie 6-8, et nous présentons une approche actuelle dans les pages suivantes. Cette préparation sera spécifiquement référence à l'artériole gracilis dans un rat comme des microvaisseaux de choix, mais la préparation de base peut être facilement appliqué aux navires isolés à partir de presque n'importe quel autre tissu ou organe à travers les espèces 9-13. Mécaniques (c.-à-dimensionnelle) des changements dans l'isolé microvaisseaux peuvent facilement être évaluéen réponse à un large éventail de paramètres physiologiques (par exemple, l'hypoxie, la pression intravasculaire, ou de cisaillement) ou défis pharmacologiques, et peut donner un aperçu des éléments mécaniques comprenant des réponses intégrées dans une intacte, bien que ex vivo, des tissus. L'importance de cette méthode est qu'elle permet la manipulation facile des influences sur la régulation intégrée de diamètre des microvaisseaux, tout en permettant aussi le contrôle de la plupart des contributions provenant d'autres sources, y compris la pression intravasculaire (myogène), l'innervation autonome, hémodynamique ( par exemple, la contrainte de cisaillement), les stimuli endothéliales dépendante ou indépendante, hormonaux, et les influences du parenchyme, afin de fournir une liste partielle. Sous des conditions appropriées expérimentales et avec des objectifs appropriés, ce qui peut servir comme un avantage par rapport in vivo ou in situ des tissus / organes des préparations, qui ne permettent pas facilement pour le contrôle facile de variables systémiques plus larges.
La malimitation jor de cette préparation est essentiellement la conséquence de ses points forts. Par définition, le comportement de ces navires est à l'étude dans des conditions où la plupart des plus importants contributeurs à la régulation de la résistance vasculaire ont été supprimés, y compris de neurones, humorale, métabolique, etc En tant que tel, l'enquêteur est mis en garde pour éviter de trop- l'interprétation et l'extrapolation des données qui sont recueillies en utilisant cette préparation. L'autre domaine de préoccupation significatif à l'égard de cette préparation est qu'il peut être très facile d'endommager les composants cellulaires tels que la paroi endothéliale ou le muscle lisse vasculaire, de telle sorte que des variables source d'erreur peut être introduit. Il est fortement recommandé que l'investigateur individuel d'utiliser des mesures appropriées pour assurer la qualité de la préparation, à la fois au début de l'expérience et périodiquement tout au long d'un protocole.
Protocole
1. Avant l'expérience
- Avant le jour l'expérience, des tubes de verre capillaires des dimensions appropriées pour la station sont tiré dans micropipettes (soit un extracteur horizontal ou vertical peut être utilisé). Le diamètre de la pointe peut être facilement ajustée en fonction de la cuve étant isolé, même si nous utilisons généralement une plage de diamètres entre 50-150 um. Ces derniers sont ensuite pliés à la configuration appropriée pour le chauffage suivant station de microvaisseaux au cours d'une flamme de butane. Conseils micropipettes sont physiquement cassé pour le diamètre approximatif (avec des pinces fines) pour la microvaisseaux en question et peut-chaussée ou polies pour les conformations appropriées, nécessaires à l'application spécifique. Pour un examen approfondi et en circulation sur ces procédures, le lecteur est invité à Davis et al. 16. Deux micropipettes sont ensuite placés dans l'opposition dans les supports de pipette pour la chambre des microvaisseaux. Ceux-ci doivent être orientés de telle sorte que les conseilssont dans un même plan vertical et horizontal au sein de la chambre de cuve.
La chambre des microvaisseaux utilisé dans ce manuscrit (figures 1 et 2) est celui qui est construit sur mesure par M. David Eick dans le Département de physiologie du Collège médical du Wisconsin ( http://www.phys.mcw.edu/ et www . eicktech.com ). Cependant, plusieurs autres configurations de la chambre des microvaisseaux sont facilement disponibles dans le commerce, avec celles élaborées par Instrumentation Systems habitable ( http://www.livingsys.com/ ) et IonOptix ( http://www.ionoptix.com/ ) étant très répandu. L'utilisation de ces autres systèmes, il peut être impératif d'utiliser un microscope inversé plutôt qu'un vertical classique, bien que cela dépend de l'expérience spécifique et les besoins en équipement. L'utilisation de microscopes inversés serait préférable à des fins expérimentales protocols nécessitant l'imagerie de fluorescence ou confocal. - Préparer une solution saline physiologique (PSS; décrites ci-dessous) et d'assurer pH est fixé à des niveaux appropriés pour les conditions expérimentales spécifiques (7,38 à 7,42 est typique et tombe dans la plage physiologique). La solution PSS peut être préparé à l'avance et réfrigérés, mais doit être vérifié à la température appropriée pour le pH avant de l'utiliser. PSS peut contenir d'albumine si l'expérimentateur ou des protocoles précis de l'exigence, même si ce n'est pas universellement obligatoire.
- Les étriers de vidéo numériques utilisés pour mesurer le diamètre du vaisseau doit être calibré à l'aide d'un hémocytomètre ou micromètre microscope. Pour un étalonnage précis, il est essentiel que le micromètre être placé dans le même plan que les micropipettes afflux / sorties dans la chambre de navire.
- Boucles cravate pour fixer le microvaisseaux aux pipettes doit être préparé et être facilement accessible pour une utilisation ultérieure. Ceux-ci peuvent être facilement préparés 8-0 ou moins ophtalmique sAVENIR. La boucle seul lien peut être préparé à l'avance et stocké dans une boîte de Petri couverte sur une petite bande de ruban inversé entourant une lame de microscope jusqu'à ce que nécessaire (ce sera de les empêcher de se perdre). (Figure 3).
2. Journée de l'Expérience
- Tout le matériel à l'appui doivent être mis en marche et vérifier son bon fonctionnement. Cela inclut la table anti-vibration/floating et le bain de circulation d'eau chauffée (réglé pour fournir la température appropriée dans le bain navire - souvent 37 ° C), tous les capteurs de pression et la pompe de vidange cuve chambre (Figure 1A et 1B). Mettez les gaz d'équilibration dans la chambre de navire et dans le perfusat et réservoirs superfusat.
- Remplissez tous les réservoirs, des tubes, et des chambres avec la solution PSS. La ligne de perfusion conduisant à la pipette d'entrée doit être entièrement rempli pour éviter la présence de bulles d'air dans cette ligne, qui pourraient se détacher et endommager la vaendothélium scular (figure 1C). Si nécessaire, utiliser une seringue pour pousser doucement les PSS tout au long de la pipette pour s'assurer qu'il est complètement plein et sans blocage qui pourrait empêcher l'écoulement de liquide de perfusion. La pression d'entrée doit être maintenue dans des limites raisonnables pour éviter d'endommager les capteurs de pression.
3. La récolte des microvaisseaux
- Après anesthésiant de l'animal à partir duquel le microvaisseaux est à prendre, le navire en question doit être isolé conformément aux procédures qui sont le plus approprié pour le système vasculaire d'être étudiée. Dans certains cas, cela peut exiger l'enlèvement de l'organe lui-même (par exemple, microvaisseaux cérébraux ou coronariens), tandis que dans d'autres, les navires peuvent être retirés directement à partir de l'animal anesthésié (par exemple, le muscle). Un exemple de l'orientation du navire dans le muscle gracilis est présenté dans la Figure 4. Estimer la longueur du navire in vivo avant de l'enlever avec pourcèpes ou étriers petits. Avant l'enlèvement du navire de l'animal / organe, il peut être très utile pour effectuer une vérification finale pour s'assurer que la chambre de navire est prêt et fonctionne correctement (y compris toutes les boucles de cravate en place).
- Retirer le récipient de l'animal / organe en le saisissant par le côté extérieur de la cuve à une extrémité avec une pince fine et couper le long de la longueur du navire jusqu'à ce qu'il soit libre, en prenant un soin extrême pour éviter tout tiraillement ou de tirer sur le navire. Une fois libéré, immédiatement le placer dans un tube à centrifuger de 1,7 mL rempli de PSS, mais ne lâchez pas du navire. Ceci est à retenir l'orientation, de telle sorte que la direction dans le bain liquide de perfusion est identique à la direction d'écoulement du sang dans l'animal.
4. Canulation le navire
- Placer le récipient dans le bain rempli et cathétériser l'extrémité proximale de la pipette d'entrée. Ce peut être mieux réalisé avec un taux de perfusion modeste à travers la canule (~ 50 mmHg de pression) etune paire de pinces fines utilisé pour maintenir de chaque côté de la partie proximale navire lumière mur (c.-à-une paire de pince dans chaque main). Dans notre laboratoire, nous utilisons une pince fine à partir des outils des sciences Beaux ( http://www.finescience.com/Home.aspx ), bien que les pinces de façon appropriée construits sera de travailler efficacement. Glissez le navire sur les conseils canule et de faire avancer le bateau sur la pointe au point où deux boucles de liaison peuvent sécuriser le navire.
- Augmenter la pression d'entrée à ~ 75 mmHg à gonfler davantage le navire et de faciliter la canulation sur la pointe de la pipette distale. L'écoulement à travers le navire doit être considéré comme une distorsion dans le réservoir superfusat à la sortie distale du navire (sous le microscope). Cathétériser l'extrémité distale du navire sur la pipette de sortie et le fixer avec deux boucles de liaison (ces boucles finales doivent être en place avant la canulation; Figure 5).
- Ajuster la canule jusque dans les coordonnées XYZ needed jusqu'à ce qu'il y est un minimum de distorsion dans le récipient, et le récipient se rapproche de la longueur vivo. Augmenter la pression d'entrée jusqu'à ce qu'il soit approximativement le pourcentage de la pression artérielle moyenne normalement connu par ce segment de vaisseau (notre laboratoire utilise 80% de la pression artérielle moyenne pour les artérioles de résistance grands du muscle gracilis 8).
- Placez une pierre bouillonnement petite délivrer le mélange de gaz approprié dans le bain et la pellicule plastique lieu ou d'un couvercle en verre sur la chambre pour éviter les éclaboussures de l'objectif du microscope. Nous utilisons une pierre bouillonnement qui est généralement disponible à tous les animaux de compagnie / magasins d'aquarium et est d'environ 1 cm de diamètre, même si une taille plus petite sera de travailler efficacement aussi bien. La présence de la pierre bouillonnement d'assurer la disponibilité du gaz approprié pour le navire à tout moment et étendra la viabilité navire. Cette pierre est enlevée pendant toutes les périodes de mesure (ou débit d'air à travers la pierre temporairement interrompu) pour éviter toute distorsion de lal'image. Libérer la pince sur la pipette d'écoulement et permettre l'écoulement à travers le récipient pendant 30 minutes. Périodiquement, le débit doit être fixé à la tubulure de sortie afin de déterminer si le navire se développe le tonus de repos. Tous les navires doivent être vérifiées pour les fuites de pression à ce point. Fuites est évident en introduisant une pression connue dans le récipient (on couramment utiliser 100-120 mm de Hg) et la sortie de serrage, suivie par l'entrée, des lignes. Si la pression intraluminale est stable, il n'ya pas de fuites visibles. Toutefois, si la pression commence à tomber, une fuite importante est présente et doit être fermé. Fuites au niveau soit de l'entrée ou pipettes d'écoulement peuvent normalement être corrigée par l'ajout d'une boucle supplémentaire lié autour du bateau sur la pipette. Par ailleurs, si un navire a une succursale petit côté qui est en permettant la fuite, cela compromettrait la capacité du navire pour contenir la pression de manière efficace et peut introduire une source supplémentaire d'erreur. Si cette fuite est identifié, il peut normalement être attaché wvec une seule boucle de 10-0 suture ophtalmique. Sinon, un seul brin taquine 6-0 suture pour que la boucle de liaison est également très efficace. Si la fuite ne peut pas être identifié ou ne peut être efficacement noués (par exemple, il n'ya pas de coffre pour la branche latérale et simplement un trou dans la paroi du vaisseau), il peut en résulter un arrêt prématuré de l'expérience et l'utilisation d'un navire de remplacement deviennent nécessaire (ce qui est généralement le navire identique dans l'autre jambe - ou sur le côté controlatéral si nécessaire - de l'animal).
Le navire devrait être autorisé à s'équilibrer en conditions d'écoulement pour un minimum de 30 minutes. Toutes les expériences sont menées dans des conditions d'écoulement. Une fois le navire a mis au point le ton satisfaisante et est sensible aux critères d'inclusion pour l'expérience en question, le navire est prêt pour étude ultérieure.
Ces critères d'inclusion peut varier en fonction du protocole expérimental spécifique et chercheur. Dans notre laboratoire, nous avons l'habitude utilize ce qui suit:- Tonalité actif de> 30% (calculé comme bD / D max x 100, où bD est l'augmentation de diamètre de la paroi artériolaire intérieure à partir des valeurs sous la pression d'équilibration en réponse à l'exposition à Ca 2 + sans PSS et D max est la valeur maximale diamètre mesuré à la pression d'équilibrage dans les 2 Ca +-libres PSS).
- Activation myogénique (maintien de la, ou de préférence une réduction, diamètre artériolaire avec la pression intraluminale accrue) comme un indice d'une couche de muscle lisse vasculaire viable.
- Une doublure viable endothéliale, comme en témoigne une réponse dilatatrice vive à l'acétylcholine (10 -6 M dans le bain).
- Critères d'inclusion supplémentaires peuvent être ajoutés en fonction du protocole expérimental spécifique selon les besoins, y compris les réponses aux constricteurs adrénergiques tels que la phényléphrine (10 -7 M), les réponses dilatatrices à des stimuli additionnels tels que l'adénosine (10 -5 M) ou une hypoxie (réduction 0% d'O 2 dans le gaz d'équilibrage).
- La section suivante est un exemple d'une «expérience maquette". Toutes les solutions requises sont préparés comme il convient, avec une attention versés au compte du facteur de dilution des PSS dans la chambre de navire. A titre d'exemple, pour certains de nos équipements, le volume de la chambre de cuve est de 20 ml. En tant que tel, pl 20 de quelques 10 résultats M -2 solution stock dans une concentration efficace de 10 -5 M dans le bain chambre navire. Après le retrait du navire, canulation, l'équilibration et la validation tel que décrit ci-dessus, l'expérience est prête à commencer. Détails tels que la randomisation et de l'efficacité du traitement sont spécifiques et l'expérience serait de consommer trop d'espace pour cet effort. En tant que tel, ceux-ci ne sont pas inclus dans le détail.
Réponses initiales de contrôle sont déterminés. Pour un stimulus physiologique par exemple telles que l'activation myogénique (induite par la pression de constriction), intraluminale prEssure est modifié de façon aléatoire sur toute la plage souhaitée, et le navire est autorisé une période de temps appropriée pour répondre (dans ce cas, nous permettrait une période de 5-7 minutes). Pour un stimulus pharmacologique par exemple comme une provocation à l'acétylcholine, le médicament est ajouté à l'arrière à partir de solutions d'achat d'actions dans un ordre aléatoire. Dans ce cas, nous utiliserions normalement une gamme de 10 -9 à 10 -5 M dans le bain, avec lavage étant définie comme une restauration de diamètre équilibration. Comme l'acétylcholine est un agent à action rapide, les réponses dilatatrices maximales peuvent être facilement atteint en seulement quelques secondes. D'autres agents (tels que les peptides) peut prendre beaucoup plus de temps pour obtenir une réponse maximale et ce bien être pris en compte, ainsi que la période de temps nécessaire pour lavage efficace. Une fois les réponses de contrôle ont été recueillies, des interventions spécifiques peuvent être imposées sur le système, y compris d'incubation de la cuve avec des agonistes des récepteurs / antagonistes, des agents agissant au niveau des canaux ioniques spécifiques, l'incitation à desaltérée pression intraluminale, les différences dans les gaz d'équilibrage ou d'agents pharmacologiques spécifiques ciblées sur les systèmes enzymatiques, pour n'en nommer que quelques-unes des interventions les plus courantes.
Après un temps approprié pour l'intervention soit efficace (ce qui devrait être testé de manière appropriée), un cycle ultérieur de la collecte des données peut être lancée. Selon le protocole expérimental spécifique, les interventions ultérieures peuvent être imposées sur le bateau ou le premier peut être enlevé (soit par un lavage - la suppression ou simple du défi physiologique - lorsque cela est possible). Une fois le navire est revenu à son état d'équilibration (qui devrait être vérifié), les interventions ultérieures peuvent être appliquées selon les besoins avec des données supplémentaires recueillies. Cette procédure générale serait poursuivie jusqu'à la fin de l'expérience ou jusqu'à ce que la qualité de la préparation navire tombe en dessous des critères de seuil préalablement déterminés (par exemple, la réponse à un agoniste ou la capacité de développer suffisamment de tonalité actif). À ce stade, l'expérience est soit conclu, ou l'enquêteur peut souhaiter recueillir des données qui est indépendante de la réactivité du bateau isolé (tels que la mécanique de la paroi du vaisseau, qui peuvent être menées en utilisant la procédure d'activation identiques myogénique, juste avec un navire dépourvu de toute tonalité actif 14). - Un nettoyage régulier de l'ensemble de l'équipement est essentiel pour l'élimination de l'accumulation de sel et de la prévention de la croissance de toutes les entités indésirables biologiques. À la fin de chaque jour l'expérience, au minimum, toutes les lignes et les chambres sont complètement vidé de PSS avec de grandes quantités d'eau distillée ou désionisée et on laisse sécher complètement. Après tous les 2-3 jours d'utilisation, un lavage avec de l'alcool éthylique est réalisée aussi bien et l'équipement est autorisé à sécher complètement. A la fin de chaque semaine d'utilisation régulière, toutes les lignes et les chambres sont remplis avec 0,1 M d'acide chlorhydrique, a permis de «incuber» pour 30 minutes, puis lavé entièrement avec de l'eau comme ci-dessus. Enfin, à lafin de 2-3 semaines d'utilisation consécutive, toutes les sections de tube sont remplacés par de nouveaux et la chambre et les réservoirs sont nettoyés avec 1,0 M de HCl suivie par une étendue de rinçage à l'eau distillée / de l'eau désionisée. Si une décoloration de la mise en place des tubes ou visuelle d'une croissance dans le tube ou tout autre élément de la chambre / réservoirs, ceux-ci sont soit remplacé ou nettoyé à fond le cas échéant. Avec un nettoyage régulier et l'entretien général, l'équipement peut durer très longtemps. Au moment de la rédaction, nos chambres de navires sont tous dans leur 8 e ou 9 e année de l'utilisation de routine et nous avons connu aucune difficulté significative avec eux.
5. Les résultats représentatifs

Figure 1A. Cette figure présente la configuration de base des microvaisseaux station. Une télévision pour le navire = affichage, b = pied à coulisse numérique; C = seringue pour pousser superfusat thrpipette afflux ough tant que de besoin; D = colonne hydrostatique pour changer la pression d'entrée du perfusat; E = microscope; F = microvaisseaux chambre; G = superfusat réservoir; H = pression moniteur (multiple peut être ajouté si nécessaire); I = pompe de vidange des microvaisseaux de chambre pour superfusat; J = réservoir de mélange de gaz d'équilibration; K = déchets contenus (pour superfusat); L = chauffe-eau circulant; tableau M anti-vibration/floating =.

La figure 1B. Ce chiffre présente une vue rapprochée de la chambre de l'installation des microvaisseaux. Dans cette figure, E = microscope; F = microvaisseaux chambre; H moniteur de pression = (alors que nous montrent un seul pour plus de simplicité, de multiples peuvent être ajoutés à différents sites que nécessaire); I = pompe de vidange des microvaisseaux chambre; N = tube fixé à la tout début de la pipette d'entrée du perfusat (une continuation de «D» dans la figure 1A); O = tube attaché à la pipette de sortie perfusat.

La figure 1C. Cette figure présente le plus proche point de vue de la chambre de microvaisseaux. Sur cette figure, N = la ligne perfusat (c.-à-tube attaché directement à la pipette d'entrée perfusat); O = tube attaché directement à la pipette d'écoulement perfusat, p = les contrôles de position horizontale et verticale pour la pipette d'entrée; Q = le superfusat égoutter pendant le bain d'eau (relié à «je» dans les figures 1A et 1B); R = l'afflux de l'eau du bain provenant du réservoir (relié à «G» à la figure 1A).

Figure 2. Ce chiffre présente une représentation schématique de l'écoulement des fluides et des gaz dans le système. Dans cette figure, A = entrées PSS ligne superfusat; B = PSS perfusat ligne à l'afflux de pipette; C = PSS superfusat vidange du bain à perdre conteneur; D = PSS perfusat sortie de la pipette de sortie; entrée E = eau chauffée dans la chambre veste; F = sortie de l'eau chauffée à partir de veste de chambre.
. Figure 3 Cette figure présente des traverses individuellement fabriqués à partir de boucles de suture ophtalmique (vu à travers un microscope à dissection avec oculaires 10x et un zoom 4.5x grossissement réglable; Groupe A) qui sont utilisés dans notre préparation et le stockage de boucles multiples cravate 8-0 et 10-0 de suture sur la bande inversée autour d'une lame de microscope qui est stocké dans un plat couvert de Petri (pour éviter de les perdre; Groupe B).
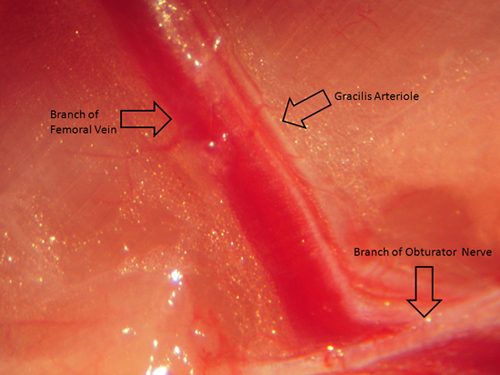
Figure 4. Ce chiffre donne une image (vu à travers un microscope standard dissection) de l'artériole gracilis résistance musculaire avant l'isolement et le retrait chirurgical pour permettre l'orientation spatiale adéquate.
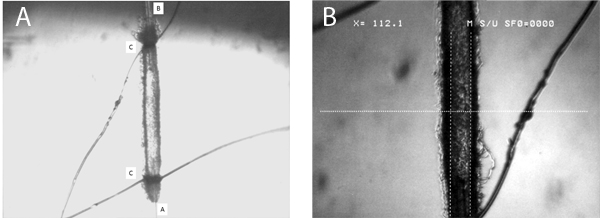
Figure 5. Ce chiffre donne une image représentative d'une microvaisseaux perforé. Panneau A indique la longueur de la cuve, avec deux entrées (A) et de sortie (B) ainsi que les pipettes boucles de liaison (C) représenté. Groupe B présente une image à un fort grossissement, montrant clairement la détermination du diamètre artériolaire intérieure avec les étriers numériques (dans ce cas le diamètre est de 112 um).

Figure 6. Cette figure présente des images représentatives d'une équilibration suivant microvaisseaux perforé. L'image est supérieure d'un récipient sous contrôle, non stimulé conditions à la pression d'équilibrage, l'image du milieu est de la cuve même après la dilatation de contester avec l'acétylcholine (10 -6 M dans le bain), et l'image de fond est de ce navire suivant constriction de contester avec de la phényléphrine (10 -7 M dans le bain).
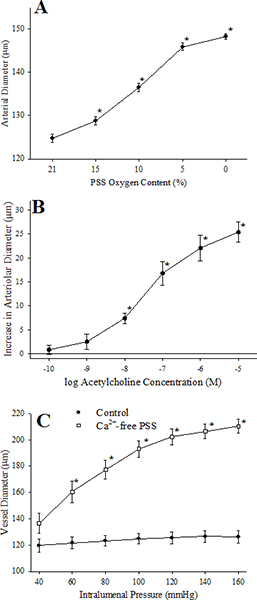
. Figure 7 Ce chiffre résume les réponses d'un des microvaisseaux isolés en réponse au défi avec: hypoxie (Groupe A, une réduction de la perfusion et superfusat PO 2 dans notre système de ~ 135 mmHg à ~ 40 mmHg), des concentrations croissantes d'acétylcholine (Groupe d'experts B), les changements de pression intravasculaire dans des conditions de contrôle et d'incubation suivant du navire avec un PSS sans calcium (Groupe C).
Access restricted. Please log in or start a trial to view this content.
Discussion
Le protocole présenté décrit la canulation isolement, le retrait et double d'un microvaisseaux du muscle squelettique, bien que cette technique générale peut être facilement appliquée à la plupart des tissus. Pour le manuscrit en cours, le terme «artériole" a été utilisé par les auteurs pour décrire un navire de résistance comprise entre 70-120 m de diamètre sous tonalité actif de repos, ce qui est également un contributeur majeur à la régulation de la résistance de perfusion à un organe o...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Ce travail a été soutenu par l'American Heart Association (EIA 0740129N) et NIH T32 HL90610.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Réactifs et appareillage | Entreprise | Commentaires / Catalogue # | |
| Chambre des navires | Coutume | Dave Eick (MCW) | |
| Bain d'eau chauffée de circulation | PolyScience et Haake | Haake DC 10 | |
| Pipettes | Frédéric Haer & Co. | Capillaire Tube 2,0 mm x 1,0 mm OD ID (27-33-1) | |
| Le moniteur de pression | Instruments de précision du monde | ||
| Réservoir d'eau chemisé | Coutume | ||
| Source de lumière externe | Instruments de précision du monde | Novaflex | |
| Extracteur Pipet | Microdonnées à grande diffusion Instruments | PMP102 micropipette Puller | |
| Achèvement completment d'outils chirurgicaux | Outils belle science | Dumont | |
| Ultra fines pinces | Outils belle science | Inox n ° 5 | |
| Fil de suture en soie | Ethilon | # 10-0 ou 9-0 | |
| Microscope stéréo | Olympe | Olympus SZ-11 | |
| Étriers vidéo analogiques | Boeckeler | Via contrôleur (Via-100) | |
| Caméra haute résolution analogique | Panasonic | GP-602 MF | |
| Ballon d'oxygène | Régional | Bilan de l'azote de 21% et 5% de CO 2 d'azote équilibre | |
| Tubes | Tygon | ||
| Vider la pompe | Cole Parmer Instrument Co. | ||
| PSS Rat modifiés | Voir la recette ci-dessous | ||
| PSS relaxants van Breemen de | Voir la recette ci-dessous |
Tableau 1. Une liste des principaux composants de l'installation des microvaisseaux station isolée présentés dans les figures.
| Mise à jour PSS Recette Rat | Pour faire deux litres de PSS | 20X Stock Sel (2L) | 20X stock régulateur (2L) |
| NaCl | 278,0 g | ||
| KCl | 14,0 g | ||
| MgSO 4 .7 H 2 O- | 11,5 g | ||
| CaCl 2-H 2 O | 9,4 g | ||
| NaHCO 3 | 80,8 g | ||
| EDTA | 0,4 g | ||
| NaH 2 PO 4 | 0,28 g | ||
| Glucose | 1,98 g | ||
| 20x stock de sel | 100 ml | ||
| 20x stock régulateur | 100 ml | ||
| Eau distillée | 1800 ml |
Tableau 2. Recette pour une solution de sel physiologique norme (PSS) utilisé dans les protocoles de microvaisseaux isolés.
Commentaires sur la recette: Faire 2 l de bouillon, sel et 2 litres de stock régulateur. Ces cêtre réfrigéré une lorsqu'il n'est pas utilisé, mais les secouer bien et souvent avant de préparer PSS. Les ingrédients supplémentaires sont ajoutés au moment de la préparation de PSS finales.
| PSS relaxants van Breemen de | Pour faire 2 litres de PSS | 20X Stock sel (1L) | 20X stock régulateur (1L) |
| NaCl | 107,4 g | ||
| KCl | 7,0 g | ||
| MgSO 4 .7 H 2 O- | 5,76 g | ||
| MgCl 2-6H 2 O | 81,32 g | ||
| NaHCO 3 | 40,4 g | ||
| HAEUne | 0,2 g | ||
| EGTA | 15,22 | ||
| NaH 2 PO 4 | 0,28 g | ||
| Glucose | 1,98 g | ||
| 20x stock de sel | 100 ml | ||
| 20x stock régulateur | 100 ml | ||
| Eau distillée | 1800 ml |
Tableau 3. Recette pour Van Breemen de solution de sel relaxant physiologique (PSS) utilisé dans les protocoles de microvaisseaux isolés dans des conditions de tonalité actif à zéro.
Commentaires sur la recette: Faire 1 L de stock de sel unee 1 L de stock régulateur. Ceux-ci peuvent être réfrigérés lorsqu'il n'est pas utilisé, mais les secouer bien et souvent avant de préparer PSS. Les ingrédients supplémentaires sont ajoutés au moment de la préparation des versions finales PSS relaxants.
Références
- Goodwill, A. G., Frisbee, S. J., Stapleton, P. A., James, M. E., Frisbee, J. C. Impact of Chronic Anticholesterol Therapy on Development of Microvascular Rarefaction in the Metabolic Syndrome. Microcirculation. , 1-18 (2009).
- Goodwill, A. G., James, M. E., Frisbee, J. C. Increased vascular thromboxane generation impairs dilation of skeletal muscle arterioles of obese Zucker rats with reduced oxygen tension. Am. J. Physiol. Heart Circ. Physiol. 295, H1522-H1528 (2008).
- Samora, J. B., Frisbee, J. C., Boegehold, M. A. Growth-dependent changes in endothelial factors regulating arteriolar tone. Am. J. Physiol. Heart Circ. Physiol. 292, H207-H214 (2007).
- Samora, J. B., Frisbee, J. C., Boegehold, M. A. Hydrogen peroxide emerges as a regulator of tone in skeletal muscle arterioles during juvenile growth. Microcirculation. 15, 151-161 (2008).
- Samora, J. B., Frisbee, J. C., Boegehold, M. A. Increased myogenic responsiveness of skeletal muscle arterioles with juvenile growth. Am. J. Physiol. Heart Circ. Physiol. 294, 2344-2351 (2008).
- Dacey, R. G., Duling, B. R. A study of rat intracerebral arterioles: methods, morphology, and reactivity. Am. J. Physiol. Heart Circ. Physiol. 243, H598-H606 (1982).
- Fredricks, K. T., Liu, Y., Lombard, J. H. Response of extraparenchymal resistance arteries of rat skeletal muscle to reduce PO2. Am. J. Physiol. 267, H706-H715 (1994).
- Durand, M. J., Raffai, G., Weinberg, B. D., Lombard, J. H. Angiotensin-(1-7) and low-dose angiotensin II infusion reverse salt-induced endothelial dysfunction via different mechanisms in rat middle cerebral arteries. Am. J. Physiol. Heart Circ. Physiol. 299, H1024-H1033 (2010).
- LeBlanc, A. J., Cumpston, J. L., Chen, B. T., Frazer, D., Castranova, V., Nurkiewicz, T. R. Nanoparticle inhalation impairs endothelium-dependent vasodilation in subepicardial arterioles. J. Toxicol. Environ. Health A. 72, 1576-1584 (2009).
- Jernigan, N. L., LaMarca, B., Speed, J., Galmiche, L., Granger, J. P., Drummond, H. A. Dietary salt enhances benzamil-sensitive component of myogenic constriction in mesenteric arteries. Am. J. Physiol. Heart Circ. Physiol. 294, H409-H420 (2008).
- Stapleton, P. A., Goodwill, A. G., James, M. E., Frisbee, J. C. Altered mechanisms of endothelium-dependent dilation in skeletal muscle arterioles with genetic hypercholesterolemia. Am. J. Physiol. Regul. Integr. Comp. Physiol. 293, R1110-R1119 (2007).
- Goodwill, A. G., Stapleton, P. A., James, M. E., d'Audiffret, A. C., Frisbee, J. C. Increased arachidonic acid-induced thromboxane generation impairs skeletal muscle arteriolar dilation with genetic dyslipidemia. Microcirculation. 15, 621-631 (2008).
- Baumbach, G. L., Hadju, M. A. Mechanics and composition of cerebral arterioles in renal and spontaneously hypertensive rats. Hypertension. 21, 816-826 (1993).
- Uchida, E., Bohr, D. F., Hoobler, S. W. A method for studying isolated resistance vessel from rabbit mesentery and brain and their responses to drugs. Circ. Res. 4, 525-536 (1967).
- Davis, M. J., Kuo, L., Chilian, W. M., Muller, J. M. I. solated Chapter 23. Isolated, perfused microvessels. In: Clinically Applied Microcirculation Research. Barker, J. H., Anderson, G. L., Menger, M. D. 32, CRC Press, Inc. 435-456 (1995).
- Lombard, J. H., Liu, Y., Fredricks, K. T., Bizub, D. M., Roman, R. J., Rusch, N. J. Electrical and mechanical responses of rat middle cerebral arterieal to reduced PO2 and prostacyclin. Am. J. Physiol. 276, H509-H516 (1994).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon