Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Бывший естественных условиях Изолированный скелета Подготовка микрососудов для исследования сосудистой реактивности
В этой статье
Резюме
Бывший естественных условиях Подготовка описана в изоляции из крупнейших гасШз мышц сопротивление артериол для допроса и сосудистых реакций на вазоактивные стимулы и оценка основных структурных свойств с помощью пассивных механики стены.
Аннотация
The isolated microvessel preparation is an ex vivo preparation that allows for examination of the different contributions of factors that control vessel diameter, and thus, perfusion resistance1-5. This is a classic experimental preparation that was, in large measure, initially described by Uchida et al.15 several decades ago. This initial description provided the basis for the techniques that was extensively modified and enhanced, primarily in the laboratory of Dr. Brian Duling at the University of Virginia6-8, and we present a current approach in the following pages. This preparation will specifically refer to the gracilis arteriole in a rat as the microvessel of choice, but the basic preparation can readily be applied to vessels isolated from nearly any other tissue or organ across species9-13. Mechanical (i.e., dimensional) changes in the isolated microvessels can easily be evaluated in response to a broad array of physiological (e.g., hypoxia, intravascular pressure, or shear) or pharmacological challenges, and can provide insight into mechanistic elements comprising integrated responses in an intact, although ex vivo, tissue. The significance of this method is that it allows for facile manipulation of the influences on the integrated regulation of microvessel diameter, while also allowing for the control of many of the contributions from other sources, including intravascular pressure (myogenic), autonomic innervation, hemodynamic (e.g., shear stress), endothelial dependent or independent stimuli, hormonal, and parenchymal influences, to provide a partial list. Under appropriate experimental conditions and with appropriate goals, this can serve as an advantage over in vivo or in situ tissue/organ preparations, which do not readily allow for the facile control of broader systemic variables.
The major limitation of this preparation is essentially the consequence of its strengths. By definition, the behavior of these vessels is being studied under conditions where many of the most significant contributors to the regulation of vascular resistance have been removed, including neural, humoral, metabolic, etc. As such, the investigator is cautioned to avoid over-interpretation and extrapolation of the data that are collected utilizing this preparation. The other significant area of concern with regard to this preparation is that it can be very easy to damage cellular components such as the endothelial lining or the vascular smooth muscle, such that variable source of error can be introduced. It is strongly recommended that the individual investigator utilize appropriate measurements to ensure the quality of the preparation, both at the initiation of the experiment and periodically throughout the course of a protocol.
протокол
1. До эксперимента
- До начала эксперимента день, стеклянные капилляры соответствующих размеров для станции тянут в микропипетки (горизонтальное или вертикальное съемник может использоваться). Диаметр кончика легко регулируется в зависимости от судна, изолированный, хотя мы обычно используем диаметром в диапазоне от 50-150 мкм. Они потом наклонился к соответствующей конфигурации микрососудов нагрева следующей станции за бутан пламени. Микропипетки советы физически разбит на приблизительный диаметр (с тонким пинцетом) для микрососудов в вопросе и может быть шлифованной или полированной к соответствующей конформации, в случае необходимости для конкретного применения. Для широкого и выдающиеся обзор этих процедур, читатель, направленных на Davis и соавт. 16. Два микропипетки затем помещаются в оппозиции в пипетку держатели для камеры микрососудов. Они должны быть ориентированы так, что советынаходятся в одной вертикальной и горизонтальной плоскости в пределах судна камеры.
Микрососудов камера, используемая в этой рукописи (рис. 1 и 2), который является обычай построил г-н Дэвид Эйк в отделе физиологии в Медицинском колледже штата Висконсин ( http://www.phys.mcw.edu/ и WWW . eicktech.com ). Тем не менее, некоторые другие конфигурации камера микрососудов легко в продаже, с тех, которые разработаны живых систем Instrumentation ( http://www.livingsys.com/ ) и IonOptix ( http://www.ionoptix.com/ ) быть очень распространенным явлением. Использование этих систем, это может быть необходимо использовать инвертированный микроскоп, а не обычные вертикально один, хотя это зависит от конкретного эксперимента, требования к оборудованию. Использование инвертированных микроскопов бы предпочтительнее для экспериментальных protocолы требующих флуоресцентные или конфокальной микроскопии. - Подготовить физиологический раствор поваренной соли (PSS, описанных ниже), а также обеспечить рН установлен на соответствующем уровне для конкретных условий эксперимента (7.38-7.42 характерна и находится в пределах физиологической нормы). PSS решения могут быть подготовлены заранее и охлажденные, но должна быть проверена при соответствующей температуре для рН до использования. PSS может содержать альбумин, если экспериментатор или конкретных протоколов требуется, хотя это не всегда обязательно.
- Цифровые видео суппортами для измерения диаметра сосуда должен быть откалиброван помощью гемоцитометра или микрометра микроскопа. Для точной калибровки, очень важно, что микрометр быть помещен в той же плоскости, приток / отток микропипетки в сосуд камеры.
- Галстук петли для крепления микрососудов в пипетки должны быть подготовлены и быть легко доступными для последующего использования. Они могут быть легко получены из 8-0 или меньше с глазнойuture. Одного цикла галстук можно приготовить заранее и хранить в закрытой чашке Петри на небольшой полоске обратной лента окружающие предметное стекло микроскопа, пока это необходимо (это будет держать их от потери). (Рис. 3).
2. День эксперимента
- Все вспомогательное оборудование должны быть включены и проверены для нормальной работы. Это включает в себя таблицу anti-vibration/floating и циркулирующей с подогревом на водяной бане (набор обеспечить соответствующую температуру в емкости ванны - обычно 37 ° C), все датчики давления и сливной сосуд камеры насоса (рис. 1А и 1В). Включите равновесия газов в камере судна и в перфузат и superfusate водоемов.
- Заполните все резервуаров, труб и камеры с PSS решение. Перфузат линии, ведущие к притоку пипетки должны быть полностью заполнены, чтобы избежать наличия пузырьков воздуха в этом направлении, которые могут выбить и повредить ваscular эндотелия (рис. 1в). Если необходимо, используйте шприц аккуратно вставьте PSS весь путь через пипетку, чтобы гарантировать, что он полностью заполнен и без блокировки, которые могут помешать перфузат потока. Приток давление должно быть в разумных пределах, чтобы не повредить датчики давления.
3. Сбор микрососудов
- После обезболивающих животных, из которых микрососудов должно быть принято, судно идет речь, должны быть изолированы в соответствии с процедурами, которые являются наиболее подходящими для сосудистой должны быть изучены. В некоторых случаях это может потребовать удаления самого органа (например, мозга или коронарных микрососудов), в то время как в других судах могут быть удалены непосредственно из наркоза животное (например, мышцы). Примером ориентации судна в мышцах гасШз представлена на рисунке 4. Оцените длина судна в естественных условиях до удаления с длябелые грибы или небольшие суппортами. До удаления судна от животного / органа, он может быть очень полезно, чтобы выполнить одну заключительную проверку, чтобы убедиться, что судно камера готова и работает нормально (в том числе все галстук петли на месте).
- Удалить судна из животных / органа, держась внешней стороны судна в один конец с тонкой щипцы и резки по длине судна, пока оно освободится, с особой осторожностью, чтобы избежать любых дергать или тянуть на судне. Когда освободился, сразу же поместить его в 1,7 мл центрифугу трубки, заполненной PSS, но не отпустить судно. Это стоит помнить, ориентации, такие, что перфузат направление в ванной будет идентична кровоток в направлении животного.
4. Cannulating судна
- Поместите сосуд в заполненной ванной и вводить иглу проксимального конца на приток пипетки. Лучше всего этого можно достичь с помощью скромного скорость перфузии через канюлю (~ 50 мм рт.ст. давления) иПара тонких щипцы используются для хранения каждой стороне проксимальной просвет сосуда стене (то есть, одна пара щипцов в каждой руке). В нашей лаборатории мы используем тонкий пинцет из изобразительных средств наук ( http://www.finescience.com/Home.aspx ), хотя любой надлежащим построены щипцы будет работать эффективно. Наденьте судно на кончиках канюлю и продвинуть судно на кончике до точки, где два галстука петли может обеспечить судна.
- Поднимите приток давление ~ 75 мм рт.ст. для дальнейшего раздувания судно и облегчить катетеризация на дистального конца пипетки. Поток через судно должно рассматриваться как искажение в superfusate водохранилище на дистальном отток судна (под микроскопом). Вводить иглу дистального конца судна, на отток пипетки и закрепите ее с двумя галстук петли (эти последние петли должны быть на месте до катетеризации, рисунок 5).
- Отрегулируйте канюля пока в XYZ координат Needeг, пока не будет минимальным искажением в сосуде, и судно приблизительно в естественных условиях длина. Поднимите приток давление, пока он не приближает процент среднее артериальное давление обычно испытывает, что судно сегмента (наша лаборатория использует 80% от среднего артериального давления на больших артериол сопротивление мышц гасШз 8).
- Поместите небольшой камень кипящей предоставления соответствующей газовой смеси в ванну и место упаковка пластиковой или стеклянной крышкой над камерой, чтобы избежать брызг микроскопа линзы. Мы используем кипящей камень, который обычно доступен на всех животных / аквариум магазинов и около 1 см в диаметре, хотя и меньшего размера будет работать эффективно, а также. Наличие восходящей камень обеспечивает доступность соответствующей газа на судно во все времена и будет распространяться судно жизнеспособность. Этот камень удаляется в течение всего периода измерения (или поток воздуха через камень временно прерван), чтобы предотвратить искажениеизображения. Отпустите зажим на отток пипетки и позволить потока через сосуд в течение 30 минут. Периодически потока должна быть прикреплена на отток трубы, чтобы определить, если судно развивает отдыха тон. Все суда должны быть проверены на утечку давления в этой точке. Утечки будет очевидным путем введения известной давление в сосуде (мы обычно используем 100-120 мм рт.ст.) и зажима отток, после чего приток, линии. Если внутрипросветный давление стабильное, нет заметных утечек. Однако, если давление начинает падать, значительная утечка, и она должна быть закрыта. Утечки либо на приток или отток пипетки обычно можно исправить путем добавления дополнительного цикла связана вокруг судна на пипетку. Кроме того, если судно имеет небольшой филиал сторона, которая позволяет утечки, это поставит под угрозу способность судна содержать давление и эффективно можно ввести дополнительный источник ошибок. Если эта утечка определена, она может быть связана обычно с Wго один цикл 10-0 глазной шва. Кроме того, одна прядь добываемые из 6-0 шва, чтобы галстук цикл также очень эффективна. Если утечки не могут быть идентифицированы или не могут быть эффективно связаны с (например, нет ствола в филиал стороне и просто отверстие в стенке сосуда), это может привести к преждевременному прекращению эксперимента и использование альтернативных судно стало необходимо (это, как правило, идентичны судно в другой ногой - или противоположной стороне в случае необходимости - животных).
Судно должно быть позволено, чтобы уравновесить ни при каких условиях потока в течение как минимум 30 минут. Все эксперименты проводились при каких условиях потока. Как только судно разработан удовлетворительный тонус и отвечающей критериям включения в эксперимент в вопросе, судно готово для последующих исследований.
Эти критерии включения может варьироваться в зависимости от конкретных экспериментальных протоколов и следователя. В нашей лаборатории мы обычно утilize следующее:- Активный тон> 30% (в расчете на ΔD / D макс х 100, где ΔD является увеличение внутреннего диаметра артериол стены из значений в равновесие давления в ответ на воздействие Са 2 + без PSS и D макс максимальное Диаметр измеряется на уравновешивания давления в Ca 2 + без PSS).
- Миогенные активации (содержание, или, предпочтительно, сокращение, диаметр артериол с повышением внутрипросветного давления), а индекс жизнеспособного сосудистой ровным слоем мышц.
- Жизнеспособной эндотелиальной выстилки, о чем свидетельствует оживленная реакция расширитель на ацетилхолин (10 -6 М в ванной).
- Дополнительными критериями включения могут быть добавлены с учетом конкретных экспериментальных протоколов по мере необходимости, в том числе констриктор ответов на адренергические агонисты, такие как фенилэфрин (10 -7 М), расширитель ответы на дополнительные стимулы, такие как аденозин (10 -5 М) или гипоксия (снижение на 0% O 2 в равновесие газа).
- В следующем разделе приводится пример "макет эксперимента". Все необходимые решения готовятся в случае необходимости, с вниманием к ответственности коэффициент разбавления PSS в корпусе камеры. Например, для некоторых из наших оборудования, объем сосуда камеры 20 мл. Таким образом, 20 мкл 10 -2 М маточного раствора приводит к эффективной концентрации 10 -5 М в ванной камеру судна. После удаления судна, катетеризация, равновесия и проверки, как описано выше, эксперимент готовы начать. Специфика таких как рандомизации лечение и эффективность конкретного эксперимента и будет потреблять чрезмерное место для этого усилия. Как таковые, они не включены в деталях.
Начальная ответы контроля определяются. Для примера физиологические стимулы, такие как миогенной активации (индуцированное давлением сужения), intralumenal пр.Essure случайно изменен на необходимый диапазон, и судно допускается соответствующий период времени, чтобы ответить (в данном случае, мы позволим 5-7 минуты периода). Для примера фармакологических стимулов, таких как проблемы с ацетилхолина, препарат добавляется в спину со склада решения в случайном порядке. В этом случае мы, как правило, используют в диапазоне от 10 -9 до 10 -5 M в ванне, с вымывания определяется как восстановление равновесия диаметре. Как ацетилхолин быстро действующего агента, максимальная ответы расширитель может быть легко достигнута всего за несколько секунд. Другие агенты (например, пептиды), может занять гораздо больше времени, чтобы вызвать максимальный ответ, и это очень необходимо учитывать, а также период времени, принятых для эффективного вымывания. Как только контроль ответы были собраны, конкретные меры могут быть наложены на систему, в том числе инкубационного сосуда с рецепторов агонистов / антагонистов, агенты, действующие в определенных ионных каналов, подстрекательствоизмененных внутрипросветного давления, различия в равновесие газов или фармакологических средств, ориентированных на конкретные ферментных систем, чтобы назвать некоторые из наиболее распространенных мер.
После того, как подходящий момент для вмешательства, чтобы быть эффективными (которые должны быть проверены должным образом), последующий раунд сбора данных может быть начат. В зависимости от конкретных экспериментальных протоколов, последующие меры могут быть наложены на судно или первые могут быть удалены (либо смыв - когда это возможно - или простое удаление физиологические проблемы). Когда судно вернулось в свое состояние равновесия (которое должно быть проверено), последующие меры могут применяться по мере необходимости с дополнительными данными, собранными. Эта общая процедура будет продолжаться до окончания эксперимента или пока качество подготовки судна падает ниже заранее определенного порогового критерия (например, реакция на агонист или возможность развить достаточную активную тон). На данном этапе эксперимента либо заключены, либо следователь, возможно, пожелают собрать данные, которые не зависят от реактивности изолированной емкости (например, механика стенки сосуда, который может быть проведен с использованием одинаковой процедуры мышечной активации, просто с судном отсутствует все активные тон 14). - Регулярная очистка все оборудование необходимо для удаления соли накопления и предотвращение роста нежелательных биологических объектов. В конце каждого дня эксперимента, как минимум, все линии и камеры полностью очищается от PSS с большим количеством дистиллированной или деионизированной водой и дать высохнуть полностью. Через каждые 2-3 дней использования, промыть этилового спирта осуществляется также и оборудование позволило полностью высохнуть. В конце каждой недели постоянного использования, все линии и камеры заполнены с 0,1 М соляной кислоты, позволили "инкубировать" в течение 30 минут, а затем промывают водой в полном объеме, как указано выше. Наконец, вконец 2-3 недели непрерывного использования, все секции труб будут заменены на новые и камеры и водохранилища очищаются с 1,0 М HCl следуют обширные промывки дистиллированной / деионизированной воды. Если обесцвечивание труб или визуального создания рост в трубы или любого элемента камеры / резервуары, они либо заменить или тщательно очищать по мере необходимости. При регулярной чистки и общее обслуживание, оборудование может длиться очень долго. На момент написания, наши камеры судна все в своей 8-й или 9-й год повседневного использования, и мы не испытывали значительные трудности с ними.
5. Представитель Результаты

Рисунок 1А. Эта цифра представляет основные настройки станции микрососудов. = Телевидения для просмотра судна; B = цифровой суппорта; C = шприц для толкания superfusate Четух приток пипеткой по мере необходимости; D = гидростатическое колонки для изменения перфузат давление притока; E = микроскопа, F = микрососудов камера, G = superfusate водохранилища; H = датчик давления (несколько можно добавлять по мере необходимости); I = микрососудов камере дренажный насос для superfusate, J = равновесия газовой смеси, бак; K = отходы, содержащиеся (для superfusate), L = циркулирующей воды нагреватель; M = anti-vibration/floating таблице.

Рисунок 1B. Эта цифра представляет собой ближе зрения микрососудов настройки камеры. На этом рисунке, E = микроскопа, F = микрососудов камеры; H = датчик давления (в то время как мы показываем только одно, для простоты, несколько могут быть добавлены в разных местах по мере необходимости); I = микрососудов камере сливной насос; N = трубка прилагается к самого начала перфузат пипетки приток (продолжение с "D" в рис. 1а), O = трубы прикреплены к перфузат пипетки отток.

Рисунок 1С. Эта цифра представляет ближайший зрения камеры микрососудов. На этом рисунке, N = перфузат линии (например, трубы крепятся непосредственно к перфузат пипетки приток), O = трубки крепятся непосредственно к перфузат пипетки отток, р = горизонтальное и вертикальное расположение элементов управления для притока пипетки, Q = superfusate слить на водяной бане (связанный с "Я" на рисунках 1А и 1В), R = приток на водяной бане ближайшие из резервуара (связанный с 'G' в рис. 1а).

Рисунок 2. Эта цифра представляет собой схематическое изображение потоков жидкостей и газов в системе. На этом рисунке = PSS superfusate линии притока; B = PSS перфузат линии приток пипетки, C = PSS superfusate мозгов из ванной в контейнер для отходов; D = PSS перфузат отток от утечки пипетки, E = с подогревом воды на входе в камеру куртку, F = с подогревом воды на выходе из камеры куртку.
Рисунок 3. Эта цифра представляет отдельный галстук петли из офтальмологических шва (если смотреть через рассечение микроскоп с 10х окулярами и 4.5x регулируемый зум, группы), которые используются в нашей подготовки и хранения нескольких петель галстук от 8-0 10-0 и шов на обратной ленту вокруг предметное стекло микроскопа, который хранится в закрытом чашке Петри (чтобы не потерять их, группа Б).
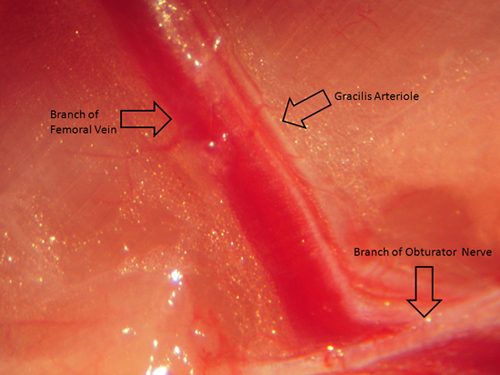
Рисунок 4. Эта цифра представляет собой изображение (если смотреть через стандартный микроскоп рассечения) сопротивления артериол мышц гасШз до хирургической изоляции и удаления для обеспечения надлежащего пространственной ориентации.
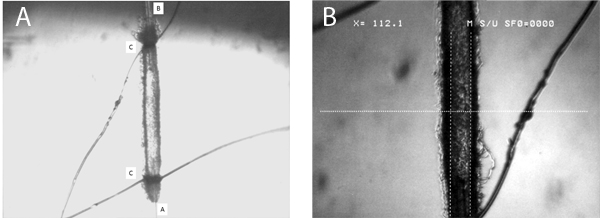
Рисунок 5. Эта цифра представляет собой репрезентативную картину канюлированные микрососудов. Группа показывает всю длину судна, и с притоком (A) и оттоком (B), пипетки, а также галстук петли (C) показано на рисунке. Группа B представляет собой изображение на большом увеличении, ясно продемонстрировав решимость внутренний диаметр артериол с цифровой суппорта (в данном случае диаметр 112 мкм).

Рисунок 6. Эта цифра представляет представитель изображения канюлированные равновесия следующие микрососудов. Верхнее изображение имеет судно под контроль, стимулированных условиях на уравновешивание давления, среднего изображения одного и того же судна после расширения, чтобы бросить вызов с ацетилхолином (10 -6 М в ванной), а нижняя изображение этого судна после constrictioп оспорить с фенилэфрин (10 -7 М в ванной).
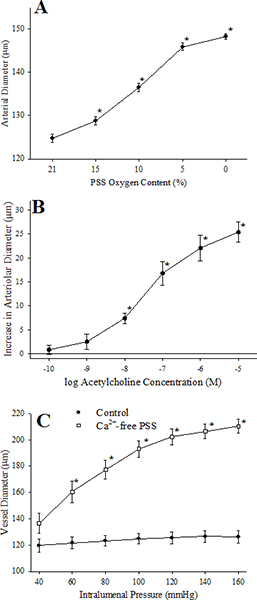
Рисунок 7. Этот показатель обобщает ответы изолированных микрососудов в ответ на вызов с: гипоксия (группы, снижение перфузат и superfusate PO 2 в нашей системе с ~ 135 мм рт.ст. до ~ 40 мм рт.ст.), повышение концентрации ацетилхолина (группа B), изменения в внутрисосудистого давления в контрольных условиях и после инкубации судна с кальцием без PSS (группа С).
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Протокол представлен описывает изоляции, удаление и двойной катетеризации из скелетных мышц сосудистой системы, хотя это общий метод может быть легко применены к большинству тканей. В текущем рукописи, термин "артериол" был использован авторами для описания сопротивления судна ?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа выполнена при финансовой поддержке Американской Ассоциации Сердца (ОВОС 0740129N) и NIH T32 HL90610.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Реактивы и оборудование | Компания | Комментарии / Catalogue # | |
| Судно палаты | Обычай | Дэйв Эйк (MCW) | |
| Подогрев оборотной воды ванны | PolyScience и Haake | Хааке DC 10 | |
| Пипец | Фредерик Haer и Ко | Капиллярные трубки диаметром 2,0 мм х 1,0 мм ID (27-33-1) | |
| Контроля давления | Инструменты Всемирной Precision | ||
| Водяной рубашкой водохранилище | Обычай | ||
| Внешний источник света | Инструменты Всемирной Precision | Novaflex | |
| Внесите Puller | Микроданных инструменты | PMP102 микропипеткой Puller | |
| Полный дополненияМент хирургических инструментов | Изобразительных средств наук | Дюмон | |
| Ultra Fine Пинцет | Изобразительных средств наук | Inox # 5 | |
| Шелковой нити шовного | Ethilon | # 10-0 или 9-0 | |
| Стерео микроскоп | Олимп | Olympus SZ-11 | |
| Аналоговое видео Штангенциркули | Boeckeler | С помощью контроллера (Via-100) | |
| Высокое разрешение аналоговой камеры | Panasonic | GP-MF 602 | |
| Кислородный баллон | Региональный | 21% баланса азота и 5% CO 2, баланс азота | |
| Трубы | Tygon | ||
| Дренажный насос | Коул Parmer машиностроительный завод | ||
| Измененный PSS Крысы | См. рецепт ниже | ||
| Ван Breemen в релаксант PSS | См. рецепт ниже |
Таблица 1. Перечень основных компонентов изолированной установке станции микрососудов представлены на рисунках.
| Измененный Рецепт Крыса PSS | Для того, чтобы два литра PSS | 20X соль бирже (2L) | 20X буферных запасов (2 л) |
| NaCl | 278,0 г | ||
| KCl | 14,0 г | ||
| MgSO 4-7H 2 O | 11,5 г | ||
| CaCl 2-H 2 O | 9,4 г | ||
| NaHCO 3 | 80,8 г | ||
| ЭДТА | 0,4 г | ||
| NaH 2 PO 4 | 0,28 г | ||
| Глюкоза | 1,98 г | ||
| 20x соль со | 100 мл | ||
| 20x буферных запасов | 100 мл | ||
| Дистиллированная вода | 1800 мл |
Таблица 2. Рецепт стандартный физиологический раствор поваренной соли (PSS), используемые в изолированных протоколов микрососудов.
Комментарии к рецепта: Сделайте 2 л соль бирже и 2 л буферных запасов. Они схранить в холодильнике, когда не используется, но избавиться от них хорошо, и часто перед приготовлением PSS. Дополнительные ингредиенты добавляются в момент подготовки окончательного PSS.
| Ван Breemen в релаксант PSS | Для того, чтобы 2 литра PSS | 20X соль бирже (1L) | 20X буферных запасов (1L) |
| NaCl | 107,4 г | ||
| KCl | 7,0 г | ||
| MgSO 4-7H 2 O | 5,76 г | ||
| MgCl 2 6H 2 O | 81,32 г | ||
| NaHCO 3 | 40,4 г | ||
| EDT | 0,2 г | ||
| EGTA | 15,22 | ||
| NaH 2 PO 4 | 0,28 г | ||
| Глюкоза | 1,98 г | ||
| 20x соль со | 100 мл | ||
| 20x буферных запасов | 100 мл | ||
| Дистиллированная вода | 1800 мл |
Таблица 3. Рецепт для расслабляет физиологические Ван Breemen в солевом растворе (PSS), используемые в изолированных протоколов микрососудов в условиях нулевой активный сигнал.
Комментарии к рецепта: Сделайте 1 л соль сом 1 л буферного запаса. Их можно хранить в холодильнике, когда не используется, но избавиться от них хорошо, и часто перед приготовлением PSS. Дополнительные ингредиенты добавляются в момент подготовки окончательного релаксант PSS.
Ссылки
- Goodwill, A. G., Frisbee, S. J., Stapleton, P. A., James, M. E., Frisbee, J. C. Impact of Chronic Anticholesterol Therapy on Development of Microvascular Rarefaction in the Metabolic Syndrome. Microcirculation. , 1-18 (2009).
- Goodwill, A. G., James, M. E., Frisbee, J. C. Increased vascular thromboxane generation impairs dilation of skeletal muscle arterioles of obese Zucker rats with reduced oxygen tension. Am. J. Physiol. Heart Circ. Physiol. 295, H1522-H1528 (2008).
- Samora, J. B., Frisbee, J. C., Boegehold, M. A. Growth-dependent changes in endothelial factors regulating arteriolar tone. Am. J. Physiol. Heart Circ. Physiol. 292, H207-H214 (2007).
- Samora, J. B., Frisbee, J. C., Boegehold, M. A. Hydrogen peroxide emerges as a regulator of tone in skeletal muscle arterioles during juvenile growth. Microcirculation. 15, 151-161 (2008).
- Samora, J. B., Frisbee, J. C., Boegehold, M. A. Increased myogenic responsiveness of skeletal muscle arterioles with juvenile growth. Am. J. Physiol. Heart Circ. Physiol. 294, 2344-2351 (2008).
- Dacey, R. G., Duling, B. R. A study of rat intracerebral arterioles: methods, morphology, and reactivity. Am. J. Physiol. Heart Circ. Physiol. 243, H598-H606 (1982).
- Fredricks, K. T., Liu, Y., Lombard, J. H. Response of extraparenchymal resistance arteries of rat skeletal muscle to reduce PO2. Am. J. Physiol. 267, H706-H715 (1994).
- Durand, M. J., Raffai, G., Weinberg, B. D., Lombard, J. H. Angiotensin-(1-7) and low-dose angiotensin II infusion reverse salt-induced endothelial dysfunction via different mechanisms in rat middle cerebral arteries. Am. J. Physiol. Heart Circ. Physiol. 299, H1024-H1033 (2010).
- LeBlanc, A. J., Cumpston, J. L., Chen, B. T., Frazer, D., Castranova, V., Nurkiewicz, T. R. Nanoparticle inhalation impairs endothelium-dependent vasodilation in subepicardial arterioles. J. Toxicol. Environ. Health A. 72, 1576-1584 (2009).
- Jernigan, N. L., LaMarca, B., Speed, J., Galmiche, L., Granger, J. P., Drummond, H. A. Dietary salt enhances benzamil-sensitive component of myogenic constriction in mesenteric arteries. Am. J. Physiol. Heart Circ. Physiol. 294, H409-H420 (2008).
- Stapleton, P. A., Goodwill, A. G., James, M. E., Frisbee, J. C. Altered mechanisms of endothelium-dependent dilation in skeletal muscle arterioles with genetic hypercholesterolemia. Am. J. Physiol. Regul. Integr. Comp. Physiol. 293, R1110-R1119 (2007).
- Goodwill, A. G., Stapleton, P. A., James, M. E., d'Audiffret, A. C., Frisbee, J. C. Increased arachidonic acid-induced thromboxane generation impairs skeletal muscle arteriolar dilation with genetic dyslipidemia. Microcirculation. 15, 621-631 (2008).
- Baumbach, G. L., Hadju, M. A. Mechanics and composition of cerebral arterioles in renal and spontaneously hypertensive rats. Hypertension. 21, 816-826 (1993).
- Uchida, E., Bohr, D. F., Hoobler, S. W. A method for studying isolated resistance vessel from rabbit mesentery and brain and their responses to drugs. Circ. Res. 4, 525-536 (1967).
- Davis, M. J., Kuo, L., Chilian, W. M., Muller, J. M. I. solated Chapter 23. Isolated, perfused microvessels. In: Clinically Applied Microcirculation Research. Barker, J. H., Anderson, G. L., Menger, M. D. 32, CRC Press, Inc. 435-456 (1995).
- Lombard, J. H., Liu, Y., Fredricks, K. T., Bizub, D. M., Roman, R. J., Rusch, N. J. Electrical and mechanical responses of rat middle cerebral arterieal to reduced PO2 and prostacyclin. Am. J. Physiol. 276, H509-H516 (1994).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены