É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
O Ex vivo Preparação microvasos isolada esquelético de Investigação da reatividade vascular
Neste Artigo
Resumo
Um Ex vivo é descrita para o isolamento das maiores grácil arteríolas musculares de resistência para interrogatório de ambas as respostas vasculares aos estímulos vasoativos e na avaliação de propriedades estruturais básicas via mecânica da parede passivos.
Resumo
A preparação de microvasos isolado é uma preparação ex vivo que permite a análise das diferentes contribuições de factores que o diâmetro dos vasos de controlo, e assim, a resistência de perfusão 1-5. Esta é uma preparação clássica experimental que foi, em grande medida, inicialmente descrita por Uchida et al. De 15 há várias décadas. Esta descrição inicial serviu de base para as técnicas que foi amplamente modificado e melhorado, principalmente no laboratório do Dr. Brian Duling da Universidade de Virginia 6-8, e nós apresentamos uma abordagem atual nas páginas seguintes. Esta preparação irá referir-se especificamente à arteríola gracilis num rato como o microvasos de escolha, mas a preparação de base pode facilmente ser aplicado aos recipientes isolados a partir de quase qualquer outro tecido ou órgão em várias espécies 9-13. Mecânico (ie, dimensional) alterações no microvasos isolado pode ser facilmente avaliadaem resposta a uma ampla gama de fisiológico embora ex (por exemplo, pressão, hipóxia intravascular, ou cisalhamento) ou desafios farmacológicos, e pode fornecer uma visão em elementos mecanicistas compreendendo respostas integrados em um intacto, in vivo de tecidos,. O significado deste método é que ele permite uma manipulação fácil das influências sobre a regulação integrado de diâmetro microvascular, enquanto também permite que para o controlo de muitas das contribuições a partir de outras fontes, incluindo a pressão intravascular (miogênica), inervação autonômica, hemodinâmica ( por exemplo, estresse, cisalhamento), disfunção endotelial, estímulos dependentes ou independentes, hormonais e influências parenquimatosas, para fornecer uma lista parcial. Sob condições experimentais adequadas e com metas apropriadas, este pode servir como uma vantagem sobre in vivo ou in situ de tecidos de órgãos / preparações, que não permitem prontamente para o controlo fácil do mais amplos variáveis sistémicas.
A malimitação jor desta preparação é essencialmente a conseqüência de suas forças. Por definição, o comportamento destes navios está sendo estudada sob condições em que muitos dos contribuintes mais significativos para a regulação da resistência vascular tenham sido removidos, incluindo neural, humoral, metabólicas, etc Como tal, o investigador deve ser advertido para evitar o excesso de interpretação e extrapolação dos dados que são coletados utilizando esta preparação. A outra área significativa de preocupação em relação a esta preparação é que ele pode ser muito fácil de danificar os componentes celulares, tais como o revestimento endotelial ou o músculo liso vascular, tal fonte que variável de erro pode ser introduzido. É fortemente recomendada que o investigador indivíduo utilizar medições adequadas para assegurar a qualidade da preparação, tanto no início da experiência e periodicamente durante todo o curso de um protocolo.
Protocolo
1. Antes da experiência
- Antes da experiência dias, os tubos capilares de vidro de dimensões apropriadas para a estação são puxados para micropipetas (quer seja um puxador horizontal ou vertical pode ser utilizado). O diâmetro da ponta pode ser facilmente ajustado dependendo do navio a ser isolado, embora geralmente usamos uma gama de diâmetros entre 50-150 uM. Estes são então dobrados para a configuração apropriada para o aquecimento de microvasos estação seguinte sobre uma chama de butano. Dicas micropipeta são fisicamente quebrado com o diâmetro aproximado (com pinça fina) para o microvascular em questão e pode chão ou polido para as conformações apropriadas, como necessárias para a aplicação específica. Para uma extensa revisão e pendentes sobre estes procedimentos, o leitor é direcionado para Davis et al. 16. Dois micropipetas são então colocados em oposição nos suportes de pipeta para a câmara de microvasos. Estes devem ser orientadas de tal modo que as pontasestão no mesmo plano vertical e horizontal dentro da câmara de recipiente.
A câmara de microvasos utilizado neste manuscrito (Figuras 1 e 2) é aquele que é construído sob encomenda pelo Sr. David Eick no Departamento de Fisiologia da Faculdade de Medicina de Wisconsin ( http://www.phys.mcw.edu/ e www . eicktech.com ). No entanto, várias outras configurações de câmara de microvasos estão prontamente disponíveis comercialmente, com aqueles desenvolvidos pelo Living Instrumentation Systems ( http://www.livingsys.com/ ) e IonOptix ( http://www.ionoptix.com/ ), sendo muito comum. Utilizando estes sistemas de outros, pode ser imperativo para utilizar um microscópio invertido, em vez de um convencional na posição vertical, embora esta seja dependente da experiência específica e os requisitos de equipamentos. O uso de microscópios invertidos seria preferível para protocolo experimentalols que requerem imagem fluorescente ou confocal. - Prepare uma solução salina fisiológica (PSS; descrito abaixo) e garantir pH é ajustado a níveis adequados para as condições específicas experimentais (7,38-7,42 é típico e cai dentro da faixa fisiológica). A solução PSS podem ser preparados de antemão e refrigerado, mas deve ser verificada à temperatura apropriada para o pH antes da utilização. PSS pode conter albumina se o experimentador ou protocolos específicos requer que, embora isto não é universalmente obrigatório.
- Os estribos de vídeo digital utilizados para medir o diâmetro do vaso deve ser calibrado usando um hemocitômetro ou micrômetro estágio do microscópio. Para a calibração precisa, é vital que o micrómetro ser colocado no mesmo plano que as micropipetas de influxo / saída da câmara de recipiente.
- Lacetes laço para prender o microvascular para as pipetas devem ser preparados e ser facilmente acessíveis para uso subsequente. Estes podem ser prontamente preparados a partir de 8-0 ou menor oftálmica suture. O loop laço único pode ser preparado antecipadamente e guardado numa placa de Petri coberta com uma pequena tira de fita reversa em torno de uma lâmina de microscópio até ser necessário (isto irá impedir que sejam perdidos). (Figura 3).
2. Dia do Experimento
- Todos os equipamentos de apoio deve ser ligado e verificado para o bom funcionamento. Isto inclui a tabela anti-vibration/floating eo banho de água circulante aquecida (ajustado para fornecer a temperatura apropriada no banho de navio - vulgarmente 37 ° C), todos os transdutores de pressão e da embarcação câmara de bomba de drenagem (Figura 1A e 1B). Ligue os gases de equilíbrio na câmara de recipiente e no perfusato e reservatórios superfusate.
- Encher todos os reservatórios, tubos, e as câmaras com a solução de PSS. A linha que conduz ao perfusato pipeta influxo deve ser completamente cheio para evitar a presença de bolhas de ar nesta linha que poderia desalojar e danificar o vaendotélio scular (Figura 1C). Se necessário, use uma seringa para empurrar cuidadosamente o PSS todo o caminho através da pipeta para garantir que ele está completamente cheio e sem qualquer bloqueio que possa impedir o fluxo de perfusato. A pressão de influxo deve ser mantida dentro de limites razoáveis, para evitar danificar os transdutores de pressão.
3. A colheita de microvasos
- Após anestesia do animal a partir do qual o microvascular é para ser tomado, o navio em questão devem ser isolados de acordo com os procedimentos que são mais apropriados para a vasculatura a ser estudado. Em alguns casos, isto pode exigir a remoção do próprio órgão (eg, microvasos cerebral ou coronária), enquanto que em outros, os vasos podem ser removidos directamente a partir do animal anestesiado (por exemplo, músculo). Um exemplo da orientação do navio dentro do músculo é apresentado na Figura 4. Estimar o comprimento da embarcação in vivo antes da remoção com, porceps ou pinças pequenas. Antes da remoção da embarcação do animal / órgão, ele pode ser muito útil para executar uma verificação final para ter certeza de que a câmara de navio está pronto e funcionando corretamente (incluindo todos os circuitos de laço no lugar).
- Remover o navio a partir do animal / órgão de preensão do lado exterior da embarcação a uma extremidade com fórceps finos e de corte ao longo do comprimento do navio até que esteja livre, tendo o cuidado extremo para evitar qualquer puxando ou puxando a bordo do navio. Uma vez libertados, imediatamente colocá-lo em um tubo de centrífuga de 1,7 mL cheio de PSS, mas não deixe de ir ao vaso. Isto é para lembrar a orientação, tal direcção que perfusato no banho será idêntico ao sentido do fluxo sanguíneo no animal.
4. Canulação do navio
- Coloque o recipiente no banho cheio e canular a extremidade proximal sobre a pipeta influxo. Isto pode ser melhor realizado com uma taxa de perfusão modesto através da cânula (~ pressão 50 mmHg) eum par de fórceps finos usado para segurar cada lado da embarcação proximal do lúmen da parede (isto é, um par de pinças em cada mão). Em nosso laboratório, utilize uma pinça fina de Ferramentas Ciência Belas ( http://www.finescience.com/Home.aspx ), embora qualquer fórceps adequadamente construídos irá funcionar eficazmente. Deslizamento da embarcação nas pontas cânula e avançar o recipiente na ponta para o ponto onde dois laços laço pode proteger o navio.
- Elevar a pressão de entrada para ~ 75 mmHg para continuar a inflar o navio e facilitar a canulação na ponta da pipeta distai. Fluxo através do vaso deve ser visto como uma distorção no reservatório superfusate na saída distai do vaso (sob o microscópio). Canular a extremidade distal do navio na pipeta de saída e fixe-a com duas voltas do laço (estes circuitos finais devem estar no local antes da canulação; Figura 5).
- Ajuste da cânula até nas coordenadas XYZ como needed, até que haja uma distorção mínima no navio, eo vaso de aproxima da de comprimento in vivo. Elevar a pressão de entrada, até que se aproxima a percentagem da pressão arterial média normalmente experimentado por esse segmento do vaso (nosso laboratório utiliza 80% da pressão arterial média para as arteríolas grande resistência do músculo gracilis 8).
- Colocar uma pedra borbulhamento pequena entregando a mistura de gás apropriado em banho eo envoltório lugar de plástico ou de uma tampa de vidro ao longo da câmara para evitar salpicos a lente microscópio. Usamos uma pedra de borbulhamento, que é geralmente disponível em todos os animais de estimação / lojas do aquário e cerca de 1 cm de diâmetro, embora um tamanho menor irá funcionar eficazmente como bem. A presença da pedra borbulhamento assegura a disponibilidade de gás adequado para o vaso em todos os momentos e vai estender viabilidade do vaso. Esta pedra é removida durante todos os períodos de medição (ou fluxo de ar através da pedra interrompida temporariamente) para evitar distorções daimagem. Libertar o grampo sobre a pipeta de saída e permitir o fluxo através do vaso durante 30 minutos. Periodicamente, o fluxo deve ser fixada no tubo de saída para determinar se o navio está a desenvolver tom de repouso. Todos os navios devem ser verificados se há vazamentos de pressão neste momento. Fugas será evidente através da introdução de uma pressão conhecida para dentro do vaso (geralmente usamos 100-120 mmHg) e de aperto o fluxo de saída, seguido pelo influxo, linhas. Se a pressão intraluminal é estável, não há fugas discerníveis. No entanto, se a pressão começa a cair, uma fuga significativa está presente e deve ser fechado. Vazamentos em qualquer entrada ou pipetas de escoamento pode normalmente ser corrigida pela adição de um loop adicional amarrado ao redor da embarcação na pipeta. Alternativamente, se o navio tem um ramo lateral pequeno que está permitindo o vazamento, isso irá comprometer a capacidade do vaso para conter pressão de forma eficaz e pode introduzir uma fonte adicional de erro. Se esse vazamento é identificado, ele pode normalmente ser amarrado wum loop om único de sutura 10-0 oftálmica. Alternativamente, um único fio de sutura 6-0 arreliado para fazer o laço laço é também altamente eficaz. Se o vazamento não pode ser identificado ou não pode ser eficazmente amarrado (por exemplo, não há tronco para o ramo lateral e simplesmente um buraco na parede do vaso), isto pode resultar em uma terminação prematura da experiência e utilização de um navio alternativo tornar-se necessário (isto é, geralmente, o navio idêntica na outra perna - ou lado contralateral, se necessário - do animal).
O vaso deve ser deixada equilibrar sob quaisquer condições de fluxo para um mínimo de 30 minutos. Todos os experimentos são conduzidos na ausência de condições de fluxo. Uma vez que o navio tem desenvolvido tom satisfatório e é responsivo aos critérios de inclusão para o experimento em questão, o navio está pronto para estudo posterior.
Estes critérios de inclusão pode variar dependendo do protocolo experimental específico e investigador. Em nosso laboratório, nós rotineiramente utilize o seguinte:- Tom activa de> 30% (calculado como x max ΔD / D 100, onde ΔD é o aumento no diâmetro da parede interior arteriolar a partir dos valores sob a pressão de equilíbrio em resposta à exposição ao Ca2 + livre de PSS e max D é o máximo diâmetro medido à pressão de equilíbrio nas 2 Ca +-livres PSS).
- Activação Miogênica (manutenção de, ou de preferência uma redução, o diâmetro arteriolar com a pressão intraluminal aumentada) como um índice de uma camada de músculo liso vascular viável.
- Um forro viável endotelial, como evidenciado por uma resposta rápida a acetilcolina dilatador (10 M -6 no banho).
- Critérios de inclusão adicionais podem ser adicionados para se adequar ao protocolo experimental específico, conforme necessário, incluindo respostas constritores aos agonistas adrenérgicos como a fenilefrina (10 -7 M), as respostas a estímulos dilatadores adicionais, tais como a adenosina (10 -5 M) ou hipóxia (redução em 0% O 2 no gás de equilibração).
- A seção seguinte é um exemplo de um "experimento simulado". Todas as soluções necessárias são preparadas conforme o caso, com especial atenção para explicar o fator de diluição dos PSS na câmara de navio. Como um exemplo, para alguns dos nossos equipamentos, o volume da câmara de recipiente é de 20 ml. Como ul, tais 20 de um 10 -2 m resultados solução de reserva em uma concentração eficaz de 10 M -5 no banho de câmara de recipiente. Após remoção navio, a canulação de equilibração, e validação como descrito acima, a experiência está pronta para iniciar. Especificidades, como randomização e efetividade do tratamento são específicos e experiência iria consumir espaço excessivo para este esforço. Como tal, estes não são incluídos em detalhe.
Respostas de controlo iniciais são determinadas. Por exemplo, um estímulo fisiológico, como a ativação miogênica (pressão induzida-constrição), intralumenal prEssure é aleatoriamente alterações ao longo da gama desejada, eo vaso é permitido um período adequado de tempo para responder (neste caso, que permitiria que um período de 5-7 minutos). Para um estímulo exemplo farmacológico como o desafio com a acetilcolina, o fármaco é adicionado à volta de soluções de reserva em uma ordem aleatória. Neste caso, seria normalmente usa um intervalo de 10 a 10 M -9 -5 no banho, com lavagem a ser definida como uma restauro de diâmetro de equilíbrio. Como acetilcolina é um agente de acção rápida, as respostas máximas dilatadores pode ser prontamente conseguida em apenas alguns segundos. Outros agentes (tais como péptidos) podem levar muito mais tempo para eliciar uma resposta máxima e isto muito ser tidas em conta, bem como o período de tempo necessário para lavagem eficaz. Uma vez que as respostas de controle foram coletados, intervenções específicas pode ser imposta ao sistema, incluindo a incubação do navio com agonistas / antagonistas de receptores, agentes que atuam em canais iônicos específicos, instigação depressão intraluminal alteradas, as diferenças de gases de equilíbrio ou agentes farmacológicos específicos destinados aos sistemas enzimáticos, para citar algumas das intervenções mais comuns.
Depois de um tempo adequado para a intervenção seja eficaz (que deve ser testado apropriadamente), uma rodada subseqüente de coleta de dados pode ser iniciado. Dependendo do protocolo experimental específico, as intervenções posteriores pode ser imposta sobre a embarcação ou o primeiro pode ser removido (ou pelo washout - remoção ou simples do desafio fisiológico - quando possível). Uma vez que o navio voltou ao seu estado de equilíbrio (que deve ser verificada), as intervenções subsequentes pode ser aplicado conforme necessário com os dados adicionais recolhidos. Este procedimento geral seria mantido até que o fim da experiência ou até que a qualidade da preparação vaso cai abaixo do limiar critérios previamente determinada (por exemplo, resposta a um agonista ou a capacidade de desenvolver tom activo suficiente). Neste ponto, a experiência ou é concluído, ou o investigador pode desejar recolha de dados que é independente da reactividade do navio isolado (tais como mecânica da parede do vaso, que podem ser realizados utilizando o procedimento idêntico de activação miogênica, apenas com um vaso falta todos tom activa 14). - A limpeza regular de todo o equipamento é essencial para a remoção de acumulação de sal e para a prevenção do crescimento de quaisquer entidades indesejados biológicos. No final de cada experiência dia, no mínimo, todas as linhas e as câmaras são completamente lavada de PSS com quantidades copiosas de água destilada ou desionizada e deixadas a secar completamente. Depois de a cada 2-3 dias de uso, uma lavagem com álcool etílico é realizada também eo equipamento é deixada a secar completamente. No final de cada semana de uso consistente, todas as linhas e as câmaras são preenchidos com 0,1 M de ácido clorídrico, deixou-se 'incubar' durante 30 minutos e, em seguida, lavou-se completamente com água, como acima. Finalmente, nofinal de 2-3 semanas de uso consecutivo, todas as secções de tubo são substituídos com o novo e da câmara, e reservatórios são limpos com 1,0 M de HCl seguido por uma extensa lavagem com água destilada / desionizada água. Se qualquer descoloração de estabelecimento tubagem ou visual de um crescimento na tubagem ou qualquer outro elemento da câmara / reservatórios, estes são substituídos ou completamente limpas, conforme apropriado. Com a limpeza regular e manutenção geral, o equipamento pode durar um tempo muito longo. No momento da escrita, câmaras nossos vasos estão todos em seu 8 º ou 9 º ano de uso rotineiro e temos experimentado nenhuma dificuldade significativa com eles.
5. Os resultados representativos

Figura 1A. Esta figura apresenta a configuração da estação de base de microvasos. A televisão = navio para ver, b = paquímetro digital; C = seringa para empurrar superfusate through pipeta influxo conforme necessário; D = coluna hidrostática para mudar a pressão de influxo perfusato; E = microscópio; F = microvasos câmara; G = superfusate reservatório; H = monitor de pressão (múltipla podem ser adicionados se necessário); I = microvasos câmara de bomba de drenagem para superfusate; J = equilíbrio tanque de mistura gasosa; K = dos resíduos (por superfusate); L = aquecedor de água circulante; M = anti-vibration/floating tabela.

Figura 1B. Esta figura apresenta uma visão mais próxima da instalação de câmara de microvasos. Nesta figura, E = microscópio; F = microvasos câmara; H monitor de pressão = (enquanto que mostram apenas um de simplicidade, múltiplo pode ser adicionado a diferentes locais, se necessário); I = microvasos câmara de bomba de drenagem, N = tubagem ligado à começo da pipeta influxo perfusato (uma continuação de 'D' na Figura 1A); O tubo = ligado à saída de pipeta perfusato.

A Figura 1C. Esta figura apresenta a mais próxima da câmara de vista microvascular. Nesta figura, N = a linha de perfusato (isto é, a tubagem ligada directamente à pipeta influxo perfusato); O = tubagem ligada directamente à saída do perfusato pipeta, P = os controles de localização horizontais e verticais para a pipeta influxo; Q = superfusate o drenar para o banho de água (ligado a 'I' nas Figuras 1A e 1B); R = influxo o para o banho de água proveniente do reservatório (ligado a 'G' na Figura 1A).

Figura 2. Esta figura apresenta uma representação esquemática do fluxo de fluidos e gases no sistema. Nesta figura, A = PSS entrada linha superfusate; B = PSS linha perfusato a entrada da pipeta; C = PSS dreno superfusate de banho para contentor de resíduos; D = PSS saída perfusato da pipeta de saída; E = entrada de água aquecida em jaqueta de câmara; F = saída de água aquecida do casaco câmara.
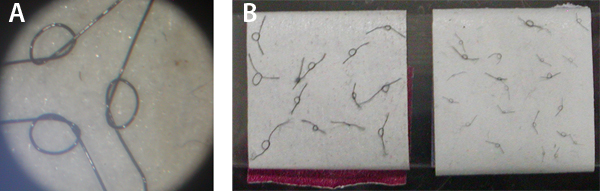
. 3 Figura Esta figura apresenta laço indivíduo circula feita a partir de sutura oftálmica (visto através de um microscópio de dissecação com oculares 10x e uma ampliação de zoom 4.5x ajustável; Painel A), que são utilizados na nossa preparação e armazenamento de lacetes tie múltiplas 8-0 e 10-0 sutura em fita invertida em torno de um lâmina de microscópio, que é armazenado numa placa de Petri coberta (para evitar a perda deles; Painel B).
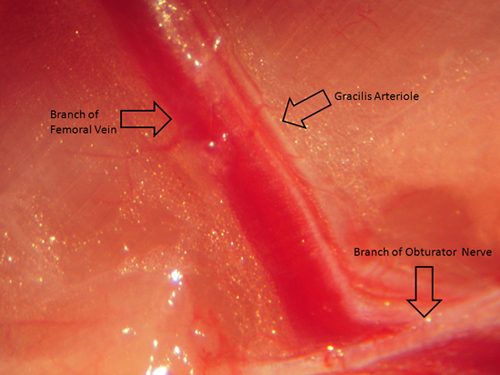
4 Figura. Esta figura fornece uma imagem (visto através de um microscópio de dissecação padrão) da arteríola resistência muscular gracilis antes do isolamento cirúrgico e remoção para permitir a orientação espacial correcta.
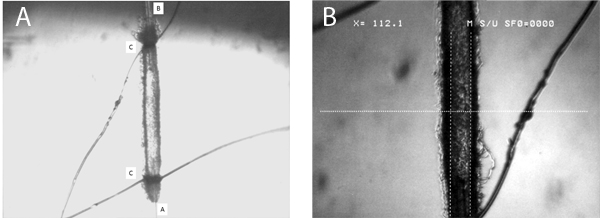
Figura 5. Esta figura fornece uma imagem representativa de um microvasos canulado. O painel A mostra a todo o comprimento do navio, com ambos influxo (A) e de saída (B), bem como pipetas loops de amarrar (C) mostrada. O painel B apresenta uma imagem com uma ampliação elevada, mostrando claramente a determinação do diâmetro arteriolar interior com as pinças digitais (neste caso, o diâmetro é de 112 mm).

Figura 6. Esta figura apresenta imagens representativas de uma equilibração canulado de microvasos a seguir. A imagem de topo é de um vaso sob controlo, não estimulada condições para a pressão de equilíbrio, a imagem do meio é do mesmo vaso após a dilatação do desafio com acetilcolina (10 M -6 no banho), ea imagem de fundo é de que navio, após constriction para desafiar com fenilefrina (10 M -7 no banho).
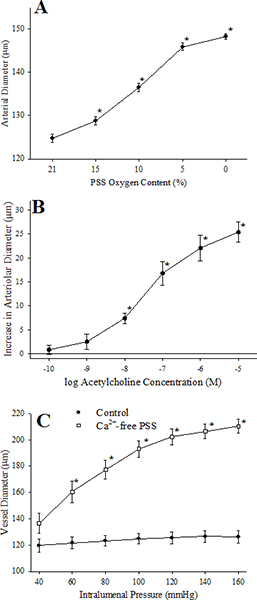
. Figura 7 Esta figura resume as respostas de um isolado de microvasos em resposta ao desafio com: hipoxia (Painel A, uma redução no perfusato e PO superfusate 2 no nosso sistema de ~ 135 mmHg para ~ 40 mmHg) do painel, concentrações crescentes de acetilcolina ( B), as mudanças na pressão intravascular, sob condições de controlo e de incubação seguinte do vaso com um PSS sem cálcio (Painel C).
Access restricted. Please log in or start a trial to view this content.
Discussão
O protocolo apresentado descreve a canulação remoção de isolamento, e uma dupla de microvasos músculo esquelético, embora esta técnica geral, pode ser facilmente aplicada a maior parte dos tecidos. Para o manuscrito atual, o termo "arteríola" tem sido usado pelos autores para descrever um navio resistência variando entre 70-120 m de diâmetro em tom de descanso ativo, que é também um contributo importante para a regulação da resistência de perfusão de um órgão ou de tecido.
Access restricted. Please log in or start a trial to view this content.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi financiado pela American Heart Association (EIA 0740129N) e T32 NIH HL90610.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagentes e Equipamentos | Companhia | Comentários / Catálogo # | |
| Câmara navio | Personalizado | Dave Eick (MCW) | |
| Banho de água aquecida circulação | PolyScience e Haake | Haake DC 10 | |
| Pipetas | Frederick Haer & Co. | Tubulação capilar 2,0 milímetros OD x 1,0 mm ID (27-33-1) | |
| Monitor de Pressão | Instrumentos de precisão do mundo | ||
| Reservatório de Água Jacketed | Personalizado | ||
| Fonte de luz externa | Instrumentos de precisão do mundo | Novaflex | |
| Extrator pipeta | Microdados Instruments | PMP102 micropipeta Puller | |
| Comple completomento de instrumentos cirúrgicos | Belas Ferramentas Ciência | Dumont | |
| Ultra pinça fina | Belas Ferramentas Ciência | Inox # 5 | |
| Fio de sutura de seda | Ethilon | # 10-0 ou 9-0 | |
| Microscópio estéreo | Olimpo | Olympus SZ-11 | |
| Analógicas Calipers Vídeo | Boeckeler | Via Controller (Via-100) | |
| Câmera de alta resolução analógica | Panasonic | GP-MF 602 | |
| Tanque de oxigênio | Regional | Balanço de nitrogênio de 21% e 5% CO 2 balanço de nitrogênio | |
| Tubulação | Tygon | ||
| Escorra bomba | Cole Parmer Instrument Co. | ||
| Modificados PSS Rato | Ver receita abaixo | ||
| PSS relaxante Van Breemen de | Ver receita abaixo |
Tabela 1. Uma lista dos componentes principais de configuração isolado de microvasos estação apresentados nas Figuras.
| Receita PSS Modificado Rato | Para fazer dois litros de PSS | 20X estoque Salt (2L) | 20X depósito (2L) |
| NaCl | 278,0 g | ||
| KCl | 14,0 g | ||
| MgSO4-7H 2 ó | 11,5 g | ||
| CaCl2-H2O | 9,4 g | ||
| de NaHCO3 | 80,8 g | ||
| EDTA | 0,4 g | ||
| NaH 2 PO 4 | 0,28 g | ||
| Glicose | 1,98 g | ||
| 20x estoque Sal | 100 mL | ||
| 20x depósito | 100 mL | ||
| Água destilada | 1800 mL |
Tabela 2. Receita para solução de sal de padrão fisiológico (PSS) utilizado nos protocolos microvascular tumoral isolados.
Comentários sobre Receita: Faça 2 L de Banco de sal e 2 L de depósito. Estes cum ser refrigerado quando não estiverem sendo usados, mas agitá-los bem e, muitas vezes antes de preparar PSS. Os ingredientes adicionais são adicionados no momento da preparação de PSS finais.
| PSS relaxante Van Breemen de | Para fazer 2 litros de PSS | 20X estoque Salt (1L) | 20X depósito (1L) |
| NaCl | 107,4 g | ||
| KCl | 7,0 g | ||
| MgSO4-7H 2 ó | 5,76 g | ||
| MgCl 2-6H 2 ó | 81,32 g | ||
| De NaHCO3 | 40,4 g | ||
| EDTA | 0,2 g | ||
| EGTA | 15,22 | ||
| NaH 2 PO 4 | 0,28 g | ||
| Glicose | 1,98 g | ||
| 20x estoque Sal | 100 mL | ||
| 20x depósito | 100 mL | ||
| Água destilada | 1800 mL |
Tabela 3. Receita para solução Van Breemen do sal relaxante fisiológica (PSS) utilizado nos protocolos microvascular tumoral isolados sob condições de tom activa zero.
Comentários sobre Receita: Faça 1 L de Banco de sal pornd L 1 de depósito. Estes podem ser refrigerado quando não estiverem sendo usados, mas agitá-los bem e, muitas vezes antes de preparar PSS. Os ingredientes adicionais são adicionados no momento da preparação de finais PSS relaxantes.
Referências
- Goodwill, A. G., Frisbee, S. J., Stapleton, P. A., James, M. E., Frisbee, J. C. Impact of Chronic Anticholesterol Therapy on Development of Microvascular Rarefaction in the Metabolic Syndrome. Microcirculation. , 1-18 (2009).
- Goodwill, A. G., James, M. E., Frisbee, J. C. Increased vascular thromboxane generation impairs dilation of skeletal muscle arterioles of obese Zucker rats with reduced oxygen tension. Am. J. Physiol. Heart Circ. Physiol. 295, H1522-H1528 (2008).
- Samora, J. B., Frisbee, J. C., Boegehold, M. A. Growth-dependent changes in endothelial factors regulating arteriolar tone. Am. J. Physiol. Heart Circ. Physiol. 292, H207-H214 (2007).
- Samora, J. B., Frisbee, J. C., Boegehold, M. A. Hydrogen peroxide emerges as a regulator of tone in skeletal muscle arterioles during juvenile growth. Microcirculation. 15, 151-161 (2008).
- Samora, J. B., Frisbee, J. C., Boegehold, M. A. Increased myogenic responsiveness of skeletal muscle arterioles with juvenile growth. Am. J. Physiol. Heart Circ. Physiol. 294, 2344-2351 (2008).
- Dacey, R. G., Duling, B. R. A study of rat intracerebral arterioles: methods, morphology, and reactivity. Am. J. Physiol. Heart Circ. Physiol. 243, H598-H606 (1982).
- Fredricks, K. T., Liu, Y., Lombard, J. H. Response of extraparenchymal resistance arteries of rat skeletal muscle to reduce PO2. Am. J. Physiol. 267, H706-H715 (1994).
- Durand, M. J., Raffai, G., Weinberg, B. D., Lombard, J. H. Angiotensin-(1-7) and low-dose angiotensin II infusion reverse salt-induced endothelial dysfunction via different mechanisms in rat middle cerebral arteries. Am. J. Physiol. Heart Circ. Physiol. 299, H1024-H1033 (2010).
- LeBlanc, A. J., Cumpston, J. L., Chen, B. T., Frazer, D., Castranova, V., Nurkiewicz, T. R. Nanoparticle inhalation impairs endothelium-dependent vasodilation in subepicardial arterioles. J. Toxicol. Environ. Health A. 72, 1576-1584 (2009).
- Jernigan, N. L., LaMarca, B., Speed, J., Galmiche, L., Granger, J. P., Drummond, H. A. Dietary salt enhances benzamil-sensitive component of myogenic constriction in mesenteric arteries. Am. J. Physiol. Heart Circ. Physiol. 294, H409-H420 (2008).
- Stapleton, P. A., Goodwill, A. G., James, M. E., Frisbee, J. C. Altered mechanisms of endothelium-dependent dilation in skeletal muscle arterioles with genetic hypercholesterolemia. Am. J. Physiol. Regul. Integr. Comp. Physiol. 293, R1110-R1119 (2007).
- Goodwill, A. G., Stapleton, P. A., James, M. E., d'Audiffret, A. C., Frisbee, J. C. Increased arachidonic acid-induced thromboxane generation impairs skeletal muscle arteriolar dilation with genetic dyslipidemia. Microcirculation. 15, 621-631 (2008).
- Baumbach, G. L., Hadju, M. A. Mechanics and composition of cerebral arterioles in renal and spontaneously hypertensive rats. Hypertension. 21, 816-826 (1993).
- Uchida, E., Bohr, D. F., Hoobler, S. W. A method for studying isolated resistance vessel from rabbit mesentery and brain and their responses to drugs. Circ. Res. 4, 525-536 (1967).
- Davis, M. J., Kuo, L., Chilian, W. M., Muller, J. M. I. solated Chapter 23. Isolated, perfused microvessels. In: Clinically Applied Microcirculation Research. Barker, J. H., Anderson, G. L., Menger, M. D. 32, CRC Press, Inc. 435-456 (1995).
- Lombard, J. H., Liu, Y., Fredricks, K. T., Bizub, D. M., Roman, R. J., Rusch, N. J. Electrical and mechanical responses of rat middle cerebral arterieal to reduced PO2 and prostacyclin. Am. J. Physiol. 276, H509-H516 (1994).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados