Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Aislamiento de células basales y de células submucosas conducto de la glándula de ratón tráquea
En este artículo
Resumen
Aquí demostramos nuestro protocolo de aislamiento de las células de los conductos glandulares basales y submucosa de tráqueas de ratón. También se demuestra el método de la inyección de células madre en la alfombrilla del ratón grasa dorsal para crear un In vivo Modelo de regeneración glándula submucosa.
Resumen
Las vías respiratorias están directamente en contacto con el medio ambiente y por lo tanto susceptibles a las lesiones de las toxinas y agentes infecciosos que se respira en 1. Las vías respiratorias grande por lo que requieren un mecanismo de reparación eficaz para proteger a nuestros cuerpos. Este proceso de reparación se produce a partir de células madre en las vías respiratorias y el aislamiento de estas células madre de las vías respiratorias es importante para la comprensión de los mecanismos de reparación y regeneración. También es importante para la comprensión de reparación anormal que puede conducir a enfermedades de las vías 2. El objetivo de este método consiste en aislar una población de células madre de ratón novela de los conductos de las glándulas submucosas traqueales y para colocar estas células in vitro y en modelos de sistemas in vivo para identificar los mecanismos de reparación y regeneración de las glándulas submucosas 3. Esta producción muestra métodos que pueden ser utilizados para aislar y ensayo de las células madre del conducto y basal de la gran vías respiratorias 3. Esto nos permitirápara estudiar las enfermedades de las vías respiratorias, tales como la fibrosis quística, el asma y la enfermedad pulmonar obstructiva crónica. En la actualidad, no existen métodos para el aislamiento de células de las glándulas submucosas y conductos no hay modelos in vivo para estudiar la regeneración de las glándulas submucosas.
Protocolo
Esquema de los pasos
1. La disección de la tráquea
2. Limpieza de la tráquea y se corta
3. Enzima digestión y el tratamiento en suspensión de células individuales
4. La tinción de FACS y clasificación
5. Procesamiento de células clasificadas para in vivo e in vitro modelos
1. La disección de la tráquea
- Sacrificar al ratón con una inyección intraperitoneal de 0,1 cc mg/0.2 de pentobarbital.
- Cortar abrir la pared abdominal, y mover los intestinos al lateral para exponer la aorta abdominal y luego disecado.
- Abrir el pecho por el corte a través del diafragma y de la pared torácica anterior en ambos lados para exponer el corazón y los pulmones. Continuar el corte en el cuello de la eliminación de las glándulas salivales y la grasa para exponer la tráquea.
- Retire el timo y cortar el pulmón de sus conexiones por debajo y por detrás. Separcomió la tráquea del esófago mediante la inserción de una pinza entre ellos luego se corta la tráquea en su parte más superior, por encima de su conexión con la laringe. A continuación, mantenga la tráquea con fórceps y disecado de su unión y continuar hacia abajo para quitarla con el corazón y los pulmones en bloque. Recorte el corazón y los pulmones cerca del hilio incluir la mayoría de los bronquios principales derecho e izquierdo.
- Coloque la tráquea en una pequeña placa Petri que contenía medio de recogida en hielo.
2. Limpieza de la tráquea y se corta
- Bajo el microscopio de disección, utilice pinzas punta muy fina (N º 5) y tijeras Vannas Tubingen (FST 15003-08 finescience.com) para limpiar la tráquea de todos los tejidos que están conectados a la misma. Esto incluye: los ganglios linfáticos, el nervio laríngeo recurrente, la grasa, la glándula tiroides y el resto de los vasos pulmonares. La parte superior de la tráquea necesita una atención especial, para eliminar los cartílagos laríngeos grandes sin comprometer el mayor grupo de SMGque se presente entre el cartílago cricoides y el primer anillo traqueal cartilaginosos (C1) 4.
- Cortar la tráquea en la parte superior y la parte inferior entre C4 y C5 y luego se corta abierta ambas partes a través de la luz de la tráquea.
3. Enzima Digestión y Transformación en suspensión de células individuales (SCS)
- Incubar la parte inferior de la tráquea en 1 ml de 16 U de dispasa en un tubo Eppendorf a temperatura ambiente (RT) durante 30 min, como se ha descrito previamente 5. A continuación, añadir 0,5 mg / ml de DNasa I en DMEM durante 20 min a TA.
- Eliminar las tráqueas digeridos en medio fresco recogida en una placa de Petri estéril, y pelar el epitelio de la superficie bajo el microscopio de disección. Utilizar una pipeta para transferir el medio que contiene el epitelio despojado a un tubo cónico de 50 ml.
- Decantar el epitelio separa por arrastre a 1.000 xg, a 4 ° C. Eliminar el sobrenadante y añadir 0,1% de tripsina / EDTA y se incuba con agitación the en un tubo de 37 ° C incubadora con agitación (200 rpm) durante 30 min. Después de la incubación, usando una punta de 1.000 l, pipetear arriba y hacia abajo para romper los grumos y formar una suspensión de células individuales.
- Coloque la tráquea superior en un tubo cónico que contenía 1 ml de 0,15% pronasa. Luego incubar a 4 ° C durante 4 horas.
- Vórtice suavemente el tubo y luego colocar la tráquea en medio de recogida fresco y confirmar bajo el microscopio de disección que hay desprendimiento completo de la superficie del epitelio (SE).
- Picar la tráquea con unas tijeras pequeñas para abrir los compartimientos SMG y luego incubar durante una hora más en pronasa a TA con agitación lenta.
- Decantar el tejido traqueal, eliminar la pronasa, añadir 0,1% de tripsina / EDTA y se incuba a 37 ° C durante 30 min con agitación como anteriormente.
- Pasaje de las células digeridas, macizos y cualquier trozos restantes de las glándulas a través de agujas 20G, 23G y 26G utilizando una jeringa de 10 ml. Repita las veces varios pases con cada tamaño de la aguja antes decese. Ahora, la mayoría de las células deben estar en un SCS.
- Se filtra la suspensión a través de un filtro de 40 mM y luego lavar el filtro y centrifugar las células. A continuación, reconstituir las células en el volumen adecuado de medio, contar las células y proceder inmediatamente a la tinción FACS y clasificación. No deje las células en 4 ° C o en hielo durante varias horas porque encontramos que esto afecta a la viabilidad y reduce gravemente la esfera que forma la eficiencia.
4. La tinción de FACS y clasificación
- Tome suficientes células para la preparación de los tubos sin teñir y teñidas sola mancha de compensación entonces el resto de las células con anticuerpos primarios, Trop2 de cabra y de rata ITGA6, durante 15 min a RT. Entonces lavar con PBS o medio de recogida, removedor el sobrenadante cuidadosamente y romper el sedimento celular.
- Tiñen con el anticuerpo secundario adecuado, incubar en la oscuridad a temperatura ambiente durante 10 min, lavar y eliminar el sobrenadante y luego romper la pastilla.
- En el FACSARIA, después de ajustar el voltaje y la indemnización, puerta de los escombros, las células muy pequeñas, dobletes celulares y células muertas. Entonces, la mayoría de las células de la SE debe ser TROP2 positivo mientras que 20-50% de las células SMG será TROP2 + 6.
- Establecer la puerta de clasificación para Trop2 + ITGA6 + células de SE (células basales) y para Trop2 + células (+ /-ITGA6 células positivas) de SMG (células de los conductos).
5. Procesamiento de Células clasificadas: en cultivo in vitro y el modelo in vivo
5.1 En el ámbito de la formación in vitro 5-9 cultura
- Mezclar 100 l de "factor de crecimiento reducido Matrigel" con 100 l de medio completo 10,11 (ver Tabla 1) que contiene hasta 50.000 células clasificadas a continuación, poner la mezcla en la cámara superior de un 24-así trans-bien. A continuación, poner 400 l de medio completo en la cámara baja y se incuba a 37 ° C. Cambio medio en la cámara baja cada dos días y añadir otros 100 l de Matrigelcada semana o antes si se adelgaza.
5.2 En el modelo in vivo
- Reconstituir la ordenados pellet de células en medio completo mezclado 1:1 con Matrigel a una concentración de 5,000-10,000 células por 50 l.
- Anestesie los receptores C57/BL6 ratones. Administrar Carprofen (5 mg / kg) subcutaenously como analgésico. Esterilice y afeitarse la espalda luego hacer una incisión longitudinal en el centro de la piel de la espalda superior. La incisión debe ser lo suficientemente grande como para identificar el lugar de la almohadilla de inyección de grasa, así como la ampolla que se forma después de la inyección. Utilice el lado romo de la tijera para ensanchar las bolsas entre la piel y el reverso de la pared torácica en ambos lados para maximizar el acceso y la visualización.
- Identifique el borde medial de la escápula, empujando la extremidad anterior del ratón hacia arriba y hacia atrás para ver el movimiento escápula. Tomar 50 l de la suspensión celular en un 300 l jeringa de insulina BD y lo inyecta en la almohadilla grasa medial a la lateral de la escápula ylas vértebras. Usted debe ser capaz de ver una ampolla de lo contrario son demasiado profundas. Repita lo mismo en el otro lado luego cortar o coser la incisión de la piel. Entrada ratones y dar Carprofen (5 mg / kg, SC) una vez al día durante 48 hr.
- Después de 3 semanas, la eutanasia a los ratones con pentobarbatol (0,1 mg/0.2 cc, IP), abra la piel como antes y diseccionar la almohadilla de grasa total por ambos lados con un margen de seguridad para evitar la pérdida de cualquier estructura de tejido que podría haberse formado y se extendió alrededor. Fijar en PFA y de inserción en parafina 12. El cuidado extremo debe ser empleado durante el recorte y el corte del bloque de no omitir o pasar por alto una estructura. La mejor práctica consiste en recortar 40 micras una vez y luego cortar una rebanada de 4 micras, lo coloca en un portaobjetos de vidrio y examinarlo bajo el microscopio para confirmar si hay "estructuras epiteliales" en esta parte del bloque o no. Si no hay nada visto, entonces recortar una vez más y repita este paso.
6. Los resultados representativos
Stripping de las tráqueas de ratón se traducirá en una tráquea denudado que es visible por microscopía de luz como se muestra en la Figura 1A. Figura 1B muestra la vista de campo brillante de una tráquea después epitelial stripping con glándulas submucosas de ser liberado de los tejidos y los racimos de uvas parecidas.
Pronasa elimina el epítopo ITGA6 y esta es la razón por la TROP2 células de los conductos no se pueden separar en ITGA6 + y - poblaciones. Sin embargo, dispasa, que conserva el epítopo ITGA6, digiere todo el epitelio de la superficie y las células de los conductos, incluso con tiempos de incubación muy corto, y por lo tanto no se puede utilizar para separar las células basales de conducto 3. La citometría de flujo de las suspensiones de células individuales deben mostrar gráficos de dispersión hacia delante y dispersión lateral que se representan en la Figura 2A. Buena separación de células de los conductos del resto si las células traqueal debe ser visto con el anticuerpo Trop2 en citometría de flujo para células activadas por fluorescencia sorting (FACS) como se ve en la Figura 2B. Esferas debe ser visible en el matrigel después de aproximadamente 1 semana en cultivo y son densos en apariencia, como se muestra en la Figura 3. La eficiencia de este proceso es del orden de 1-2% y las células individuales estará aún presente en el matrigel y probablemente representan células de los conductos de las glándulas submucosas que no poseen la capacidad de auto-renovación. La inyección de células madre del conducto en los resultados cojín de ratón de grasa en la formación de la glándula submucosa, como estructuras que se muestran la figura 4. Estos son vistos en los bloques, incluso sin tinción H & E. Estos son esféricas y poseen un lumen central. Muchas secciones transversales deben hacerse a través de la almohadilla de grasa con el fin de no perder estas estructuras epiteliales.
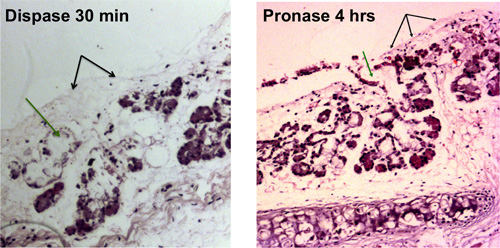
Figura 1. La digestión enzimática del epitelio traqueal. La eliminación de las células epiteliales de la superficie se muestra con blacflechas k, la eliminación de las células en los conductos de las glándulas submucosas se muestra con las flechas verdes. Tráqueas denudados que son visibles al microscopio óptico se muestran después de 30 minutos de digestión dispasa y después de 4 horas de digestión con pronasa.

La Figura 2A. I. Citometría de flujo de las suspensiones de células individuales que muestran dispersión representativo adelante y parcelas dispersión lateral de tráqueas de ratón después de la superficie epitelial de extracción. ii. Parcelas FACS representativos para TROP2 expresión en células de los conductos de tráqueas ratón.
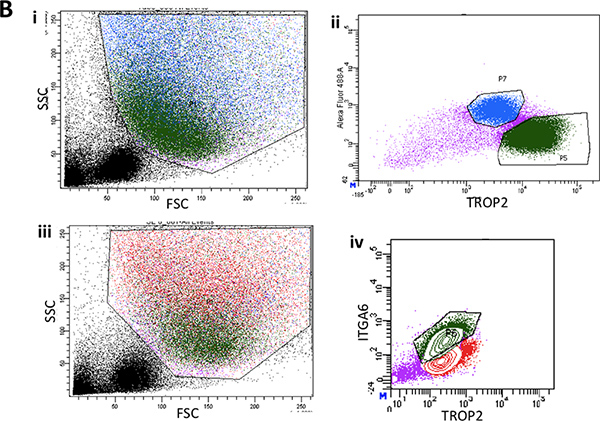
La Figura 2B. I. Citometría de flujo de las suspensiones de células individuales de la superficie del epitelio despojado de los dos tercios inferiores de la tráquea de ratón que muestra la dispersión hacia adelante y representante parcelas dispersión lateral. ii. FACS trama típica de ITGA6 expresión in surface epitelio. iii. Otra FACS gráfico representativo de adelante y dispersión lateral de la superficie del epitelio que muestra de nuevo gating de la población de células basales en verde. iv. Típica ITGA6 y TROP2 población de células que expresan en verde.
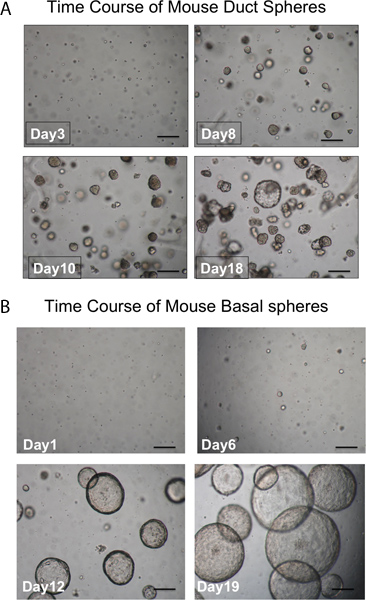
Figura 3. Transcurso de tiempo de desarrollo de las esferas. A. Conducto esferas. Esferas debe ser visible en el matrigel después de aproximadamente 1 semana en cultivo y casi todos son densos en apariencia. Las células individuales que no forman esferas también se ven. (Barra de escala = 50 mm). Esferas B. basales son más grandes y luminal en apariencia. Las células individuales que no forman esferas también se ven. (Barra de escala = 50 mm).
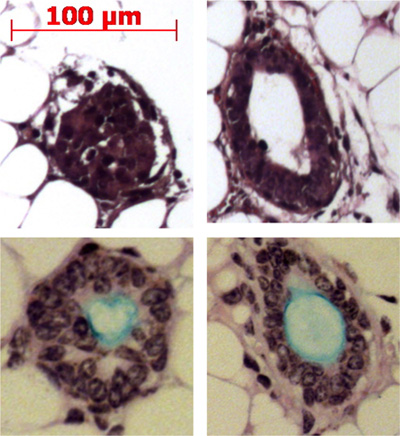
Figura 4. La inyección de células madre del conducto en los resultados cojín de ratón de grasa en la formación de la glándula submucosa como estructuras. Estructuras representativasse muestran en la almohadilla de grasa y algunos se muestran producir mucina (luz azul) con la Alcian azul ácido periódico de Schiff mancha.
Discusión
Esta técnica para aislar células de los conductos y basal de las vías respiratorias es importante para mejorar nuestra comprensión de la reparación de las vías respiratorias y las enfermedades de las vías respiratorias y regeneración. Las técnicas descritas aquí son algunas medidas críticas. El primero es el período optimizado digestión enzimática. La segunda es la creación de una única suspensión celular a través de pasada en serie con agujas de calibre progresivamente más altas para prevenir la rotu...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Nos gustaría reconocer el amplio FACS de células madre del Centro de Investigación y sobre todo gracias a Jessica Scholes y Codrea Felicia por su ayuda con la clasificación de células. El trabajo fue financiado por el CIRM RN2-00904-1, K08 HL074229, American Thoracic Society / COPD Foundation ATS-06-065, La Fundación preocupación, la UCLA Jonsson Comprehensive Cancer Center Thoracic Oncology Program / SPORE pulmón Cáncer, la Universidad de California del Cáncer Investigación Comité de Coordinación y el Gwynne Hazen cereza Memorial Laboratories (BG).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | El número de catálogo | |
| Medio completo 10: DMEM-F-12, 50/50, 1X) | Mediatech | 15 a 090-CV | |
| Hepes (15 mM) | Invitrogen | 15630 | |
| Bicarbonato de sodio (3,6 mm o 0,03%) | Invitrogen | 25080 | |
| L-glutamina (4 mM) | Mediatech | 25-005-Cl | |
| Penicilina (100 U / ml) | Mediatech | 30 a 001-CI | |
| Estreptomicina (100 mg / m) | Mediatech | 30 a 001-CI | |
| La anfotericina B (0,25 g / ml) | Lonza | 17-836R | |
| Eninsulina (10 mg / ml) | Sigma | I6634 | |
| Transferrina (5 mg / ml) | Sigma | T1147 | |
| La toxina del cólera (0,1 g / ml) | Sigma | C8052 | |
| Factor de crecimiento epidérmico (25 ng / ml) | BD | 354001 | |
| Extracto de pituitaria bovina (30 mg / ml) | Invitrogen | 13028-014 | |
| Suero bovino fetal (5%) | Pescador | SH3008803HI | |
| El ácido retinoico (0,05 mM) | Sigma | R2625 | |
| Factor de crecimiento reducido Matrigel | BD | 354230 |
Tabla 1. Completar componentes de medios.
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| Pronasa | Roche | 10165921001 | Utilizado en un 0,15%: -O / N a 4 ° C para aislar la digestión total de células de la tráquea (para cultivo ALI) -4 Digestión hr 4 ° C para aislar SMG |
| Dispasa | BD Biosciences | 354235 | Usado en 16 Unidades: 30 min a RT |
| DNasa I | Sigma | DN25 | Usado a 0,5 mg / ml: 20-30 min a RT |
Enzimas Tabla 2. Utilizado para la digestión enzimática de la tráquea.
Referencias
- Bartlett, J. A., Fischer, A. J., McCray, P. B. Innate immune functions of the airway epithelium. Contrib. Microbiol. 15, 147-163 (2008).
- Finkbeiner, W. E. Physiology and pathology of tracheobronchial glands. Respir. Physiol. 118, 77-83 (1999).
- Hegab, A. E. A Novel Stem/Progenitor Cell Population from Murine Tracheal Submucosal Gland Ducts with Multipotent Regenerative Potential. Stem Cells. , (2011).
- Jeffery, P. K. Morphologic features of airway surface epithelial cells and glands. Am. Rev. Respir. Dis. 128, S14-S20 (1983).
- Rock, J. R. Basal cells as stem cells of the mouse trachea and human airway epithelium. Proc. Natl. Acad. Sci. U.S.A. 106, 12771-12775 (2009).
- Goldstein, A. S. Trop2 identifies a subpopulation of murine and human prostate basal cells with stem cell characteristics. Proc. Natl. Acad. Sci. U.S.A. 105, 20882-20887 (2008).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- McQualter, J. L., Yuen, K., Williams, B., Bertoncello, I. Evidence of an epithelial stem/progenitor cell hierarchy in the adult mouse lung. Proc. Natl. Acad. Sci. U.S.A. 107, 1414-1419 (2010).
- Inayama, Y. In vitro and in vivo growth and differentiation of clones of tracheal basal cells. Am. J. Pathol. 134, 539-549 (1989).
- You, Y., Richer, E. J., Huang, T., Brody, S. L. Growth and differentiation of mouse tracheal epithelial cells: selection of a proliferative population. Am. J. Physiol. Lung. Cell. Mol. Physiol. 283, L1315-L1321 (2002).
- Wu, X., Peters-Hall, J. R., Bose, S., Pena, M. T., Rose, M. C. Human Bronchial Epithelial Cells Differentiate to 3D Glandular Acini on Basement Membrane Matrix. Am. J. Respir. Cell Mol. Biol. , (2010).
- Ooi, A. T. Presence of a putative tumor-initiating progenitor cell population predicts poor prognosis in smokers with non-small cell lung cancer. Cancer Res. 70, 6639-6648 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados