È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Isolamento delle cellule basali e sottomucosa cellule del dotto di Gland mouse Trachea
In questo articolo
Riepilogo
Qui mostriamo il nostro protocollo per l'isolamento di cellule della ghiandola basali e sottomucoso condotto da trachee del mouse. Abbiamo anche dimostrare il metodo di iniezione di cellule staminali nel cuscinetto di grasso dorsale del mouse per creare un In vivo di rigenerazione ghiandola sottomucosa.
Abstract
Grandi vie aeree sono direttamente in contatto con l'ambiente e quindi suscettibile al danno da tossine e agenti infettivi che respiro in 1. Le vie aeree di grandi dimensioni richiedono quindi un meccanismo di riparazione efficace per proteggere i nostri corpi. Questo processo di ripristino si verifica a partire da cellule staminali delle vie aeree e isolare queste cellule staminali delle vie aeree è importante per la comprensione dei meccanismi di riparazione e rigenerazione. E 'anche importante per comprendere riparazione anormale che può portare a malattie delle vie aeree 2. L'obiettivo di questo metodo è quello di isolare una nuova popolazione di cellule staminali da tracheali dotti delle ghiandole topo sottomucosi e di inserire in queste cellule in vitro e in vivo sistemi modello per identificare i meccanismi di riparazione e rigenerazione delle ghiandole della sottomucosa 3. Questa produzione mostra i metodi che possono essere utilizzati per isolare e saggio le cellule staminali condotto e basale del grande vie aeree 3. Questo ci permetteràstudiare le patologie delle vie aeree, come la fibrosi cistica, asma e malattia polmonare ostruttiva cronica. Attualmente, non esistono metodi per l'isolamento delle cellule della ghiandola sottomucosa condotto e non ci sono modelli in vivo per studiare la rigenerazione delle ghiandole della sottomucosa.
Protocollo
Schema delle fasi di
1. Dissezione della trachea
2. Pulizia trachea e tagliarlo
3. Enzima digestione e la trasformazione in sospensione singola cella
4. La colorazione per FACS e l'ordinamento
5. Lavorazione di cellule filtrate per in vivo e in vitro
1. Dissezione di Trachea
- Euthanize il mouse con una iniezione intraperitoneale di 0,1 cc mg/0.2 di pentobarbital.
- Tagliare la parete addominale, e spostare l'intestino verso il lato per esporre l'aorta addominale e poi sezionarlo.
- Aprite la cassa, tagliando attraverso il diaframma e della parete toracica anteriore su entrambi i lati per esporre il cuore ei polmoni. Continua tagliando nel collo rimuovendo le ghiandole salivari e grassi per esporre la trachea.
- Togliere il timo e tagliare il polmone al largo delle sue connessioni sotto e dietro. Separmangiato la trachea dall'esofago inserendo una pinza tra loro poi tagliare la trachea nella sua parte più alta sopra la sua connessione con la laringe. Quindi tenete la trachea con una pinza e sezionarlo dal suo attaccamento e continuare verso il basso per rimuoverlo con il cuore e polmone en-blocco. Tagliare il cuore ei polmoni, vicino alla ilo includere la maggior parte dei bronchi principali destro e sinistro.
- Posizionare la trachea in una piccola scatola di Petri contenente la raccolta media su ghiaccio.
2. Pulizia Trachea e Cutting It
- Sotto il microscopio da dissezione, utilizzare pinze punto molto fini (n ° 5) e Vannas forbici Tübingen (FST 15003-08 finescience.com) per pulire la trachea da tutti gli altri tessuti ad esso. Ciò include: linfonodi, nervo laringeo ricorrente, grassi, tiroide e le restanti vasi polmonari. La parte superiore della trachea richiede un'attenzione particolare, per rimuovere le cartilagini laringee grandi senza compromettere il più grande gruppo di SMGche è stata presentata tra la cartilagine cricoide e il primo anello tracheale cartilagineo (C1) 4.
- Tagliare la trachea nella parte superiore e la parte inferiore tra C4 e C5 e quindi tagliare aprire entrambe le parti attraverso il lume della trachea.
3. Digestione enzimatica e Trasformazione in sospensione singola cella (SCS)
- Incubare la parte inferiore della trachea in 1 ml di 16 dispasi U in una provetta Eppendorf a temperatura ambiente (RT) per 30 minuti, come precedentemente descritto 5. Quindi aggiungere 0,5 mg / ml DNasi I in DMEM per ulteriori 20 minuti a RT.
- Rimuovere le trachee digeriti in fresco medio di raccolta in una piastra di Petri sterile, e spellare l'epitelio superficiale sotto il microscopio da dissezione. Utilizzare una pipetta per trasferire il terreno contenente l'epitelio spogliato in una provetta da 50 ml.
- Centrifugare la epitelio strippato a 1000 xga 4 ° C. Rimuovere il surnatante e aggiungere 0,1% tripsina / EDTA e incubare agitando °in un tubo e 37 ° C agitando incubatore (200 rpm) per 30 min. Dopo l'incubazione, utilizzando una punta 1000 microlitri, pipettare su e giù per rompere grumi e formano un'unica sospensione cellulare.
- Posizionare la trachea superiore in un tubo conico contenente 1 ml di 0,15% pronasi. Incubare a 4 ° C per 4 h.
- Vortex delicatamente il tubo e quindi inserire la trachea nel terreno raccolta fresca e confermare sotto il microscopio da dissezione che c'è completo distacco dell'epitelio di superficie (SE).
- Tritate la trachea con una forbice fine per aprire i vani SMG e poi incubare per un'ora di più in pronasi a temperatura ambiente con agitazione lenta.
- Centrifugare il tessuto tracheale, rimuovere la pronasi, aggiungere 0,1% tripsina / EDTA e incubare a 37 ° C per 30 minuti con agitazione come sopra.
- Passage le cellule digeriti, e gli eventuali grumi bei pezzi rimanenti di ghiandole attraverso aghi 20G, 23G e 26G utilizzando una siringa da 10 ml. Ripetere i tempi passaging più con ogni formato dell'ago primadimissioni. Ora, la maggior parte delle cellule dovrebbe essere in una SCS.
- Filtrare la sospensione attraverso un colino 40 pm quindi lavare il filtro e far girare le cellule. Poi ricostituire le cellule nel volume appropriato del mezzo, contare le cellule e procedere immediatamente alla colorazione FACS e l'ordinamento. Non lasciare le celle a 4 ° C o su ghiaccio per diverse ore, perché abbiamo scoperto che questo riguarda la redditività e riduce notevolmente la sfera formando efficienza.
4. La colorazione per FACS e ordinamento
- Prendere numero sufficiente di cellule per la preparazione dei tubi senza macchia e singola compensazione macchiati quindi macchiare il resto delle cellule con anticorpi primari, Trop2 capra e ratto ITGA6, per 15 minuti a temperatura ambiente. Lavare quindi con PBS o la raccolta media, rimozione del surnatante con molta attenzione e rompere il pellet di cellule.
- Colorare con l'appropriato anticorpo secondario, incubare al buio a temperatura ambiente per 10 minuti, lavare e rimuovere il surnatante e quindi rompere il pellet.
- Sulle FACSARIA, dopo aver regolato la tensione e la compensazione, porta i detriti, cellule molto piccole, doppietti cellulari e cellule morte. Quindi, la maggior parte delle cellule del vento dovrebbe essere TROP2 positivo, mentre il 20-50% delle cellule SMG sarà TROP2 + 6.
- Impostare la porta di ordinamento per Trop2 ITGA6 + + cellule di SE (cellule basali) e per Trop2 + cellule (+ /-ITGA6 cellule positive) da SMG (cellule del dotto).
5. La lavorazione di cellule Ordinati per: coltura in vitro e il modello in vivo
5.1 In ambito vitro la formazione di 5-9 cultura
- Miscelare 100 ml di "fattore di crescita ridotto Matrigel" con 100 pl di mezzo completo 10,11 (vedi Tabella 1) contenente fino a 50.000 cellule filtrate poi mettere questa miscela nella camera superiore di un 24-ben trans-well. Poi, mettete 400 ml di terreno completo in camera inferiore e incubare a 37 ° C. Variazione media camera inferiore a giorni alterni e di aggiungere ulteriori 100 pl di Matrigelogni settimana o prima, se diventa sottile.
5.2 Nel modello in vivo
- Ricostituire la cella ordinati pellet in mezzo completo miscelato 1:1 con Matrigel ad una concentrazione di 5.000-10.000 cellule per 50 pl.
- Anestetizzare la C57/BL6 topi riceventi. Somministrare Carprofen (5 mg / kg) subcutaenously come analgesico. Sterilizzare le spalle e la barba poi fare una incisione cutanea longitudinale centrale nella parte superiore della schiena. L'incisione deve essere abbastanza grande per identificare il sito di iniezione grasso pad nonché la bozza che forma dopo l'iniezione. Utilizzare il lato smussato della forbice di allargare sacche tra la pelle e il retro della parete toracica su entrambi i lati per massimizzare l'accesso e la visualizzazione.
- Identificare il bordo mediale della scapola spingendo il mouse verso l'alto arti anteriori e indietro per vedere il movimento scapola. Prelevare 50 ml di sospensione cellulare in una siringa 300 ml insulina BD e iniettare nel cuscinetto adiposo appena mediale alla scapola e lateralmentele vertebre. Si dovrebbe essere in grado di vedere una bozza altrimenti sono troppo profonde. Ripetere lo stesso sull'altro lato quindi clip o punto l'incisione cutanea. Controllare topi e dare Carprofen (5 mg / kg, SC) una volta al giorno per 48 ore.
- Dopo 3 settimane, i topi con l'eutanasia pentobarbatol (0.1 mg/0.2 cc, IP), aprire la pelle come sopra e sezionare il pad latte intero da entrambi i lati con un margine di sicurezza per evitare di perdere qualsiasi struttura del tessuto che potrebbe essersi formato ed esteso intorno. Fissare in PFA ed embed in paraffina 12. Estrema attenzione deve essere impiegato durante la preparazione e il taglio del blocco di non ignorare o trascurare una struttura. La pratica migliore è quella di tagliare 40 pm una volta quindi tagliare un 4 fetta micron, posizionarlo su un vetrino ed esaminare al microscopio per verificare se ci sono delle "strutture epiteliali" in questa parte del blocco o meno. Se non c'è niente visto, quindi tagliare di nuovo e ripetere l'operazione.
6. Risultati rappresentativi
Stripping delle trachee topo si tradurrà in una trachea spoglia che è visibile al microscopio ottico come mostrato nella Figura 1A. Figura 1B mostra la vista di un campo chiaro trachea dopo strippaggio con epiteliale ghiandole della sottomucosa stati rilasciati dai tessuti e grappoli d'uva simili.
Pronase rimuove l'epitopo ITGA6 e questo è il motivo per cui i TROP2 cellule del dotto non può essere separato in ITGA6 + e - le popolazioni. Tuttavia, dispasi, che conserva l'epitopo ITGA6, digerisce tutto l'epitelio di superficie e le cellule del dotto anche con tempi di incubazione molto brevi, e pertanto non può essere utilizzato per separare condotto da cellule basali 3. La citometria a flusso delle sospensioni di cellule singole dovrebbe mostrare i diagrammi a dispersione in avanti e laterali che sono rappresentati nella Figura 2A. Buona separazione delle cellule del dotto dal resto se le cellule della trachea deve essere visto con l'anticorpo Trop2 in citometria a flusso per la cella attivata Sorti fluorescenteng (FACS) come mostrato nella figura 2B. Sfere dovrebbe essere visibile nella matrigel dopo circa 1 settimana in coltura e sono densi in apparenza come mostrato in Figura 3. L'efficienza di questo processo è dell'ordine di 1-2% e singole cellule sarà ancora presente in matrigel e probabilmente rappresentano cellule dei dotti delle ghiandole della sottomucosa che non hanno la capacità di auto-rinnovamento. Iniezione di cellule staminali condotto nel grasso mouse pad risultati nella formazione della ghiandola sottomucosa strutture simili che sono mostrate Figura 4. Questi sono visti nei blocchi anche senza colorazione H & E. Questi sono sferiche e possiedono un lume centrale. Molte sezioni devono essere effettuate tramite il cuscinetto adiposo al fine di non perdere queste strutture epiteliali.
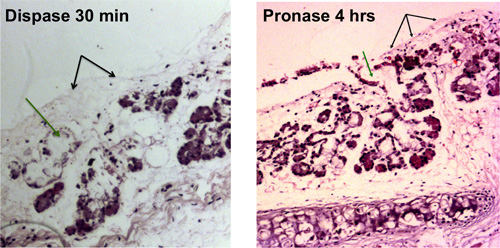
Figura 1. Digestione enzimatica di epitelio tracheale. La rimozione delle cellule epiteliali di superficie viene visualizzato con black frecce, la rimozione delle cellule nei dotti delle ghiandole della sottomucosa è mostrato con frecce verdi. Trachee denudato che sono visibili al microscopio ottico sono presenti dopo 30 minuti di digestione dispasi e dopo 4 ore di digestione pronasi.

Figura 2A. I. La citometria a flusso delle sospensioni di cellule singole che mostrano rappresentante forward scatter e diagrammi a dispersione laterali da trachee del mouse dopo superficie epiteliale stripping. ii. Rappresentante trame FACS per TROP2 espressione in cellule del dotto di trachee del mouse.
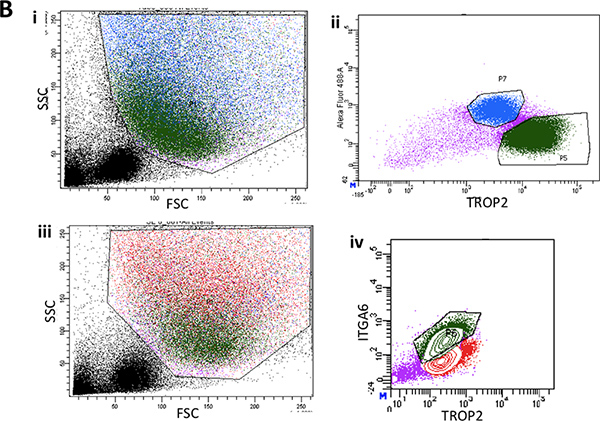
Figura 2B. I. La citometria a flusso delle sospensioni singola cellula da epitelio superficiale spogliato dei i due terzi inferiori della trachea del mouse mostra forward scatter rappresentante e diagrammi a dispersione laterali. ii. Tipico diagramma di FACS ITGA6 espressione in surfaccia epitelio. iii. Un altro terreno rappresentante FACS di scatter in avanti e laterale da epitelio superficiale che mostra retro gating della popolazione di cellule basali in verde. iv. ITGA6 tipica e TROP2 esprimere popolazione cellulare in verde.
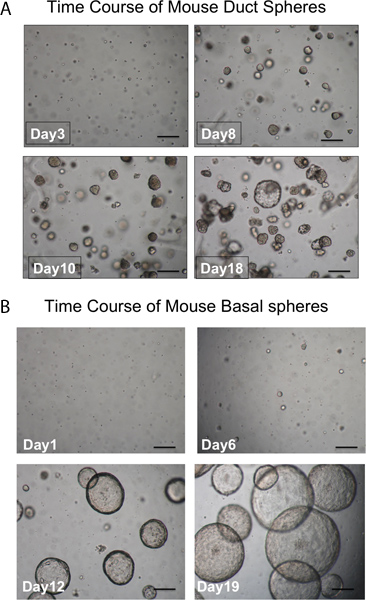
Figura 3. Naturalmente il tempo di sviluppo di sfere. Sfere A. Duct. Sfere dovrebbe essere visibile nella matrigel dopo circa 1 settimana di cultura e quasi tutti sono densi in apparenza. Singole cellule che non formano sfere sono anche visto. (Scala bar = 50 micron). Sfere B. basali sono più grandi e luminale in apparenza. Singole cellule che non formano sfere sono anche visto. (Scala bar = 50 micron).
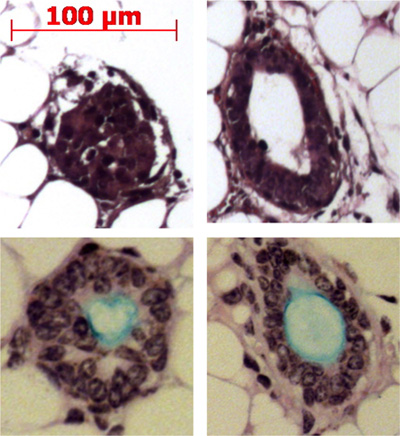
Figura 4. Iniezione di cellule staminali condotto nel grasso mouse pad risultati nella formazione della ghiandola sottomucosa strutture simili. Rappresentativi delle strutturesono riportati nella cuscinetto adiposo e alcuni sono mostrati produrre mucina (azzurro) con l'Alcian blue acido periodico Schiff macchia.
Discussione
Questa tecnica di isolare cellule del dotto e basale dalle vie aeree è importante per migliorare la nostra comprensione della riparazione e rigenerazione delle vie aeree e malattie delle vie aeree. Le tecniche qui descritte sono a pochi passi critici. Il primo è il periodo ottimizzato digestione enzimatica. Il secondo è la creazione di una sospensione singola cellula tramite seriale passaging con aghi calibro progressivamente più elevate per impedire ghigliottina cella ma per rompere ammassi cellulari. Il terzo è l...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Vorremmo riconoscere gli indirizzi di massima Stem Cell FACS centro di ricerca e in particolare ringrazio Jessica Scholes e Felicia Codrea per il loro aiuto con la selezione delle cellule. Il lavoro è stato finanziato dal CIRM RN2-00904-1, K08 HL074229, American Thoracic Society / BPCO Fondazione ATS-06-065, la Fondazione preoccupazione, Il toracica UCLA Jonsson Comprehensive Cancer Center Oncology Program / Lung Cancer SPORE, l'Università della California Cancer La ricerca e il Comitato di Coordinamento Gwynne Hazen Cherry Memorial Laboratories (BG).
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | |
| Completa media 10: DMEM-F-12, 50/50, 1X) | Mediatech | 15-090-CV | |
| Hepes (15 mm) | Invitrogen | 15630 | |
| Bicarbonato di sodio (3,6 mm o 0,03%) | Invitrogen | 25080 | |
| L-glutammina (4 mM) | Mediatech | 25-005-Cl | |
| Penicillina (100 U / ml) | Mediatech | 30-001-CI | |
| Streptomicina (100 mg / m) | Mediatech | 30-001-CI | |
| Amfotericina B (0,25 mg / ml) | Lonza | 17-836R | |
| Ininsulina (10 pg / ml) | Sigma | I6634 | |
| Transferrina (5 mg / ml) | Sigma | T1147 | |
| Tossina colerica (0,1 mcg / ml) | Sigma | C8052 | |
| Epidermal Growth Factor (25 ng / ml) | BD | 354001 | |
| Bovina estratto ipofisario (30 mg / ml) | Invitrogen | 13028-014 | |
| Siero fetale bovino (5%) | Pescatore | SH3008803HI | |
| L'acido retinoico (0,05 mM) | Sigma | R2625 | |
| Fattore di crescita ridotto Matrigel | BD | 354230 |
Tabella 1. Completare i componenti Media.
| Nome del reagente | Azienda | Numero di catalogo | Commenti |
| Pronase | Roche | 10165921001 | Usato a 0,15%: -O / N a 4 ° C per isolare la digestione totale delle cellule tracheali per la cultura (ALI) -4 Digestione hr 4 ° C per isolare SMG |
| Dispasi | BD Biosciences | 354235 | Usato a 16 unità: 30 min a RT |
| DNasi I | Sigma | DN25 | Usato a 0,5 mg / ml: 20-30 min a RT |
Enzimi Tabella 2. Utilizzato per la digestione enzimatica della trachea.
Riferimenti
- Bartlett, J. A., Fischer, A. J., McCray, P. B. Innate immune functions of the airway epithelium. Contrib. Microbiol. 15, 147-163 (2008).
- Finkbeiner, W. E. Physiology and pathology of tracheobronchial glands. Respir. Physiol. 118, 77-83 (1999).
- Hegab, A. E. A Novel Stem/Progenitor Cell Population from Murine Tracheal Submucosal Gland Ducts with Multipotent Regenerative Potential. Stem Cells. , (2011).
- Jeffery, P. K. Morphologic features of airway surface epithelial cells and glands. Am. Rev. Respir. Dis. 128, S14-S20 (1983).
- Rock, J. R. Basal cells as stem cells of the mouse trachea and human airway epithelium. Proc. Natl. Acad. Sci. U.S.A. 106, 12771-12775 (2009).
- Goldstein, A. S. Trop2 identifies a subpopulation of murine and human prostate basal cells with stem cell characteristics. Proc. Natl. Acad. Sci. U.S.A. 105, 20882-20887 (2008).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- McQualter, J. L., Yuen, K., Williams, B., Bertoncello, I. Evidence of an epithelial stem/progenitor cell hierarchy in the adult mouse lung. Proc. Natl. Acad. Sci. U.S.A. 107, 1414-1419 (2010).
- Inayama, Y. In vitro and in vivo growth and differentiation of clones of tracheal basal cells. Am. J. Pathol. 134, 539-549 (1989).
- You, Y., Richer, E. J., Huang, T., Brody, S. L. Growth and differentiation of mouse tracheal epithelial cells: selection of a proliferative population. Am. J. Physiol. Lung. Cell. Mol. Physiol. 283, L1315-L1321 (2002).
- Wu, X., Peters-Hall, J. R., Bose, S., Pena, M. T., Rose, M. C. Human Bronchial Epithelial Cells Differentiate to 3D Glandular Acini on Basement Membrane Matrix. Am. J. Respir. Cell Mol. Biol. , (2010).
- Ooi, A. T. Presence of a putative tumor-initiating progenitor cell population predicts poor prognosis in smokers with non-small cell lung cancer. Cancer Res. 70, 6639-6648 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon