É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Isolamento de células basais e células Duct submucosa Glândulas de Rato Traquéia
Neste Artigo
Resumo
Aqui demonstramos nosso protocolo para isolamento de células basais e das glândulas submucosas duto de traqueias de rato. Nós também demonstram o método de injecção de células estaminais na almofada de gordura dorsal do rato para criar um In vivo Modelo de regeneração da glândula submucosa.
Resumo
Grandes vias aéreas estão diretamente em contato com o meio ambiente e, portanto, suscetível a lesões de toxinas e agentes infecciosos que respiramos em 1. Grandes vias aéreas, portanto, exigem um mecanismo de reparo eficiente para proteger os nossos corpos. Este processo de reparo ocorre a partir de células-tronco nas vias aéreas e isolar essas células-tronco das vias aéreas é importante para compreender os mecanismos de reparo e regeneração. Também é importante para a compreensão de reparação anormal que pode conduzir a doenças das vias aéreas 2. O objectivo deste método é para isolar uma população de células estaminais a partir de novo os ratos ductos de glândulas submucosas traqueal e para colocar estas células in vitro e em sistemas de modelos in vivo para identificar os mecanismos de reparação e regeneração das glândulas submucosas 3. Isto mostra a produção de métodos que podem ser utilizados para isolar e ensaio das células estaminais e do ducto basal das vias aéreas grandes 3. Isto permitirápara o estudo de doenças das vias respiratórias, como a fibrose cística, asma e doença pulmonar obstrutiva crónica. Actualmente, não existem métodos para o isolamento de células das glândulas submucosas duto e não existem modelos in vivo para estudar a regeneração de glândulas submucosas.
Protocolo
Esboço de Passos
1. Dissecção da traquéia
2. Limpeza traquéia e cortá-lo
3. Digestão enzimática e transformação em suspensão de célula única
4. A coloração por FACS e triagem
5. Processamento de células classificadas para in vivo e in vitro, em modelos
1. Dissecção da traquéia
- Euthanize o rato com uma injeção intraperitoneal de 0,1 cc mg/0.2 de pentobarbital.
- Cortar abrir a parede abdominal, e mover os intestinos para o lado a exposição da aorta abdominal e depois dissecá-lo.
- Abra o peito, cortando através do diafragma e da parede torácica anterior em ambos os lados para expor o coração e os pulmões. Continuar a cortar-se para dentro do gargalo de remover gordura e glândulas salivares para expor a traqueia.
- Remover o timo e cortar o pulmão fora de suas conexões abaixo e atrás. SeparComeram a traqueia do esófago, inserindo uma pinça entre elas, em seguida, cortado a traqueia, na sua parte mais superior acima da sua ligação com a laringe. Em seguida, mantenha a traquéia com uma pinça e dissecá-lo de seu apego e continue para baixo para removê-lo com o coração e pulmão en-bloco. Cortar o coração e os pulmões próximo ao hilo para incluir a maioria dos brônquios direito e esquerdo principal.
- Coloque a traqueia numa placa de Petri que continha a recolha meio em gelo.
2. Traquéia limpeza e corte-
- Sob o microscópio de dissecação, utilize uma pinça de ponto muito finas (n º 5) e Tübingen Vannas tesouras (FST 15003-08 finescience.com) para limpar a traquéia de todos os outros tecidos ligados a ele. Isto inclui: gânglios linfáticos, nervos laríngeo recorrente, gordura, glândula tireóide e restantes vasos pulmonares. A parte superior da traqueia requer atenção especial, para remover as cartilagens laríngeas grandes, sem comprometer o maior grupo de SMGque esteja alojada entre a cartilagem cricóide eo primeiro anel traqueal cartilaginoso (C1) 4.
- Cortar a traqueia para dentro da parte superior e da parte inferior entre C4 e C5 e, em seguida, cortado ambas as partes através do lúmen da traqueia.
3. A digestão enzimática e Transformação em suspensão de célula única (SCS)
- Incubar a parte inferior da traqueia, em 1 ml de 16 U dispase em um tubo de Eppendorf à temperatura ambiente (RT) durante 30 minutos, como descrito anteriormente 5. Em seguida, adicionar 0,5 mg / ml de DNase I em DMEM durante mais 20 min à temperatura ambiente.
- Remover as traqueias digeridas em meio fresco a recolha de uma placa de Petri esterilizada, e retirar o epitélio da superfície sob o microscópio de dissecação. Usar uma pipeta para transferir o meio contendo o epitélio evaporadas para um tubo cónico de 50 ml.
- Girar o epitélio despojado a 1.000 xg, a 4 ° C. Remover o sobrenadante e adicionar 0,1% de tripsina / EDTA e incubado com agitação thtubo e em 37 ° C agitando incubadora (200 rpm) durante 30 min. Após a incubação, utilizando uma ponta de 1000 uL, pipetar para cima e para baixo para quebrar aglomerados e formar uma suspensão de células simples.
- Coloque a traqueia superior, num tubo cónico contendo 1 ml de pronase 0,15%. Em seguida, incuba-se a 4 ° C durante 4 horas.
- Vortex suavemente o tubo e, em seguida, colocar a traqueia para meio fresco e recolha de confirmar sob o microscópio de dissecação que haja separação completa da superfície do epitélio (SE).
- Picar a traqueia com uma tesoura fina de abrir os compartimentos SMG e depois incubar durante mais uma hora à temperatura ambiente em pronase, com agitação lenta.
- Girar o tecido traqueal, remover a pronase, adicionar 0,1% de tripsina / EDTA e incubado a 37 ° C durante 30 min com agitação como acima descrito.
- Passagem das células digeridas, aglomerados e quaisquer partes restantes das glândulas através de agulhas 20G, 23G e 26G utilizando uma seringa de 10 ml. Repita as vezes várias passagens em cada um com o tamanho de agulha antescargo. Agora, a maioria das células deve ser em um SCS.
- Filtrar a suspensão através de um filtro 40 mM em seguida, lave o coador e girar as células. Em seguida reconstituir as células no volume apropriado de meio, e contar as células imediatamente para coloração de FACS e de classificação. Não deixar as células em 4 ° C ou sobre gelo durante várias horas, pois verificou-se que isto afecta a viabilidade e reduz gravemente a esfera formando eficiência.
4. A coloração para FACS e classificação
- Tome células suficientes para a preparação dos tubos não coradas e único de compensação coradas então manchar o resto das células com os anticorpos primários, Trop2 cabra e de rato ITGA6, durante 15 min a RT. Em seguida, lave com PBS ou recolher médio, removedor do sobrenadante com muito cuidado e quebrar o pellet celular.
- Mancha com o anticorpo secundário adequado, incubar no escuro à temperatura ambiente durante 10 min, lavar e remover o sobrenadante e em seguida romper a pelota.
- Nas FACSARIA, depois de ajustar sua tensão e compensação, portão para fora dos escombros, células muito pequenas, doublets celulares e células mortas. Em seguida, a maioria das células da SE deve ser TROP2 positivo enquanto 20-50% de células SMG será TROP2 + 6.
- Definir o gate de triagem para Trop2 + + ITGA6 células de células basais (SE) e para Trop2 + células (+ /-ITGA6 células positivas) de SMG (células do ducto).
5. Processamento células separadas para: Cultura in vitro e in vivo no modelo do
5,1 in vitro esfera formando 5-9 cultura
- Misturar 100 ul de "Factor de Crescimento reduzido Matrigel" com 100 ul de meio completo 10,11 (ver Tabela 1), contendo até 50.000 células seleccionadas em seguida, colocar esta mistura na câmara superior de um poço de 24 trans-poço. Em seguida, colocar 400 ul de meio completo em câmara inferior e incubar a 37 ° C. Alterar meio em câmara baixa a cada dois dias e adicionar 100 ul extra de Matrigela cada semana ou mais cedo, se torna-se fina.
5.2 No modelo in vivo
- Reconstituir o pellet de células classificadas em meio completo misturado 1:1 com matrigel a uma concentração de 5.000-10.000 células por 50 ul.
- Anestesiar os receptores C57/BL6 ratos. Administrar carprofeno (5 mg / kg) subcutaenously como analgésico. Esterilizar e raspar as costas em seguida, fazer uma incisão na pele central longitudinal na parte superior das costas. A incisão deve ser grande o suficiente para identificar o local da injecção de gordura almofada, bem como a bolha que se forma depois da injecção. Use o lado sem corte da tesoura para alargar malotes entre a pele ea parte de trás da parede torácica em ambos os lados para maximizar o acesso e visualização.
- Identificar a borda medial da escápula, empurrando o membro anterior mouse para cima e para trás para ver o movimento da escápula. Tomar 50 ul da suspensão de células para uma seringa de insulina 300 ul BD e injectá-la no corpo adiposo apenas à escápula medial e lateral, paraas vértebras. Você deve ser capaz de ver uma bolha se não você são muito profundas. Repita a mesma do outro lado, em seguida, o grampo ou o ponto de incisão na pele. Verificar ratos e dar carprofeno (5 mg / kg, SC), uma vez por dia, durante 48 hr.
- Após 3 semanas, a eutanásia ratos com pentobarbatol (0,1 cc mg/0.2, IP), abra a pele como acima e dissecar a almofada toda a gordura de ambos os lados com uma margem de segurança para evitar a falta de qualquer estrutura de tecido que pode ter se formado e estendido ao redor. Fixar em PFA e embed em parafina 12. Extremo cuidado deve ser empregado durante o corte e cortar o bloco não para ignorar ou esquecer uma estrutura. A melhor prática é cortar 40 um uma vez e depois cortar uma fatia mM 4, coloque-o sobre uma lâmina de vidro e examiná-lo sob o microscópio para confirmar se existem "estruturas epiteliais" nesta parte do bloco ou não. Se não há nada visto, então cortar mais uma vez e repita esta etapa.
6. Resultados representativos
Stripping das traqueias rato irá resultar numa traqueia desnudada que é visível por microscopia de luz, como mostrado na Figura 1A. Figura 1B mostra uma vista de campo claro de uma traqueia após decapagem com epitelial glândulas submucosas ser libertados a partir dos tecidos e dos cachos de uvas que se assemelham.
Pronase remove o epítopo ITGA6 e é por isso que as condutas TROP2 células não podem ser separados em ITGA6 + e - as populações. No entanto, dispase, que preserva o epítopo ITGA6, digere todos epitélio da superfície e as células do ducto, mesmo com tempos de incubação muito curtos e, portanto, não pode ser utilizado para separar as células basais da conduta 3. A citometria de fluxo das suspensões de células individuais deve mostrar a frente diagramas de dispersão e de dispersão lateral, que estão representados na Figura 2A. Uma boa separação das células do ducto do resto, se as células da traqueia deve ser visto com o anticorpo Trop2 em citometria de fluxo por fluorescência de células activado sorting (FACS), como visto na Figura 2B. Esferas deve ser visível na matrigel após cerca de 1 semana em cultura e são densos em aparência, como mostrado na Figura 3. A eficiência deste processo é a ordem de 1-2%, e as células individuais ainda estará presente no matrigel e provavelmente representam células de ductos glândulas submucosas que não possuem a capacidade de auto-renovação. A injecção de células-tronco duto no rato resultados almofada de gordura na formação da glândula submucosa estruturas semelhantes que são mostrados Figura 4. Estes são vistos nos blocos, mesmo sem coloração de H & E. Estes são esféricos e possuem um lúmen central. Muitas secções transversais necessitam de ser feitos por meio da almofada de gordura, a fim de não perder essas estruturas epiteliais.
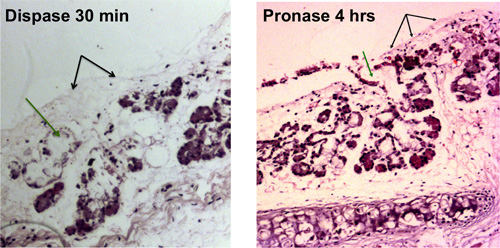
Figura 1. Digestão enzimática de epitélio traqueal. A remoção de células epiteliais da superfície é mostrada com blacsetas k, a remoção das células das glândulas submucosas dutos é mostrado com setas verdes. Traqueias desnudadas que são visíveis por microscopia de luz são apresentados após 30 min de digestão dispase e após 4 h de digestão com pronase.

Figura 2A. I. Citometria de fluxo das suspensões de células individuais que mostram dispersão frontal representante e gráficos de dispersão laterais da traquéia de rato depois de superfície epitelial stripping. ii. Representante parcelas FACS para TROP2 expressão em células do duto de traquéia de rato.
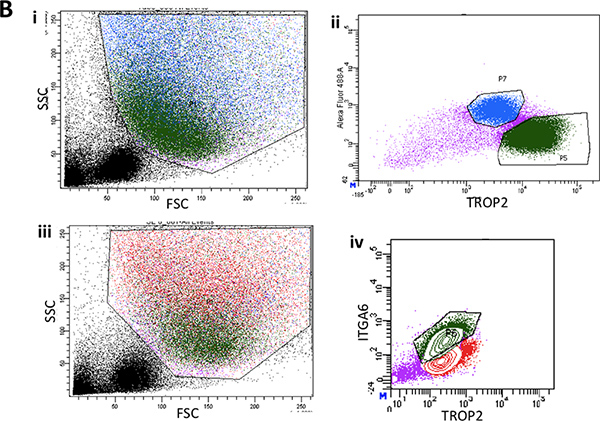
Figura 2B. I. A citometria de fluxo das suspensões de células isoladas a partir de epitélio da superfície despida de dois terços inferiores da traqueia de rato mostrando dispersão representativo para a frente e diagramas de dispersão lateral. ii. Lote típico de FACS ITGA6 expressão em surface epitélio. iii. Outra parcela FACS representante da frente e dispersão lateral do epitélio superfície mostrando volta gating da população de células basais em verde. iv. ITGA6 típico e TROP2 expressar população de células em verde.
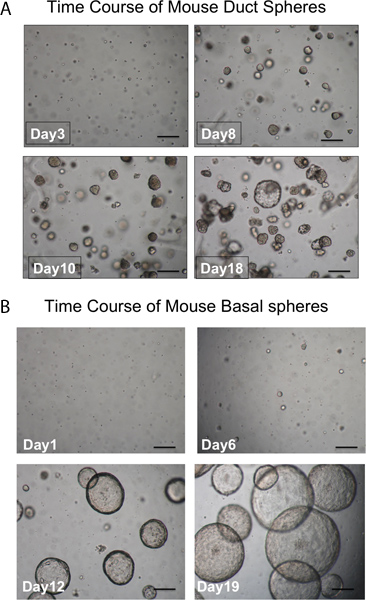
Figura 3. Evolução temporal do desenvolvimento das esferas. A. esferas de condutas. Esferas deve ser visível na matrigel após cerca de 1 semana de cultura e quase todos são densos em aparência. As células individuais que não formam esferas são também observadas. (Barra de escala = 50 mm). Esferas B. basais são maiores e luminal na aparência. As células individuais que não formam esferas são também observadas. (Barra de escala = 50 mm).
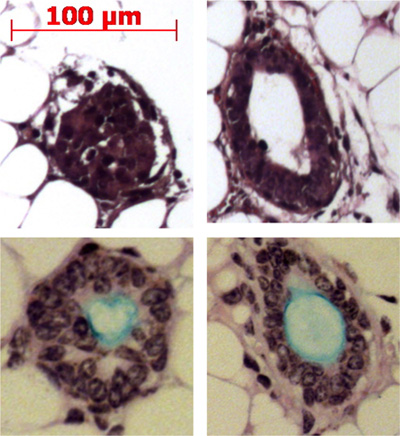
Figura 4. A injecção de células-tronco duto no rato resultados almofada de gordura na formação da glândula submucosa estruturas semelhantes. Estruturas representativassão mostrados na almofada de gordura e alguns são apresentados produzindo mucina (azul claro), com o ácido de Schiff periódico mancha azul Alcian.
Discussão
Esta técnica para isolar as células do ducto e basal das vias aéreas é importante para melhorar a compreensão de reparação e regeneração das vias aéreas e de doenças das vias respiratórias. As técnicas descritas aqui incluem alguns passos críticos. O primeiro é o período de digestão enzimática optimizado. A segunda é a criação de uma suspensão de células individuais através de passagens em série com agulhas calibre progressivamente mais elevadas para impedir ruptura da célula, mas a romper-se g...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Gostaríamos de reconhecer as grandes Stem Cell FACS Centro de Pesquisa e agradecer especialmente Jessica Scholes e Felicia Codrea por sua ajuda com a classificação celular. O trabalho foi financiado pelo CIRM RN2-00904-1, K08 HL074229, da American Thoracic Society / Fundação DPOC ATS-06-065, A Fundação preocupação, a UCLA Jonsson Comprehensive Cancer Center Thoracic Oncology SPORE Cancer Program / Pulmão, da Universidade da Califórnia do Câncer Pesquisa Comissão de Coordenação e Gwynne Hazen cereja Memorial Laboratories (BG).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | |
| Conclua médio 10: DMEM-F-12, 50/50, 1X) | Mediatech | 15-090 CV- | |
| Hepes (15 mM) | Invitrogen | 15630 | |
| Bicarbonato de sódio (3,6 mM ou 0,03%) | Invitrogen | 25080 | |
| L-glutamina (4 mM) | Mediatech | 25-005 Cl- | |
| Penicilina (100 U / ml) | Mediatech | 30-001 CI- | |
| Estreptomicina (100 ug / m) | Mediatech | 30-001 CI- | |
| Anfotericina B (0,25 ug / ml) | Lonza | 17-836R | |
| EmSulin (10 ug / ml) | Sigma | I6634 | |
| Transferrina (5 ug / ml) | Sigma | T1147 | |
| Toxina da cólera (0,1 ng / ml) | Sigma | C8052 | |
| Factor de Crescimento Epidérmico (25 ng / ml) | BD | 354001 | |
| Extrato de Pituitária Bovina (30 ug / ml) | Invitrogen | 13028-014 | |
| O soro de bovino fetal (5%) | Pescador | SH3008803HI | |
| Ácido retinóico (0,05 uM) | Sigma | R2625 | |
| Fator de Crescimento reduzido Matrigel | BD | 354230 |
Tabela 1. Conclua componentes de mídia.
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| Pronase | Roche | 10165921001 | Usado em 0,15%: -O / n a 4 ° C para isolar a digestão total de células para a cultura de traqueia (ALI) Digestão hr -4 4 ° C para isolar SMG |
| Dispase | BD Biosciences | 354235 | Usado menos 16 Unidades: 30 min à TA |
| DNase I | Sigma | DN25 | Utilizada a 0,5 mg / ml: 20-30 min à temperatura ambiente |
Enzimas Tabela 2. Usado para a digestão enzimática da traqueia.
Referências
- Bartlett, J. A., Fischer, A. J., McCray, P. B. Innate immune functions of the airway epithelium. Contrib. Microbiol. 15, 147-163 (2008).
- Finkbeiner, W. E. Physiology and pathology of tracheobronchial glands. Respir. Physiol. 118, 77-83 (1999).
- Hegab, A. E. A Novel Stem/Progenitor Cell Population from Murine Tracheal Submucosal Gland Ducts with Multipotent Regenerative Potential. Stem Cells. , (2011).
- Jeffery, P. K. Morphologic features of airway surface epithelial cells and glands. Am. Rev. Respir. Dis. 128, S14-S20 (1983).
- Rock, J. R. Basal cells as stem cells of the mouse trachea and human airway epithelium. Proc. Natl. Acad. Sci. U.S.A. 106, 12771-12775 (2009).
- Goldstein, A. S. Trop2 identifies a subpopulation of murine and human prostate basal cells with stem cell characteristics. Proc. Natl. Acad. Sci. U.S.A. 105, 20882-20887 (2008).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- McQualter, J. L., Yuen, K., Williams, B., Bertoncello, I. Evidence of an epithelial stem/progenitor cell hierarchy in the adult mouse lung. Proc. Natl. Acad. Sci. U.S.A. 107, 1414-1419 (2010).
- Inayama, Y. In vitro and in vivo growth and differentiation of clones of tracheal basal cells. Am. J. Pathol. 134, 539-549 (1989).
- You, Y., Richer, E. J., Huang, T., Brody, S. L. Growth and differentiation of mouse tracheal epithelial cells: selection of a proliferative population. Am. J. Physiol. Lung. Cell. Mol. Physiol. 283, L1315-L1321 (2002).
- Wu, X., Peters-Hall, J. R., Bose, S., Pena, M. T., Rose, M. C. Human Bronchial Epithelial Cells Differentiate to 3D Glandular Acini on Basement Membrane Matrix. Am. J. Respir. Cell Mol. Biol. , (2010).
- Ooi, A. T. Presence of a putative tumor-initiating progenitor cell population predicts poor prognosis in smokers with non-small cell lung cancer. Cancer Res. 70, 6639-6648 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados