Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Isolement de cellules basales et les cellules sous-muqueux du canal de la glande de la souris Trachée
Dans cet article
Résumé
Ici, nous démontrons notre protocole pour l'isolement de cellules basales et sous-muqueuse du canal de la glande trachées de souris. Nous démontrons également la méthode de l'injection de cellules souches dans le coussinet adipeux de souris dorsale de créer un In vivo Modèle de régénération glande sous-muqueuse.
Résumé
Les grandes voies aériennes sont directement en contact avec l'environnement et donc vulnérables aux blessures des toxines et des agents infectieux qui nous souffle dans 1. Les grandes voies aériennes exigent donc un mécanisme de réparation efficace pour protéger nos corps. Ce processus de réparation se produit à partir de cellules souches dans les voies respiratoires et d'isoler ces cellules souches à partir des voies respiratoires est importante pour comprendre les mécanismes de réparation et de régénération. Il est également important pour la compréhension de réparation anormale qui peut conduire à des maladies des voies respiratoires 2. Le but de cette méthode est d'isoler une population de cellules souches roman de la souris conduits des glandes sous-muqueuses trachéales et de placer ces cellules in vitro et dans des modèles in vivo pour identifier les mécanismes de réparation et de régénération des glandes sous-muqueuses 3. Cette production présente des méthodes qui peuvent être utilisées pour isoler et doser les cellules souches conduit et de la base de la grande voies respiratoires 3. Cela nous permettrapour étudier les maladies des voies respiratoires, comme la fibrose kystique, l'asthme et la bronchopneumopathie chronique obstructive. À l'heure actuelle, il n'existe pas de méthodes d'isolement des cellules des glandes sous-muqueuses conduit et il n'y a pas de modèles in vivo pour étudier la régénération des glandes sous-muqueuses.
Protocole
Aperçu des étapes
1. Dissection de la trachée
2. Nettoyage de la trachée et le couper
3. Digestion enzymatique et la transformation en suspension cellulaire unique
4. Coloration pour FACS et le tri
5. Le traitement de cellules triées in vivo et in vitro sur des modèles
1. Dissection de la trachée
- Euthanasier la souris avec une injection intrapéritonéale de 0,1 mg/0.2 cc de pentobarbital.
- Couper la paroi abdominale, et déplacer l'intestin vers le côté pour exposer l'aorte abdominale et ensuite le disséquer.
- Ouvrez le coffre en coupant à travers la membrane et la paroi thoracique antérieure des deux côtés pour exposer le cœur et les poumons. Continuer la découpe dans le col enlever les glandes salivaires gras et d'exposer la trachée.
- Retirer le thymus et couper le poumon de ses liens ci-dessous et derrière. Separmangé la trachée de l'oesophage par l'insertion d'une pince entre eux puis couper la trachée, à sa partie supérieure la plus au-dessus de sa liaison avec le larynx. Ensuite, maintenez la trachée avec une pince et le disséquer de son attachement et de continuer vers le bas pour l'enlever du cœur et des poumons en bloc. Découpez le coeur et les poumons à proximité du hile pour inclure la plupart des bronches droite et gauche principale.
- Placez la trachée dans une petite boîte de Petri contenant la collecte moyenne sur la glace.
2. Nettoyage de la trachée et Cutting It
- Sous le microscope de dissection, utiliser une pince pointe très fine (n ° 5) et Vannas ciseaux Tübingen (FST 15003-08 finescience.com) pour nettoyer la trachée à partir de tous les autres tissus qui s'y rattachent. Cela comprend: les ganglions lymphatiques, du nerf laryngé récurrent, la graisse, la glande thyroïde et des autres vaisseaux pulmonaires. La partie supérieure de la trachée nécessite une attention particulière, pour enlever les cartilages du larynx grands sans pour autant compromettre le plus grand groupe de SMGqui est logé entre le cartilage cricoïde et le premier anneau de la trachée cartilagineux (C1) 4.
- Couper la trachée dans la partie supérieure et la partie inférieure entre C4 et C5, puis découpé les deux parties à travers la lumière de la trachée.
3. Digestion enzymatique et Transformation en suspension cellulaire unique (SCS)
- Incuber la partie inférieure de la trachée dans 1 ml de 16 dispase U dans un tube Eppendorf à température ambiante (RT) pendant 30 min, tel que décrit précédemment 5. Ajoutez ensuite 0,5 mg / ml de DNase I dans du DMEM pendant 20 minutes supplémentaires à température ambiante.
- Retirez les trachées digérés dans le milieu de la collecte de frais dans une boîte de Pétri stérile, et de retirer l'épithélium de surface sous la loupe binoculaire. Utiliser une pipette pour transférer le milieu contenant l'épithélium dépouillés dans un tube conique de 50 ml.
- Isoler l'épithélium dénudé à 1000 xg à 4 ° C. Enlever le surnageant et ajouter 0,1% de trypsine / EDTA et incuber en agitant eTube électronique à un 37 ° C Incubateur agitateur (200 rpm) pendant 30 min. Après l'incubation, avec une pointe de 1000 pi, pipeter de haut en bas pour briser les mottes et forment une suspension cellulaire unique.
- Placer la trachée supérieure dans un tube conique contenant 1 ml de pronase 0,15%. Puis incuber à 4 ° C pendant 4 heures.
- Vortexer doucement le tube, puis placer la trachée dans le milieu de collecte frais et confirmer sous le microscope de dissection qu'il ya un complet détachement de l'épithélium de surface (SE).
- Hachez la trachée avec une paire de ciseaux fins d'ouvrir les compartiments SMG puis incuber pendant une heure de plus dans la pronase à température ambiante sous agitation lente.
- Isoler le tissu trachéal, retirez la pronase, ajouter 0,1% de trypsine / EDTA et incuber à 37 ° C pendant 30 min en agitant comme ci-dessus.
- Passage des cellules digérées, des bouquets et des morceaux restants de glandes à travers des aiguilles 20G, 23G 26G et en utilisant une seringue de 10 ml. Répéter les passages fois plusieurs les uns avec les aiguilles avantdémissionner. Maintenant, la plupart des cellules doit être dans un SCS.
- Filtrer la suspension à travers un filtre 40 uM puis laver le filtre et centrifuger les cellules. Puis reconstituer les cellules dans le volume approprié de milieu, compter les cellules et passer immédiatement à coloration FACS et le tri. Ne laissez pas les cellules à 4 ° C ou sur de la glace pendant plusieurs heures, car nous avons trouvé que cela affecte la viabilité et réduit considérablement la sphère constituant efficacité.
4. Coloration pour FACS et tri
- Prenez suffisamment de cellules pour préparer les tubes non colorées et unique compensation teinté puis colorer le reste des cellules avec des anticorps primaires, TROP2 chèvre et le rat ITGA6, pendant 15 min à température ambiante. Ensuite laver avec du PBS ou de collecte moyen, dissolvant le surnageant avec beaucoup de soin et de briser le culot cellulaire.
- Colorer avec l'anticorps secondaire approprié, incuber dans l'obscurité à température ambiante pendant 10 minutes, laver et enlever le surnageant et le culot puis casser.
- Sur le FACSARIA, après avoir réglé votre tension et de compensation, porte sur les débris, les cellules très petites, doublets cellulaires et les cellules mortes. Ensuite, la plupart des cellules en provenance du SE devrait être TROP2 positif, tandis que 20-50% des cellules SMG sera TROP2 + 6.
- Réglez votre porte de tri pour TROP2 + + ITGA6 cellules du SE (cellules basales) et pour TROP2 + cellules (+ /-ITGA6 cellules positives) de SMG (cellules des canaux).
5. Traitement cellules triées pour: culture in vitro et in vivo dans le modèle de la
5.1 Dans la sphère vitro formant 5-9 culture
- Mélanger 100 ul de "Facteur de croissance réduite Matrigel" avec 100 ul de milieu complet 10,11 (voir tableau 1) contenant jusqu'à 50.000 cellules triées puis mettre ce mélange dans la chambre supérieure de 24 et trans-même. Ensuite, mettre 400 ul de milieu complet dans la chambre inférieure et incuber à 37 ° C. Changer le milieu de la chambre basse tous les jours et ajouter supplément de 100 ul de Matrigelchaque semaine ou plus tôt si elle devient mince.
5.2 Dans le modèle in vivo
- Reconstituer la cellule triée culot dans du milieu complet mélange 1:1 avec matrigel à une concentration de 5.000-10.000 cellules par 50 pl.
- Anesthésier les bénéficiaires C57/BL6 souris. Administrer carprofène (5 mg / kg) subcutaenously comme analgésique. Stériliser et raser le dos, puis faire une incision cutanée longitudinale centrale dans le haut du dos. L'incision doit être assez grand pour identifier le site du coussinet adipeux par injection ainsi que la bulle qui se forme après l'injection. Utilisez le côté non tranchant des ciseaux pour élargir poches entre la peau et l'arrière de la paroi thoracique, des deux côtés afin de maximiser l'accès et la visualisation.
- Identifier le bord interne de l'omoplate en appuyant sur la patte avant de la souris et en arrière pour voir le mouvement omoplate. Prenez 50 ul de la suspension cellulaire dans un 300 seringue d'insuline BD ul et l'injecter dans le coussinet adipeux juste en dedans de l'omoplate et latéraleles vertèbres. Vous devriez être capable de voir une bulle, sinon vous êtes trop profonde. Répétez la même chose de l'autre côté puis clip ou point de l'incision cutanée. Vérifiez souris et donner carprofène (5 mg / kg, SC) une fois par jour pendant 48 h.
- Après 3 semaines, euthanasier les souris avec pentobarbatol (0,1 mg/0.2 cc, IP), ouvrez la peau comme ci-dessus et de disséquer le pavé toute la graisse des deux côtés avec une marge de sécurité pour éviter de manquer une structure de tissu qui pourrait avoir été formé et étendu autour. Fixer en PFA et embed dans la paraffine 12. Un soin extrême doit être employée pendant le parage et le découpage du bloc de ne pas contourner ou d'ignorer une structure. La meilleure pratique consiste à couper 40 pm une fois puis couper une tranche 4 pm, placez-le sur une lame de verre et l'examiner au microscope afin de confirmer s'il ya des «structures épithéliales» dans cette partie du bloc ou non. S'il n'y a rien vu, puis coupez une fois de plus et répétez cette étape.
6. Les résultats représentatifs
Stripping des trachées de souris se traduira par une trachée dénudée qui est visible par microscopie optique comme indiqué sur la figure 1A. figure 1B montre la vue en fond clair d'une trachée après épithéliale stripping avec glandes sous-muqueuses étant libérés par les tissus et les grappes qui ressemblent à des raisins.
Pronase supprime l'épitope ITGA6 et c'est pourquoi les TROP2 cellules des canaux ne peuvent pas être séparés en ITGA6 + et - des populations. Cependant, la dispase, qui préserve l'épitope ITGA6, digère tout l'épithélium de surface et les cellules des canaux même avec des temps d'incubation très courte, et ne peut donc pas être utilisé pour séparer conduit à partir des cellules basales 3. La cytométrie en flux des suspensions de cellules isolées doivent montrer en avant des diagrammes de dispersion dispersion et le côté qui sont représentés dans la figure 2A. Une bonne séparation des cellules du canal du reste, si les cellules trachéales doivent être considérés avec l'anticorps TROP2 en cytométrie en flux pour cellules activées par fluorescence Sorting (FACS) comme on le voit sur la figure 2B. Sphères doit être visible dans le matrigel après environ 1 semaine de culture et sont denses en apparence comme le montre la figure 3. L'efficacité de ce processus est de l'ordre de 1-2% et des cellules individuelles seront toujours présents dans le matrigel et représentent probablement les cellules des canaux des glandes sous-muqueuses qui ne possèdent pas la capacité d'auto-renouvellement. L'injection de cellules souches conduit à des résultats du coussinet adipeux de souris dans la formation de sous-muqueuse glandulaire comme des structures qui sont présentés Figure 4. Ceux-ci sont visibles dans les blocs de même sans coloration H & E. Ceux-ci sont sphériques et possèdent une lumière centrale. Beaucoup de sections doivent être faits par l'intermédiaire du coussinet adipeux afin de ne pas manquer ces structures épithéliales.
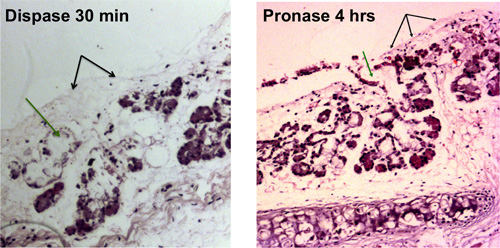
Figure 1. Digestion enzymatique de l'épithélium trachéal. Extraction des cellules épithéliales de surface est représenté avec blacflèches k, la suppression des cellules dans les conduits des glandes sous-muqueuses est indiqué par des flèches vertes. Trachées dénudées qui sont visibles au microscope optique sont présentés après 30 min de la digestion dispase et après 4 heures de digestion pronase.

La figure 2A. I. La cytométrie en flux des suspensions cellulaires simples montrant représentant diffusion vers l'avant et des diagrammes de dispersion secondaires de trachées de souris après décapage surface épithéliale. ii. Représentatifs des parcelles FACS pour TROP2 expression dans les cellules des canaux de trachées de souris.
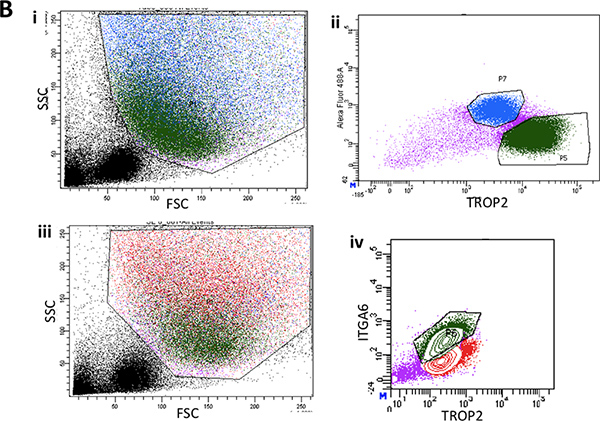
La figure 2B. I. La cytométrie en flux des suspensions de cellules isolées à partir de l'épithélium de surface dénudée des deux tiers inférieurs de la trachée de souris montrant dispersion représentant l'avant et des diagrammes de dispersion secondaires. ii. Typique parcelle FACS de l'expression dans ITGA6 surface épithélium. iii. Un autre tracé représentatif FACS de l'avant et la diffusion latérale de l'épithélium de surface montrant retour déclenchement de la population cellulaire basale en vert. iv. ITGA6 typique et TROP2 population de cellules exprimant en vert.
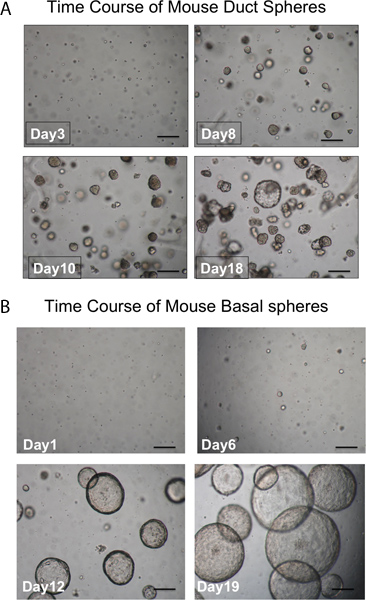
Figure 3. Évolution dans le temps de développement des sphères. A. sphères conduits. Sphères doit être visible dans le matrigel après environ 1 semaine dans la culture et la quasi-totalité sont denses en apparence. Les cellules individuelles qui ne font pas sphères sont également observées. (Échelle = 50 pm). B. sphères basales sont plus grandes et luminale en apparence. Les cellules individuelles qui ne font pas sphères sont également observées. (Échelle = 50 pm).
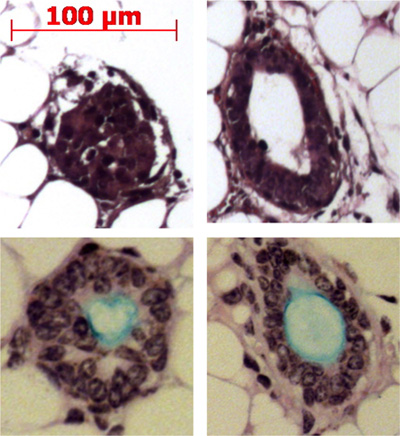
Figure 4. L'injection de cellules souches conduit à des résultats du coussinet adipeux de souris dans la formation de sous-muqueux glande structures semblables. Structures représentativessont présentés dans le coussinet adipeux et certains sont présentés production de mucine (bleu clair) avec le bleu Alcian acide périodique Schiff tache.
Discussion
Cette technique conduit à isoler des cellules basales et des voies respiratoires est importante pour améliorer notre compréhension de la réparation des voies respiratoires et de la régénération et de maladies des voies respiratoires. Les techniques décrites ici sont quelques critiques. La première est la période de digestion enzymatique optimisé. Le second est la création d'une suspension cellulaire unique à travers passage en série avec des aiguilles de jauge progressivement plus élevés pour éviter...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Nous tenons à remercier les grandes souches cellulaires FACS Centre de Recherche et surtout remercier Jessica Scholes et Felicia Codrea pour leur aide dans le tri cellulaire. Le travail a été financé par le CIRM RN2-00904-1, K08 HL074229, l'American Thoracic Society / MPOC Fondation ATS-06-065, La Fondation Concern, UCLA Jonsson Le Comprehensive Cancer Center SPORE thoracique Cancer Oncology Program / poumon, le cancer de l'Université de Californie coordination de la recherche et du Comité Gwynne Hazen cerise Memorial Laboratories (BG).
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | |
| Milieu complet 10: DMEM-F-12, 50/50, 1X) | Mediatech | 15-090 CV- | |
| Hepes (15 mM) | Invitrogen | 15630 | |
| Le bicarbonate de sodium (3,6 mm ou 0,03%) | Invitrogen | 25080 | |
| L-glutamine (4 mM) | Mediatech | 25-005 Cl- | |
| Pénicilline (100 U / ml) | Mediatech | 30-001-CI | |
| Streptomycine (100 ug / m) | Mediatech | 30-001-CI | |
| L'amphotéricine B (0,25 pg / ml) | Lonza | 17-836R | |
| EnSulin (10 pg / ml) | Sigma | I6634 | |
| Transferrine (5 ug / ml) | Sigma | T1147 | |
| La toxine du choléra (0,1 pg / ml) | Sigma | C8052 | |
| Le facteur de croissance épidermique (25 ng / ml) | BD | 354001 | |
| Extrait pituitaire bovin (30 pg / ml) | Invitrogen | 13028-014 | |
| Sérum de veau fœtal (5%) | Pêcheur | SH3008803HI | |
| L'acide rétinoïque (0,05 uM) | Sigma | R2625 | |
| Facteur de croissance réduit Matrigel | BD | 354230 |
Tableau 1. Remplissez composantes médias.
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| Pronase | Roche | 10165921001 | Utilisé à 0,15%: -O / n à 4 ° C pour isoler la digestion nombre total de cellules trachéales (pour la culture ALI) -4 Digestion h 4 ° C pour isoler SMG |
| Dispase | BD Biosciences | 354235 | Utilisé à 16 unités: 30 min à température ambiante |
| DNase I | Sigma | DN25 | Utilisé à raison de 0,5 mg / ml: 20-30 min à température ambiante |
Les enzymes du tableau 2. Utilisée pour la digestion enzymatique de la trachée.
Références
- Bartlett, J. A., Fischer, A. J., McCray, P. B. Innate immune functions of the airway epithelium. Contrib. Microbiol. 15, 147-163 (2008).
- Finkbeiner, W. E. Physiology and pathology of tracheobronchial glands. Respir. Physiol. 118, 77-83 (1999).
- Hegab, A. E. A Novel Stem/Progenitor Cell Population from Murine Tracheal Submucosal Gland Ducts with Multipotent Regenerative Potential. Stem Cells. , (2011).
- Jeffery, P. K. Morphologic features of airway surface epithelial cells and glands. Am. Rev. Respir. Dis. 128, S14-S20 (1983).
- Rock, J. R. Basal cells as stem cells of the mouse trachea and human airway epithelium. Proc. Natl. Acad. Sci. U.S.A. 106, 12771-12775 (2009).
- Goldstein, A. S. Trop2 identifies a subpopulation of murine and human prostate basal cells with stem cell characteristics. Proc. Natl. Acad. Sci. U.S.A. 105, 20882-20887 (2008).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- McQualter, J. L., Yuen, K., Williams, B., Bertoncello, I. Evidence of an epithelial stem/progenitor cell hierarchy in the adult mouse lung. Proc. Natl. Acad. Sci. U.S.A. 107, 1414-1419 (2010).
- Inayama, Y. In vitro and in vivo growth and differentiation of clones of tracheal basal cells. Am. J. Pathol. 134, 539-549 (1989).
- You, Y., Richer, E. J., Huang, T., Brody, S. L. Growth and differentiation of mouse tracheal epithelial cells: selection of a proliferative population. Am. J. Physiol. Lung. Cell. Mol. Physiol. 283, L1315-L1321 (2002).
- Wu, X., Peters-Hall, J. R., Bose, S., Pena, M. T., Rose, M. C. Human Bronchial Epithelial Cells Differentiate to 3D Glandular Acini on Basement Membrane Matrix. Am. J. Respir. Cell Mol. Biol. , (2010).
- Ooi, A. T. Presence of a putative tumor-initiating progenitor cell population predicts poor prognosis in smokers with non-small cell lung cancer. Cancer Res. 70, 6639-6648 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon