Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La generación de células T reguladoras inducidas de células humanas primarias T vírgenes y de memoria
En este artículo
Resumen
Se describe un método para la generación de regulación, la memoria y el ingenuo células T de un donante de sangre humana única. Polarizada Tregs puede ser entonces en comparación con otros subconjuntos en una variedad de aplicaciones genéticas y funcionales con homogeneidad genética, incluyendo un ensayo de supresión también detallan aquí.
Resumen
El desarrollo y mantenimiento de las células CD4 + inmunosupresores células T reguladoras (Tregs) contribuir a la tolerancia periférica necesaria para permanecer en homeostasis inmunológica con la gran cantidad de antígenos propios y comensales en y sobre el cuerpo humano. Las perturbaciones en el equilibrio entre las células T reguladoras y células T inflamatorias convencionales puede resultar en la inmunopatología o el cáncer. Aunque la inyección terapéutica de Tregs ha demostrado ser eficaz en modelos murinos de la colitis 1, diabetes tipo I 2, la artritis reumatoide y enfermedad de injerto contra huésped, 4 varias diferencias fundamentales en humanos versus ratón TREG biología 5 hasta ahora ha impedido el uso clínico. La falta de número suficiente, la pureza, la estabilidad y la especificidad de recalada terapéutico Tregs necesaria una plataforma dinámica de desarrollo TREG humana en la que para optimizar las condiciones para su expansión ex vivo 6.
Aquí Describe un método para la diferenciación de las células T reguladoras inducidas (iTregs) a partir de un solo donante de sangre periférica humana que se puede dividir en cuatro etapas: el aislamiento de células mononucleares de sangre periférica, la selección magnética de células T CD4 +, en el cultivo celular in vitro y activadas por fluorescencia clasificación de células (FACS) de subconjuntos de células T. Puesto que la transcripción TREG firma factor de forkhead P3 caja (FoxP3) es un factor de transcripción inducida por activación en los seres humanos 7 y ningún otro marcador único existe, un panel de combinatoria de marcadores debe ser utilizado para identificar las células T con actividad supresora. Después de seis días de cultivo, las células de nuestro sistema pueden ser demarcadas en las células T ingenuas, las células T de memoria o iTregs en función de su expresión relativa de CD25 y CD45RA. Mientras que las células T ingenuas de memoria y tienen diferentes informes sobre las necesidades de polarización y plasticidades 8, pre-clasificación de la población de células T inicial en CD45RA + y CD45RO + subconjuntos puede be utiliza para examinar estas discrepancias. De acuerdo con los demás, nuestra CD25 Hola CD45RA - iTregs expresar altos niveles de FoxP3 9, GITR y CTLA 4-11 y bajos niveles de CD127 12. Tras FACS de cada población, las células resultantes pueden ser utilizados en un ensayo supresor que evalúa la capacidad relativa para retardar la proliferación de carboxifluoresceína succinimidil éster (CFSE)-etiquetados células T autólogas.
Protocolo
1. Aislamiento de células mononucleares de sangre periférica (CMSP) de capa leucocitaria
- Adquirir una unidad de la capa leucocitaria del hospital o las inmediaciones del centro de sangre. Nuestro banco de sangre nos da alrededor de 40-60 ml de la capa leucocitaria obtenida por unidad de donantes de sangre normales.
- Verter la sangre en un frasco de vidrio esterilizado 500 ml que contiene PBS estéril para diluir la capa leucocitaria. El volumen final de PBS + capa leucocitaria debe ser de 250 ml.
- Llenar diez tubos cónicos de 50 ml cada uno con 20 ml solución Lymphoprep.
- Suavemente superponer la solución Lymphoprep con 25 ml de la capa leucocitaria diluido, teniendo cuidado de no molestar a la solución Lymphoprep.
- Derivado tubos durante 30 minutos a temperatura ambiente a 500 x g. Asegúrese de apagar el freno de la centrífuga, por lo que no se perturbe la fracción de linfocitos.
- Recoger las PBMC en la interfase entre la Lymphoprep y las capas medias de plasma con una pipeta. Aspirar el plasma de media hasta alrededor de 1 mltodavía cubre la capa de la capa leucocitaria que contiene las CMSP. Utilice una pipeta de 10 ml para transferir PBMCs ml a un tubo de nuevo 50.
- Lavar las células dos veces con PBS y después se resuspenden las células en 50 ml de medio RPMI frío para el recuento en un hemocitómetro. La recuperación típica es de 8 x 10 8 - 1 x 10 9 PBMCs.
Este procedimiento puede ser reducido para pequeños volúmenes de sangre. La dilución de muestras de sangre entera es de 1:1 en PBS.
2. Selección magnética negativa de las células CD4 + Total de células T, CD4 + CD45RA + células T ingenuas o CD4 + CD45RO + células T de memoria de PBMC usando kits EasySep enriquecimiento (Tecnologías de la célula madre)
Pasos a seguir para 1 x 10 8 a 4.25 x 10 8 PBMCs.
- Resuspender las PBMC a una concentración final de 5 x 10 7 por ml en PBS que contenía 2% de FBS y EDTA 1 mM. Mueva las células a un nuevo tubo de polipropileno 14 ml de fondo redondo.
- Aislamiento del total de linfocitos CD4 + células T humanos por parte de la selección negativa: añadir CD4 + humanas de células T Cóctel de enriquecimiento de anticuerpos (50 l por ml de PBMCs), mezcla y se incuba durante 10 minutos a temperatura ambiente.
- Aislamiento de células T humanas no tratados previamente por selección negativa: añadir 50 l de anticuerpo anti-CD45RO por ml de suspensión de células PBMC, mezclar e incubar durante 15 minutos a temperatura ambiente. Añadir un cóctel de enriquecimiento incluye en el kit (50 l de por ml de CMSP), mezcla y se incuba a temperatura ambiente durante 10 minutos.
- El aislamiento de las células T de memoria por selección negativa: añadir CD4 humano de células T de memoria + cocktail de enriquecimiento de anticuerpos (50 l por ml de PBMCs), mezcla y se incuba durante 10 minutos a temperatura ambiente.
- Mezclar bien para partículas magnéticas igualmente distribuirlos a lo largo de la solución. ¿Es nanopartículas no vórtice del juego de ingenuo.
- Añadir las partículas magnéticas (100 l por ml de PBMCs para CD4 + totales y selección ingenuo células T, 50 l por ml de PBMCs para la selección de células T de memoria). Mezclar pipeteando suavemente 2-3 veces y se incuba a temperatura ambiente durante 10 minutos para la selección de células T ingenuas o 5 minutos para CD4 de memoria o total + selección de células T.
- Añadir PBS que contenía 2% de FBS y 1 mM de EDTA para llevar el volumen hasta 10 ml por tubo. Mezclar suavemente pipeteando 2-3 veces antes de colocar el tubo sin tope salarial en la plata del imán EasySep durante 5, 10 o 2,5 para el total de CD4 + T cells, subconjuntos ingenua y la memoria, respectivamente.
- Con el tubo aún en imán EasySep, vierta el líquido en un tubo nuevo de 50 ml para aislar las células de interés.
- Repita los pasos 2.5 y 2.6 para una mejor recuperación.
3. Condiciones de cultivo celular para inducir células T reguladoras
- El día antes de los pasos 1 y 2, las placas de cultivo de tejidos capa por primera diluyendo anticuerpo anti-CD3 (OKT3 clon) a una concentración de 1 mg / ml en PBS estéril. Para una placa de 6 pocillos agregar 2 ml de PBS + anti-CD3 por pozo, por una placa de 12 y agregar 1 ml o una placa de 24 pocillos añadir 500 ml por pocillo. Mantener la placa revestida a 4 ° C hasta su uso.
- Para preparar el medio de polarización mediante la adición de 10% inactivado por calor suero fetal bovino (FBS), 100 U / ml de penicilina, estreptomicina 100 mg / ml y 50 mM mercaptoetanol β-a RPMI-1640 suplementado con pre-2,06 mM Glutamax-I y 25 mM tampón HEPES. A continuación, agregue 2 ng / ml de TGF-β y 5 ng / mL de IL-2. Aquí, uno puede agregar ligandos o inhibidores de interés para los medios de comunicación. Resuspender las células de la etapa 2 en una concentración de 2 x 10 6 células / ml de medio de polarización.
- Pre-caliente las placas a 37 ° C y aspirar el PBS de anti-CD3 recubiertos pozos antes de añadir las células. Añadir 4 ml por pocillo de la suspensión celular para una placa de 6 pocillos, 2 ml de células de una placa de 12 o bien 1 ml de células de un 24 pocillos. Rellena los pozos vacíos con PBS para reducir la evaporación de lamedios de comunicación. Incubar durante 3 días a 37 ° C / 5% de CO 2.
- El recubrimiento posterior el día 3, la desaceleración placa en una centrífuga durante 5 minutos a 500 x g. Sin perturbar las células T en la parte inferior de la placa, retirar la mitad de los medios de comunicación y reemplazar con medio fresco. Alternativamente, si el bien se convierte en hacinamiento con las células (concentración por encima de 3 x 10 6 / ml), se divide el volumen en partes iguales en otra placa recubierta con anti-CD3 y añadir medio fresco de nuevo hasta el volumen original. Incubar durante dos a tres días más a 37 ° C / 5% de CO 2.
4. Fluorescencia de células activadas clasificación (FACS) de tres poblaciones de células T
- Preparar FACS tampón de lavado mediante la adición de 0,5% (w / v) de albúmina de suero bovino (BSA) y 2 mM de EDTA a PBS estéril. Tampón a 4 ° C a hacer frío.
- Eliminar las células de cultivo de células bien y enjuagar cada pocillo con 2 ml de PBS para asegurar la recuperación de células completa. Coloque todas las células en tubos de 50 ml de polipropileno y centrifugar a 500 xg durante 10minutos a 4 ° C.
- Contar las células en un hemocitómetro para determinar la densidad celular.
- Lugar 3.5 x 10 5 células por tubo en cuatro diferentes redondo de 5 ml tubos de la base de poliestireno para los controles de compensación. Coloque las células que quedan en tubos de 50 ml de polipropileno, no más de 35 x 10 6 células por tubo.
- Centrifugue las células durante 5 minutos a 4 ° C y los medios de comunicación aspirado. Resuspender las células se ordenan en 90 l de tampón de lavado en frío por 1 x 10 6 células. Resuspender en 100 l de tampón de lavado en frío de los tubos de control de compensación.
- Para las células para ser ordenados, combine 2 l de anti-CD25-PE, 3 l de anti-CD45RA-PE-Cy5 y 1 l de anti-CD127-APC por 1 x 10 6 células. Añadir ningún anticuerpo para el tubo de compensación primer control, 2 l de anti-CD25-PE para el segundo tubo, 3 l de anti-CD45RA - PE-Cy5 al tercer tubo and1 l de anti-CD127-APC para el cuarto tubo. Incubar todos los tubos en hielo durante 45 minutos en la oscuridad.
- Añadir 10 ml de tampón de lavado en frío a las células para ser ordenados y 1 ml a los tubos de compensación de control. Centrifugar todas las células a 500 xg durante 5 minutos a 4 ° C.
- Aspirar células de amortiguamiento y resuspende a una concentración de 1 x 10 7 células por ml de tampón de lavado. Añadir 1,5 l de DNasa II por ml de células antes de filtrar a través de un filtro de células 40 mM de nylon. Mueva células a múltiples tubos de 5 ml de polipropileno de fondo redondo con no más de 3,5 ml por tubo. Resuspender las células de compensación de control en 300 L de tampón de lavado.
- Ajuste la compensación en el citómetro de flujo para reducir al mínimo la detección MoFlo cruz por el PE, APC y los filtros de PE-Cy5. Establecer las puertas para ordenar iTregs (CD25 CD127 Hola -/LOW CD45RA - las células), no tratados previamente (CD25-CD45RA +) y memoria (CD25 - CD45RA -) las células T en 5 ml de fondo redondo tubos de poliestireno que contienen 1 ml de suero de ternera recién nacida.
5. Supresión de ensayo
- Haga Supprmedios ESIÓN de ensayo mediante la adición de 100 U / ml de penicilina, 100 ug / ml de estreptomicina, 5 ng / ml de IL-2 y 2 ng / ml de TGF-β a AIM-V.
- El día del ensayo, purificar heterólogos CD4 + células T de la capa leucocitaria, como se indica en los pasos 1 y 2. Estas serán las células diana para el ensayo de supresión y no contiene células CD25 + Treg, como puede verse en la Figura 2, el día 0.
- Las células que lleven CellTrace kit como las instrucciones del fabricante, excepto con sólo 1 l de solución al 5 mM de existencias por ml de células en lugar de l 2. Mantener fuera de la luz directa, añadir 18 l de DMSO la suministrada por el kit CellTrace a un vial de CFSE para hacer una solución madre 5 mM. Resuspender el número requerido de células diana (hasta un máximo de 1 x 10 7) en precalentado PBS + 0,1% (w / v) de BSA a una concentración final de 1 x 10 6 células / ml. Añadir 1 l de la CFSE 5 mM por ml de las células y se incuba en un baño de agua 37 ° C durante 5 minutES. Añadir 5 volúmenes de medio RPMI completo, enfriado con hielo con FBS al 10% para saciar tinción y se incuba en hielo durante 5 minutos. Lave las células dos veces más con el frío RPMI completo y volver a suspender las de 1 x 10 5 células por cada 100 l de medio de ensayo de supresión.
- Treg cuentas inspector de extinción se encuentran en una concentración de valores de 2 x 10 7 perlas / mL. Pellet un número de perlas igual al número total de células por experimento por centrifugación rápida en un tubo eppendorf. Lavar perlas una vez con RPMI y re-sedimento. Después de la aspiración de RPMI, perlas de volver a suspender de modo que la cantidad apropiada de perlas por pocillo en 8 l de medio de ensayo de supresión.
- Para una placa de cultivo de 96 abajo y todo el tejido, añade manchadas CFSE células (1 x 10 5 células / ml), cuentas del inspector y las células polarizadas y ordenados (1 x 10 5 células / ml) en los medios de comunicación frescas supresión de ensayo a un objetivo deseado (manchada CFSE): efector (ordenados) relación en un volumen final de 200 l. Todas las condiciones se establecen por triplicadoCates.
- Preparar el primero de dos condiciones de control mediante la adición de 100 l de células teñidas CFSE, 8 l de perlas inspector y 1 x 10 5 de células frescas, no teñidas en 92 l medio ensayo supresor por pocillo. Preparar el segundo control con los mismos componentes celulares como las anteriores pero sin Treg cuentas de los inspectores.
- Cubrir la placa en papel de aluminio y se incuba a 37 ° C / 5% de CO 2 durante cinco días.
- En la oscuridad, muestras de células de cada pocillo por pipeteado y el lugar en un redondo de 5 ml tubo de poliestireno inferior. Centrifugar las células a 500 xg durante 5 minutos a 4 ° C, medios aspirado, y resuspender en 300 l FACS frío tampón de lavado de la etapa 4. Analizar los primeros 3 x 10 4 + CFSE eventos en vivo de la puerta de linfocitos que representa las células diana en un histograma con el software Cell Quest.
6. Los resultados representativos
Ejemplo de pseudocolor de citometría de flujo salpican las parcelas durante un tiempo de cinco días-COUdiferenciación RSE iTreg de seguimiento basado en la relación co-expresión de CD25 con FoxP3, CTLA-4 y CD45RA puede verse en la Figura 2. El histograma de la figura 3 muestra un ensayo de supresión con éxito en el que, ordenados iTregs (CD25 Hi CD45RA - CD127 células -/LOW). Son sólo el subconjunto de un cultivo de cinco días que ha adquirido la capacidad reguladora / supresor de la Figura 4 muestra la inducción de células T reguladoras de un grupo de células T ingenuas (paneles superiores) y un grupo de células T de memoria (paneles inferiores), después de cinco días de cultivo en medio iTreg estándar. CFSE tinción de las células iniciales demuestran que tanto las células T vírgenes (panel superior derecho) o de la memoria (panel inferior derecho) se diferencian para iTregs (más altas que expresan las células FoxP3) sólo después de varias rondas de división celular.
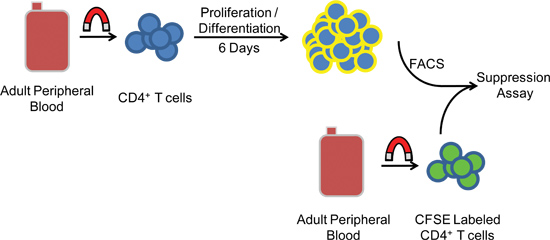
Figura 1. Esquema de procedimiento experimental. PBMCs are separado de la sangre periférica humana mediante centrifugación en gradiente de antes de la selección magnética negativa de las células CD4 + CD25 - las células T. Después de cinco a seis días en cultivo, las células se someten FACS y se co-incubaron con células heterólogas CFSE diana marcadas para medir la actividad supresora.
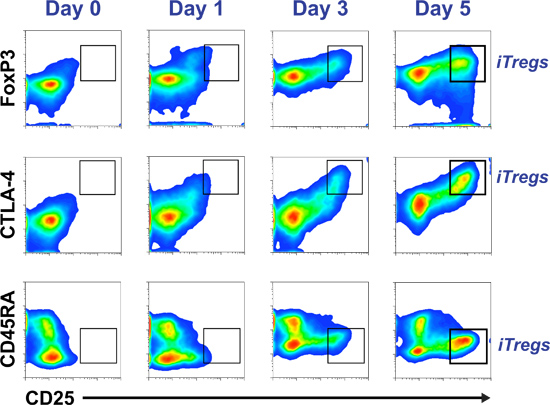
Figura 2 purificada CD4 + CD25 humanas primarias -. Las células T se cultivan en iTreg medio. Una parte alícuota de las células se recogieron sólo después del aislamiento (día 0) y en los días 1, 3 y 5 de cultivo celular para controlar el progreso de CD45RA, FoxP3, CTLA 4-CD25 y marcadores. El perfil corresponde a iTreg CD45RA -, FoxP3 Hola, CTLA-4 y CD25 Hi Hi (resaltado en la ventana en el gráfico).
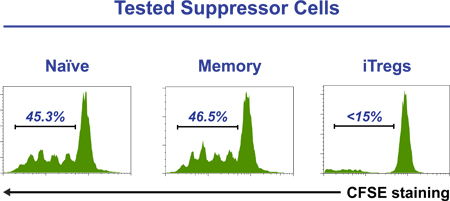
Figura 3. Purificada CD4 + CFSE laBeled células (1 x 10 5 / pocillo) se cultivaron con Treg cuentas de supresión de los inspectores en la presencia de células ordenados ingenuo, la memoria o iTreg (3 x 10 4 / pocillo). Después de cinco días, las células se recogieron y el perfil CFSE de las células teñidas se analizaron por citometría de flujo. La presencia de células iTreg suprime completamente la proliferación de células T CD4 +. Los números son indicativos de porcentaje de células marcadas CFSE que han sido sometidos a la división.

Figura 4 humana purificada primaria ingenuo. (CD4 + CD25 - CD45RA +) y memoria (CD4 + CD25 - CD45RO +) las células T están manchadas con CFSE y cultivadas en iTreg medio. Después de cinco días, las células se fenotipo y estimaron las tasas de división celular. Como se indica en la Figura 2, el subconjunto iTreg diferenciarse de ambos subconjuntos corresponde aCD45RA - CD25 Hi Hi FoxP3 y CTLA-4 de alta (estos dos últimos no se muestra). Perfiles comparativos de tinción CFSE identificar iTregs (aquí como la más alta que expresan FoxP3 células T), como las células más proliferativas de la cultura durante cinco días.
Access restricted. Please log in or start a trial to view this content.
Discusión
Si bien la transferencia TREG es una gran promesa terapéutica para combatir el rechazo del injerto autoinmunidad y otros trastornos inmunes o inflamatorias mediadas, métodos para su generación eficiente y el mantenimiento estable todavía no se han desarrollado. Dado que sólo el 1-5% de la circulación de las células T son células T reguladoras, su expansión controlada y la diferenciación supera esta escasez como un importante elemento de disuasión de la aplicación de células T reguladoras en la clínica. Por...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer a Jennifer Strange y Bauman Greg por su ayuda con el análisis de citometría de flujo y clasificación. Este trabajo fue apoyado por el Número de Subvenciones del NIH 2P20 RR020171 de la CNRR y por la Universidad de Kentucky de los fondos de inicio de FM; GIE reconoce el apoyo de la Beca de Postgrado y la Beca Presidencial de Oportunidades de Kentucky.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| Lymphoprep | Axis-Shield | 1114547 | Mantener a temperatura ambiente |
| Refrigerada de sobremesa Centrífuga | Eppendorf | 5810R | |
| Bright-Line Hemocitómetro | Hausser Científico | 3110 | |
| EasySep Humanos células T CD4 + Kit de enriquecimiento | Stem Cell Technologies | 19052 | |
| EasySep CD4 + de memoria Humanos de las células T del kit de enriquecimiento | Stem Cell Technologies | 19157 | |
| EasySep Humanos ingenuo CD4 + células T del kit de enriquecimiento | Stem Cell Technologies | 19155 | |
| The Big Easy Mag EasySepneto | Stem Cell Technologies | 18001 | Plata |
| Redondo de 5 ml tubos de la base de poliestireno | BD Falcon | 352008 | |
| 15 ml Tubos de centrífuga de polipropileno | VWR | 89004-368 | |
| 14 de polipropileno ml de fondo redondo de Tubos | BD Falcon | 352059 | |
| 50 ml Tubos de centrífuga de polipropileno | VWR | 89004-364 | |
| Humano anticuerpo anti-CD3 | Bio X de la célula | BE0001-2 | Clon: OKT3 |
| 24 de poliestireno de cultivo celular Plata | BD Falcon | 353047 | |
| 96 Pues bien tejido de fondo redondo cultivo en placa | Grenier Bio-One | 650180 | |
| RPMI 1640 con Glutamax-I y tampón HEPES | Gibco | 72400 | |
| Suero fetal bovino (SFB) | Gibco | 16000 | |
| β-mercaptoetanol | Sigma | M7522 | |
| Humana Recombinante TGF-β1 | eBioscience | 14-8348-62 | |
| Humana Recombinante de IL-2 | eBioscience | 14-8029-63 | |
| Albúmina de Suero Bovino (BSA) | MP Biomedicals Inc. | 810531 | |
| EDTA 0,5 M | Amresco | E177 | |
| Mouse Anti-Human CD25-PE | Miltenyi Biotec | 130-091-024 | Clon: 4E3 |
| Ratón anti-humano CD45RA-PE-Cy5 | eBioscience | 15-0458-42 | Clon: HI100 |
| Ratón anti-humano CD127-APC | Miltenyi Biotec | 130-094-890 | Clon: MB15-18C9 |
| DNasa II | MP Biomedicals Inc. | 190370 | |
| MoFlo citómetro de flujo | Beckman Coulter | ||
| FlowJo Software | Árbol Star, Inc. | ||
| Cell Quest Pro Software | BD Biosciences | ||
| Suero de ternera recién nacido | Gibco | 16010 | |
| L-glutamina | Gibco | 25030 | |
| AIM-V | Gibco | 0870112 | |
| CFSE CellTrace Proliferación Celular Kit | Invitrogen | C34554 | |
| Treg perlas de supresión de Inspector | Miltenyi Biotec | 130-092-909 | |
| La penicilina-estreptomicina | Gibco | 15140 | |
| 40 mM de nylon cepa celularer | BD Falcon | 352340 |
Referencias
- Powrie, F., Correa-Oliveira, R., Mauze, S., Coffman, R. L. Regulatory interactions between CD45RBhigh and CD45RBlow CD4+ T cells are important for the balance between protective and pathogenic cell-mediated immunity. The Journal of Experimental Medicine. 179, 589-600 (1994).
- Tarbell, K. V. Dendritic cell-expanded, islet-specific CD4+ CD25+ CD62L+ regulatory T cells restore normoglycemia in diabetic NOD mice. The Journal of Experimental Medicine. 204, 191-201 (2007).
- Morgan, M. E. Effective treatment of collagen-induced arthritis by adoptive transfer of CD25+ regulatory T cells. Arthritis and Rheumatism. 52, 2212-2221 (2005).
- Taylor, P. A., Lees, C. J., Blazar, B. R. The infusion of ex vivo activated and expanded CD4(+)CD25(+) immune regulatory cells inhibits graft-versus-host disease lethality. Blood. 99, 3493-3493 (2002).
- Ziegler, S. F. FOXP3: of mice and men. Annual Review of Immunology. 24, 209-226 (2006).
- Riley, J. L., June, C. H., Blazar, B. R. Human T regulatory cell therapy: take a billion or so and call me in the morning. Immunity. 30, 656-6565 (2009).
- Morgan, M. E. Expression of FOXP3 mRNA is not confined to CD4+CD25+ T regulatory cells in humans. Human Immunology. 66, 13-20 (2005).
- Wang, J., Huizinga, T. W. J., Toew, R. E. M. De Novo Generation and Enhanced Suppression of Human CD4+CD25+ Regulatory T Cells by Retinoic Acid. Journal of Immunology. 183, 4119-4126 (2009).
- Hori, S., Nomura, T., Sakaguchi, S. Control of regulatory T cell development by the transcription factor Foxp3. Science (New York, N.Y.). 299, 1057-1061 (2003).
- McHugh, R. S. CD4(+)CD25(+) immunoregulatory T cells: gene expression analysis reveals a functional role for the glucocorticoid-induced TNF receptor. Immunity. 16, 311-323 (2002).
- Takahashi, T. Immunologic Self-Tolerance Maintained by Cd25+Cd4+Regulatory T Cells Constitutively Expressing Cytotoxic T Lymphocyte-Associated Antigen 4. The Journal of Experimental Medicine. 192, 303-310 (2000).
- Liu, W. CD127 expression inversely correlates with FoxP3 and suppressive function of human CD4+ T reg cells. The Journal of Experimental Medicine. 203, 1701-1711 (2006).
- Schraven, B., Kalinke, U. CD28 superagonists: what makes the difference in humans. Immunity. 28, 591-595 (2008).
- Reneer, M. C. Peripherally induced human Regulatory T cells uncouple Kv1.3 activation from TCR-associated signaling. European Journal of Immunology. , (2011).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados