Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Generation der induzierte regulatorische T-Zellen aus primären humanen naiven und Gedächtnis-T-Zellen
In diesem Artikel
Zusammenfassung
Wir beschreiben ein Verfahren zum Erzeugen regulatorische, Speicher und naive T-Zellen aus einem einzelnen menschlichen Blutspender. Polarisierten Tregs können dann auf andere Teilmengen in einer Vielzahl von genetischen und funktionelle Anwendungen mit genetische Homogenität, einschließlich einer Unterdrückung Assay auch hier detailliert verglichen werden.
Zusammenfassung
Die Entwicklung und Pflege von immunsuppressiven CD4 + regulatorischen T-Zellen (Tregs) Mitwirkung an der peripheren Toleranz notwendig, um in immunologischen Homöostase mit der großen Menge von sich selbst und kommensalen Antigene in und auf den menschlichen Körper verbleiben. Störungen in der Balance zwischen Treg und entzündlichen konventionellen T-Zellen können in Immunpathologie oder Krebs führen. Obwohl therapeutische Injektion von Tregs gezeigt wurde, dass sein in Mausmodellen der Colitis 1, Diabetes Typ I 2, rheumatoider Arthritis und graft versus host disease, 4 einige grundlegende Unterschiede in der menschlichen Biologie im Vergleich zu Maus Treg 5 wirksam ist bislang klinischen Einsatz ausgeschlossen. Das Fehlen einer ausreichenden Zahl, Reinheit, Stabilität und Spezifität der therapeutischen Homing Tregs erforderte eine dynamische Plattform des menschlichen Treg Entwicklung, auf denen Voraussetzungen für ihre ex vivo Expansion von 6 bis zu optimieren.
Hier we describe ein Verfahren zur Differenzierung von induzierten Tregs (iTregs) aus einem einzigen menschlichen peripheren Blut-Donor, bei dem in vier Stufen unterteilt werden: Isolierung von peripheren mononukleären Blutzellen, magnetische Selektion von CD4 + T-Zellen in vitro Zellkultur und Fluoreszenz-aktivierten Zellsortierung (FACS) von T-Zell-Untergruppen. Da die Treg Unterschrift Transkriptionsfaktors forkhead box P3 (FOXP3) ist ein Aktivierungs-induzierten Transkriptionsfaktor beim Menschen 7 und keine andere einzigartige Marker vorhanden ist, eine kombinatorische Panel von Markern muss verwendet werden, um T-Zellen mit Suppressor-Aktivität zu identifizieren. Nach sechs Tagen in Kultur, kann Zellen in unserem System in naive T-Zellen, Gedächtnis-T-Zellen oder iTregs ihrer relativen Expression von CD25 und CD45RA Basis abgegrenzt werden. Als Erinnerung und naiven T-Zellen unterschiedlicher Polarisation berichtet Anforderungen und Plastizitäten 8 haben, Vorsortierung des ursprünglichen T-Zell-Population in CD45RA + und CD45RO + Teilmengen können be verwendet, um diese Unstimmigkeiten zu prüfen. In Übereinstimmung mit anderen, unsere CD25 Hallo CD45RA - iTregs Express ein hohes Maß an FoxP3 9, GITR und CTLA-4-11 und geringe Mengen an CD127 12. Nach FACS jeder Population, kann resultierenden Zellen in einer Suppressor-Assay, der die relativen Fähigkeit, die Proliferation von Carboxyfluorescein-succinimidylester (CFSE)-markierten autologen T-Zellen verzögert bewertet werden.
Protokoll
1. Isolierung von humanen peripheren mononukleären Zellen (PBMCs) aus Buffy-Coat-
- Erwerben Sie eine Einheit der Buffy-Coat aus dem Krankenhaus oder in der Nähe Blut im Stadtzentrum. Unser Blut Zentrum bietet uns etwa 40-60 ml Buffy-Coat pro Einheit von normalen Blutspendern gewonnen.
- Gießen Sie das Blut in einer autoklavierten 500 ml Glasflasche mit sterilem PBS zu verdünnen Buffy-Coat. Das Endvolumen des PBS + Leukozytenmanschette sollte 250 ml sein.
- Füllen Sie zehn 50 ml konische Röhrchen mit je 20 ml Lymphoprep Lösung.
- Sanft überlagern die Lymphoprep Lösung mit 25 mL der verdünnten buffy coat, man aufpassen, nicht um die Lymphoprep Lösung zu stören.
- Spin Röhrchen für 30 Minuten bei Raumtemperatur bei 500 xg. Achten Sie darauf, um das Gerät auszuschalten Zentrifuge die Bremse, so dass keine Störung der Lymphozyten-Fraktion.
- Collect die PBMCs an der Grenzfläche zwischen dem Lymphoprep und die Plasma-mittleren Schichten mit einer Pipette. Saugen Sie den Plasma-Medium aus, bis etwa 1 mlbedeckt die Buffy-Coat-Schicht, die die PBMCs. Verwenden Sie eine 10 ml Pipette zu PBMCs auf ein neues 50 ml Tube zu übertragen.
- Waschen der Zellen zweimal mit PBS gewaschen und dann resuspendiert Zellen in 50 ml kaltem RPMI zum Zählen auf einem Hämocytometer. Typische Erholung ist 8 x 10 8 - 1 x 10 9 PBMCs.
Dieses Verfahren kann sich für kleinere Mengen an Blut skaliert werden. Verdünnung von Vollblutproben ist 1:1 in PBS.
2. Magnetische negativen Selektion von insgesamt CD4 + T-Zellen, CD4 + CD45RA + naiven T-Zellen oder CD4 + CD45RO + Memory T-Zellen aus PBMCs unter Verwendung EasySep Enrichment Kit (Stem Cell Technologies)
Schritte für 1 x 10 8 bis 4,25 x 10 8 PBMCs folgen.
- Resuspendieren PBMCs zu einer Endkonzentration von 5 x 10 7 pro ml in PBS mit 2% FBS und 1 mM EDTA. Bewegen Sie Zellen in ein frisches 14 ml Polypropylen-Röhrchen mit rundem Boden.
- Isolierung von Gesamt-humanen CD4 + T-Zellen durch negative Selektion: add menschlichen CD4 + T-Zell-Enrichment Cocktail von Antikörpern (50 ul pro ml PBMCs), mischen und inkubieren Sie für 10 Minuten bei Raumtemperatur.
- Isolierung von humanen naiven T-Zellen durch negative Selektion: add 50 ul anti-CD45RO Antikörper pro ml PBMC Zellsuspension, mischen und inkubieren für 15 Minuten bei Raumtemperatur. In Anreicherung Cocktail mit dem Bausatz (50 ul pro ml PBMCs), homogenisiert und Inkubieren bei Raumtemperatur für 10 Minuten zur Verfügung gestellt.
- Isolierung von menschlichen Gedächtnis-T-Zellen durch negative Selektion: add menschliche Gedächtnis CD4 + T-Zell-Enrichment Cocktail von Antikörpern (50 ul pro ml PBMCs), mischen und inkubieren für 10 Minuten bei Raumtemperatur.
- Mischen magnetischer Teilchen auch gleich zu verteilen diese in der gesamten Lösung. Nicht vortexen Nanopartikeln aus naiv-Kit.
- In der magnetischen Teilchen (100 ul pro ml PBMCs für insgesamt CD4 + und naive T-Zell-Auswahl, 50 ul pro ml PBMCs für Gedächtnis-T-Zell-Auswahl). Durch vorsichtiges Pipettieren 2-3 mal und Inkubieren bei Raumtemperatur für 10 Minuten für naive T-Zell-Auswahl oder 5 Minuten für insgesamt Speicher oder CD4 + T-Zell-Auswahl.
- In PBS mit 2% FBS und 1 mM EDTA, um die Lautstärke bis zu 10 ml pro Röhrchen zu bringen. Durch vorsichtiges Pipettieren 2-3 mal, bevor Sie nicht begrenzten Schlauch in Silber EasySep Magnet für 5, 10 oder 2,5 Minuten für insgesamt CD4 + T-Zellen, naiven und Gedächtnis Teilmengen jeweils.
- Mit Schlauch noch in EasySep Magnet, gießen Flüssigkeit in neue 50 ml Tube zu interessierenden Zellen zu isolieren.
- Wiederholen Sie die Schritte 2.5 und 2.6 für eine bessere Erholung.
3. Cell Culture Bedingungen zur Induktion regulatorischer T-Zellen
- Der Tag vor den Schritten 1 und 2, Mantel Gewebekulturplatten durch erste Verdünnen Anti-CD3-Antikörper (Klon OKT3) zu einer Konzentration von 1 pg / ml in sterilem PBS. Für eine 6-Well-Platte 2 mL PBS + Anti-CD3 pro Well hinzugefügt, für eine 12-Well-Platte 1 ml oder für eine 24-Well-Platte hinzufügen 500 ul pro Well. Halten die beschichtete Platte bei 4 ° C bis zur Verwendung.
- Planen Polarisationsmedium durch Zugabe von 10% Hitze-inaktiviertem fötalem Rinderserum (FBS), 100 U / ml Penicillin, 100 ug / ml Streptomycin und 50 uM β-Mercaptoethanol in RPMI-1640 mit 2,06 mM vor ergänzt Glutamax-I und 25 mM HEPES-Puffer. Als Nächstes fügen 2 ng / ml TGF-β und 5 ng / ml IL-2. Hier kann man hinzufügen, Liganden oder Inhibitoren von Interesse für die Medien. Die Zellen aus Schritt 2 in einer Konzentration von 2 × 10 6 Zellen / ml Polarisationsmedium.
- Pre-warmen Platten bei 37 ° C und saugen Sie den PBS von anti-CD3-beschichteten Vertiefungen vor dem Hinzufügen Zellen. In 4 ml pro Vertiefung der Zellsuspension für eine 6-Well-Platte, 2 ml Zellen für eine 12-Well-Platte oder 1 ml Zellen für eine 24-Well-Platte. Füllen Sie leere Vertiefungen mit PBS, um Verdunstung zu reduzieren vonMedien. Inkubieren für 3 Tage bei 37 ° C / 5% CO 2.
- Am Tag 3 nach der Beschichtung, Spin-down-Platte in einer Zentrifuge für 5 Minuten bei 500 x g. Ohne Störung T-Zellen am Boden der Platte, die Hälfte von Medien und ersetzen Sie sie durch frische Medien. Alternativ, wenn der gut wird überfüllt mit Zellen (Konzentration von mehr als 3 x 10 6 / ml), teilen Sie die Lautstärke gleichmäßig in eine andere anti-CD3 beschichteten Platte, und fügen Sie frisches Medium wieder auf ursprünglichen Volumens. Inkubieren für zwei bis drei Tage bei 37 ° C / 5% CO 2.
4. Fluorescence-Activated Cell Sorting (FACS) von drei Populationen von T-Zellen
- Planen FACS Waschpuffer durch Zugabe von 0,5% (w / v) Rinderserumalbumin (BSA) und 2 mM EDTA zu sterilem PBS. Platz Puffer bei 4 ° C bis kalt.
- Entfernen Zellen aus der Zellkultur gut und spülen jedes Well mit 2 ml PBS, um eine vollständige Erholung der Zellen zu gewährleisten. Legen Sie alle Zellen in 50 ml Polypropylen-Röhrchen und zentrifugieren bei 500 xg für 10Minuten bei 4 ° C
- Zählen der Zellen in einem Hämozytometer auf die Zelldichte zu bestimmen.
- Platz 3-5 x 10 5 Zellen pro Röhrchen in vier getrennten 5 ml Rundboden Polystyrol-Röhrchen für die Entschädigung Kontrollen. Legen verbleibenden Zellen in 50-ml-Polypropylenröhrchen, nicht mehr als 35 x 10 6 Zellen pro Röhrchen.
- Spin-Down-Zellen für 5 Minuten bei 4 ° C und absaugen Medien. Die Zellen in 90 ul kaltem Waschpuffer pro 1 × 10 6 Zellen sortiert werden. Resuspendieren in 100 &mgr; l kaltem Waschpuffer die Kompensations-Röhren.
- Um die Zellen sortiert werden, kombinieren 2 &mgr; l Anti-CD25-PE, 3 ul von anti-CD45RA-PE-Cy5 und 1 ul anti-CD127-APC pro 1 x 10 6 Zellen. In keine Antikörper gegen den ersten Kompensationswert Steuerrohr, 2 ul Anti-CD25-PE mit dem zweiten Rohr, 3 ul Anti-CD45RA - PE-Cy5 mit dem dritten Rohr and1 ul Anti-CD127-APC an den vierten Schlauch. Alle Röhrchen auf Eis für 45 Minuten im Dunkeln.
- 10 ml kaltem Waschpuffer zu den Zellen sortiert wird, und 1 ml der Kompensations-Röhrchen. Zentrifuge alle Zellen bei 500 xg für 5 Minuten bei 4 ° C
- Saugen Puffer und resuspendieren Zellen bei einer Konzentration von 1 x 10 7 Zellen pro ml Waschpuffer. In 1,5 ul DNase II pro ml Zellen vor der Filterung durch eine 40 uM Nylon Zellsieb. Bewegen Zellen mehrere 5 ml Rundkolben Polypropylenröhrchen mit nicht mehr als 3,5 ml pro Röhrchen. Resuspendieren Entschädigung Kontroll-Zellen in 300 ul Waschpuffer.
- Setzen Sie auf Entschädigung MoFlo Durchflusszytometer zu Cross-Erkennung durch das PE, APC und PE-Cy5-Filter zu minimieren. Stellen Sie Toren iTregs (CD25 CD127 Hallo -/LOW CD45RA - Zellen) zu sortieren, naive (CD25-CD45RA +) und Speicher (CD25 - CD45RA -) T-Zellen in 5 ml Rundboden Polystyrol-Röhrchen mit 1 ml Serum von neugeborenen Kälbern.
5. Unterdrückung Assay
- Machen SUPPRMultisession Testmedien durch Zugabe von 100 U / ml Penicillin, 100 ug / ml Streptomycin, 5 ng / ml IL-2 und 2 ng / ml TGF-β zu AIM-V.
- Der Tag des Tests, zu reinigen heterologen CD4 + T-Zellen aus Buffy-Coat-wie in den Schritten 1 und 2 angegeben. Diese werden die Zielzellen zur Unterdrückung Assay und enthält keine CD25 + Treg Zellen, wie in 2, Tag 0 zu sehen ist.
- Label-Zellen mit CellTrace Kit nach den Anweisungen des Herstellers, mit der Ausnahme, nur 1 ul 5 mM Stammlösung pro ml Zellen anstelle von 2 ul. Fernhalten von direktem Licht, fügen Sie 18 ul des DMSO durch die CellTrace Kit geliefert, um ein Fläschchen mit CFSE, um eine 5 mM Stammlösung zu machen. Resuspendieren die erforderliche Anzahl von Zielzellen (maximal 1 x 10 7) in vorgewärmtem PBS + 0,1% (w / v) BSA in einer Endkonzentration von 1 × 10 6 Zellen / ml. Fügen Sie 1 ul 5 mM CFSE pro ml Zellen und Inkubation bei 37 ° C im Wasserbad für 5 minutes. In 5 Volumina abgeschlossen, eiskaltes RPMI mit 10% FBS zu löschen Färbung und Inkubation auf Eis für 5 Minuten. Waschen der Zellen noch zweimal mit kaltem komplettem RPMI resuspendieren und 1 x 10 5 Zellen pro 100 ul der Unterdrückung Assay Medien.
- Treg-Unterdrückung Inspektor Perlen sind an einer Börse Konzentration von 2 x 10 7 Beads / ml. Pellet eine Anzahl von Kugeln gleich der gesamten Anzahl der Zellen pro Experiment praktischen Zentrifugation in einer Eppendorf-Röhrchen. Waschen Perlen einmal mit RPMI und Re-Pellet. Nach Aspiration von RPMI, resuspendieren Perlen, so dass die entsprechende Menge an Perlen pro Well sind in 8 ul der Unterdrückung Assay Medien.
- Um eine 96-Well Rundboden Gewebekulturplatte, fügen CFSE-gefärbten Zellen (1 x 10 5 Zellen / ml), Inspektor Perlen und polarisiert und sortierten Zellen (1 x 10 5 Zellen / ml) in frischem Unterdrückung Assay Medien zu einem gewünschten Ziel (CFSE gebeizt): Manipulator (sortiert)-Verhältnis in einem Endvolumen von 200 ul. Alle Bedingungen sind in dreifacher gesetztCates.
- Bereiten Sie den ersten von zwei Kontrollbedingungen durch Zugabe von 100 L CFSE gefärbten Zellen, 8 ul Inspektor Perlen und 1 x 10 5 von frischen, ungefärbten Zellen in 92 ul-Suppressor-Assay-Medium pro Vertiefung. Bereiten Sie die zweite Steuereinheit mit den gleichen zellulären Komponenten wie oben, jedoch ohne Treg-Inspektor Perlen.
- Abdeckplatte in Alufolie und bei 37 ° C / 5% CO 2 für fünf Tage.
- In der Dunkelheit sammeln Zellen aus jeder Vertiefung durch Pipettieren und in einen 5 ml Rundboden-Röhrchen Polystyrol. Zentrifuge Zellen bei 500 × g für 5 Minuten bei 4 ° C, Überstand Medien und Resuspension in 300 ul kalten FACS Waschpuffer aus Schritt 4. Analysieren Sie die ersten 3 x 10 4 CFSE + Ereignisse aus der Live-Lymphozyten-Gate vertreten Zielzellen in einem Histogramm mit Cell Quest-Software.
6. Repräsentative Ergebnisse
Beispiel für durchflusszytometrische Pseudocolor Dot-Plots über einen Fünf-Tage-couBörse Überwachung iTreg Differenzierung der relativen Co-Expression von CD25 mit FoxP3 basiert, kann CTLA-4 und CD45RA in 2 gesehen werden. Das Histogramm in Abbildung 3 zeigt eine erfolgreiche Unterdrückung Test, bei dem iTregs (CD25 Hallo CD45RA - CD127 -/LOW Zellen) sortiert. Sind die einzige Teilmenge aus einer Fünf-Tage-Kultur, die regulatorischen / Suppressor-Fähigkeit erworben hat, Abbildung 4 zeigt die Induktion von Tregs aus einer naiven T-Zell-Pool (obere Bilder) und einem Speicher-T-Zell-Pool (untere Bilder), nach fünf Tagen Kultur in Standard iTreg Medium. CFSE Färbung der ursprünglichen Zellen nachweisen, dass entweder naiv (oben rechts) oder Memory T-Zellen (unten rechts) zu iTregs (höchste Foxp3-exprimierenden Zellen) zu differenzieren erst nach mehreren Runden der Zellteilung.
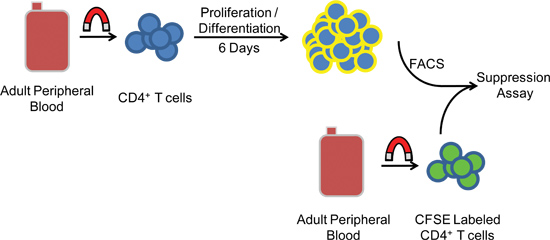
Abbildung 1. Schematische Darstellung des experimentellen Verfahren. PBMCs are aus humanen peripheren Blut über Zentrifugation abgetrennt, bevor magnetischen negativen Selektion von CD4 + CD25 - T-Zellen. Nach fünf bis sechs Tagen in Kultur, Zellen unterzogen und mit FACS heterologen CFSE markierten Ziel-Zellen co-inkubiert, um Suppressor-Aktivität zu messen.
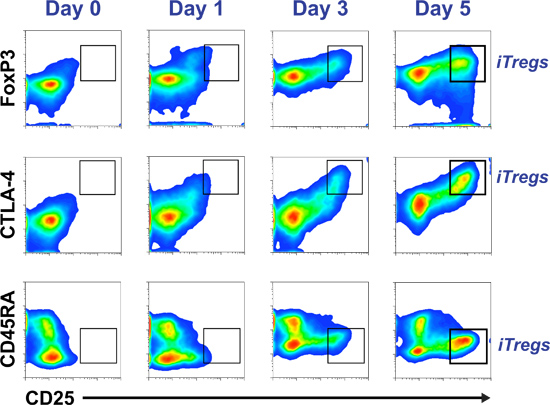
2 Gereinigte humane primäre CD4 + CD25 -. T-Zellen in iTreg Medium kultiviert. Ein Aliquot der Zellen nur nach der Isolierung (Tag 0) und an den Tagen 1, 3 und 5 der Zellkultur gesammelt, um den Fortschritt von CD45RA, FoxP3, CTLA-4 und CD25-Marker zu überwachen. Die iTreg Profil entspricht CD45RA -, FoxP3 Hallo, CTLA-4 und CD25 Hallo Hallo (hervorgehoben in der in-Graph-Fenster).
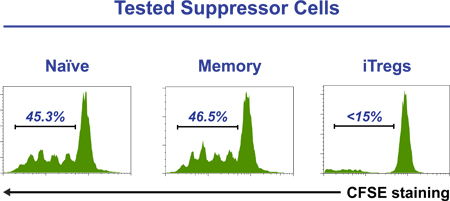
Abbildung 3. Gereinigten CD4 + CFSE lamarkierter Zellen (1 × 10 5 / Well) mit Treg Unterdrückung Inspektor Kügelchen in der Anwesenheit von sortierten naiven, Speicher oder iTreg kultiviert (3 x 10 4 / Vertiefung). Nach fünf Tagen werden die Zellen geerntet und das Profil der CFSE gefärbten Zellen wird mittels Durchflusszytometrie analysiert. Die Anwesenheit von iTreg Zellen vollständig aufhebt Proliferation von CD4 + T-Zellen. Zahlen sind bezeichnend für Prozentsatz der CFSE-markierten Zellen, die Teilung erfahren haben.

Abbildung 4 Gereinigte humane primäre naiv. (CD4 + CD25 - CD45RA +) und Speicher (CD4 + CD25 - CD45RO +) T-Zellen werden mit CFSE und kultiviert in iTreg Medium gefärbt. Nach fünf Tagen werden die Zellen phänotypisiert und die Zellteilung Raten geschätzt. Wie in 2 gezeigt, entspricht die iTreg Teilmenge aus beiden Teilmengen differenziert, umCD45RA - CD25 FoxP3 Hallo Hallo und CTLA-4 Hallo (letzteren beiden nicht gezeigt). Vergleichende CFSE Färbung Profile identifizieren iTregs (hier als den höchsten Ausdruck FoxP3 T-Zellen) als die proliferative Zellen während der Fünf-Tage-Kultur.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Während Treg Transfer birgt ein enormes therapeutisches Versprechen im Kampf gegen Autoimmunität Transplantatabstoßung und anderen Immunerkrankungen oder entzündlichen vermittelten Erkrankungen, Methoden für ihre effiziente Erzeugung und Aufrechterhaltung stabiler sind noch nicht entwickelt worden. Da nur 1-5% der zirkulierenden humanen T-Zellen Tregs sind, überwindet ihre kontrollierte Expansion und Differenzierung dieser Mangel als eine große Abschreckung der Umsetzung der Tregs in die Klinik. Auf der anderen S...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Die Autoren möchten sich Jennifer Strange und Greg Bauman für ihre Hilfe bei Durchflusszytometrie-Analyse und-sortierung zu danken. Diese Arbeit wurde von den NIH Grant Number 2P20 RR020171 aus dem NCRR und von der University of Kentucky Startup-Fonds FM unterstützt; GIE erkennt die Unterstützung des Präsidiums und der Graduate Fellowship Kentucky Chance Fellowship.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| Lymphoprep | Axis-Shield | 1114547 | Halten Sie bei Raumtemperatur |
| Gekühlte Tischzentrifuge | Eppendorf | 5810R | |
| Leuchtrahmen Hämocytometer | Hausser Scientific | 3110 | |
| EasySep Humane CD4 + T-Zell-Enrichment Kit | Stem Cell Technologies | 19052 | |
| EasySep Human Memory CD4 + T-Zell-Enrichment Kit | Stem Cell Technologies | 19157 | |
| EasySep Menschliche naiven CD4 + T-Zell-Enrichment Kit | Stem Cell Technologies | 19155 | |
| The Big Easy EasySep Mag.Netto- | Stem Cell Technologies | 18001 | Silber |
| 5 ml Rundboden Polystyrol-Röhrchen | BD Falcon | 352008 | |
| 15 ml Polypropylen-Zentrifugenröhrchen | VWR | 89004-368 | |
| 14 ml Polypropylen-Rundboden-Röhrchen | BD Falcon | 352059 | |
| 50 ml Polypropylen-Zentrifugenröhrchen | VWR | 89004-364 | |
| Menschliche Anti-CD3-Antikörper | Bio X Zelle | BE0001-2 | Klon: OKT3 |
| 24 Well Polystyrol Zell Kulturplatte | BD Falcon | 353047 | |
| 96 Well Rundboden Gewebekulturplatte | Grenier Bio-One | 650180 | |
| RPMI 1640 mit Glutamax-I-und HEPES-Puffer | Gibco | 72400 | |
| Fötales Rinderserum (FBS) | Gibco | 16000 | |
| β-Mercaptoethanol | Sigma | M7522 | |
| Rekombinantes humanes TGF-β1 | eBioscience | 14-8348-62 | |
| Rekombinantes humanes IL-2 | eBioscience | 14-8029-63 | |
| Rinderserumalbumin (BSA) | MP Biomedicals Inc. | 810531 | |
| 0,5 M EDTA | Amresco | E177 | |
| Maus anti-human CD25-PE | Miltenyi Biotec | 130-091-024 | Klon: 4E3 |
| Maus Anti-Human CD45RA-PE-Cy5 | eBioscience | 15-0458-42 | Klon: HI100 |
| Maus anti-human CD127-APC | Miltenyi Biotec | 130-094-890 | Klon: MB15-18C9 |
| DNase II | MP Biomedicals Inc. | 190370 | |
| MoFlo Durchflusszytometer | Beckman Coulter | ||
| FlowJo Software | Baum-Star, Inc. | ||
| Cell Quest Pro Software | BD Biosciences | ||
| Serum von neugeborenen Kälbern | Gibco | 16010 | |
| L-Glutamin | Gibco | 25030 | |
| AIM-V | Gibco | 0870112 | |
| CellTrace CFSE Cell Proliferation Kit | Invitrogen | C34554 | |
| Treg-Suppression Inspector Perlen | Miltenyi Biotec | 130-092-909 | |
| Penicillin-Streptomycin | Gibco | 15140 | |
| 40 uM Nylon ZellstammER | BD Falcon | 352340 |
Referenzen
- Powrie, F., Correa-Oliveira, R., Mauze, S., Coffman, R. L. Regulatory interactions between CD45RBhigh and CD45RBlow CD4+ T cells are important for the balance between protective and pathogenic cell-mediated immunity. The Journal of Experimental Medicine. 179, 589-600 (1994).
- Tarbell, K. V. Dendritic cell-expanded, islet-specific CD4+ CD25+ CD62L+ regulatory T cells restore normoglycemia in diabetic NOD mice. The Journal of Experimental Medicine. 204, 191-201 (2007).
- Morgan, M. E. Effective treatment of collagen-induced arthritis by adoptive transfer of CD25+ regulatory T cells. Arthritis and Rheumatism. 52, 2212-2221 (2005).
- Taylor, P. A., Lees, C. J., Blazar, B. R. The infusion of ex vivo activated and expanded CD4(+)CD25(+) immune regulatory cells inhibits graft-versus-host disease lethality. Blood. 99, 3493-3493 (2002).
- Ziegler, S. F. FOXP3: of mice and men. Annual Review of Immunology. 24, 209-226 (2006).
- Riley, J. L., June, C. H., Blazar, B. R. Human T regulatory cell therapy: take a billion or so and call me in the morning. Immunity. 30, 656-6565 (2009).
- Morgan, M. E. Expression of FOXP3 mRNA is not confined to CD4+CD25+ T regulatory cells in humans. Human Immunology. 66, 13-20 (2005).
- Wang, J., Huizinga, T. W. J., Toew, R. E. M. De Novo Generation and Enhanced Suppression of Human CD4+CD25+ Regulatory T Cells by Retinoic Acid. Journal of Immunology. 183, 4119-4126 (2009).
- Hori, S., Nomura, T., Sakaguchi, S. Control of regulatory T cell development by the transcription factor Foxp3. Science (New York, N.Y.). 299, 1057-1061 (2003).
- McHugh, R. S. CD4(+)CD25(+) immunoregulatory T cells: gene expression analysis reveals a functional role for the glucocorticoid-induced TNF receptor. Immunity. 16, 311-323 (2002).
- Takahashi, T. Immunologic Self-Tolerance Maintained by Cd25+Cd4+Regulatory T Cells Constitutively Expressing Cytotoxic T Lymphocyte-Associated Antigen 4. The Journal of Experimental Medicine. 192, 303-310 (2000).
- Liu, W. CD127 expression inversely correlates with FoxP3 and suppressive function of human CD4+ T reg cells. The Journal of Experimental Medicine. 203, 1701-1711 (2006).
- Schraven, B., Kalinke, U. CD28 superagonists: what makes the difference in humans. Immunity. 28, 591-595 (2008).
- Reneer, M. C. Peripherally induced human Regulatory T cells uncouple Kv1.3 activation from TCR-associated signaling. European Journal of Immunology. , (2011).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten