このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
初代ヒトナイーブおよびメモリーT細胞から誘導した調節性T細胞の生成
要約
我々は、単一のヒトの血液ドナーからの規制は、メモリとナイーブT細胞を生成する方法を説明します。偏Tregsのは、その後もここで詳述抑制アッセイを含む遺伝的均一性を持つ遺伝子や機能のさまざまなアプリケーション内の他のサブセットと比較することができます。
要約
免疫CD4 +制御性T細胞(Tregの)の開発と保守はで、人体の自己と共生抗原の膨大な量の免疫学的恒常性のままにするために必要な末梢性寛容に貢献しています。 Tregsのと炎症、従来のT細胞のバランスの乱れは、免疫病理や癌になる可能性があります。 Tregの治療注入大腸炎1、I型糖尿病2、関節リウマチ、移植片対宿主病は、ヒト対マウスTregの生物学5の4いくつかの根本的な違いのマウスモデルに有効であることが示されているが、これまでの臨床使用を排除しています。十分な数、純度、安定性と治療Tregのホーミング特異性の欠如は、彼らのex vivoでの拡張6のための条件を最適化する上で人間のTregの開発のダイナミックなプラットフォームを必要とした。
ここでは、Din vitroでの細胞培養と蛍光活性化末梢血単核細胞、CD4の磁気選択+ T細胞の分離、4つの段階に分けることができ、単一のヒト末梢血ドナーから誘導Tregsの(iTregs)の分化方法を傍接させるT細胞サブセットの細胞選別(FACS)。 Tregの署名の転写因子のフォークヘッドボックスのP3(Foxp3は)人間の7の活性化誘導転写因子および他のユニークなマーカーであるため存在しますが、マーカーの組み合わせパネルは抑制活性を有するT細胞を同定するために使用する必要があります。文化の中で6日後、私たちのシステムの細胞がナイーブT細胞は、CD25とCD45RAのそれらの相対的発現に基づいてメモリーT細胞またはiTregsに画定することができます。メモリなどとナイーブT細胞はCD45RA +およびCD45RO +サブセットができますbに初期のT細胞集団の事前選別は、別の報告偏光の要件と塑性挙動8を持っているeは、これらの不一致を調べるために使用されます。他者との一貫性のある、私たちのCD25 こんにちは CD45RA - FoxP3の9のiTregs急行高レベル、GITRおよびCTLA-4 11およびCD127 12の低レベル。各集団のFACSに続いて、得られた細胞は、カルボキシフルオレセインスクシンイミジルエステル(CFSE)で標識したT細胞自家の増殖を抑制するための相対的能力を評価し、抑制アッセイで使用することができます。
プロトコル
1。バフィーコートからヒト末梢血単核細胞(PBMC)の分離
- 病院や近くの血液センターの場所からバフィーコートのいずれかの単位を取得します。私たちの血液センターでは、正常な血液ドナーから得た単位当たりのバフィコートの約40〜60 mLで提供してくれます。
- バフィーコートを希釈するために滅菌したPBSを含むオートクレーブ500mLのガラス瓶に血液を注ぐ。 PBS +バフィーコートの最終容量は250mLのでなければなりません。
- 20 mLのLymphoprep溶液を用いて各10 50mLのコニカルチューブを埋める。
- 優しくLymphoprep解決を邪魔しないように注意して、希釈したバフィーコートの25 mLのLymphoprepソリューションを重ねる。
- 500×gで室温で30分間チューブをスピン。リンパ球分画を邪魔しないようにするように、遠心機のブレーキをオフにしていることを確認してください。
- Lymphoprepとピペットを用いてプラズマ媒質層との界面でのPBMCを収集します。約1mLまでプラズマ媒質をオフに吸引まだPBMCを含むバフィーコート層をカバーしています。新しい50 mlチューブにPBMCを転送するために10 mLのピペットを使用しています。
- PBSで2回細胞を洗浄し、血球を計数するための冷RPMI 50mlに細胞を再懸濁します。 1×10 9 PBMCを-典型的な回復は8×10 8である。
この手順は、血液の小さなボリューム用にスケールダウンすることができます。全血サンプルの希釈は、PBSで1:1です。
2。合計CD4の磁気負の選択+ T細胞、CD4 + CD45RA +ナイーブT細胞またはCD4 + CD45RO + EasySep濃縮キットを使用してPBMCからのメモリーT細胞が(幹細胞技術)
4.25×10 8末梢血単核細胞〜1×10 8のために従うべき手順を実行します。
- 2%FBSおよび1mMのEDTAを含むPBS中でmL当たり5×10 7の最終濃度にPBMCを再懸濁します。新鮮な14 mLの丸底ポリプロピレンチューブに細胞を移動します。
- 合計ヒトCD4 + T細胞の負の選択によるの単離:ヒトCD4 + T細胞の濃縮抗体のカクテル(PBMCのmL当たり50μL)、混合し、室温で10分間インキュベートを追加します。
- 負の選択によるヒトナイーブT細胞の単離:PBMC細胞懸濁液、ミックスのmL当たりの抗CD45RO抗体50μLを加え、室温で15分間インキュベートします。キット(PBMCのml当たり50μL)、10分間室温で混合し、インキュベートで提供される濃縮カクテルを追加します。
- 負の選択によるヒトメモリーT細胞の分離は、人間の記憶CD4 +抗体のT細胞の濃縮カクテル(PBMCのmL当たり50μL)、ミックスを追加し、室温で10分間インキュベートします。
- 同様に、ソリューション全体に配布するだけでなく磁性粒子を混ぜ合わせます。渦ナノ粒子は、ナイーブなキットからしないでください。
- 磁性粒子(合計100 CD4ためのPBMCのmL当たりμL+とナイーブT細胞の選択、メモリーT細胞選択のためのPBMCのmL当たり50μL)を追加します。優しくナイーブT細胞の選択やメモリまたは合計CD4 + T細胞選択のための5分間、10分間室温で2〜3倍とインキュベートをピペッティングにより混和する。
- PBSアップチューブあたり10 mLにボリュームを持って来るために2%FBSおよび1mM EDTAを含む追加します。静かに合計CD4 + T細胞、ナイーブおよびメモリーサブセットは、それぞれ5、10または2.5分間銀EasySep磁石に上限なしチューブを配置する前に2〜3回ピペッティングして混ぜる。
- まだEasySep磁石のチューブで、興味のある細胞を単離するために、新しい50 mlチューブに液体を注ぐ。
- ステップ2.5と優れた回復のための2.6を繰り返します。
3。調節性T細胞を誘導する細胞培養条件
- 第一抗CD3抗体を希釈することにより、ステップ1と2、コート組織培養プレートの前日(滅菌PBS中の1μg/ mLの濃度にOKT3クローン)。 6ウェルプレートはPBSを2mL +ウェルあたり抗CD3を追加するために、12ウェルプレートに1 mLを加え、または24ウェルプレートのウェルあたり500μLを追加します。コーティングしたプレート4℃で使用するまで保管してください。
- RPMI-1640 2.06 mMのグルタミン-Iおよび25 mMのプリ補足し、100 U / mlペニシリン、100μg/ mlのストレプトマイシン及び50μMβ-メルカプトエタノール、10%熱不活性化ウシ胎児血清(FBS)を添加することにより偏光媒体を準備します。 HEPES緩衝液。次に、2 ng / mLのTGF-β、5 ng / mLのIL-2を追加します。ここで、一つのメディアに関心のリガンド又は阻害剤を追加することができます。偏光媒体の2×10 6細胞/ mLの濃度で、ステップ2から細胞を再懸濁します。
- 37前のウォームプレート°Cとセルを追加する前に、抗CD3でコーティングされた井戸のPBSを吸引除去する。 12ウェルプレートまたは24ウェルプレートの細胞を1mLの細胞の2mLを、6ウェルプレートに4 mLのウェルあたりの細胞懸濁液を追加します。の蒸発を減らすためにPBSで空の井戸を埋めるメディア。 37℃/ 5%CO 2で3日間インキュベートします。
- 3日後めっきでは、500×gで5分間遠心分離にプレートをスピンダウンする。プレートの下にT細胞に影響を与えずに、メディアの半分を削除し、新鮮な培地と交換します。井戸が細胞(3×10 6個 / ml以上の濃度)で過密になった場合あるいは、同様に別の抗CD3コートプレートにボリュームを分割し、元のボリュームに戻って新鮮な培地を追加します。 37℃/ 5%CO 2で二から三日以上インキュベートします。
4。 T細胞の3つの集団の蛍光活性化セルソーティング(FACS)
- 滅菌したPBSに0.5%(w / v)のウシ血清アルブミン(BSA)および2mM EDTAを加えることにより洗浄バッファーFACSを準備します。 4の場所バッファは°C、コールド取得します。
- ウェル細胞培養液から細胞を除去し、完全な細胞の回復を確実にするためにPBS 2mLで各ウェルを洗浄してください。 50 mLのポリプロピレンチューブ内のすべてのセルを配置し、10、500 xgで遠心分離分4℃で
- 細胞密度を決定するために血球の細胞をカウントします。
- 補償制御のための4つの独立した5 mLの丸底ポリスチレンチューブ内の場所チューブあたり3〜5×10 5細胞を。 50 mLのポリプロピレンチューブ、チューブあたり以上35以上×10 6細胞の残りのセルを配置します。
- 4°Cと吸引メディアで5分間、細胞をスピンダウンする。 1×10 6細胞当たりの冷洗浄緩衝液90μLにソートする細胞を再懸濁します。冷洗浄緩衝液100μLの補償制御チューブに再懸濁します。
- ソートする細胞に、抗CD25-PE、1×10 6細胞当たりの抗CD127-APCの抗CD45RA-PE-Cy5で、1μLの3μLの2μLを兼ね備えています。第四管に抗CD127-APCの第3のチューブAND1μLにPE-Cy5で-第1の補償制御管、第二の管に抗CD25-PEの2μL、抗CD45RAの3μLにない抗体を加えなかった。暗闇の中で45分間氷上でチューブをインキュベートします。
- はソートするセルと補償制御チューブに1 mLに冷洗浄緩衝液10mLを追加します。 4℃で5分間、500 xgですべての細胞を遠心℃、
- 洗浄緩衝液のmL当たり1×10 7個の細胞の濃度でバッファと再懸濁し、細胞を吸引除去する。 40μmのナイロンセルストレーナーでろ過する前に、細胞のmL当たりのDNase IIの1.5μLを追加します。チューブあたり以上3.5未満mLで、複数の5 mLの丸底ポリプロピレンチューブに細胞を移動します。洗浄バッファー300μLで補償制御の細胞を再懸濁します。
- PE、APCとPE-Cy5のフィルタによってゼロクロス検出を最小限に抑えるためにMoFloフローサイトメーターで補正を設定します。 1 mLの新生仔ウシ血清を含む5 mLの丸底のポリスチレンチューブにT細胞、ナイーブ(CD25-CD45RA +)とメモリ(CD25 - - CD45RA) - iTregs(細胞CD25 こんにちは CD127 -/LOW CD45RA)をソートするためにゲートを設定します。
5。抑制アッセイ
- supprを作るessionアッセイ100 U / mLのペニシリン、ストレプトマイシン100μg/ mLで、5 ng / mLのIL-2およびTGF-βにAIM-Vの2 ng / mLを加えることによってメディア。
- 手順1および2に示すように、アッセイの日は、異種のCD4 +バフィーコートからT細胞を精製する。これらは抑制アッセイの標的細胞となり、 図2、0日目に見られるように、CD25 + Treg細胞が含まれていません。
- 代わりに2μLの細胞のmL当たり5 mMのストック溶液のわずか1μLを用いて除いては、製造元の指示に従って、CellTraceキットのラベル細胞。直接光から出たまま、5 mMのストック溶液を作るためにCFSE 1バイアルにCellTraceキットによって提供されるDMSOの18μLを追加します。 1×10 6細胞/ mlの最終濃度になるように温めておいたPBS + 0.1%(w / v)のBSAにおける標的細胞の必要な数(1×10 7の最大数まで)に再懸濁します。細胞のmL当たりの5mM CFSEの1μLを加え、5 minut、37°Cの水浴中でインキュベートES。染色を急冷し、氷上で5分間インキュベートし、10%FBSを完全に、氷冷RPMI 5ボリュームを追加します。風邪完全RPMIと抑制アッセイ培地100μLあたりに再懸濁し、1×10 5細胞で2回以上の細胞を洗浄します。
- Tregの抑制インスペクタビーズは 2×10 7ビーズ/ mLのストック濃度である。ペレット、ビーズの数は、エッペンドルフチューブ内で簡単に遠心分離して実験ごとに細胞の総数に等しい。 RPMIおよび再ペレットで一回ビーズを洗浄します。 RPMI吸引した後、再懸濁し、ビーズはとてもよく当たりビーズの適切な量の抑制アッセイ培地の8μLであることを。
- 96ウェル丸底組織培養プレートに、希望するターゲットにCFSEで染色した細胞(1×10 5細胞/ mL)を、インスペクタビーズや新鮮な抑制アッセイ培地の偏光およびソート細胞(1×10 5細胞/ mL)を追加(CFSE染色):200μLの最終容量でエフェクター(ソート)の比率。すべての条件がtripliに設定されているケイツ。
- ウェルあたり92μL抑制アッセイ培地にCFSE染色した細胞、インスペクタビーズの8μL、新鮮な、染色細胞の1×10 5の100μLを加えることにより二つの制御条件の最初の準備をします。上記のようなものインスペクタビーズのTregせずに、同じ細胞成分と第二の制御を準備します。
- 五日間37℃/ 5%CO 2でアルミホイルとインキュベートし、プレートをカバーしています。
- 暗闇の中で、5 mLの丸底ポリスチレンチューブにピペッティングし、場所によって、各ウェルから細胞を収集します。 4°C、吸引メディアで5分間、500 xgで遠心し、ステップ4から洗浄バッファー300μL冷たいFACSに再懸濁します。最初の3×10 4 CFSE +細胞クエスト·ソフトウェアとヒストグラムで標的細胞を表すライブリンパ球ゲートからのイベントを分析します。
6。代表的な結果
5日間の時間カップリングを介し、フローサイトメトリー疑似カラードットプロットの例RSE監視iTregの差別化がFoxP3のとCD25の共発現の相対に基づいて、CTLA-4とCD45RAは、 図2で見ることができます。 図3のヒストグラムはiTregs(CD25 こんにちは CD45RA - CD127 -/LOW細胞 )がソートされている成功した抑制アッセイを示しています。規制/抑制能力を獲得した5日間の培養物からのサブセットのみですが、図4は、Tregの誘導を示しています。ナイーブT細胞プール(上パネル)およびメモリーT細胞プール(下パネル)から、標準iTreg培地中で5日間培養した後。初期の細胞のCFSE染色はどちらナイーブ(右上パネル)やメモリーT細胞(右下のパネル)だけ細胞分裂のいくつかのラウンド後にiTregs(最高Foxp3を発現する細胞)に分化することを示している。
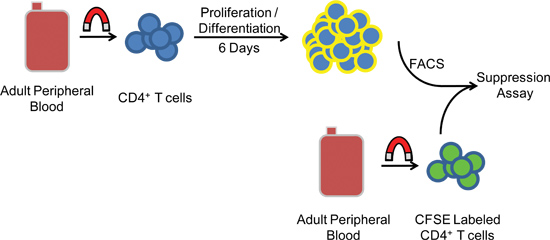
図1実験手順の概略図。 PBMCをART細胞- + CD25 CD4の磁気負の選択の前に勾配遠心分離を介してヒト末梢血から分離電子。文化の中で五から六日後、細胞は、FACSを受け、抑制活性を測定するために異種のCFSE標識した標的細胞と共培養されています。
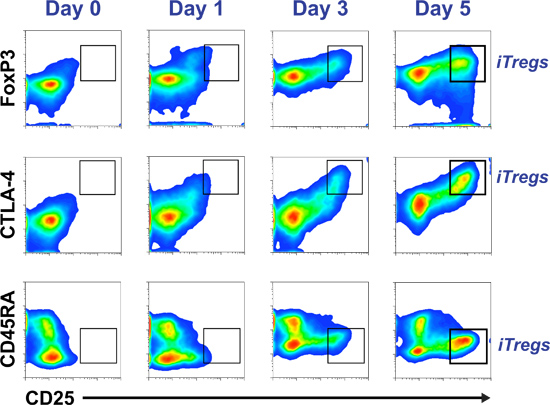
図2精製ヒト初代CD4 + CD25 - T細胞は培地をiTregで培養されています。細胞のアリコートは、CD45RAは、Foxp3、CTLA-4とCD25マーカーの進行状況を監視するためだけに分離(0日)後1日目、3、細胞培養の5で収集されます。 iTregプロファイルは、CD45RAに対応する-は、Foxp3 こんにちは 、CTLA-4 HiとCD25 ハイ (イングラフウィンドウで強調表示されている)。
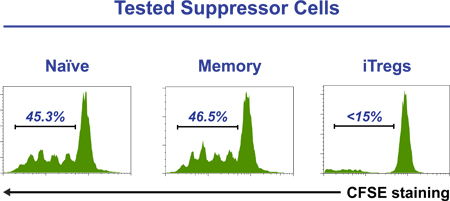
図3精製CD4 + CFSEラbeled細胞(1×10 5 /ウェル)をソートナイーブ、メモリーまたはiTreg細胞(3×10 4 /ウェル)の存在下で抑制インスペクタビーズをTreg細胞で培養されています。 5日後、細胞を採取し、染色した細胞のCFSEプロファイルはフローサイトメトリーによって分析されます。 iTreg細胞の存在は完全にCD4細胞の増殖+ T細胞を消失させる。数字が除算を受けたCFSEで標識した細胞の割合を示している。

図は4つの精製したヒト初代ナイーブ(CD4 + CD25 - CD45RA +)とメモリ(CD4 + CD25 - CD45RO +)T細胞は、培地をiTregにおけるCFSE培養で染色されています。 5日後、細胞を表現型と細胞分裂率が推定されている。 図2に示すように、両方のサブセットに区別iTregサブセットはに対応していCD45RA - CD25 こんにちは FoxP3のHiとCTLA-4 のHi(後者の二つ示されていません)。比較CFSE染色プロファイルは、5日間の培養中で最も増殖細胞としてiTregs(ここでは最高に発現FoxP3のT細胞など)を識別します。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
Tregの転送が自己免疫移植片拒絶反応および他の免疫または炎症媒介性疾患との闘いで膨大な治療可能性を秘めていますが、その効率的な生成と安定した保守のための方法はまだ開発されていない。ヒトT細胞を循環させる唯一の百分の1から5は、Tregsのであるので、その制御の拡大と分化は、クリニックにTregの実装の主要な抑止力としては、この不足を克服しています。我々はTGN1412試験13...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは、開示することは何もありません。
謝辞
著者は、フローサイトメトリー解析とソーティングと彼らの支援についてジェニファー·ストレンジとグレッグ·バウマンに感謝したいと思います。この作品は、NCRRからNIHグラント番号2P20 RR020171によってサポートされており、FMにケンタッキー大学のスタートアップ資金によりされた。GIEは、大統領大学院フェローシップとケンタッキー州の機会奨学金の支援を承認します。
Access restricted. Please log in or start a trial to view this content.
資料
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| Lymphoprep | 軸シールド | 1114547 | 室温で保つ |
| 冷蔵ベンチトップ遠心機 | エッペンドルフ | 5810R | |
| 明るいライン血球 | Hausser科学 | 3110 | |
| EasySepヒトCD4 + T細胞の濃縮キット | セル技術を幹 | 19052 | |
| EasySep人間の記憶CD4 + T細胞の濃縮キット | セル技術を幹 | 19157 | |
| EasySepヒトナイーブCD4 + T細胞の濃縮キット | セル技術を幹 | 19155 | |
| ビッグイージーEasySepマグネット | セル技術を幹 | 18001 | シルバー |
| 5 mLの丸底ポリスチレンチューブ | BDファルコン | 352008 | |
| 15 mLのポリプロピレン遠心チューブ | VWR | 89004-368 | |
| 14 mLのポリプロピレン丸底チューブ | BDファルコン | 352059 | |
| 50 mLのポリプロピレン遠心チューブ | VWR | 89004-364 | |
| ヒト抗CD3抗体 | バイオXセル | BE0001-2 | クローン:OKT3 |
| 24ウェル細胞ポリスチレン培養プレート | BDファルコン | 353047 | |
| 96ウェル丸底組織培養プレート | グルニエバイオOne | 650180 | |
| グルタミン-IおよびHEPES緩衝液を含むRPMI1640 | ギブコ | 72400 | |
| ウシ胎児血清(FBS) | ギブコ | 16000 | |
| β-メルカプトエタノール | シグマ | M7522 | |
| 組換えヒトTGF-β1 | ベイバイオサイエンス | 14-8348-62 | |
| 組換えヒトIL-2 | ベイバイオサイエンス | 14-8029-63 | |
| ウシ血清アルブミン(BSA) | MPバイオメディカル株式会社 | 810531 | |
| 0.5 M EDTA | Amresco | E177 | |
| マウス抗ヒトCD25-PE | ミルテニーバイオテク | 130-091-024 | クローン:4E3 |
| マウス抗ヒトCD45RA-PE-Cy5を | ベイバイオサイエンス | 15-0458-42 | クローン:HI100 |
| マウス抗ヒトCD127-APC | ミルテニーバイオテク | 130-094-890 | クローン:MB15-18C9 |
| DNアーゼII | MPバイオメディカル株式会社 | 190370 | |
| MoFloフローサイトメーター | ベックマン·コールター | ||
| FlowJoソフトウェア | ツリースター株式会社 | ||
| セルクエストProソフトウェア | BDバイオサイエンス | ||
| 新生仔ウシ血清 | ギブコ | 16010 | |
| L-グルタミン酸 | ギブコ | 25030 | |
| AIM-V | ギブコ | 0870112 | |
| CellTrace CFSE細胞増殖キット | インビトロジェン | C34554 | |
| Treg細胞の抑制インスペクタビーズ | ミルテニーバイオテク | 130-092-909 | |
| ペニシリン - ストレプトマイシン | ギブコ | 15140 | |
| 40μmのナイロン細胞株えー | BDファルコン | 352340 |
参考文献
- Powrie, F., Correa-Oliveira, R., Mauze, S., Coffman, R. L. Regulatory interactions between CD45RBhigh and CD45RBlow CD4+ T cells are important for the balance between protective and pathogenic cell-mediated immunity. The Journal of Experimental Medicine. 179, 589-600 (1994).
- Tarbell, K. V. Dendritic cell-expanded, islet-specific CD4+ CD25+ CD62L+ regulatory T cells restore normoglycemia in diabetic NOD mice. The Journal of Experimental Medicine. 204, 191-201 (2007).
- Morgan, M. E. Effective treatment of collagen-induced arthritis by adoptive transfer of CD25+ regulatory T cells. Arthritis and Rheumatism. 52, 2212-2221 (2005).
- Taylor, P. A., Lees, C. J., Blazar, B. R. The infusion of ex vivo activated and expanded CD4(+)CD25(+) immune regulatory cells inhibits graft-versus-host disease lethality. Blood. 99, 3493-3493 (2002).
- Ziegler, S. F. FOXP3: of mice and men. Annual Review of Immunology. 24, 209-226 (2006).
- Riley, J. L., June, C. H., Blazar, B. R. Human T regulatory cell therapy: take a billion or so and call me in the morning. Immunity. 30, 656-6565 (2009).
- Morgan, M. E. Expression of FOXP3 mRNA is not confined to CD4+CD25+ T regulatory cells in humans. Human Immunology. 66, 13-20 (2005).
- Wang, J., Huizinga, T. W. J., Toew, R. E. M. De Novo Generation and Enhanced Suppression of Human CD4+CD25+ Regulatory T Cells by Retinoic Acid. Journal of Immunology. 183, 4119-4126 (2009).
- Hori, S., Nomura, T., Sakaguchi, S. Control of regulatory T cell development by the transcription factor Foxp3. Science (New York, N.Y.). 299, 1057-1061 (2003).
- McHugh, R. S. CD4(+)CD25(+) immunoregulatory T cells: gene expression analysis reveals a functional role for the glucocorticoid-induced TNF receptor. Immunity. 16, 311-323 (2002).
- Takahashi, T. Immunologic Self-Tolerance Maintained by Cd25+Cd4+Regulatory T Cells Constitutively Expressing Cytotoxic T Lymphocyte-Associated Antigen 4. The Journal of Experimental Medicine. 192, 303-310 (2000).
- Liu, W. CD127 expression inversely correlates with FoxP3 and suppressive function of human CD4+ T reg cells. The Journal of Experimental Medicine. 203, 1701-1711 (2006).
- Schraven, B., Kalinke, U. CD28 superagonists: what makes the difference in humans. Immunity. 28, 591-595 (2008).
- Reneer, M. C. Peripherally induced human Regulatory T cells uncouple Kv1.3 activation from TCR-associated signaling. European Journal of Immunology. , (2011).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved