É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Geração de Células T reguladoras induzidas a partir de células T humanas primárias Naïve e Memória
Neste Artigo
Resumo
Nós descrevemos um método para a geração de células T de memória, regulamentar e ingénuos a partir de um único dador de sangue humano. Tregs polarizada pode ser então comparada com outros subconjuntos de uma variedade de aplicações genéticas e funcionais com homogeneidade genética, incluindo um ensaio de supressão também detalhados aqui.
Resumo
O desenvolvimento e manutenção das células T CD4 + de imunossupressores células T reguladoras (Tregs) contribuem para a tolerância periférica necessária para permanecer na homeostase imunológica com a grande quantidade de antigénios próprios e comensais e no corpo humano. Perturbações no equilíbrio entre Tregs e inflamatórias células T convencionais podem resultar em imunopatologia ou cancro. Embora a injecção terapêutica de Tregs foi mostrado para ser eficaz em modelos murinos de colite 1, diabetes tipo I 2, artrite reumatóide e doença do enxerto versus hospedeiro, 4 várias diferenças fundamentais em humanos versus rato Treg biologia 5 tem, até agora impedida a utilização clínica. A falta de um número suficiente, pureza, estabilidade e especificidade de homing terapêutico Tregs exigiu uma plataforma dinâmica do desenvolvimento Treg humana em que para optimizar as condições para a sua expansão ex vivo 6.
Aqui nós Dcircunscrever um método para a diferenciação de induzida Tregs (iTregs) a partir de um único dador de sangue periférico humano, que pode ser dividido em quatro etapas: isolamento de células mononucleares do sangue periférico, a selecção magnética de células T CD4 +, em cultura celular in vitro e fluorescência activado separação de células (FACS) de subconjuntos de células T. Uma vez que o factor de transcrição Treg assinatura P3 caixa forkhead (FoxP3) é um factor de transcrição induzida por activação em seres humanos 7 e sem outros marcadores únicos existe, um painel de combinatória de marcadores, deve ser utilizado para identificar as células T com actividade supressora. Depois de seis dias em cultura, as células no nosso sistema pode ser demarcada em naive células T, células T de memória ou iTregs com base na sua expressão relativa de CD25 e CD45RA. Como as células T de memória e naïve têm diferentes requisitos de polarização relatados e plasticidades 8, pré-triagem da população inicial de células T em CD45RA + e CD45RO + subconjuntos pode be usado para examinar essas discrepâncias. Consistente com os outros, nossa CD25 Hi CD45RA - níveis elevados de iTregs expressas FoxP3 9, GITR e CTLA-4 11 e baixos níveis de CD127 12. Na sequência de FACS de cada população, as células resultantes podem ser utilizados num ensaio de supressor que avalia a capacidade relativa para retardar a proliferação de carboxifluoresceína succinimidil éster (CFSE)-rotulado células T autólogas.
Protocolo
1. Isolamento de Células mononucleares do sangue periférico (PBMCs) de Buffy Coat
- Adquirir uma unidade de revestimento buffy do hospital ou centro de localização nas proximidades de sangue. Nosso centro de sangue nos fornece cerca de 40-60 mL de buffy coat por unidade obtido a partir de doadores de sangue normais.
- Derrame sangue em uma garrafa de vidro esterilizada contendo 500 mL PBS estéril para diluir buffy coat. O volume final de PBS + buffy coat deve ser de 250 mL.
- Encha dez 50 mL tubos cónicos cada uma com 20 mL solução de Lymphoprep.
- Suavemente sobrepor a solução Lymphoprep com 25 mL de buffy coat diluída, tendo cuidado para não perturbar a solução Lymphoprep.
- Girar tubos durante 30 minutos à temperatura ambiente a 500 x g. Assegure-se para desligar o freio de centrífuga, de modo a não perturbar a fracção de linfócitos.
- Recolher as PBMCs na interface entre o Lymphoprep e as camadas de plasma médio com uma pipeta. Aspirar o off plasma médio até cerca de 1 mLainda cobre a camada de buffy coat contendo as CMSPs. Usar uma pipeta 10 mL de transferir para um tubo de PBMCs mL novo 50.
- Lave as células duas vezes com PBS e em seguida, ressuspender as células em 50 mL de RPMI frio para contagem num hemocitómetro. Recuperação típica é de 8 x 10 8 - 1 x 10 9 PBMCs.
Este procedimento pode ser reduzida para pequenos volumes de sangue. A diluição das amostras de sangue total é de 1:1 em PBS.
2. Seleção Negativa magnética de células CD4 + Total de células T, CD4 + CD45RA células T naive ou CD4 + CD45RO + células T de memória de PBMCs utilizando Kits de enriquecimento EasySep (células-tronco Technologies)
Passos a seguir para 1 x 10 8 a 4,25 x 10 8 PBMCs.
- PBMCs Ressuspender a uma concentração final de 5 x 10 7 por mL em PBS contendo 2% de FBS e 1 mM de EDTA. Mover células para a 14 mL de polipropileno novo tubo de fundo redondo.
- Isolamento do total de células CD4 + de células T humanas por selecção negativa: adicionar T CD4 + humanas de cocktail de Enriquecimento Célula de anticorpos (50 uL por mL de PBMCs), misturar e incubar durante 10 minutos à temperatura ambiente.
- Isolamento de células T humanas naive por selecção negativa: adicionar 50 ul de anti-CD45RO anticorpo por mL de suspensão de células PBMC, misturar e incubar durante 15 minutos à temperatura ambiente. Adicionar cocktail de enriquecimento fornecido com o kit (50 uL de por mL de PBMCs), misturar e incubar à temperatura ambiente durante 10 minutos.
- Isolamento de células T humanas de memória por selecção negativa: adicionar CD4 + humanas de memória T Cocktail Enriquecimento Célula de anticorpos (50 uL por mL de PBMCs), misturar e incubar durante 10 minutos à temperatura ambiente.
- Misture bem para partículas magnéticas igualmente distribuí-los em toda a solução. Faça nanopartículas não vórtice de kit ingênuo.
- Adicionar as partículas magnéticas (100 uL por mL de PBMCs para CD4 + totais e selecção de células T ingénuos, 50 uL por mL de PBMCs para a memória de selecção de células T). Mix com cuidado pipetando 2-3 vezes e incubar à temperatura ambiente por 10 minutos para a selecção de células T naïve ou 5 minutos de memória ou total T CD4 + de seleção de célula.
- Adicionar PBS contendo 2% de FBS e 1 mM de EDTA para levar o volume até 10 mL por tubo. Misture com cuidado pipetando 2-3 vezes antes de colocar tubo sem tampa em prata ímã EasySep para 5, 10 ou 2,5 minutos para CD4 total de células T, subconjuntos ingênuos e memória, respectivamente.
- Com tubo ainda no ímã EasySep, despeje o líquido em novo tubo de 50 ml para isolar as células de interesse.
- Repita os passos 2.5 e 2.6 para uma melhor recuperação.
3. Condições de cultura celular para induzir as células T reguladoras
- Um dia antes passos 1 e 2, o revestimento placas de cultura de tecidos por primeira diluição anticorpo anti-CD3 (OKT3 clone) a uma concentração de 1 ug / mL em PBS estéril. Para uma placa de 6 poços adicionar 2 mL de PBS + anti-CD3 por poço, para uma placa de 12 poços adicionar 1 mL ou para uma placa de 24 poços adicionar 500 uL por poço. Manter a placa revestida a 4 ° C até à utilização.
- Preparar meio de polarização através da adição de 10% inactivado pelo calor de soro fetal bovino (FBS), 100 U / mL de penicilina, estreptomicina 100 ug / mL e 50 uM β-mercaptoetanol para RPMI-1640 pré-suplementado com 2,06 mM mM Glutamax-I e 25 tampão HEPES. Em seguida, adicionar 2 ng / mL de TGF-β e 5 ng / mL de IL-2. Aqui, pode-se adicionar ligantes ou inibidores de interesse para a mídia. Ressuspender as células a partir do passo 2, a uma concentração de 2 x 10 6 células / ml de meio de polarização.
- Pré-aquecer as placas a 37 ° C e aspirar o PBS de anti-CD3 poços revestidos antes de adicionar as células. Adicionar 4 mL por poço de suspensão de células para uma placa de 6 poços, 2 mL de células para uma placa de 12 poços ou 1 mL de células para uma placa de 24 bem. Encha poços vazios com PBS para reduzir a evaporação demeios de comunicação. Incubar durante 3 dias a 37 ° C / 5% de CO 2.
- No dia 3 pós de revestimento, girar para baixo da placa numa centrífuga durante 5 minutos a 500 x g. Sem perturbar as células T na parte inferior da placa, remover metade dos meios de comunicação e substituir com meios frescos. Alternativamente, se o bem torna-se cheia com células (concentração acima de 3 x 10 6 / mL), dividir o volume igualmente em outra placa de anti-CD3 revestido e adicionar meios frescos para trás até ao volume original. Incubar durante dois a três dias mais a 37 ° C / 5% de CO 2.
4. Fluorescência-activated cell sorting (FACS) de três populações de células T
- Preparar tampão de lavagem de FACS pela adição de 0,5% (w / v) de albumina sérica bovina (BSA) e 2 mM de EDTA para PBS estéril. Tampão a 4 ° C para obter a frio.
- Remover as células de cultura de células bem e enxaguar cada poço com 2 mL de PBS para assegurar a recuperação completa das células. Coloque todas as células em 50 tubos de polipropileno mL e centrifugar a 500 xg durante 10minutos a 4 ° C.
- Contar as células em um hemocitómetro para determinar a densidade celular.
- O local de 3-5 x 10 células por tubo 5 em quatro separadas 5 mL tubos de fundo redondo de poliestireno para os controlos de compensação. Coloque células restantes em tubos de 50 ml de polipropileno, não mais do que 35 x 10 6 células por tubo.
- Girar para baixo células durante 5 minutos a 4 ° C e meios de comunicação aspirado. Ressuspender as células a serem classificados em 90 uL de tampão de lavagem fria por 1 x 10 6 células. Ressuspender em 100 L de tampão de lavagem a frio dos tubos de controle de compensação.
- Para as células a ser ordenados, combinar 2 uL de anti-CD25-PE, 3 uL de anti-CD45RA-PE-Cy5 e 1 uL de anti-CD127-APC por 1 x 10 6 células. Adicionar nenhum anticorpo para o primeiro tubo de compensação de controlo, 2 uL de anti-CD25-PE para o segundo tubo, 3 uL de anti-CD45RA - PE-Cy5 ao terceiro tubo uL de anti-e1 CD127-APC para o tubo de quarto. Incubar todos os tubos em gelo durante 45 minutos no escuro.
- Adicionar 10 mL de tampão de lavagem a frio para as células a ser ordenados e 1 ml para os tubos de controlo de compensação. Centrifugar todos os células a 500 xg durante 5 minutos a 4 ° C.
- Aspirar células tampão e ressuspender a uma concentração de 1 x 10 células por 7 mL de tampão de lavagem. Adicionar 1,5 ul de DNase II por mL de células antes de filtrar através de um coador de 40 uM de células de nylon. Mover as células a várias 5 mL redondos tubos de polipropileno de fundo com não mais do que 3,5 mL por tubo. Ressuspender as células controle de compensação em 300 uL de tampão de lavagem.
- Defina a compensação em MoFlo citômetro de fluxo para minimizar a detecção cruzada pela, PE APC e PE-Cy5 filtros. Definir portas para classificar iTregs (CD25 CD127 Hi -/LOW CD45RA - células), virgens (CD25-CD45RA +) e memória (CD25 - CD45RA -) células T em 5 mL tubos de fundo redondo de isopor contendo 1 mL soro de bezerro recém-nascido.
5. Ensaio de supressão
- Faça SUPPRession meio de ensaio por adição de 100 U / mL de penicilina, 100 ug / mL de estreptomicina, 5 ng / mL de IL-2 e 2 ng / mL de TGF-β ao AIM-V.
- No dia do ensaio, purificar CD4 + de células T heterólogas a partir de buffy coat, como indicado nos passos 1 e 2. Estas serão as células alvo para o ensaio de supressão e não contém células CD25 + Treg, como pode ser visto na Figura 2, dia 0.
- Células de etiqueta com CellTrace kit como as instruções do fabricante, excepto utilizando apenas 1 ul de solução-mãe 5 mM por mL de células, em vez de 2 uL. Mantendo fora da luz directa, adicionar 18 uL de DMSO a fornecida pelo kit CellTrace para um frasco de CFSE para fazer uma solução estoque de 5 mM. Ressuspender o número necessário de células alvo (até um máximo de 1 x 10 7) em pré-aquecido PBS + 0,1% (w / v) de BSA para uma concentração final de 1 x 10 6 células / ml. Adicionar 1 mL de 5 mM CFSE por mL de células e incubar em um banho de água 37 ° C durante 5 minutes. Adicionar 5 volumes de completa, gelada RPMI com FBS 10% para extinguir a coloração e incubar em gelo durante 5 minutos. Lave as células duas vezes mais com frio RPMI completo e ressuspender 1 x 10 células por 5 100 uL de meio de ensaio de supressão.
- Grânulos inspector Treg supressão são a uma concentração stock de 2 x 10 7 grânulos / mL. Pellet um número de pérolas igual ao número total de células por experimento por centrifugação rápida em um tubo de Eppendorf. Lavar uma vez com RPMI grânulos e re-sedimento. Após a aspiração de RPMI, grânulos Ressuspenda de modo que a quantidade apropriada de grânulos por poço estão em 8 uL de meio de ensaio de supressão.
- Para uma placa de fundo redondo bem 96 cultura de tecidos, adicionar CFSE coradas células (1 x 10 5 células / mL), grânulos de inspector e células polarizadas e ordenadas (1 x 10 5 células / mL) em meio de ensaio fresco de supressão de um alvo desejado (manchado CFSE): razão (ordenadas) efectora em um volume final de 200 uL. Todas as condições são definidas em tripliCates.
- Preparar a primeira de duas condições de controlo por adição de 100 uL de células coradas CFSE, 8 uL de pérolas de inspector e 1 x 10 5 de fresco, de células não coradas em 92 uL de meio de ensaio supressor por poço. Preparar o segundo controlo com os mesmos componentes celulares, como acima, mas sem Tregs grânulos inspector.
- Cobrir a placa em folha de alumínio e incubar a 37 ° C / 5% de CO2 durante cinco dias.
- No escuro, colete células de cada poço por pipetagem e coloque em um tubo de 5 mL de poliestireno de fundo redondo. Centrifugar células a 500 xg durante 5 minutos a 4 ° C, aspirado meios, e ressuspender em 300 ul de FACS frio tampão de lavagem a partir do passo 4. Analisar o primeiro 3 x 10 4 CFSE + eventos ao vivo a partir do portão de linfócitos representando as células-alvo em um histograma com software da Quest Cell.
6. Os resultados representativos
Exemplo de pseudo de citometria de fluxo pontilham parcelas ao longo de um tempo de cinco dias-coudiferenciação iTreg rse monitorização com base na relação co-expressão de CD25 com FoxP3, CTLA-4 e CD45RA pode ser visto na Figura 2. O histograma na Figura 3 mostra um ensaio de supressão sucesso, em que ordenadas iTregs (CD25 Hi CD45RA - CD127 células -/LOW). São apenas o subconjunto de uma cultura de cinco dias, que adquiriu capacidade reguladora / supressor A Figura 4 mostra a indução de Tregs a partir de uma piscina ingénuo de células T (painéis superiores) e uma memória de pool de células T (painéis inferiores), após cinco dias de cultura em meio de iTreg padrão. CFSE coloração de células iniciais demonstram que tanto as células T naive (painel superior direito) ou memória (painel inferior direito) para diferenciar iTregs (mais FoxP3-células que expressam) somente após várias rodadas de divisão celular.
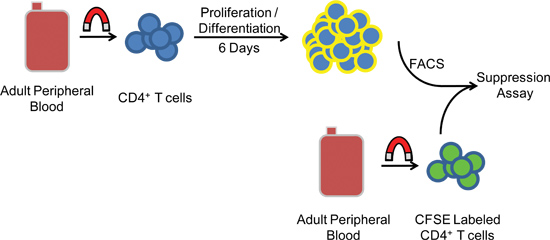
Figura 1. Esquemática do procedimento experimental. PBMCs are separados do sangue periférico humano através de centrifugação de gradiente de antes da seleção negativa magnética de células CD4 + CD25 - células T. Depois de cinco a seis dias em cultura, as células submetidas FACS e são co-incubados com heterólogos CFSE células alvo marcadas para medir a actividade supressora.
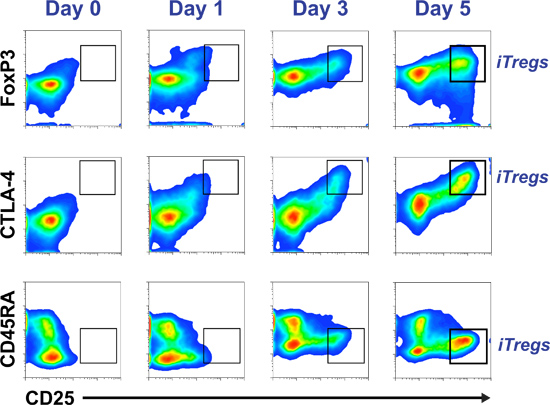
A Figura 2 humana purificada CD4 + primárias CD25 -. Células T são cultivadas em meio iTreg. Uma alíquota de células são recolhidas apenas depois do isolamento (dia 0) e nos dias 1, 3 e 5 de cultura de células para monitorizar o progresso de CD45RA, FoxP3, CTLA-4 e CD25 marcadores. O perfil corresponde a iTreg CD45RA -, FoxP3 Hi, Hi CTLA-4 e CD25 Hi (em destaque na janela de gráfico).
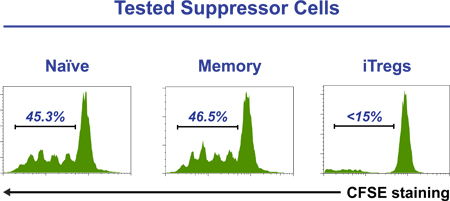
Figura 3. Purificada CD4 + CFSE lacélulas Beled (1 x 10 5 / poço) são cultivadas com Tregs grânulos inspector de supressão, na presença de ordenados células de memória, ou ingénuo iTreg (3 x 10 4 / poço). Após cinco dias, as células são colhidas e do perfil de CFSE das células coradas é analisada por citometria de fluxo. A presença de células iTreg completamente abolida a proliferação de células T CD4 +. Os números são indicativos de percentagem de células CFSE-rotulados que tenham sido submetidos a divisão.

Figura 4 purificada humana primária ingênuo. (CD4 + CD25 - CD45RA +) e memória (CD4 + CD25 - CD45RO +) células T são corados com CFSE e cultivadas em iTreg médio. Após cinco dias, as células são fenotipado e as taxas de divisão celular estimado. Como indicado na Figura 2, o subconjunto iTreg diferenciados a partir de ambos os subconjuntos corresponde àCD45RA - CD25 FoxP3 Hi Hi e CTLA-4 Hi (dois últimos não mostrado). Perfis de coloração comparativos CFSE identificar iTregs (aqui como mais elevados nas células que expressam Foxp3 T) como as células mais proliferativas durante a cultura de cinco dias.
Access restricted. Please log in or start a trial to view this content.
Discussão
Enquanto a transferência Treg promissora terapêutico no combate enorme rejeição do enxerto autoimunidade e outras desordens imunitárias ou inflamatórias mediadas, métodos para a sua geração eficiente e manutenção estável ainda não tenham sido desenvolvidos. Como apenas 1-5% de circulação de células T humanas são Tregs, a sua expansão controlada e diferenciação supera esta escassez como um impedimento principal da aplicação de Tregs na clínica. Por outro lado, como aprendemos com o julgamento TGN14...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores gostariam de agradecer a Jennifer Strange e Greg Bauman para a sua assistência com a análise de Citometria de Fluxo e classificação. Este trabalho foi financiado pelo NIH Grant Número 2P20 RR020171 do NCRR e pela Universidade de Kentucky fundos de inicialização para FM; GIE agradece o apoio da Sociedade de Pós-Graduação Presidencial e da Irmandade Opportunity Kentucky.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Nome do reagente | Companhia | Número de Catálogo | Comentários |
| Lymphoprep | Axis-Shield | 1114547 | Manter a temperatura ambiente |
| Centrífuga de bancadas refrigerado | Eppendorf | 5810R | |
| Brilhante-Line hemocitômetro | Hausser Científico | 3110 | |
| CD4 + T EasySep Humanos Kit Enriquecimento celular | Stem Cell Technologies | 19052 | |
| EasySep Humanos da Memória + T CD4 Kit Enriquecimento celular | Stem Cell Technologies | 19157 | |
| EasySep Humanos CD4 + T Naïve Kit Enriquecimento celular | Stem Cell Technologies | 19155 | |
| The Big Easy EasySep Magrede | Stem Cell Technologies | 18001 | Prata |
| 5 mL tubos de poliestireno de fundo redondo | BD Falcon | 352008 | |
| 15 ml de centrífuga tubos de polipropileno | VWR | 89004-368 | |
| 14 mL de polipropileno de fundo redondo Tubos | BD Falcon | 352059 | |
| 50 ml de centrífuga tubos de polipropileno | VWR | 89004-364 | |
| Anticorpo anti-CD3 humano | Cell Bio X | BE0001-2 | Clone: OKT3 |
| 24 Bem celular placa de cultura de poliestireno | BD Falcon | 353047 | |
| 96 Bem fundo redondo placa de cultura de tecidos | Grenier Bio-One | 650180 | |
| RPMI 1640 com Glutamax-I e tampão HEPES | Gibco | 72400 | |
| Soro fetal de bovino (FBS) | Gibco | 16000 | |
| β-mercaptoetanol | Sigma | M7522 | |
| Recombinante Humana TGF-β1 | eBioscience | 14-8348-62 | |
| Human IL-2 recombinante | eBioscience | 14-8029-63 | |
| Albumina de soro bovino (BSA) | MP Biomedicals Inc. | 810531 | |
| EDTA 0,5 M | Amresco | E177 | |
| Rato anti-humano CD25-PE | Miltenyi Biotec | 130-091-024 | Clone: 4E3 |
| Rato anti-humano CD45RA-PE-Cy5 | eBioscience | 15-0458-42 | Clone: HI100 |
| Rato anti-humano CD127-APC | Miltenyi Biotec | 130-094-890 | Clone: MB15-18C9 |
| DNase II | MP Biomedicals Inc. | 190370 | |
| MoFlo citómetro de fluxo | Beckman Coulter | ||
| FlowJo Software | Árvore Star, Inc. | ||
| Célula Quest Software Pro | BD Biosciences | ||
| Recém-nascido Calf Serum | Gibco | 16010 | |
| L-glutamina | Gibco | 25030 | |
| AIM-V | Gibco | 0870112 | |
| CFSE CellTrace Kit Proliferação de Células | Invitrogen | C34554 | |
| Treg Contas Inspetor de Supressão | Miltenyi Biotec | 130-092-909 | |
| Penicilina-Estreptomicina | Gibco | 15140 | |
| 40 estirpe celular iM Nyloner | BD Falcon | 352340 |
Referências
- Powrie, F., Correa-Oliveira, R., Mauze, S., Coffman, R. L. Regulatory interactions between CD45RBhigh and CD45RBlow CD4+ T cells are important for the balance between protective and pathogenic cell-mediated immunity. The Journal of Experimental Medicine. 179, 589-600 (1994).
- Tarbell, K. V. Dendritic cell-expanded, islet-specific CD4+ CD25+ CD62L+ regulatory T cells restore normoglycemia in diabetic NOD mice. The Journal of Experimental Medicine. 204, 191-201 (2007).
- Morgan, M. E. Effective treatment of collagen-induced arthritis by adoptive transfer of CD25+ regulatory T cells. Arthritis and Rheumatism. 52, 2212-2221 (2005).
- Taylor, P. A., Lees, C. J., Blazar, B. R. The infusion of ex vivo activated and expanded CD4(+)CD25(+) immune regulatory cells inhibits graft-versus-host disease lethality. Blood. 99, 3493-3493 (2002).
- Ziegler, S. F. FOXP3: of mice and men. Annual Review of Immunology. 24, 209-226 (2006).
- Riley, J. L., June, C. H., Blazar, B. R. Human T regulatory cell therapy: take a billion or so and call me in the morning. Immunity. 30, 656-6565 (2009).
- Morgan, M. E. Expression of FOXP3 mRNA is not confined to CD4+CD25+ T regulatory cells in humans. Human Immunology. 66, 13-20 (2005).
- Wang, J., Huizinga, T. W. J., Toew, R. E. M. De Novo Generation and Enhanced Suppression of Human CD4+CD25+ Regulatory T Cells by Retinoic Acid. Journal of Immunology. 183, 4119-4126 (2009).
- Hori, S., Nomura, T., Sakaguchi, S. Control of regulatory T cell development by the transcription factor Foxp3. Science (New York, N.Y.). 299, 1057-1061 (2003).
- McHugh, R. S. CD4(+)CD25(+) immunoregulatory T cells: gene expression analysis reveals a functional role for the glucocorticoid-induced TNF receptor. Immunity. 16, 311-323 (2002).
- Takahashi, T. Immunologic Self-Tolerance Maintained by Cd25+Cd4+Regulatory T Cells Constitutively Expressing Cytotoxic T Lymphocyte-Associated Antigen 4. The Journal of Experimental Medicine. 192, 303-310 (2000).
- Liu, W. CD127 expression inversely correlates with FoxP3 and suppressive function of human CD4+ T reg cells. The Journal of Experimental Medicine. 203, 1701-1711 (2006).
- Schraven, B., Kalinke, U. CD28 superagonists: what makes the difference in humans. Immunity. 28, 591-595 (2008).
- Reneer, M. C. Peripherally induced human Regulatory T cells uncouple Kv1.3 activation from TCR-associated signaling. European Journal of Immunology. , (2011).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados