Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Генерация индуцированного регуляторных Т клеток из первичной человека наивного и Т-клеток памяти
В этой статье
Резюме
Мы опишем метод для создания нормативной, оперативной памяти и наивных Т-клеток из одной человеческой донорской крови. Поляризованный Tregs можно затем по сравнению с другими подмножества в различных генетических и функциональных приложений с генетической однородности, в том числе подавление анализ также подробно здесь.
Аннотация
Разработка и сопровождение иммуносупрессивных CD4 + регуляторных Т-клеток (Tregs) способствуют периферической толерантности необходимо оставаться в иммунологический гомеостаз с огромным количеством себе и комменсальных антигенов и на организм человека. Возмущения в балансе между Tregs и воспалительных обычные Т-клеток может привести к иммунопатологии или рак. Хотя терапевтические инъекции Tregs было показано, что эффективность в мышиных моделях колита 1, тип диабета 2, ревматоидный артрит и трансплантат против хозяина, 4 несколько принципиальных отличий в сравнении с человеческой мыши Treg биологии 5, до сих пор препятствует клинического использования. Отсутствие достаточного количества, чистоты, стабильности и наведения специфику терапевтической Tregs необходимость динамическая платформа развития человека Treg, на котором для оптимизации условий для расширения своих бывших естественных 6.
Здесь уровня Дописывать круг метод дифференциации индуцированных Tregs (iTregs) из одной человеческой периферической крови доноров, которые могут быть разбиты на четыре этапа: изоляция мононуклеарных клеток периферической крови, магнитные выбор CD4 + Т-клетки, в пробирке культуру клеток и флуоресцентных активированный сортировки клеток (FACS) Т подмножеств клеток. С Treg подпись транскрипционный фактор forkhead окно P3 (FOXP3) является активация вызванных фактором транскрипции у людей 7 и никакой другой уникальный маркер существует, комбинаторной панели маркеров должны быть использованы для определения Т-лимфоцитов с супрессорной активности. После шести дней в культуре клетки в нашей системе может быть разграничены на наивных Т-клеток, Т-клетки памяти или iTregs на основе их относительной выражение CD25 и CD45RA. В ячейках памяти и наивных Т имеют различные сообщил поляризации требования и пластичности 8 предварительной сортировки исходной популяции Т-клеток в CD45RA + + и CD45RO подмножества может бE используется для изучения этих расхождений. В соответствии с другим, наши CD25 Привет CD45RA - iTregs экспресс высокого уровня FOXP3 9 GITR и CTLA-4 11 и низкого уровня CD127 12. После FACS каждой популяции, полученные в результате клетки могут быть использованы в анализе супрессоров, которая оценивает относительную способность замедлить распространение карбоксифлуоресцеина сукцинимидил эфира (CFSE)-меченных аутологичных Т-клеток.
протокол
1. Выделение человека мононуклеарных клеток периферической крови (МНПК) из шерсти Баффи
- Приобретает одну единицу слой кровяного сгустка из больницы или поблизости от расположения центра крови. Наш центр крови дает нам около 40-60 мл лейкомассы на единицу получил от нормальных доноров крови.
- Налейте крови в автоклаве 500 мл стеклянный флакон, содержащий стерильный PBS разбавить лейкомассы. Окончательный объем PBS + лейкомассы должно быть 250 мл.
- Заполнить десять 50 мл конические пробирки по 20 мл Lymphoprep решение.
- Аккуратно наложить Lymphoprep решение с 25 мл разбавленного слоя кровяного сгустка, стараясь не нарушить Lymphoprep решение.
- Спиновая трубы в течение 30 минут при комнатной температуре в 500 х гр. Убедитесь в том, чтобы выключить тормоза центрифуги, чтобы не мешать лимфоцитов фракции.
- Соберите МНПК на границе Lymphoprep и плазмы средних слоев с пипеткой. Аспирируйте плазмы от средней до около 1 млпо-прежнему покрывает слой лейкомассы содержащие МНПК. С помощью 10 мл пипетки перенести МНПК на новый 50 мл трубку.
- Промойте клетки дважды PBS и ресуспендируют клеток в 50 мл холодной RPMI рассчитывать на гемоцитометра. Типичные восстановления составляет 8 × 10 8 - 1 х 10 9 МНПК.
Эта процедура может быть уменьшено для небольших объемов крови. Разведение образцов цельной крови составляет 1:1 в PBS.
2. Магнитные негативной селекции Всего CD4 + Т-клеток CD4 + + CD45RA наивные Т-клеток CD4 + или CD45RO + Т-клеток памяти с использованием МНПК EasySep комплекты обогащения (стволовых клеточных технологий)
Последовательность действий для 1 х 10 8 до 4,25 х 10 8 МНПК.
- Ресуспендируйте МНПК до конечной концентрации 5 × 10 7 процентов мл в PBS, содержащем 2% FBS и 1 мМ ЭДТА. Перемещение клеток к новому 14 мл полипропиленовые круглой трубе вниз.
- Изоляция от общего числа человеческих CD4 + T-клеток негативный отбор: добавить человека CD4 + Т-клеток Обогащение коктейль антител (50 мкл на мл МНПК), перемешать и инкубировать 10 минут при комнатной температуре.
- Выделение человека наивных Т-клеток путем отрицательного отбора: добавить 50 мкл анти-CD45RO антитела на мл клеточной суспензии МКПК, перемешать и инкубировать 15 минут при комнатной температуре. Добавить обогащения коктейль поставляемые в наборе (50 мкл на мл МНПК), перемешайте и выдержите при комнатной температуре в течение 10 минут.
- Выделение человека Т-клеток памяти негативный отбор: добавить памяти человека CD4 + Т-клеток Обогащение коктейль антител (50 мкл на мл МНПК), перемешать и инкубировать 10 минут при комнатной температуре.
- Смешайте магнитных частиц и в равной степени распределить их по всему решению. Не вихрь наночастиц из наивных комплект.
- Добавить магнитных частиц (100 мкл на мл МНПК для общего CD4 + T и наивно выбора ячейки, 50 мкл на мл МНПК для выбора ячейки памяти T). Микс, мягко пипетки 2-3 раза и инкубировать при комнатной температуре в течение 10 минут для наивных Т выбора ячейки или 5 минут на память или полное CD4 + Т-клеточной селекции.
- Добавить PBS, содержащий 2% FBS и 1 мМ ЭДТА, чтобы довести объем до 10 мл на трубе. Смешать, осторожно пипеткой 2-3 раза прежде, чем поместить трубку в раскрытый серебряный магнит EasySep на 5, 10 или 2,5 минут для полной CD4 + Т-клеток, наивные и память подмножества соответственно.
- В трубке по-прежнему в магнит EasySep, залить жидкость в новой 50 мл трубку, чтобы изолировать клетки интерес.
- Повторите шаги 2.5 и 2.6 для лучшего восстановления.
3. Условия культуры клеток, чтобы вызвать регуляторных Т клеток
- За день до шаги 1 и 2, пальто пластин культуры тканей, сначала разбавляя анти-CD3 антитела (OKT3 клон) в концентрации 1 мкг / мл в стерильном PBS. Для 6-луночного планшета добавляют 2 мл PBS + анти-CD3 на лунку, для 12-луночного планшета добавляют 1 мл или 24-луночного планшета добавить 500 мкл на лунку. Держите покрытие пластин при температуре 4 ° C до использования.
- Подготовить поляризация среды добавлением 10% тепла инактивированной эмбриональной телячьей сыворотки (FBS), 100 ед / мл пенициллина, 100 мкг / мл стрептомицина и 50 мкМ β-меркаптоэтанол в RPMI-1640 предварительно дополнить 2,06 мм Glutamax-я и 25 мМ HEPES буфера. Затем добавьте 2 нг / мл TGF-β и 5 нг / мл IL-2. Здесь можно добавить лигандами или ингибиторов, представляющих интерес для СМИ. Ресуспендируйте клетки на шаге 2 в концентрации 2 х 10 6 клеток / мл поляризации среды.
- Предварительно теплой пластин при 37 ° С и аспирации PBS из анти-CD3-лунок перед добавлением клеток. Добавить 4 мл на лунку клеточной суспензии для 6 лунками, 2 мл клеток для 12-луночного планшета или 1 мл клеток для 24-луночного планшета. Заполнение пустых скважин с PBS, чтобы уменьшить испарениесредства массовой информации. Выдержите в течение 3 дней при температуре 37 ° C / 5% CO 2.
- На 3-й день после покрытия, замедления вращения пластин в центрифуге в течение 5 минут при 500 х гр. Не нарушая Т-клеток в нижней части плиты, удалите половину средств массовой информации и заменить свежей информации. Кроме того, если и становится переполнен клеток (концентрация выше 3 х 10 6 / мл), разделите объем в равной степени в другой анти-CD3 покрытием плиты и добавить свежие СМИ обратно до первоначального объема. Выдержите в течение двух-трех дней при температуре 37 ° C / 5% CO 2.
4. Флуоресценции, активированных сортировки клеток (FACS) трех популяций Т-клеток
- Подготовить FACS моющий буфер добавлением 0,5% (вес / объем) бычьего сывороточного альбумина (БСА) и 2 мМ ЭДТА в стерильной PBS. Место буфера при 4 ° С для получения холода.
- Удалить из клеток и клеточных культур и промойте каждую лунку с 2 мл PBS, чтобы обеспечить полное восстановление клеток. Поместите все клетки в 50 мл труб полипропиленовых и центрифуги в 500 мкг в течение 10минут при 4 ° C.
- Подсчитать ячейки гемоцитометра, чтобы определить плотность клеток.
- Место 3-5 х 10 5 клеток на трубе в четыре отдельные 5 мл круглым дном полистирола трубы для компенсации управления. Положите оставшиеся клетки в 50 мл полипропиленовые трубы, не более 35 х 10 6 клеток на трубе.
- Спином вниз клетки в течение 5 минут при температуре 4 ° C и аспирации СМИ. Ресуспендируйте клетки должны быть отсортированы в 90 мкл холодного промывочного буфера в 1 х 10 6 клеток. Ресуспендируйте в 100 мкл холодного буфера стиральные трубы компенсации управления.
- Для ячейки, которые будут отсортированы, объединить 2 мкл анти-CD25-PE, 3 мкл против CD45RA-PE-Cy5 и 1 мкл анти-CD127 АПК на 1 х 10 6 клеток. Добавить нет антител к первой трубе контроль компенсации, 2 мкл анти-CD25-PE на второй трубе, 3 мкл против CD45RA - PE-Cy5 третьей трубы and1 мкл анти-CD127 АПК в четвертом трубку. Выдержите все трубы на льду в течение 45 минут в темноте. Добавить 10 мл холодного буфера стирки клетки должны быть отсортированы и 1 мл в пробирки компенсации управления. Центрифуга всех клеток в 500 мкг в течение 5 минут при 4 ° C.
- Аспирируйте буфера и ресуспендирования клеток в концентрации 1 х 10 7 клеток на мл промывочного буфера. Добавить 1,5 мкл ДНКазы II на мл клеток до фильтрации через сито 40 мкМ клетки нейлона. Перемещение клеток в нескольких 5 мл труб круглого сечения нижней полипропилена с не более 3,5 мл на трубе. Ресуспендируйте клеток компенсации контроля в 300 мкл промывочного буфера.
- Установите компенсацию на проточный цитометр MoFlo минимизировать крест обнаружения PE, APC и PE-Cy5 фильтров. Установить ворота сортировать iTregs (CD25 CD127 Привет -/LOW CD45RA - клетки), наивно (CD25 +-CD45RA) и памяти (CD25 - CD45RA -) Т-клеток в 5 мл круглым дном полистирола пробирки 1 мл новорожденных телячьей сыворотки.
5. Анализ борьбе
- Сделать suppression анализа СМИ, добавив 100 ЕД / мл пенициллина, 100 мкг / мл стрептомицина, 5 нг / мл IL-2 и 2 нг / мл TGF-β в AIM-V.
- В день теста, очистить гетерологичных CD4 + Т-клеток из лейкомассы, как указано в пунктах 1 и 2. Это будут клетки-мишени для подавления анализа и не содержат CD25 + клеток Treg, как видно на рисунке 2, 0-й день.
- Этикетка клеток CellTrace комплект в соответствии с инструкциями производителя, за исключением использования только 1 мкл 5 мМ маточного раствора в мл клеток вместо 2 мкл. Сохранение из прямого света, добавьте 18 мкл ДМСО поставляется комплект CellTrace в один флакон CFSE сделать 5 мМ маточного раствора. Ресуспендируйте необходимое количество клеток-мишеней (не более 1 х 10 7) в подогретую PBS + 0,1% (вес / объем) BSA до конечной концентрации 1 х 10 6 клеток / мл. Добавить 1 мкл 5 мМ CFSE на мл клеток и инкубировать при 37 ° С на водяной бане в течение 5 Minutх годов. Добавить 5 томов полного, ледяной RPMI с 10% FBS, чтобы утолить окрашивания и инкубировать на льду в течение 5 минут. Промойте клетки в два раза больше холодной полной RPMI и ресуспендируют 1 х 10 5 клеток в 100 мкл среды подавление анализа.
- TREG бисером подавление инспектора находятся на складе концентрации 2 х 10 7 бусин / мл. Гранул количество шариков равно общему числу клеток в эксперименте быстро центрифугирования в пробирке Эппендорф. Вымойте бисером раз с RPMI и вновь гранул. После того, как стремление RPMI, Ресуспендируйте бусины так, чтобы соответствующее количество бусин в хорошо находится в 8 мкл СМИ подавление анализа.
- Для 96 с круглым дном пластины культуре ткани, добавить CFSE-окрашенных клеток (1 х 10 5 клеток / мл), инспектор бисера и поляризованное и сортируют клетки (1 х 10 5 клеток / мл) в свежем анализе подавление средств массовой информации к желаемой цели (CFSE окрашенных) эффекторные (отсортированы) соотношение в конечном объеме 200 мкл. Все условия, которые установлены в tripliКейтс.
- Подготовка первого из двух условий контроль, добавляя по 100 мкл клеток CFSE окрашенные, 8 мкл инспектор бусы и 1 х 10 5 свежих, неокрашенных клеток в 92 мкл супрессоров среднего анализ на лунку. Подготовка второй элемент управления с тем же клеточных компонентов, как указано выше, но без TREG инспектор бисера.
- Крышка в алюминиевую фольгу и инкубировать при температуре 37 ° C / 5% CO 2 в течение пяти дней.
- В темноте, сбора клеток из каждой лунки с помощью пипетки и место в 5 мл полистирола круглой трубе вниз. Центрифуга клеток при 500 мкг в течение 5 минут при температуре 4 ° C, аспирации средствах массовой информации, и ресуспендируют в 300 мкл холодного FACS промывочного буфера, начиная с шага 4. Анализ первых 3-х 10 4 + CFSE события из живых лимфоцитов ворота представляющие клетки-мишени в виде гистограммы с сотового программное обеспечение Quest.
6. Представитель Результаты
Пример проточной цитометрии псевдо разбросанных участков в течение пяти дней временной связьюРГП разграничение iTreg мониторинга на основе относительной коэкспрессией CD25 с FOXP3, CTLA-4 и CD45RA можно увидеть на рисунке 2. Гистограмма на рисунке 3 показан успешный тест подавления, в котором сортируются iTregs (CD25 Привет CD45RA - CD127 -/LOW клеток). Являются только подмножество из пятидневной культура, которая приобрела регулирования / подавитель способность Рисунок 4 показывает индукция Tregs от наивных Т-клеток бассейн (верхняя панель) и ячейки памяти T бассейн (нижняя панель), по истечении пяти дней культуры в стандартной среде iTreg. CFSE окрашивания исходных клеток показали, что либо наивные (вверху справа) или Т-клетки памяти (внизу справа) дифференцироваться в iTregs (высшая FOXP3-экспрессирующие клетки) только после нескольких раундов деления клеток.
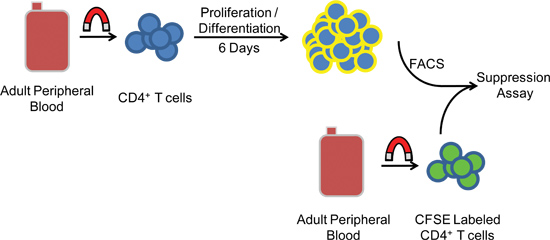
Рисунок 1. Схема экспериментальной процедуры. МНПК арэлектронной выделяется из периферической крови человека с помощью центрифугирования в градиенте магнитного до отрицательного отбора CD4 + CD25 - Т-клеток. Через пять-шесть дней в области культуры, клетки подвергаются FACS и совместно инкубируют с гетерологичной CFSE меченых клеток-мишеней для измерения активности супрессоров.
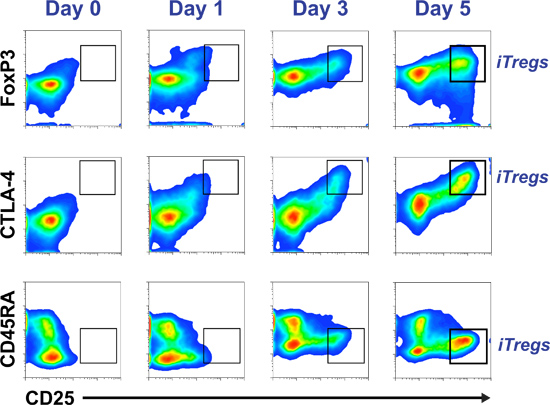
Рисунок 2 очищенная человека первичных CD4 + CD25 -. Т-клетки культивировали в iTreg среды. Аликвоту клеток собраны только после изоляции (день 0) и на 1, 3 и 5 клеточных культур для контроля за ходом CD45RA, FOXP3, CTLA-4 и CD25 маркеров. ITreg профиль соответствует CD45RA -, FOXP3 Привет, CTLA-4 и CD25 Привет Привет (выделены в окне графика).
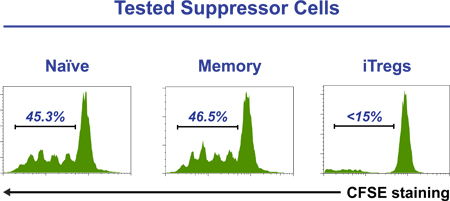
Рисунок 3. Очищенная CD4 + CFSE лаБелед клетки (1 х 10 5 / а) культивируют с TREG бисером подавление инспектор в присутствии отсортированы наивным, памяти или iTreg клеток (3 х 10 4 / а). Через пять дней, клетки собирают и CFSE профиль окрашенных клеток анализировали с помощью проточной цитометрии. Наличие iTreg клетки полностью отменяет распространение CD4 + Т-клеток. Цифры свидетельствуют о процентах CFSE-меченых клеток, которые прошли подразделения.

Рисунок 4 очищенные человеческие первичной наивно. (CD4 + CD25 - CD45RA +) и памяти (CD4 + CD25 - CD45RO +) Т-клетки окрашиваются CFSE и культурной iTreg в среду. Через пять дней клетки phenotyped и скорость деления клеток оценивается. Как показано на рисунке 2, iTreg подмножество отличается от обоих подмножества соответствуетCD45RA - CD25 Привет Привет FOXP3 и CTLA-4 Привет (два последних не показано). Сравнительный профиль окрашивания CFSE определить iTregs (здесь как высшая выражения FOXP3 Т-клетки), как наиболее пролиферативные клетки в течение пяти дней культуры.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Хотя Treg передачи держит огромный терапевтический обещание в борьбе с аутоиммунными отторжения трансплантата и других иммунных или воспалительных опосредованного нарушения, методы их эффективного формирования и стабильного обслуживания до сих пор не разработаны. Как только 1-5% цирку...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Авторы выражают благодарность Дженнифер Странно и Грег Баумана за помощь в анализе потока цитометрии и сортировки. Эта работа была поддержана Количество NIH Грант 2P20 RR020171 от NCRR и Университета Кентукки средства для запуска FM; ГНС признает поддержку президентской стипендии Высшее и стипендий Кентукки возможностей.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Название реагента | Компания | Номер по каталогу | Комментарии |
| Lymphoprep | Ось-Shield | 1114547 | Хранить при комнатной температуре |
| Холодильные настольные центрифуги | Эппендорф | 5810R | |
| Яркий-Line гемоцитометра | Хауссер Научные | 3110 | |
| EasySep человека CD4 + Т-клеток Обогащение Kit | Технологии стволовых клеток | 19052 | |
| EasySep человека CD4 + Т-памяти сотового обогащению Kit | Технологии стволовых клеток | 19157 | |
| EasySep человека наивного CD4 + Т-клеток Обогащение Kit | Технологии стволовых клеток | 19155 | |
| Big Easy EasySep Magчистый | Технологии стволовых клеток | 18001 | Серебро |
| 5 мл Круглые трубы полистирола Нижний | BD Сокол | 352008 | |
| 15 мл полипропиленовые трубы центрифуги | VWR | 89004-368 | |
| 14 мл полипропиленовые с круглым дном трубы | BD Сокол | 352059 | |
| 50 мл полипропиленовые трубы центрифуги | VWR | 89004-364 | |
| Человека анти-CD3 антитела | Bio X сотовых | BE0001-2 | Клон: OKT3 |
| 24 Ну Сотовые плиты из полистирола культуры | BD Сокол | 353047 | |
| 96 лунок круглым дном тканевой культуры плиты | Гренье Bio-One | 650180 | |
| RPMI 1640 с Glutamax-я и HEPES буфера | Гибко | 72400 | |
| Эмбриональной телячьей сыворотки (FBS) | Гибко | 16000 | |
| β-меркаптоэтанол | Сигма | M7522 | |
| Рекомбинантного человеческого TGF-β1 | eBioscience | 14-8348-62 | |
| Рекомбинантного человеческого IL-2 | eBioscience | 14-8029-63 | |
| Бычьего сывороточного альбумина (БСА) | MP Biomedicals Инк | 810531 | |
| 0,5 М ЭДТА | Amresco | E177 | |
| Мышь против человека CD25-PE | Miltenyi Biotec | 130-091-024 | Клон: 4E3 |
| Мышь против человека CD45RA-PE-Cy5 | eBioscience | 15-0458-42 | Клон: HI100 |
| Мышь против человека CD127 АПК | Miltenyi Biotec | 130-094-890 | Клон: MB15-18C9 |
| ДНКазы II | MP Biomedicals Инк | 190370 | |
| MoFlo Проточный цитометр | Beckman Coulter | ||
| FlowJo Software | Дерево Звезды, Inc | ||
| Сотовые Quest Pro Software | BD Biosciences | ||
| Новорожденный теленок сыворотки | Гибко | 16010 | |
| L-глютамин | Гибко | 25030 | |
| AIM-V | Гибко | 0870112 | |
| CellTrace CFSE пролиферации клеток Kit | Invitrogen | C34554 | |
| TREG бисер борьбе с инспектором | Miltenyi Biotec | 130-092-909 | |
| Пенициллин, стрептомицин | Гибко | 15140 | |
| 40 мкМ клеточной линии нейлонэ | BD Сокол | 352340 |
Ссылки
- Powrie, F., Correa-Oliveira, R., Mauze, S., Coffman, R. L. Regulatory interactions between CD45RBhigh and CD45RBlow CD4+ T cells are important for the balance between protective and pathogenic cell-mediated immunity. The Journal of Experimental Medicine. 179, 589-600 (1994).
- Tarbell, K. V. Dendritic cell-expanded, islet-specific CD4+ CD25+ CD62L+ regulatory T cells restore normoglycemia in diabetic NOD mice. The Journal of Experimental Medicine. 204, 191-201 (2007).
- Morgan, M. E. Effective treatment of collagen-induced arthritis by adoptive transfer of CD25+ regulatory T cells. Arthritis and Rheumatism. 52, 2212-2221 (2005).
- Taylor, P. A., Lees, C. J., Blazar, B. R. The infusion of ex vivo activated and expanded CD4(+)CD25(+) immune regulatory cells inhibits graft-versus-host disease lethality. Blood. 99, 3493-3493 (2002).
- Ziegler, S. F. FOXP3: of mice and men. Annual Review of Immunology. 24, 209-226 (2006).
- Riley, J. L., June, C. H., Blazar, B. R. Human T regulatory cell therapy: take a billion or so and call me in the morning. Immunity. 30, 656-6565 (2009).
- Morgan, M. E. Expression of FOXP3 mRNA is not confined to CD4+CD25+ T regulatory cells in humans. Human Immunology. 66, 13-20 (2005).
- Wang, J., Huizinga, T. W. J., Toew, R. E. M. De Novo Generation and Enhanced Suppression of Human CD4+CD25+ Regulatory T Cells by Retinoic Acid. Journal of Immunology. 183, 4119-4126 (2009).
- Hori, S., Nomura, T., Sakaguchi, S. Control of regulatory T cell development by the transcription factor Foxp3. Science (New York, N.Y.). 299, 1057-1061 (2003).
- McHugh, R. S. CD4(+)CD25(+) immunoregulatory T cells: gene expression analysis reveals a functional role for the glucocorticoid-induced TNF receptor. Immunity. 16, 311-323 (2002).
- Takahashi, T. Immunologic Self-Tolerance Maintained by Cd25+Cd4+Regulatory T Cells Constitutively Expressing Cytotoxic T Lymphocyte-Associated Antigen 4. The Journal of Experimental Medicine. 192, 303-310 (2000).
- Liu, W. CD127 expression inversely correlates with FoxP3 and suppressive function of human CD4+ T reg cells. The Journal of Experimental Medicine. 203, 1701-1711 (2006).
- Schraven, B., Kalinke, U. CD28 superagonists: what makes the difference in humans. Immunity. 28, 591-595 (2008).
- Reneer, M. C. Peripherally induced human Regulatory T cells uncouple Kv1.3 activation from TCR-associated signaling. European Journal of Immunology. , (2011).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены