Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La colonización de Euprymna scolopes Squid por Vibrio fischeri
En este artículo
Resumen
El método describe el procedimiento mediante el cual el hawaiano calamar bobtail, Euprymna scolopes Y su simbionte bacteriano, Vibrio fischeri, Se elevan por separado y después se introdujo para permitir la colonización específica del órgano de luz calamar por las bacterias. Detección colonización por bacterias luminiscencia-derivado y por recuento directo de las colonias se describen.
Resumen
Bacterias específicas se encuentran en asociación con el tejido animal 1-5. Estas bacterias de acogida las asociaciones (simbiosis) pueden ser perjudiciales (patógeno), no tienen ninguna consecuencia de fitness (comensales), o ser beneficiosa (mutualismo). Si bien se ha prestado mucha atención a las interacciones patógenas, poco se sabe acerca de los procesos que determinan la adquisición reproducible de beneficio / comensal bacterias del medio ambiente. El mutualismo de luz de órganos entre la marina bacteria Gram negativa V. fischeri y el calamar hawaiano bobtail, E. scolopes, representa una interacción muy específico en el que un único equipo (E. scolopes) establece una relación simbiótica con una sola especie bacteriana (V. fischeri) a lo largo de su ciclo de vida 6,7. La bioluminiscencia producida por V. fischeri durante esta interacción proporciona un beneficio anti-depredadores a E. scolopes durante las actividades nocturnas, mientras que 8,9el tejido del huésped, rica en nutrientes proporciona V. fischeri con un nicho protegido 10. En cada generación de acogida, esta relación se resume, por lo que representa un proceso predecible que puede ser evaluado en detalle en las distintas etapas de desarrollo simbiótico. En el laboratorio, el menor calamar escotilla aposymbiotically (uncolonized), y, si se recogen dentro de los primeros 30-60 minutos y se transfiere a simbionte agua libre, no puede ser colonizado excepto por el inóculo experimental 6. Esta interacción proporciona así un sistema modelo útil en la cual evaluar los pasos individuales que conducen a la adquisición específica de un microbio simbiótica desde el entorno de 11,12.
Aquí se describe un método para evaluar el grado de colonización que se produce cuando recién nacidas aposymbiotic E. scolopes están expuestos a (artificial) de agua de mar que contienen V. fischeri. Este ensayo simple describe la inoculación, la infección natural, y la recuperaciónde bacterias simbiontes del órgano de luz naciente de la E. scolopes. Hay que tener cuidado para proporcionar un entorno uniforme para los animales durante el desarrollo simbiótico, especialmente con respecto a la calidad del agua y las señales de luz. Métodos para caracterizar la población simbiótica descritos incluyen (1) la medición de bioluminiscencia por bacterias derivados, y (2) directo de las colonias el recuento de los simbiontes recuperados.
Protocolo
1. Preparación de inóculos bacterianos
- Día 0
Dos días antes de la inoculación de calamar, la placa de las cepas bacterianas pertinentes sobre LBS 13 de agar. - Incubar las bacterias a 25-28 ° C durante la noche.
- Día 1
Inocular 3 ml de medio de LBS en un tubo de cultivo de vidrio con una colonia de cada uno de V. fischeri cepa de infección. Preparar los tubos duplicados como copia de seguridad. - Día 2
(Coordinar medidas bacterianas 1.4-1.6 con los pasos de calamar 3.7-3.10)
1 h antes de la inoculación, las bacterias subcultivo 1:80 (37,5 l) en 3 ml FTCM en un tubo de cultivo de vidrio y crecer durante 1 hora con aireación. - Medir el diámetro exterior 600 de la muestra antes de la inoculación. Las mediciones típicas son 0.3-0.6 dependiendo de la cepa.
- Para un inóculo de destino de 3-5 x 10 3 UFC / ml de calcular el volumen del inóculo de la siguiente manera: El volumen de inóculo (l) = 1,25 / OD 600 (por ejemplo, para OD 600 = 0,5, el volumen del inóculo calculado = 1.25/0.5 = 2,5 l). Esta cantidad se añade directamente al agua de mar que contienen calamar en el Paso 4,1. Este cálculo puede ser necesario ajustar para diferentes cepas de V. fischeri o para la inoculación en los niveles inferiores o superiores a los especificados aquí.
2. Preparación de placas de agar para el recuento de los inóculos
- Para cada tratamiento, LBS etiqueta placas (2 por tratamiento) a las muestras de la placa del inóculo en el Paso 4,1.
- Agregar 5 gotas de enchapado estériles por placa.
3. Colección de los menores de calamar
- Medir la salinidad del Océano instantánea utilizando el refractómetro y ajustar a 35 ‰.
- Filtro 1 L de Instant Ocean utilizando la unidad de filtración y una línea de vacío adjunto o bomba de vacío, para generar esterilizada por filtración, Instant Ocean (FSIO). Oxigenar el agua por agitación vigorosamente antes de cada dispensación. The la unidad de filtro se puede reutilizar durante 2 días.
- Alícuota 40-50 ml de FSIO en cada uno de dos (2) cuencos de muestra desechables. Etiqueta de uno como Earlies y uno como timelies.
- Preparar un exceso de pipetas de plástico para la adquisición de los calamares juveniles mediante la reducción de la pipeta aproximadamente 1 cm de la punta, por encima de las crestas más bajas (ver Figura 3). Esto facilita un área más amplia a través del cual el calamar puede pasar en el ordeño. Desechar cualquier pipetas de transferencia en los que existe una superficie rugosa expuesta.
- Utilizando pipetas de transferencia preparados, recoger E. scolopes que eclosionaron durante la noche y transferir de un tazón de earlies FSIO. Crías iniciales han sido en el sistema de huevo durante más de 1 h, y son susceptibles a la colonización por contaminar V. fischeri en el sistema de huevo. No utilice earlies para los experimentos de colonización sensibles.
- Comprobar que los tanques de huevo cada minuto 30-45 para las crías nuevas. Asegúrese de que todas las crías se borran en cada cdiablos. Retire las crías con una pipeta de transferencia, y el depósito en el recipiente de timelies FSIO. Los animales recogidos en el momento oportuno se encuentran disponibles para los experimentos de colonización.
- Cuando la colección se ha terminado (~ 45 minutos después del atardecer), la transferencia del calamar al laboratorio principal. Empíricamente, es ventajoso para colonizar los animales bajo condiciones de laboratorio ininterrumpidas de luz para inoculaciones 3 h.
- Para cada tratamiento, preparar un recipiente con 40 ml FSIO. Añadir los calamares a los tazones de fuente para el ensayo (máximo n = 40 por plato).
- Preparar un recipiente adicional como aposymbiotic control (negativo).
- Preparar una pipeta de transferencia específico para cada tratamiento.
- La eutanasia calamares extra en 2% de etanol.
4. Squid Colonización
- Día 2 - El uso de un Pipetman P10, prescindir de la alícuota calculada de las bacterias (Paso 1.5) en cada tazón calamar (Paso 3.8) para cada tratamiento. Iniciar un temporizador de 3 h inmediatamente después dela primera inoculación.
- Para cada tratamiento, crear un "vórtice" en el recipiente con la pipeta de transferencia dedicado mediante la colocación de la pipeta cerca del borde de la taza y pipeteando arriba y abajo varias veces para mezclar el agua y el calamar durante aproximadamente 10 segundos. La mezcla completa es crítico.
- Placa de 50 l de cada plato en una placa de agar LBS desde el Paso 2.2 (para técnicos repeticiones, dos placas de 50 placas de l por tratamiento). Incubar a 25-28 ° C durante la noche.
- Preparar cuencos de lavado (100 ml FSIO / EA) para cada tratamiento.
- Preparar los viales de Drosophila (4 ml FSIO / EA) para cada calamar.
- Después de exactamente 3 horas, traslado al calamar a sus respectivos lavabos (completo para todo el tratamiento). Esto evita que la inoculación.
- Proceda a la transferencia de cada calamar individuo a su propio vial de Drosophila con FSIO. Utilizar una pipeta de transferencia designada para cada tratamiento.
- Mueva bandejas de frascos de Drosophila a la facilidad de calamar para volver a la día / nDERECHO ciclo de luz de los animales experimentaron durante la embriogénesis.
- Día 3 - Preparar los viales de Drosophila (4 ml FSIO / EA) para cada calamar.
- Antes de atardecer a 22-24 h después de la inoculación, transferir cada calamar de un nuevo vial de Drosophila. Utilizar una pipeta de transferencia designada para cada tratamiento.
- Día 4 - Preparar la etiqueta tubos de microcentrífuga de 1,5 ml (1/squid).
- Antes de atardecer en 46-48 h después de la inoculación, medir y registrar la luminiscencia de cada calamar en el vial de Drosophila (conjunto luminómetro para la integración 6 s, y de auto-lectura sobre el cierre de la tapa).
- Como control negativo para la luminiscencia de fondo, medir un vial con FSIO que no contiene ningún calamar.
- Transferir cada calamar en un volumen de aproximadamente 700 l de un tubo de microcentrífuga de 1,5 ml de la Etapa 4,12. Mover a una caja de cartón del congelador. Una vez que la tapa se coloca en la caja, no lo saque como las señales de luz para la expulsión bacterias no son well-entendido.
- Congelar tubos de microcentrífuga a -80 ° C durante la noche.
5. Determinación de los niveles de colonización
- Para cada calamar, preparar dos (2) tubos de microcentrífuga, cada uno con 475 l FSIO (o autoclave 70% Instant Ocean).
- Preparar morteros, en primer lugar con un Kimwipe para limpiar la mano del mortero y eliminar los desechos brutos y / o tejidos.
- Colocar morteros punta hacia abajo en un vaso de precipitados de 50 ml que contiene 95% de etanol. El etanol se añade a una altura de aproximadamente 3 cm.
- Por cada mano de mortero, retire del vaso y limpiar la punta con un Kimwipe.
- Sumerja la mano del mortero de nuevo en el baño de etanol, extraer e insertar (punta hacia arriba) en un bastidor de tubo de microcentrífuga y deje que se seque completamente durante aproximadamente 15 minutos.
- Descongele los calamares en un estante de tubo de microcentrífuga (máximo = n = 8).
- Si es necesario, ajustar el volumen a 700 l.
- El uso de un mortero desde el Paso 5.5, alterar el tejido de los animales hasta que el saco de la tinta rupturaras (el agua se torne de un color gris oscuro).
- Retire la mano del mortero y asegurar todo el tejido queda en el tubo.
- Vortex brevemente el tejido durante exactamente 10 segundos (usar un cronómetro).
- Permitir el tejido para descansar durante 10 minutos. El tejido se asienta y las bacterias y la tinta permanece en solución. Para los cálculos que siguen, las bacterias o solución de tinta es la [A] de dilución (es decir, la luz de E. scolopes homogeneizado de órganos en 700 l). Diluciones seriadas 1:20 ([B], [C]) se describen a continuación.
- Para el [B] dilución, se añaden 25 l [A] para uno de los tubos de microcentrífuga preparados en el paso 5,1. Vortex.
- Para la [C] dilución, se añaden 25 l [B] para uno de los tubos de microcentrífuga preparados en el paso 5,1. Vortex.
- Placa de 50 l de cada dilución en agar LBS, 2 repeticiones por tratamiento.
- Incubar las placas a 25-28 ° C durante la noche.
6. Análisis de Datos
- Para calcular el UFC / órgano de luz (LO), los paísest colonias en la placa para cada tratamiento en el cual 10-400 colonias están presentes, y utilizar la fórmula adecuada:
UFC / LO = (colonias en [A] Placa) x 14, o
UFC / LO = (colonias en [B] placa) x 280, o
UFC / LO = (colonias en [C] placa) x 5600. - Trazar puntos de datos individuales y medianas en una escala logarítmica.
- Los datos a menudo no se distribuyen normalmente, con diferentes variaciones y los valores extremos puede contener biológicamente significativa de la información. Por lo tanto, no paramétricos pruebas proporcionan un método útil para determinar si los tratamientos difieren significativamente.
- Utilice el software GraphPad Prism para el análisis estadístico. Para ambos tratamientos, el uso del test de Wilcoxon. Para las comparaciones entre más de dos tratamientos, el uso de la prueba de Kruskal-Wallis con el post-tests apropiados.
7. Los resultados representativos
Los resultados de un ensayo de colonización de la muestra se muestran en la Figura 4. Dos cepas de V. fischeri que presentan diferentes niveles relativos de la luminiscencia se inocularon en seis calamares, junto con seis de calamar que sirvió como aposymbiotic (colonizada) controles. La E. scolopes simbionte, ES114 14, y la más brillante Sepiola robusta simbionte, SR5 15,16. Niveles similares de inóculo (Fig. 4A) dar lugar a la colonización del 100% a menos de 3 h. A las 48 h, los niveles de luminiscencia (Fig. 4B) y los recuentos de CFU (Fig. 4C) se determinaron para evaluar la aptitud colonización de la cepa. Determinación de la luminiscencia específica (Fig. 4D; bacteria por) permite la determinación del brillo de cada cepa bacteriana durante la simbiosis.

Figura 1. Diagrama de flujo del procedimiento de colonización. Las bacterias y los calamares se recogen por separado, luego se mezcla en el inóculo se especifica. Calamar se lavan, se transfiere entonces al agua nueva a las 3 h, 24 h, y 4 8 horas después de la inoculación. A las 48 h, la luminiscencia se midió y los animales se congelan, que sirve para esterilizar la superficie de los animales. Luz de órganos colonizados bacterias permanecen viables a -80 ° C a través de un deshielo (no se necesita ciclos hielo-deshielo).
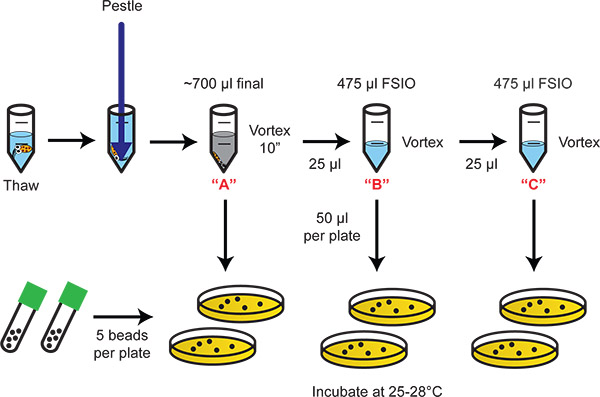
Figura 2. Diagrama de flujo que ilustra la homogeneización y dilución en placas de las bacterias. Serie de 20 diluciones proporcionar la gama dinámica apropiada para la enumeración de las bacterias colonizadas.

Figura 3. Transferencia pipetas con una conicidad eje apropiadamente a un agujero estrecho estrecho (A) que dañarían calamar menores. El tratamiento previo al cortar la sección más estrecha con unas tijeras o una hoja de afeitar se obtiene una herramienta apropiada (B) para la transferencia de los calamares juveniles.
s/ftp_upload/3758/3758fig4.jpg "/>
Figura 4. Datos de ejemplo para un ensayo de colonización. (A) Los niveles de las bacterias en los tazones de fuente de inóculo. (B) La luminiscencia de los calamares individual. (C) recuentos de colonias de calamares individual. (D) luminosidad específica de calamar individual. Apo, Aposymbiotic (colonizada control negativo).
Discusión
El ensayo se describe la colonización permite el análisis de un proceso de simbiosis natural en un entorno controlado de laboratorio. Como tal, se puede utilizar para evaluar la colonización por cepas mutantes, por parte de diferentes aislamientos naturales, y bajo regímenes químicas diferentes. Las variaciones en los experimentos descritos se utilizan comúnmente para evaluar diferentes aspectos de la simbiosis. La cinética de colonización puede ser medida mediante el examen de luminiscencia durante las primeras...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores agradecen el apoyo Mattias Gyllborg instalación calamares y los comentarios sobre este manuscrito, Michael Hadfield y el Laboratorio Marino Kewalo para la asistencia durante la recolección de campo, y los miembros del Laboratorio de Ruby y McFall Ngai-por sus contribuciones a este protocolo. Trabajo en el Laboratorio de Mandel es apoyado por la NSF IOS-0843633.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre de reactivo | Empresa | Número de catálogo | Comentarios |
| Tubos de vidrio Cultura, 16 mm de diámetro | VWR | 47729-580 | |
| Tapas para tubos de cultivo de vidrio | Pescador | NC9807998 | |
| Espectrofotómetro visible para la determinación de OD 600 | Biowave | CO8000 | Cualquier espectrofotómetro capaz de medir DO 600 va a funcionar. Esta unidad puede medir el diámetro exterior 600 de líquido directamente en los tubos de vidrio de cultivo. Algunos de ajuste del cálculo de inóculo puede ser necesario dependiendo del instrumento utilizado. |
| GloMax 20/20 de un solo tubo luminómetro | Promega | E5311 | Equivalente a la Turner Biosystems 20/20n luminómetro. Incluye el soporte del tubo de microcentrífuga. |
| GloMax 20/20 Norma Luz | Promega | E5341 | Para la calibración del luminómetro. |
| Refractómetro de mano | Foster y Smith Aquatics | CD-14035 | Calibrar antes de cada uso con agua desionizada. Enjuagar después de cada uso con agua desionizada para evitar la acumulación de sal. |
| Instant Ocean (concentrado de agua de mar artificial) | Foster & Smith Aquatics | CD-16881 | Preparar a 35 ‰ en agua desionizada, utilizando el refractómetro, a continuación, a través de un filtro de 0,2 micras SFCA filtro. |
| Unidad de filtración | Nalgene | 158-0020 | El surfactante libre de acetato de celulosa (SFCA) de la membrana, de 0,2 m. Hemos observado resultados variables, con algunos filtros que contienen surfactantes de PSA. |
| Pipetas de transferencia | Pescador | 13-711 -9 a.m. | Con una tijera o cuchilla de afeitar, cortar la punta limpiamente por encima de la cresta primero para aumentar el diámetro de la punta de la pipeta y evitar apretar las crías de calamar. |
| Tazones de muestra desechables (vasos de plástico) | Cometa | T9S (9 oz.) | Tazones para la inoculación, con diámetro superior de 3 ¼ ", de diámetro menor de 2 ¼", altura de 3 ". Bowls crear un entorno homogéneo, ya que no tienen borde inferior, en la que el calamar puede quedar atrapado en un nicho de bajo oxígeno. El tamaño se ha optimizado de 40 ml de inóculo. Disponible en webstaurantstore.com, # 619PI9. |
| Drosophila Viales | VWR | 89092-720 | De diámetro Vial coincide con la apertura en el PMT luminómetro. |
| Tubos de microcentrífuga de 1,5 ml | ISC Bioexpress | C-3217-1CS | Los tubos deben adaptarse a la forma de las manos de mortero. |
| El etanol, Prueba 200 | Pescador | BP2818-100 | |
| Pistilos | Kimble Chase / Kontes | 749521-1500 | |
| Cuentas de enchapado, 5 mm de diámetro | Kimble Chase, | 13500 5 | Preparar 5 por tubo y autoclave. |
Referencias
- Aas, J. A., Paster, B. J., Stokes, L. N., Olsen, I., Dewhirst, F. E. Defining the normal bacterial flora of the oral cavity. J. Clin. Microbiol. 43, 5721-5732 (2005).
- Mandel, M. J., Wollenberg, M. S., Stabb, E. V., Visick, K. L., Ruby, E. G. A single regulatory gene is sufficient to alter bacterial host range. Nature. 458, 215-218 (2009).
- Grice, E. A., Segre, J. A. The skin microbiome. Nat. Rev. Microbiol. 9, 244-253 (2011).
- Malic, S. Detection and identification of specific bacteria in wound biofilms using peptide nucleic acid fluorescent in situ hybridization (PNA FISH). Microbiology. 155, 2603-2611 (2009).
- Turnbaugh, P. J. The human microbiome project. Nature. 449, 804-810 (2007).
- Nyholm, S. V., McFall-Ngai, M. J. The winnowing: establishing the squid-Vibrio symbiosis. Nat. Rev. Microbiol. 2, 632-642 (2004).
- Ruby, E. G. Lessons from a cooperative, bacterial-animal association: the Vibrio fischeri-Euprymna scolopes light organ symbiosis. Annu. Rev. Microbiol. 50, 591-624 (1996).
- McFall-Ngai, M. J., Ruby, E. G. Symbiont recognition and subsequent morphogenesis as early events in an animal-bacterial mutualism. Science. 254, 1491-1494 (1991).
- Jones, B., Nishiguchi, M. Counterillumination in the Hawaiian bobtail squid, Euprymna scolopes Berry (Mollusca: Cephalopoda). Marine Biology. 144, 1151-1155 (2004).
- Graf, J., Ruby, E. G. Host-derived amino acids support the proliferation of symbiotic bacteria. Proc. Natl. Acad. Sci. U.S.A. 95, 1818-1822 (1998).
- Ruby, E. G., McFall-Ngai, M. J. A squid that glows in the night: development of an animal-bacterial mutualism. J. Bacteriol. 174, 4865-4870 (1992).
- Lee, P. N., McFall-Ngai, M. J., Callaerts, P., de Couet, H. G. The Hawaiian bobtail squid (Euprymna scolopes): a model to study the molecular basis of eukaryote-prokaryote mutualism and the development and evolution of morphological novelties in cephalopods. Cold Spring Harbor Protocols. , (2009).
- Stabb, E., Visick, K., Millikan, D., Corcoran, A. The Vibrio fischeri-Euprymna scolopes symbiosis: a model marine animal-bacteria interaction. Recent Advances in Marine Science and Technology. , (2001).
- Boettcher, K. J., Ruby, E. G. Depressed light emission by symbiotic Vibrio fischeri of the sepiolid squid Euprymna scolopes. J. Bacteriol. 172, 3701-3706 (1990).
- Fidopiastis, P. M., von Boletzky, S., Ruby, E. G. A new niche for Vibrio logei, the predominant light organ symbiont of squids in the genus Sepiola. J. Bacteriol. 180, 59-64 (1998).
- Bose, J. L. Contribution of rapid evolution of the luxR-luxI intergenic region to the diverse bioluminescence outputs of Vibrio fischeri strains isolated from different environments. Appl. Environ. Microbiol. 77, 2445-2457 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados