このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
の植民地化 Euprymna scolopesイカでビブリオフィシャリ
要約
メソッドは、ハワイアンボブテイルイカ手順を概説 Euprymna scolopesとその共生細菌、ビブリオフィシャリ別々に調達し、細菌によってイカの光器官の特定の植民地化を可能にするために導入されています。細菌由来の発光によって、ダイレクトコロニーカウントによって植民地化の検出は、記載されています。
要約
特定の細菌は、動物の組織1-5アソシエーションに記載されています。このようなホストベースの細菌アソシエーション(共生)、(病原性)有害であるなしフィットネスセンター結果(共生)を持っていない、または(相利共生)有益であることができます。注目は、病原体の相互作用に与えてきたが、少しは環境からの有益な/共生細菌の再現性の買収を決定するプロセスについて知られています。海洋グラム陰性菌の間に光臓器共生V.シャリとハワイボブテイルイカ、E. scolopesは 、1つのホスト(E. scolopes)は、その生涯6,7の過程を通じて一細菌種(V.シャリ )との共生関係を確立するには高度に特異的な相互作用を表しています。 V.によって生成された生物発光この相互作用中にシャリは大腸菌に抗捕食性の利点を提供しています夜行性の活動中scolopesながら8,9、栄養豊富な宿主組織を提供しますV.保護されたニッチ10とシャリ 。各ホストの生成時に、この関係は、このように共生発展のさまざまな段階で詳細に評価することができる予測可能なプロセスを表す、recapitulatedされています。研究室では、少年イカハッチaposymbiotically(uncolonized)、および、最初の30-60分以内に収集され、シンビオント-free水に転送する場合には、実験的な接種6による場合を除いて植民地化することはできません。この相互作用は、このように環境11,12から共生微生物の具体的な買収につながる個々のステップを評価するためにする有用なモデルシステムを提供します。
ここでは、新たにaposymbiotic E.孵化したときに発生し植民地化の程度を評価する方法について説明します。 scolopesは含まれている(人工)海水にさらされているV.シャリ。このシンプルなアッセイは、予防接種、自然感染、およびリカバリについて説明します。E.の初期の光の臓器から共生細菌のscolopes。ケアは特に水質と光の合図に関しては、共生の開発中に動物のための一貫性のある環境を提供するために取られます。説明した共生の人口を特徴付けるための方法は、細菌由来の生物発光の(1)測定、回収共生のカウント(2)ダイレクトコロニーが含まれています。
プロトコル
1。細菌接種の準備
- 0日
イカ接種、プレートLBS 13寒天の関連菌株の2日前まで。 - 25から28℃で一晩、細菌をインキュベートします。
- 1日目
それぞれの1つのコロニーのガラス培養チューブに3mlのLBS培地に接種V.感染のシャリ株 。バックアップとしてチューブを複製する準備をします。 - 2日目
(イカの手順3.7から3.10を有する細菌のステップ1.4から1.6に調整)
接種前に1時間、継代培養菌ガラス培養チューブに3mlのLBSに1:80(37.5μL)および曝気1時間成長します。 - 接種前にサンプルのOD 600を測定します 。典型的な測定値が0.3から0.6株に依存している。
- 3〜5×10 3 CFU / mlのターゲット接種のために次のように接種量を計算します。接種量(μL)= 1.25 / OD 600(例えば、OD 600 = 0.5、計算された接種量= 1.25/0.5 = 2.5μl)を、この量は、ステップ4.1にイカを含む海水に直接追加されます。この計算ではVの異なる系統を調整する必要があるかもしれませんシャリまたはここで指定されたものより低い、または高いレベルでの接種のために。
2。接種の列挙のために寒天プレートの準備
- それぞれの治療のために、ステップ4.1の接種のプレートのサンプルへのラベルLBSプレート(処理ごとに2つ)。
- プレートあたり5滅菌メッキビーズを追加します。
3。 Squidの少年のコレクション
- 屈折計を使用してInstant海の塩分濃度を測定し、35‰に調整します。
- フィルター滅菌インスタントオーシャン(FSIO)を生成し、濾過ユニットと接続された真空ラインや真空ポンプを使用してインスタントオーシャンのフィルタ1 L。各調剤に積極的に前に渦巻くによる水酸素を送り込む。番目のメールフィルターユニットは、2日間再利用することができます。
- 2(2)使い捨てサンプルボウルのそれぞれにアリコートFSIOの40〜50 mlを。ラベルが短縮さなどの1つとtimeliesとして1。
- 最低の尾根(図3を参照)の上に、先端から約1cmピペットを切断することによって少年イカを取得するためのプラスチック製トランスファーピペットの過剰準備をします。これは、イカは、コレクションに渡すことができるを通じて、より広いエリアを容易にします。大まかな露出面がである任意の転送ピペットを破棄します。
- 準備された転送ピペットを用いて、E.を収集一晩孵化FSIOの時間が短縮さのボウルに転送するscolopes。初期の孵化は1以上の時間卵システムになってと汚染によって植民地化の影響を受けやすいたV.卵·システム内のシャリ 。敏感な植民地化実験のための時間が短縮さを使用しないでください。
- 卵のタンクに新しい幼体ごとに30-45分を確認してください。すべての孵化は各cの間にクリアされていることを確認してください一体。 FSIOのtimeliesボウルに転送ピペットで孵化し、預金を削除します。タイムリーに収集された動物は、植民地化実験のために用意されています。
- コレクションが終了したときに(〜45分夕暮れ後)は、主室にイカを転送します。経験的にそれが3時間の接種のために中断されない実験室の光条件の下で動物を植民地化するのが有利である。
- それぞれの治療のために、40ミリリットルFSIOとボウルを用意します。アッセイのためのボウル(ボウルあたりの最大はn = 40)にイカを追加します。
- aposymbiotic(負)のコントロールとして追加のボウルを用意してください。
- それぞれの治療のために専用のピペットを準備します。
- 2%のエタノールで余分なイカを安楽死させる。
4。イカの植民地
- 2日目- P10ピペットマンを使用して、各治療のためにそれぞれのイカ丼(ステップ3.8)への細菌の計算されたアリコート(ステップ1.5)を分注する。直後に3時間のタイマーを起動します。第一接種。
- それぞれの治療のために、ボウルの縁の近くにピペットを置き、約10秒間水とイカを混ぜて繰り返しを上下にピペッティングすることにより、専用のピペットでボウルの "渦"を作成します。十分に混合することが重要です。
- ステップ2.2からLBS寒天プレート上に各鉢からプレートを50μl(技術のために、治療ごとにプレート2を50μlプレートを複製します)。 25から28℃で一晩インキュベートします。
- それぞれの治療のために洗浄ボウル(100ミリリットルFSIO / EA)を準備します。
- 各イカのためにショウジョウバエバイアル(4ミリリットルFSIO / EA)を準備します。
- ちょうど3時間後、それぞれのウォッシュボウル(すべての治療のための完全な)にイカを転送します。これは、接種を停止します。
- FSIOを持つ独自のショウジョウバエのバイアルに、個々のイカを転送するために進んでください。それぞれの治療のために指定されたピペットを使用しています。
- 日/ nに戻るにはイカ施設にショウジョウバエのバイアルトレイを移動するIGHTライトサイクルの動物は胚発生の間に経験した。
- 3日目-それぞれのイカのために準備ショウジョウバエバイアル(4ミリリットルFSIO / EA)。
- 22から24時間後接種で夕暮れ前に、新しいショウジョウバエのバイアルにそれぞれのイカを転送します。それぞれの治療のために指定されたピペットを使用しています。
- 4日目 -標識された1.5 mlのマイクロ遠心チューブ(1/squid)を準備します。
- 前の46から48時間後接種は、メジャーでの夕暮れに、 ショウジョウバエのバイアル(6の統合と蓋の閉鎖で自動読み込みのためにルミノメーターセット)のそれぞれのイカの発光を記録します。
- バックグラウンド発光のための陰性コントロールとして、任意のイカが含まれていませんFSIOバイアルを測定します。
- ステップ4.12から1.5 mlのマイクロ遠心チューブに約700μlのボリューム内の各イカを転送します。段ボールフリーザーボックスに移動します。蓋は、ボックス上に配置されると、WELはありませんバクテリアの追放のための光手がかりとして、それを削除しないでくださいL-理解していた。
- -80°Cで一晩遠心管を凍結します。
5。植民地化レベルの決定
- 各イカの場合は、475μlのFSIO(または70%インスタントオーシャンをオートクレーブ)で2(2)マイクロチューブ、それぞれを準備します。
- 第一杵をきれいにし、大まかな汚物を除去および/または組織を削除するには、キムワイプを使用して乳棒を準備します。
- 場所は、95%エタノールを含む50 mlのビーカーに先端ダウン乳棒。エタノールは約3 cmの高さに追加する必要があります。
- 各乳棒では、ビーカーから削除し、キムワイプで先端を拭きます。
- ディップは、エタノール浴中に戻って乳棒削除し、挿入(最大TIP)マイクロチューブのラックに約15分間完全に風乾することができます。
- マイクロチューブのラック(最大N = 8)でイカを解凍します。
- 必要な場合は、700μlに音量を調整します。
- ステップ5.5から乳棒を用いて、インク嚢RUPまで、動物の組織を混乱させるTuresの(水が濁った灰色に変わります。)
- 杵を削除し、すべての組織がチューブに残っていることを確認してください。
- 正確に10秒(タイマーを使用)のために簡単にボルテックス組織を。
- 組織は10分間休憩することができます。組織が落ち着くし、細菌やインクは溶液中に残っています。続く計算では、細菌/インク·ソリューションは、[A]希釈(すなわち、700μlのE. scolopes光臓器ホモジネート)です。シリアル1:20希釈([B]、[C])以下に記載されています。
- [B]希釈する場合は、ステップ5.1で調製したマイクロ遠心チューブのいずれかに25μlの[A]を追加します。渦。
- [C]希釈する場合は、ステップ5.1で調製したマイクロ遠心チューブのいずれかに25μlの[B]を追加します。渦。
- LBS寒天培地上に各希釈液の50μlをプレート、2は、治療ごとに複製されます。
- 25から28℃で一晩培養する。
6。データ解析
- CFU /発光器(LO)、国を計算するには10から400コロニーが存在し、適切な式を使用しているそれぞれの治療のためにプレート上のTコロニー:
CFU / LO =([A]プレート上のコロニー)×14、または
CFU / LO =([B]プレート上のコロニー)×280、または
CFU / LO =([C]プレート上のコロニー)×5600。 - 対数スケール上の個々のデータ点と中央値をプロットします。
- データは、多くの場合、通常、分散が異なると、配布されていないと、外れ値が意味のある生物学的情報を含めることができます。したがって、非パラメトリックテストでは、治療が著しく異なるかどうかを判断するのに便利な方法を提供します。
- 統計分析のためのグラフパッドプリズムソフトウェアを使用します。二つの治療については、ウィルコクソンの順位和検定を使用しています。以上の二つの試験治療間の比較については、適切な事後テストとクラスカル·ワリス検定を使用しています。
7。代表的な結果
サンプルのコロニー形成アッセイの結果を図4に示されています。の2系統 V.発光の異なる相対レベルを示すシャリはaposymbiotic(uncolonized)コントロールを務めた6イカと一緒に、6イカに接種し、それぞれであった。 E. scolopesシンビオントは、ES114 14、明るくSepiolaロブスタシンビオントは、SR5 15,16。同様の接種レベル(図4A)3時間以内に100%の植民地化につながる。 48時間、発光レベル(図4B)とCFUカウントが(図4C)株のコロニー形成能力を評価するために決定した。特定の発光(図4D、当たり細菌)の決定は、共生時に各菌株の明るさの測定が可能になります。

植民地化手順の図1のフローチャート。細菌とイカが指定さ接種で混合し、別々に収穫されます。 Squidは、その後3時間、24時間、および4で新しい水に移し、洗浄され、 8時間後の接種。 48時間で表面殺菌し、動物に機能する、発光を測定し、動物が凍結されています。光オルガンは、細菌が-80℃で生存し続ける植民地°Cを1つ融解(追加の凍結融解サイクル)を通して。
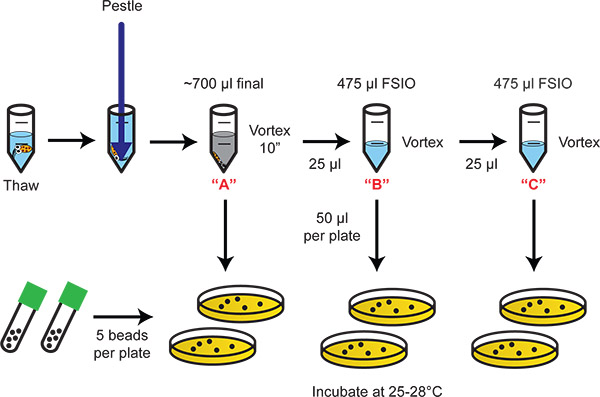
均質化と細菌の希釈メッキを示す図2のフローチャート。シリアル20倍希釈では、植民地化細菌の列挙のための適切なダイナミックレンジを提供しています。

図3。少年イカを損なうことになるナローボア()に適切に狭いシャフトのテーパーでピペットを転送します。ハサミやカミソリの刃の狭いセクションをカットすることにより前処理(B)は、少年イカを転送するための適切なツールが得られます。
s/ftp_upload/3758/3758fig4.jpg "/>
図4コロニー形成アッセイのためのサンプルデータ。接種ボウルの中の細菌の(A)レベル。個々のイカの(B)発光。 (C)個々のイカのコロニーカウントされます。個々のイカの(D)特定の発光。 APO、Aposymbiotic(ネガティブコントロールをuncolonized)。
ディスカッション
説明され植民地化アッセイは、制御された実験室環境での自然共生プロセスの分析が可能になります。このように、それは異なった自然の菌株によって、さまざまな化学物質制度の下で、変異株によるコロニー形成を評価するために使用することができます。記載の実験のバリエーションは、一般的に共生の異なる側面を評価するために使用されています。植民地化の動力学は、一致検出器?...
開示事項
著者らは、開示することは何もありません。
謝辞
著者らは、イカ施設をサポートするために、この原稿についてのコメント、マイケル·ハドフィールドとフィールドのコレクションの間に援助のケワロ海洋研究所およびこのプロトコルへの貢献のために、Rubyとマクフォール·ガイ研究所のメンバーのGyllborgマティアスに感謝します。マンデル研究所での作業は、NSF IOS-0843633によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| ガラス培養管、16ミリメートルの直径 | VWR | 47729-580 | |
| ガラスの培養管用キャップ | フィッシャー | NC9807998 | |
| OD 600を決定するための可視分光光度計 | Biowave | CO8000 | OD 600を測定することができる任意の分光光度計は動作します。このユニットは、ガラス培養チューブに液体を直接のOD 600を測定することができます。接種計算のいくつかの調整は、使用する機器に応じて必要となる場合があります。 |
| GloMax 20分の20シングルチューブルミノメーター | プロメガ | E5311 | ターナーアプライドバイオシステムズ20/20nルミノメーターと同等の。マイクロ遠心チューブホルダーが含まれています。 |
| GloMax 20分の20ライト標準 | プロメガ | E5341 | ルミノメーターのキャリブレーションのために。 |
| 屈折計、ハンドヘルド | フォスターとスミス水泳 | CD-14035 | 脱イオン水でそれぞれ使用前に校正します。塩ビルドアップを防止するために、脱イオン水で使用後は洗い流してください。 |
| インスタントオーシャン(人工海水の濃縮物) | フォスター&スミス水泳 | CD-16881 | 0.2μmのSFCAフィルターを介してフィルタし、屈折計を使用して、脱イオン水に35‰を準備します。 |
| ろ過ユニット | ナルゲン | 158-0020 | 界面活性剤フリー酢酸セルロース(SFCA)膜、0.2μmである。我々はいくつかの界面活性剤を含むPESフィルターで変数の結果を観察した。 |
| 転送ピペット | フィッシャー | 13から711 -9AM | ハサミやカミソリの刃を使用して、ピペットの先端の直径を増加させ、イカの孵化を圧迫を避けるために第一のリッジの上にきれいに先端を切った。 |
| 使い捨てサンプルボウル(プラスチックタンブラー) | 彗星 | T9S(9オンス) | 彼らはイカが低酸素ニッチの中に閉じ込められてしまうことができる全く底リムを持っていないので、上部の直径が3¼ "、下の直径2¼"、高さ3 "の接種のためのボウルは、ボウルは、同種の環境を作成します。サイズが最適化されています40 mlの接種。webstaurantstore.comで入手可能、#619PI9。 |
| ショウジョウバエバイアル | VWR | 89092-720 | バイアルの直径は、ルミノメーターのPMTの開口部に一致します。 |
| 1.5 mlのマイクロ遠心チューブ | ISC Bioexpress | C-3217-1CS | チューブは、杵の形状に合わせなければなりません。 |
| エタノール、200プルーフ | フィッシャー | BP2818から100 | |
| 乳棒 | キンブルチェイス/ Kontes | 749521-1500 | |
| メッキビーズ、直径5 mm | キンブルチェイス | 13500 5 | チューブ、オートクレーブあたり5を準備します。 |
参考文献
- Aas, J. A., Paster, B. J., Stokes, L. N., Olsen, I., Dewhirst, F. E. Defining the normal bacterial flora of the oral cavity. J. Clin. Microbiol. 43, 5721-5732 (2005).
- Mandel, M. J., Wollenberg, M. S., Stabb, E. V., Visick, K. L., Ruby, E. G. A single regulatory gene is sufficient to alter bacterial host range. Nature. 458, 215-218 (2009).
- Grice, E. A., Segre, J. A. The skin microbiome. Nat. Rev. Microbiol. 9, 244-253 (2011).
- Malic, S. Detection and identification of specific bacteria in wound biofilms using peptide nucleic acid fluorescent in situ hybridization (PNA FISH). Microbiology. 155, 2603-2611 (2009).
- Turnbaugh, P. J. The human microbiome project. Nature. 449, 804-810 (2007).
- Nyholm, S. V., McFall-Ngai, M. J. The winnowing: establishing the squid-Vibrio symbiosis. Nat. Rev. Microbiol. 2, 632-642 (2004).
- Ruby, E. G. Lessons from a cooperative, bacterial-animal association: the Vibrio fischeri-Euprymna scolopes light organ symbiosis. Annu. Rev. Microbiol. 50, 591-624 (1996).
- McFall-Ngai, M. J., Ruby, E. G. Symbiont recognition and subsequent morphogenesis as early events in an animal-bacterial mutualism. Science. 254, 1491-1494 (1991).
- Jones, B., Nishiguchi, M. Counterillumination in the Hawaiian bobtail squid, Euprymna scolopes Berry (Mollusca: Cephalopoda). Marine Biology. 144, 1151-1155 (2004).
- Graf, J., Ruby, E. G. Host-derived amino acids support the proliferation of symbiotic bacteria. Proc. Natl. Acad. Sci. U.S.A. 95, 1818-1822 (1998).
- Ruby, E. G., McFall-Ngai, M. J. A squid that glows in the night: development of an animal-bacterial mutualism. J. Bacteriol. 174, 4865-4870 (1992).
- Lee, P. N., McFall-Ngai, M. J., Callaerts, P., de Couet, H. G. The Hawaiian bobtail squid (Euprymna scolopes): a model to study the molecular basis of eukaryote-prokaryote mutualism and the development and evolution of morphological novelties in cephalopods. Cold Spring Harbor Protocols. , (2009).
- Stabb, E., Visick, K., Millikan, D., Corcoran, A. The Vibrio fischeri-Euprymna scolopes symbiosis: a model marine animal-bacteria interaction. Recent Advances in Marine Science and Technology. , (2001).
- Boettcher, K. J., Ruby, E. G. Depressed light emission by symbiotic Vibrio fischeri of the sepiolid squid Euprymna scolopes. J. Bacteriol. 172, 3701-3706 (1990).
- Fidopiastis, P. M., von Boletzky, S., Ruby, E. G. A new niche for Vibrio logei, the predominant light organ symbiont of squids in the genus Sepiola. J. Bacteriol. 180, 59-64 (1998).
- Bose, J. L. Contribution of rapid evolution of the luxR-luxI intergenic region to the diverse bioluminescence outputs of Vibrio fischeri strains isolated from different environments. Appl. Environ. Microbiol. 77, 2445-2457 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved