É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Colonização de Euprymna scolopes Squid por Vibrio fischeri
Neste Artigo
Resumo
O método descreve o procedimento pelo qual o squid bobtail havaiana, Euprymna scolopes E seu simbionte bacteriano, Vibrio fischeri, São levantadas separadamente e, em seguida, introduzido para permitir a colonização específica do órgão luz lula pelas bactérias. Detecção de colonização por bactérias luminescência e derivados por meio de contagem direta colônia são descritas.
Resumo
Bactérias específicas são encontrados em associação com tecidos animais 1-5. Tais host-bacterianas associações (simbiose) pode ser prejudicial (patogênicos), não tem conseqüência fitness (comensal), ou ser benéfica (mutualismo). Enquanto muita atenção tem sido dada às interações patogênicas, pouco se sabe sobre os processos que determinam a aquisição reprodutível de benéficos / comensal bactérias do ambiente. O mutualismo luz de órgãos entre a bactéria Gram-negativa marinha V. fischeri eo havaiano bobtail lula, E. scolopes, representa uma interação altamente específica em que um host (E. scolopes) estabelece uma relação simbiótica com apenas uma espécie bacteriana (V. fischeri) durante todo o curso da sua vida 6,7. A bioluminescência produzido por V. fischeri durante essa interação fornece um benefício anti-predatória de E. scolopes durante atividades noturnas 8,9, enquantoo tecido hospedeiro rico em nutrientes fornece V. fischeri com um nicho protegido 10. Durante cada geração de acolhimento, esta relação é recapitulada, representando assim um processo previsível que pode ser avaliado em detalhe em vários estágios de desenvolvimento simbiótico. No laboratório, a juvenil lula escotilha aposymbiotically (não colonizada), e, se recolhida dentro dos primeiros 30-60 minutos e transferida para simbionte livre de água, não podem ser colonizados excepto por o inoculo experimental 6. Esta interacção proporciona assim um sistema modelo útil no qual se pode avaliar os passos individuais que levam à aquisição específica de um micróbio simbiótica a partir do ambiente 11,12.
Aqui nós descrevemos um método para avaliar o grau de colonização que ocorre quando recém-eclodidos E. aposymbiotic scolopes são expostos a (artificial) a água do mar que contêm V. fischeri. Este ensaio simples descreve a inoculação, a infecção natural, e recuperaçãodo simbionte bacteriano do órgão luz nascente da E. scolopes Care. é levado para proporcionar um ambiente consistente para os animais durante o desenvolvimento simbiótico, especialmente no que diz respeito à qualidade da água e sinais de luz. Métodos para caracterizar a população simbiótico descrito incluem (1) medição da bioluminescência bactérias derivados, e (2) colônia contagem direta de simbiontes recuperados.
Protocolo
1. Preparação de inóculos
- Dia 0
Dois dias antes da inoculação lula, o prato de cepas bacterianas relevantes sobre LBS 13 ágar. - Incubar as bactérias em 25-28 ° C durante a noite.
- Dia 1
Inocular 3 ml de meio LBS em um tubo de vidro com uma cultura de cada colônia V. fischeri linhagem de infecção. Prepare duplicar tubos como backup. - Dia 2
(Coordenar passos bacterianas 1,4-1,6 com passos de lula 3.7-3.10)
1 h antes da inoculação, as bactérias subcultura 1:80 (37,5 ul) em 3 lbs ml num tubo de cultura de vidro e crescer durante 1 h, com arejamento. - Medir a OD 600 da amostra antes da inoculação. Medições típicas são 0,3-0,6, dependendo da estirpe.
- Para um inoculo alvo de 3-5 x 10 3 UFC / ml calcular o volume de inoculo como se segue: Inoculo volume (ul) = 1,25 / OD 600 (por exemplo, para OD 600 = 0,5, o volume de inóculo calculado = 1.25/0.5 = 2,5 ul). Este montante é adicionado diretamente à água do mar contendo lula no Passo 4.1. Este cálculo pode necessitar de ser ajustada para diferentes estirpes de V. fischeri ou para inoculação em níveis mais baixos ou mais elevado do que aqueles aqui especificado.
2. Preparação de placas de ágar para contagem dos inóculos
- Para cada tratamento, as placas de etiquetas lbs (2 por tratamento) para amostras de placa do inoculo no Passo 4,1.
- Adicionar 5 gotas de revestimento estéreis por placa.
3. Colecção de Jovens Squid
- Medir a salinidade do oceano instantânea utilizando o refratômetro e ajustar a 35 ‰.
- Filtrar 1 L de Instant Ocean usando a unidade de filtração e uma linha de vácuo anexado ou bomba de vácuo, para gerar esterilizada por filtração instantânea Marinho (FSIO). Água oxigenar o agitando vigorosamente antes de cada distribuição. The unidade de filtro pode ser reutilizado durante 2 dias.
- Alíquota 40-50 ml de FSIO em cada um de dois (2) taças de amostra descartáveis. Um rótulo como earlies e um como timelies.
- Preparar um excesso de pipetas de transferência de plástico para a aquisição de lula juvenil, cortando a pipeta cerca de 1 cm a partir da ponta, acima as mais baixas cristas (ver Figura 3). Isso facilita uma zona mais ampla através do qual o lula pode passar após a coleta. Descartar quaisquer pipetas de transferência em que há uma superfície áspera exposta.
- Usando pipetas de transferência preparados, recolher E. scolopes que nasceram durante a noite e transfira para a tigela earlies de FSIO. Hatchlings primeiros foram no sistema de ovo por mais de 1 hora e são suscetíveis à colonização por meio da contaminação V. fischeri no sistema de ovo. Não use earlies para experimentos de colonização sensíveis.
- Verifique todos os tanques de ovos min 30-45 para filhotes novos. Assegurar que todos os filhotes são apagadas durante cada cParreira. Remover filhotes com uma pipeta de transferência e depósito no vaso timelies de FSIO. Animais coletados em tempo hábil estão disponíveis para experimentos de colonização.
- Quando a coleta foi concluída (~ 45 min depois do anoitecer), transferir a lula para o laboratório principal. Empiricamente, é vantajoso para colonizar os animais em condições de laboratório ininterruptas de luz para as inoculações 3 h.
- Para cada tratamento, preparar uma tigela com 40 ml FSIO. Adicionar lula para as tigelas para o ensaio (no máximo n = 40 por tigela).
- Prepare uma tigela adicional como um controle (negativo) aposymbiotic.
- Prepara-se uma pipeta de transferência dedicado para cada tratamento.
- Euthanize lula extra em etanol a 2%.
4. Colonização Squid
- Dia 2 - Usando um Pipetman P10, dispensar a alíquota calculada de bactérias (Passo 1,5) em cada taça lula (Passo 3,8) para cada tratamento. Iniciar uma 3 h temporizador imediatamente apósa primeira inoculação.
- Para cada tratamento, criar um "vórtice" na tigela com a pipeta de transferência dedicado, colocando a pipeta perto da borda da taça e pipetagem cima e para baixo repetidamente para misturar a água e lulas por cerca de 10 seg. Uma mistura completa é crítica.
- UL placa 50 de cada recipiente para uma placa de agar a partir do Passo LBS 2,2 (para técnica repetições, placa duas placas 50 ul por tratamento). Incubar a 25-28 ° C durante a noite.
- Preparar taças de lavagem (100 ml FSIO / EA) para cada tratamento.
- Preparar Drosophila frascos (4 ml FSIO / EA) para cada lula.
- Depois de exatamente 3 horas, a lula para transferir suas tigelas de lavagem respectivos (completa para todos os tratamentos). Isso interrompe a inoculação.
- Vá para transferir cada lula indivíduo à sua própria Drosophila frasco com FSIO. Usar uma pipeta de transferência designado para cada tratamento.
- Mover bandejas de Drosophila frascos à facilidade de lula para retornar ao dia / nciclo de luz ight os animais experimentaram durante a embriogênese.
- Dia 3 - Prepare Drosophila frascos (4 ml FSIO / ea) para cada lula.
- Antes de anoitecer em 22-24 h pós-inoculação, transferir cada lula para um frasco de Drosophila novo. Usar uma pipeta de transferência designado para cada tratamento.
- Dia 4 - Prepare rotulado tubos de 1,5 ml de microcentrífuga (1/squid).
- Antes de anoitecer, às 46-48 h pós-inoculação, medir e registrar a luminescência de cada lula no frasco Drosophila (conjunto luminômetro de integração 6 s e auto-ler sobre fechamento da tampa).
- Como um controlo negativo para a luminescência de fundo, medir um frasco com FSIO que não contém qualquer lula.
- Transfira cada lulas em um volume de aproximadamente 700 ul a um tubo de microcentrífuga de 1,5 ml a partir do Passo 4,12. Mover-se para uma caixa de papelão freezer. Uma vez que a tampa é colocada na caixa, não removê-lo como as pistas de luz para a expulsão bactérias não são well-entendido.
- Congelar tubos de microcentrífuga a -80 ° C durante a noite.
5. Determinação dos níveis de colonização
- Para cada lula, preparar dois tubos (2) microcentrífuga, cada um com 475 FSIO ul (ou autoclavados 70% Instant Ocean).
- Preparar pilões usando primeiro uma Kimwipe para limpar o pilão e remover detritos bruto e / ou tecido.
- O local de pilões ponta para baixo em um copo de 50 ml contendo etanol a 95%. Etanol deve ser adicionado a uma altura de cerca de 3 cm.
- Para cada pilão, retire do copo e limpe a ponta com uma Kimwipe.
- Mergulhar o pilão de volta para o banho de etanol, remover e inserir (ponta para cima) em um suporte de tubos de microcentrífuga e deixa-se secar ao ar completamente durante aproximadamente 15 minutos.
- Lulas descongelar em um suporte de tubos de microcentrífuga (no máximo n = 8).
- Se necessário, ajustar o volume para 700 ul.
- Usando um pilão a partir do Passo 5,5, perturbar o tecido animal até que a tinta saco rupestruturas (a água vai virar uma cor cinza escuro).
- Remover o pilão e assegurar todo o tecido permanece no tubo.
- Vortex brevemente o tecido por exatamente 10 segundos (use um timer).
- Permitir que o tecido a descansar durante 10 min. O tecido vai assentar e as bactérias e de tinta permanecer na solução. Para os cálculos que se seguem, as bactérias / solução de tinta é a [A] de diluição (isto é, a E. scolopes homogenato órgão de luz em 700 uL). Diluições 1:20 em série ([B] [C]) são descritos abaixo.
- Para a [B] diluição, adicionar 25 uL [A] a um dos tubos de microcentrífuga preparado no passo 5.1. Vortex.
- Para a [C] diluição, adicionar 25 uL [B] a um dos tubos de microcentrífuga preparado no passo 5.1. Vortex.
- UL placa 50 de cada diluição em agar LBS, 2 repetições por tratamento.
- Incubar as placas a 25-28 ° C durante a noite.
6. Análise de Dados
- Para calcular o UFC / órgão luz (LO), paísescolónias t sobre a placa para cada tratamento em que 10-400 colónias estão presentes, e utilizar a fórmula apropriado:
UFC / LO = (colônias em [A] placa) x 14, ou
UFC / LO = (colônias em [B] placa) x 280, ou
UFC / LO = (colônias em [C] placa) x 5600. - Traçar pontos de dados individuais e medianas em uma escala logarítmica.
- Os dados não são frequentemente normalmente distribuído, com desvios diferentes, e os valores extremos podem conter biologicamente significativa de informação. Portanto, não paramétricos testes fornecem um método útil para determinar se os tratamentos diferem de forma significativa.
- Use o software GraphPad Prism para análise estatística. Por dois tratamentos, use o teste de Wilcoxon Rank Sum. Para comparações entre mais de dois tratamentos, utilize o teste Kruskal-Wallis com pós-testes apropriados.
7. Os resultados representativos
Os resultados de um ensaio de colonização da amostra são mostrados na Figura 4. Duas cepas de V. fischeri que apresentam diferentes níveis relativos de luminescência foram inoculadas em seis lula, juntamente com seis lula que serviu aposymbiotic (colonizada) controles. O E. scolopes simbionte, ES114 14, e mais brilhante Sepiola robusta simbionte, SR5 15,16. Níveis de inóculo similares (Fig. 4A) levar a colonização 100% dentro de 3 h. Às 48 h, os níveis de luminescência (Fig. 4B) e as contagens de CFU (Fig. 4C) foram determinados para avaliar a proficiência colonização da estirpe. Determinação da luminescência específico (Fig. 4D; bactéria per) permite a determinação do brilho de cada estirpe bacteriana durante o simbiose.

Figura Fluxograma 1. Do procedimento de colonização. As bactérias e as lulas são colhidas separadamente e depois misturado ao inóculo especificado. Lulas foram lavadas e, em seguida transferida para a água de novo em 3 h, 24 h, e 4 8 após a inoculação h. Aos 48 h, a luminescência é medida e os animais são congelados, que serve para a superfície a esterilizar os animais. Luz órgão-colonizado bactérias permanecem viáveis a -80 ° C através de um descongelamento (sem adicionais de congelação-descongelação ciclos).
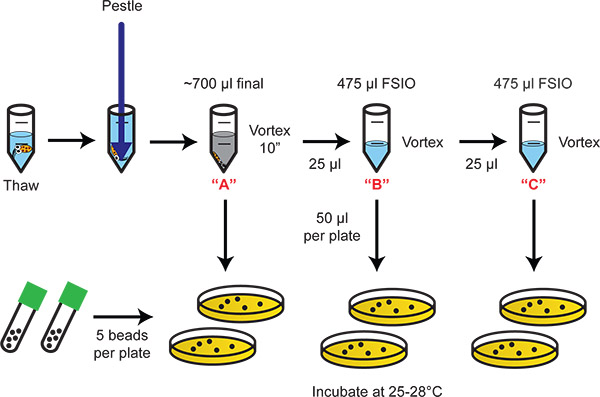
Figura Fluxograma 2. Ilustrando homogeneização e diluição em placas de bactérias. Serial 20-diluições fornecer a gama dinâmica adequado para enumeração de bactérias colonizadas.

Figura 3. Transferir pipetas com uma conicidade eixo adequadamente estreita para um furo estreito (A), que prejudicaria lula juvenil. O pré-tratamento, cortando o mais estreita secção com uma tesoura ou uma lâmina de barbear produz uma ferramenta apropriada (B) para a transferência de lula juvenil.
s/ftp_upload/3758/3758fig4.jpg "/>
Figura 4. Dados de amostra para um ensaio de colonização. (A) Os níveis de bactéria nas bacias de inóculo. (B) luminescência de lula individual. (C) contagem de colônias de lula individual. (D) luminescência específico de lula individual. Apo, Aposymbiotic (não colonizadas controle negativo).
Discussão
O ensaio de colonização descrito permite a análise de um processo natural simbiótica num ambiente controlado de laboratório. Como tal, pode ser usado para avaliar a colonização por estirpes mutantes, por diferentes isolados naturais, e sob regimes químicas diferentes. Variações sobre os experimentos descritos são comumente usados para avaliar diferentes aspectos da simbiose. A cinética da colonização pode ser medido por análise de luminescência durante as primeiras 24 h, o que pode ser detectado au...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores agradecem Mattias Gyllborg para squid apoio instalações e dos comentários deste manuscrito, Michael Hadfield eo Kewalo Laboratório Marinho de assistência durante a coleta de campo, e os membros do Laboratório de Ruby e McFall-Ngai para contribuições para este protocolo. Trabalho no Laboratório de Mandel é suportado pela NSF IOS-0843633.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de Catálogo | Comentários |
| Tubos de Vidro Cultura, 16 mm de diâmetro | VWR | 47729-580 | |
| Tampas para tubos de cultura de vidro | Pescador | NC9807998 | |
| Espectrofotómetro visível para a determinação de OD 600 | Biowave | CO8000 | Qualquer espectrofotómetro capaz de medir OD 600 irá funcionar. Esta unidade pode medir a OD 600 de líquido directamente nos tubos de cultura de vidro. Alguns ajustamento do cálculo inoculo pode ser necessário, dependendo do instrumento utilizado. |
| GloMax 20/20 Luminometer Único-Tube | Promega | E5311 | Equivalente ao BioSystems Turner 20/20n Luminometer. Inclui o suporte do tubo de microcentrífuga. |
| GloMax 20/20 Luz padrão | Promega | E5341 | Para a calibração luminómetro. |
| Refratômetro, Handheld | Foster e Smith Aquatics | CD-14.035 | Calibrar antes de cada uso com água deionizada. Lavar depois de cada uso com água deionizada para evitar acúmulo de sal. |
| Instantânea Oceano (concentrado de água do mar artificial) | Foster & Smith Aquatics | CD-16.881 | Preparar a 35 ‰ em água desionizada, utilizando o refractómetro, seguida de filtração através de um filtro de 0,2 uM SFCA. |
| Unidade de filtração | Nalgene | 158-0020 | Surfactante livre de membrana de acetato de celulose (SFCA), 0,2 m. Temos observado resultados variáveis com alguns filtros surfactante contendo PES. |
| Pipetas de transferência | Pescador | 13-711 -09:00 | Usando uma tesoura ou lâmina de barbear, cortar a ponta de forma limpa acima do rebordo primeiro para aumentar o diâmetro da ponta da pipeta e evitar espremer os filhotes de lula. |
| Descartáveis Bowls exemplo (copos de plástico) | Cometa | T9 (9 oz.) | Taças para a inoculação, com diâmetro superior 3 ¼ ", menor diâmetro 2 ¼", altura 3 ". Bowls criar um ambiente homogêneo, pois não possuem borda inferior, em que lula pode ficar preso em um nicho de baixo oxigênio. O tamanho é otimizado para 40 ml de inóculo. Disponível em webstaurantstore.com, # 619PI9. |
| Drosophila frascos | VWR | 89092-720 | Vial diâmetro corresponde a abertura na PMT luminómetro. |
| Tubos de microcentrífuga de 1,5 ml | ISC Bioexpress | C-3217-1CS | Os tubos devem caber a forma dos pilões. |
| Etanol, 200 Prova | Pescador | BP2818-100 | |
| Pilões | Kimble Chase / Kontes | 749521-1500 | |
| Contas do chapeamento, 5 mm de diâmetro | Kimble perseguição | 13500 5 | Preparar 5 por tubo e em autoclave. |
Referências
- Aas, J. A., Paster, B. J., Stokes, L. N., Olsen, I., Dewhirst, F. E. Defining the normal bacterial flora of the oral cavity. J. Clin. Microbiol. 43, 5721-5732 (2005).
- Mandel, M. J., Wollenberg, M. S., Stabb, E. V., Visick, K. L., Ruby, E. G. A single regulatory gene is sufficient to alter bacterial host range. Nature. 458, 215-218 (2009).
- Grice, E. A., Segre, J. A. The skin microbiome. Nat. Rev. Microbiol. 9, 244-253 (2011).
- Malic, S. Detection and identification of specific bacteria in wound biofilms using peptide nucleic acid fluorescent in situ hybridization (PNA FISH). Microbiology. 155, 2603-2611 (2009).
- Turnbaugh, P. J. The human microbiome project. Nature. 449, 804-810 (2007).
- Nyholm, S. V., McFall-Ngai, M. J. The winnowing: establishing the squid-Vibrio symbiosis. Nat. Rev. Microbiol. 2, 632-642 (2004).
- Ruby, E. G. Lessons from a cooperative, bacterial-animal association: the Vibrio fischeri-Euprymna scolopes light organ symbiosis. Annu. Rev. Microbiol. 50, 591-624 (1996).
- McFall-Ngai, M. J., Ruby, E. G. Symbiont recognition and subsequent morphogenesis as early events in an animal-bacterial mutualism. Science. 254, 1491-1494 (1991).
- Jones, B., Nishiguchi, M. Counterillumination in the Hawaiian bobtail squid, Euprymna scolopes Berry (Mollusca: Cephalopoda). Marine Biology. 144, 1151-1155 (2004).
- Graf, J., Ruby, E. G. Host-derived amino acids support the proliferation of symbiotic bacteria. Proc. Natl. Acad. Sci. U.S.A. 95, 1818-1822 (1998).
- Ruby, E. G., McFall-Ngai, M. J. A squid that glows in the night: development of an animal-bacterial mutualism. J. Bacteriol. 174, 4865-4870 (1992).
- Lee, P. N., McFall-Ngai, M. J., Callaerts, P., de Couet, H. G. The Hawaiian bobtail squid (Euprymna scolopes): a model to study the molecular basis of eukaryote-prokaryote mutualism and the development and evolution of morphological novelties in cephalopods. Cold Spring Harbor Protocols. , (2009).
- Stabb, E., Visick, K., Millikan, D., Corcoran, A. The Vibrio fischeri-Euprymna scolopes symbiosis: a model marine animal-bacteria interaction. Recent Advances in Marine Science and Technology. , (2001).
- Boettcher, K. J., Ruby, E. G. Depressed light emission by symbiotic Vibrio fischeri of the sepiolid squid Euprymna scolopes. J. Bacteriol. 172, 3701-3706 (1990).
- Fidopiastis, P. M., von Boletzky, S., Ruby, E. G. A new niche for Vibrio logei, the predominant light organ symbiont of squids in the genus Sepiola. J. Bacteriol. 180, 59-64 (1998).
- Bose, J. L. Contribution of rapid evolution of the luxR-luxI intergenic region to the diverse bioluminescence outputs of Vibrio fischeri strains isolated from different environments. Appl. Environ. Microbiol. 77, 2445-2457 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados