A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
קולוניזציה של Euprymna scolopes קלמארי על ידי Vibrio fischeri
In This Article
Summary
השיטה מתארת את התהליך שבאמצעותו דיונון הוואי bobtail, Euprymna scolopes ו הסימביונט חיידקי שלה, Vibrio fischeri, גדלים בנפרד ולאחר מכן הציג כדי לאפשר התיישבות מסוים של איבר אור דיונון על ידי החיידקים. איתור קולוניזציה על ידי הארה bacterially הנגזרות ועל ידי ספירת המושבה ישירה מתוארים.
Abstract
חיידקים מסוימים נמצאים בקשר עם רקמה חיה 1-5. אלה מארח חיידקים עמותות (symbioses) יכול להזיק (פתוגניים), ללא השפעה על כושר (commensal), או להיות מועיל (mutualistic). תוך תשומת לב רבה ניתנה אינטראקציות פתוגניים, מעט מאוד ידוע על תהליכי המכתיבים את הרכישה לשחזור של מועילות / commensal חיידקים מהסביבה. הדדיות אור איברים בין חיידק גראם שלילי ימי ו ' fischeri ואת הוואי bobtail דיונון, א scolopes, מייצג אינטראקציה מאוד ספציפיות שבהם אחד מארח (א 'scolopes) היא יוצרת מערכת יחסים סימביוטית עם רק 1 זן חיידקי (פס' fischeri) לאורך כל תקופת חייה 6,7. ביולומינציה המיוצר על ידי ו ' fischeri במהלך האינטראקציה הזו מעניקה יתרון נגד טורפים את א ' scolopes במהלך פעילויות ליליות 8,9, ואילורקמת מזין עשיר המארח מספק V. fischeri עם נישה מוגנים 10. במהלך כל דור המארח, קשר זה הוא סיכם, ובכך מייצג תהליך צפוי כי ניתן להעריך בפירוט בשלבים שונים של פיתוח סימביוטי. במעבדה, דיונון נעורים האץ' aposymbiotically (uncolonized), ואם אסף בתוך 30-60 דקות הראשונות והועברו מים הסימביונט חינם, לא ניתן יישבו אלא הבידוד הניסוי 6. אינטראקציה זו ובכך מספק מערכת מודל שימושי בו כדי להעריך את הצעדים בודדים שהובילו לרכישת מסוים של חיידק סימביוטי מהסביבה 11,12.
כאן אנו מתארים שיטה להעריך את מידת קולוניזציה המתרחשת כאשר שזה עתה בקעו א aposymbiotic scolopes חשופים (מלאכותית) מי ים המכילים V. fischeri. assay זה פשוט מתאר חיסון, דלקת טבעי, והתאוששותהסימביונט של חיידקי מאיבר אור המתהווה של א ' scolopes. טיפול נלקח על מנת לספק סביבה עקבי את בעלי החיים במהלך ההתפתחות סימביוטי, במיוחד בכל הנוגע לאיכות המים רמזים קלים. שיטות לאפיין את האוכלוסייה סימביוטי תיאר כוללים (1) מדידה של ביולומינציה bacterially הנגזרות, ו (2) המושבה ישירה ספירת symbionts התאושש.
Protocol
1. הכנת Inocula בקטריאלי
- יום 0
יומיים לפני חיסון דיונון, הצלחת זני חיידקים הרלוונטיים על 13 ק"ג אגר. - דגירה חיידקים על 25-28 מעלות צלזיוס למשך הלילה.
- יום 1
לחסן 3 ק"ג מ"ל ובינוניים צינור תרבות זכוכית עם מושבת אחד בכל V. fischeri זן לזיהום. הכן לשכפל צינורות כגיבוי. - יום 2
(לתאם צעדים חיידקים 1.4-1.6 בצעדים דיונון 3.7-3.10)
1 שעות לפני חיסון, חיידקים תת 1:80 (37.5 μl) ל -3 ק"ג מ"ל צינור זכוכית תרבות ולגדול עבור H 1 עם אוורור. - למדוד את OD 600 המדגם לפני חיסון. מדידות אופייניים הם 0.3-0.6 בהתאם לזן.
- עבור הבידוד יעד של 3-5 x 10 3 CFU / ml לחשב את נפח הבידוד כדלקמן: נפח הבידוד (μl) = 1.25 / OD 600 (לדוגמה: OD 600 = 0.5, נפח הבידוד מחושב = 1.25/0.5 = 2.5 μl). סכום זה מתווסף ישירות אל מי הים המכילים דיונון בשלב 4.1. חישוב זה עשוי צריך להיות מותאם על זנים שונים של V. fischeri או חיסון ברמות נמוכות או גבוהות יותר מאלה המצוינים כאן.
2. הכנת צלחות אגר על ספירת Inocula
- עבור כל טיפול, LBS תווית צלחות (2 לכל טיפול) קטעים צלחת של הבידוד בשלב 4.1.
- הוסף 5 חרוזים ציפוי סטריליות בכל צלחת.
3. אוסף של קטינים דיונון
- למדוד את המליחות של האוקיינוס מיידית באמצעות refractometer ולהתאים את 35 ‰.
- סנן 1 L האוקיינוס מיידית באמצעות יחידת סינון קו ואקום המצורפת או משאבת ואקום, כדי ליצור פילטר לעקר מיידית האוקיינוס (FSIO). מי חמצן על ידי מתערבל לפני במרץ זה מחלק. היחידת מסנן דואר ניתן לעשות שימוש חוזר למשך 2 ימים.
- Aliquot 40-50 מ"ל של FSIO בכל אחד שתי (2) מדגם קערות חד פעמיות. לייבל 1 כמו earlies ואחד כפי timelies.
- הכן עודף של בטפי להחדרת נוזלים העברת פלסטיק לרכישת דיונון נעורים ידי חיתוך פיפטה כ 1 ס"מ מקצה, מעל הרכסים הנמוכים ביותר (ראה איור 3). זה מקל על שטח רחב יותר שדרכו הדיונון יכול לעבור על האוסף. לבטל את כל בטפי להחדרת נוזלים העברת שבו יש משטח מחוספס חשופים.
- באמצעות העברה בטפי להחדרת נוזלים מוכנים, לאסוף א ' scolopes כי בקעו במשך הלילה מעבירים לקערה earlies של FSIO. גוזלי המוקדמות היו במערכת הביצה במשך 1 שעה ו רגישים קולוניזציה על ידי זיהום V. fischeri במערכת ביצה. אין להשתמש earlies לניסויים קולוניזציה רגישים.
- בדוק טנקים ביצים כל 30-45 דקות של גוזלים חדשים. ודא שכל גוזלי נמחקים במהלך כל גלעזאזל. הסרה של גוזלים עם טפטפת העברה, ואת ההפקדה לקערה timelies של FSIO. בעלי חיים שנאספו במועד זמינים ניסויים קולוניזציה.
- כאשר אוסף סיימה (~ 45 דקות אחרי השקיעה), להעביר את הדיונון למעבדה הראשית. אמפירי זה יתרון ליישב את החיות תחת אור ללא הפרעה בתנאי מעבדה של 3 חיסונים ש.
- עבור כל טיפול, להכין קערה עם 40 מ"ל FSIO. הוסף דיונון על קערות עבור assay (עד n = 40 בכל קערה).
- להכין קערה נוספת כביקורת (שלילי) aposymbiotic.
- הכן פיפטה העברת ייעודי עבור כל טיפול.
- להרדים דיונון נוסף אתנול 2%.
4. קלמארי להתיישבות
- יום 2 - שימוש Pipetman P10, לוותר aliquot מחושב של החיידק (שלב 1.5) לתוך קערה כל דיונון (שלב 3.8) עבור כל טיפול. הפעל את שעון העצר 3 שעות מיד לאחרחיסון 1.
- עבור כל טיפול, ליצור "מערבולת" בקערה עם פיפטה העברת ייעודי על ידי הנחת פיפטה ליד קצה הקערה pipetting מעלה ומטה שוב ושוב לערבב את המים דיונון תמורת כ 10 שניות. ערבוב יסודי הוא קריטי.
- 50 צלחת μl מהקערה כל לצלחת LBS אגר משלב 2.2 (עבור משכפל טכנית, שתי צלחות צלחת 50 μl לכל טיפול). דגירה של 25-28 מעלות צלזיוס למשך הלילה.
- להכין קערות רחצה (100 מ"ל FSIO / EA) עבור כל טיפול.
- הכן תסיסנית בקבוקונים (4 מ"ל FSIO / EA) עבור כל דיונון.
- אחרי שעה בדיוק 3, להעביר את הדיונון כדי קערות המיוחסים להם לשטוף (מלאה לטיפול בכלל). זה עוצר את חיסון.
- להמשיך להעביר את כל דיונון הפרט הבקבוקון עצמו תסיסנית עם FSIO. השתמש פיפטה העברת המיועד לטיפול זה.
- העבר מגשים של תסיסנית צלוחיות למתקן דיונון לחזור היום / nמחזור אור ight בעלי החיים חוו במהלך embryogenesis.
- יום 3 - הכן תסיסנית בקבוקונים (4 מ"ל FSIO / EA) עבור כל דיונון.
- לקראת ערב ב 22-24 חיסון שלאחר שעות, להעביר את כל דיונון כדי בקבוקון חדש תסיסנית. השתמש פיפטה העברת המיועד לטיפול זה.
- יום 4 - להכין שכותרתו 1.5 microcentrifuge מ"ל צינורות (1/squid).
- לקראת ערב ב 46-48 מדד H, לאחר חיסון ולהקליט הארה של דיונון כל בקבוקון תסיסנית (קבוצה Luminometer לשילוב של 6 ו אוטומטי לקרוא על סגירת המכסה).
- כביקורת שלילית על רקע הארה, למדוד את הבקבוקון עם FSIO שאינו מכיל כל דיונון.
- להעביר את כל דיונון בהיקף של כ 700 μl כדי צינור 1.5 מ"ל microcentrifuge משלב 4.12. עבור אל תיבת במקפיא קרטון. לאחר המכסה מונח על התיבה, לא להסיר אותו כמו רמזים קלים לגירוש חיידקים אינם welאני מובנת.
- להקפיא את צינורות microcentrifuge ב -80 מעלות צלזיוס למשך הלילה.
5. קביעת רמות קולוניזציה
- עבור כל דיונון, להכין שני (2) צינורות microcentrifuge, כל אחד עם 475 FSIO μl (או autoclaved האוקיינוס מיידית 70%).
- להכין מהעלי ידי 1 באמצעות Kimwipe לנקות את העלי ולהסיר גולמי ופסולת / או רקמות.
- מקום מהעלי עצה למטה בכוס 50 מ"ל המכיל 95% אתנול. אתנול יש להוסיף עד לגובה של כ 3 ס"מ.
- עבור כל העלי, להסיר הגביע ולנגב את קצה עם Kimwipe.
- טובלים בוכנה חזרה לאמבטיה אתנול, להסיר ולהוסיף (עצה למעלה) למעמד צינור microcentrifuge ולאפשר לייבוש באוויר לחלוטין למשך כ 15 דקות.
- ההפשרה דיונון במעמד צינור microcentrifuge (מקסימום n = 8).
- במידת הצורך, להתאים את עוצמת הקול כדי μl 700.
- באמצעות העלי משלב 5.5, לשבש את הרקמה החיה עד הדיו שק RUPtures (מים יהפוך צבע אפור עכור).
- הסר את העלי ולהבטיח את כל רקמת נשאר בצינור.
- המערבולת בקצרה רקמה בדיוק 10 שניות (להשתמש טיימר).
- אפשר רקמות לנוח 10 דקות. רקמת יישב ואת חיידקים דיו להישאר פתרון. עבור החישובים הבאים, החיידקים / פתרון דיו הוא [] דילול (כלומר scolopes איבר א 'אור homogenate ב μl 700). דילולים 1:20 סידורי ([ב '], [C]) מתוארים להלן.
- עבור דילול [B], הוסף 25 μl [] לאחד הצינורות microcentrifuge שהוכנו בשלב 5.1. מערבולת.
- עבור דילול [C], הוסף 25 μl [B] לאחד הצינורות microcentrifuge שהוכנו בשלב 5.1. מערבולת.
- פלייט 50 μl של דילול על כל אגר LBS, 2 משכפל לכל טיפול.
- דגירה את הצלחות על 25-28 מעלות צלזיוס למשך הלילה.
6. ניתוח נתונים
- כדי לחשב את CFU / איבר אור (LO), counטי המושבות על צלחת עבור כל טיפול בו 10-400 מושבות קיימות, ולהשתמש את הנוסחה המתאימה:
CFU / LO (= מושבות על צלחת []) x 14, או
CFU / LO = (מושבות בצלחת [B]) x 280, או
CFU / LO = (מושבות בצלחת [C]) x 5600. - להתוות נתונים בודדים נקודות ו חציונים על סולם לוגריתמי.
- הנתונים הם לעתים קרובות לא מופץ בדרך כלל, עם סטיות שונות, חריגים עשויים להכיל מידע בעל משמעות ביולוגית. לכן, אי - פרמטריים בדיקות לספק שיטה יעילה כדי לקבוע אם טיפולים שונים באופן משמעותי.
- השתמש פריזמה GraphPad תוכנה לניתוח סטטיסטי. עבור שני טיפולים, השתמש דירוג ווילקוקסון מבחן סכום. להשוואות בין יותר משני טיפולים, להשתמש במבחן Kruskal-ואליס עם מבחני הודעה המתאימים.
7. נציג תוצאות
תוצאות assay קולוניזציה המדגם מוצגים באיור 4. שני זנים של ו ' fischeri כי מפגינים רמות שונות של הארה יחסית היו כל מחוסן את הדיונון 6, יחד עם דיונון 6 ששימש (uncolonized) שולטת aposymbiotic. ה scolopes הסימביונט, ES114 14, בהיר Sepiola רובוסטה הסימביונט, SR5 15,16. רמות הבידוד דומה (איור 4 א) להוביל קולוניזציה 100% בתוך 3 שעות. ב 48 שעות, רמות הארה (איור 4B) וספירות CFU (איור 4C) נקבעו על מנת להעריך את המיומנות קולוניזציה של זן. קביעת הארה מסוימת (איור 4D, לכל חיידק) מאפשר לקבוע את הבהירות של כל זן חיידקי במהלך סימביוזה.

1. תרשים זרימה תרשים של ההליך קולוניזציה. חיידקים דיונון נקצרים בנפרד, ולאחר מכן מערבבים את הבידוד המצוין. קלמארי נשטפים, הועבר לאחר מכן מים חדשה 3 שעות, 24 שעות, ו 4 8 שעות שלאחר חיסון. ב 48 שעות הארה נמדד החיות קפואים, המשמשת אל פני השטח, לעקר את החיות. אור איבר יישבו חיידקים נשארים קיימא ב -80 ° C דרך הפשרה 1 (ללא תוספת ההקפאה, ההפשרה מחזורים).
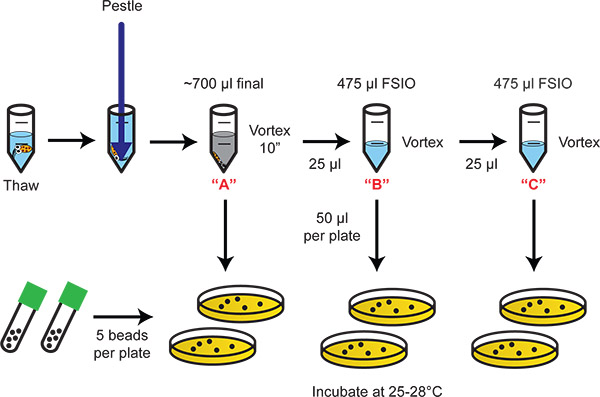
2. תרשים זרימה תרשים הממחיש homogenization ו ציפוי דילול של החיידקים. טורי 20-לקפל דילולים לספק טווח דינמי המתאים ספירה של חיידקים התיישבו.

איור 3. העברת בטפי להחדרת נוזלים עם להתחדד פיר צר כראוי משעמם צרים (א ') כי היה לפגוע דיונון נעורים. טיפול מקדים על ידי ניתוק החלק הצר ביותר עם מספריים או סכין גילוח מניבה הכלי המתאים (ב ') להעברת דיונון נעורים.
s/ftp_upload/3758/3758fig4.jpg "/>
איור 4. נתונים לדוגמה עבור assay קולוניזציה. (A) של רמות החיידקים בבתי קערות הבידוד. (ב) הארה של דיונון הפרט. (ג) ספירת מושבה של דיונון הפרט. (ד) הארה ספציפית של דיונון הפרט. Apo, Aposymbiotic (uncolonized שליטה שלילי).
Discussion
Assay קולוניזציה תיאר מאפשרת ניתוח של תהליך סימביוטי טבעי בסביבת מעבדה מבוקרת. ככזה, הוא יכול לשמש כדי להעריך את ההתיישבות על ידי זנים מוטנטים, לפי מבודד טבעיים שונים, תחת משטרים כימיים שונים. וריאציות על הניסויים המתוארים משמשים בדרך כלל כדי להעריך אספקטים שונים של סי?...
Disclosures
החוקרים אין לי מה לחשוף.
Acknowledgements
המחברים מודים מתיאס Gyllborg לתמיכה מתקן דיונון על הערות על כתב היד הזה, מייקל Hadfield ואת מעבדה ימית Kewalo לקבלת סיוע במהלך איסוף בשדה, ואנשי המעבדה רובי McFall-נגאי תרומות לפרוטוקול זה. העבודה במעבדה מנדל נתמך על ידי NSF IOS-0843633.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | תגובות |
| תרבות זכוכית צינורות, קוטר 16 מ"מ | VWR | 47729-580 | |
| כמוסות של צינורות זכוכית תרבות | דיג | NC9807998 | |
| ספקטרופוטומטר הנראה להגדרה של OD 600 | Biowave | CO8000 | כל ספקטרופוטומטר מסוגל למדוד OD 600 יעבוד. יחידה זו יכולה למדוד את OD 600 הנוזל ישירות צינורות תרבות זכוכית. יש התאמה של חישוב הבידוד עשוי להיות נחוץ בהתאם המכשיר בשימוש. |
| GloMax 20/20 Single-Tube Luminometer | Promega | E5311 | שווה BioSystems טרנר 20/20n Luminometer. לרבות בעל צינור microcentrifuge. |
| GloMax 20/20 רגיל אור | Promega | E5341 | לצורך כיול Luminometer. |
| Refractometer, מחשב כף יד | פוסטר ו סמית Aquatics | CD-14035 | כיול לפני כל שימוש במים deionized. יש לשטוף לאחר כל שימוש במים deionized כדי למנוע הצטברות מלח. |
| מיידית האוקיינוס (מלאכותית להתרכז מי ים) | פוסטר & Smith Aquatics | CD-16881 | הכן על 35 ‰ במים deionized, באמצעות refractometer, לסנן ואז דרך 0.2 מיקרומטר SFCA הסינון. |
| סינון יחידה | Nalgene | 158-0020 | פעילי שטח ללא תאית אצטט (SFCA) הממברנה, 0.2 מיקרומטר. ראינו תוצאות משתנות עם כמה פעילי שטח, המכילים מסנני PES. |
| העברת טפטפות | דיג | 13-711 -09:00 | בעזרת מספריים או סכין גילוח, לחתוך את קצה נקי מעל הרכס הראשון כדי להגדיל את הקוטר של קצה פיפטה ולהימנע לסחוט את גוזלי דיונון. |
| לדוגמה קערות חד פעמיים (כוסות פלסטיק) | שביט | T9S (9 גר '.) | קערות עבור חיסון, בקוטר 3 ¼ העליון ", נמוך בקוטר 2 ¼", גובה 3 ". קערות ליצור סביבה הומוגנית שאין בהם שפת התחתונה, שבה הדיונון יכול להילכד בתוך גומחה הדל בחמצן. בגודל מותאם עבור 40 מ"ל הבידוד. ניתן להשיג webstaurantstore.com, # 619PI9. |
| תסיסנית בקבוקוני פלסטיק | VWR | 89092-720 | קוטר בקבוקון תואם הפתיחה על PMT Luminometer. |
| 1.5 מ"ל צינורות Microcentrifuge | ISC Bioexpress | C-3217-1CS | צינורות יש להתאים את צורת מהעלי את. |
| , אתנול 200 Proof | דיג | BP2818-100 | |
| מהעלי | קימבל צ'ייס / Kontes | 749521-1500 | |
| ציפוי חרוזים, בקוטר 5 מ"מ | קימבל צ'ייס | 13500 5 | הכן 5 לכל צינור החיטוי. |
References
- Aas, J. A., Paster, B. J., Stokes, L. N., Olsen, I., Dewhirst, F. E. Defining the normal bacterial flora of the oral cavity. J. Clin. Microbiol. 43, 5721-5732 (2005).
- Mandel, M. J., Wollenberg, M. S., Stabb, E. V., Visick, K. L., Ruby, E. G. A single regulatory gene is sufficient to alter bacterial host range. Nature. 458, 215-218 (2009).
- Grice, E. A., Segre, J. A. The skin microbiome. Nat. Rev. Microbiol. 9, 244-253 (2011).
- Malic, S. Detection and identification of specific bacteria in wound biofilms using peptide nucleic acid fluorescent in situ hybridization (PNA FISH). Microbiology. 155, 2603-2611 (2009).
- Turnbaugh, P. J. The human microbiome project. Nature. 449, 804-810 (2007).
- Nyholm, S. V., McFall-Ngai, M. J. The winnowing: establishing the squid-Vibrio symbiosis. Nat. Rev. Microbiol. 2, 632-642 (2004).
- Ruby, E. G. Lessons from a cooperative, bacterial-animal association: the Vibrio fischeri-Euprymna scolopes light organ symbiosis. Annu. Rev. Microbiol. 50, 591-624 (1996).
- McFall-Ngai, M. J., Ruby, E. G. Symbiont recognition and subsequent morphogenesis as early events in an animal-bacterial mutualism. Science. 254, 1491-1494 (1991).
- Jones, B., Nishiguchi, M. Counterillumination in the Hawaiian bobtail squid, Euprymna scolopes Berry (Mollusca: Cephalopoda). Marine Biology. 144, 1151-1155 (2004).
- Graf, J., Ruby, E. G. Host-derived amino acids support the proliferation of symbiotic bacteria. Proc. Natl. Acad. Sci. U.S.A. 95, 1818-1822 (1998).
- Ruby, E. G., McFall-Ngai, M. J. A squid that glows in the night: development of an animal-bacterial mutualism. J. Bacteriol. 174, 4865-4870 (1992).
- Lee, P. N., McFall-Ngai, M. J., Callaerts, P., de Couet, H. G. The Hawaiian bobtail squid (Euprymna scolopes): a model to study the molecular basis of eukaryote-prokaryote mutualism and the development and evolution of morphological novelties in cephalopods. Cold Spring Harbor Protocols. , (2009).
- Stabb, E., Visick, K., Millikan, D., Corcoran, A. The Vibrio fischeri-Euprymna scolopes symbiosis: a model marine animal-bacteria interaction. Recent Advances in Marine Science and Technology. , (2001).
- Boettcher, K. J., Ruby, E. G. Depressed light emission by symbiotic Vibrio fischeri of the sepiolid squid Euprymna scolopes. J. Bacteriol. 172, 3701-3706 (1990).
- Fidopiastis, P. M., von Boletzky, S., Ruby, E. G. A new niche for Vibrio logei, the predominant light organ symbiont of squids in the genus Sepiola. J. Bacteriol. 180, 59-64 (1998).
- Bose, J. L. Contribution of rapid evolution of the luxR-luxI intergenic region to the diverse bioluminescence outputs of Vibrio fischeri strains isolated from different environments. Appl. Environ. Microbiol. 77, 2445-2457 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved