È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
La colonizzazione delle Euprymna scolopes Squid da Vibrio fischeri
In questo articolo
Riepilogo
Il metodo descrive la procedura con cui il calamaro hawaiano bobtail, Euprymna scolopes E il suo simbionte batterica, Vibrio fischeri, Vengono allevati separatamente e poi introdotta per consentire colonizzazione specifica dell'organo luce calamari dai batteri. Rilevamento colonizzazione da parte di luminescenza batteri derivati e conteggio delle colonie diretta sono descritti.
Abstract
Batteri specifici sono presenti in associazione con tessuti animali 1-5. Tali host-batteriche associazioni (simbiosi), può essere dannoso (patogeno), non hanno alcuna conseguenza fitness (commensale), o essere di beneficio (mutualità). Mentre molta attenzione è stata data alle interazioni patogeni, si sa poco sui processi che determinano l'acquisizione riproducibile di benefici / commensale batteri dall'ambiente. La luce-organo mutualismo tra la marina batterio Gram-negativo V. fischeri e la Hawaiian Bobtail calamari, E. scolopes, rappresenta una interazione altamente specifica in cui un host (E. scolopes) stabilisce un rapporto simbiotico con una sola specie batteriche (V. fischeri) nel corso della sua vita 6,7. Bioluminescenza prodotta da V. fischeri durante questa interazione fornisce un anti-predatorio beneficio E. scolopes durante le attività notturne 8,9, mentreil tessuto ricco di nutrienti host fornisce V. fischeri con una nicchia protetta 10. Durante ogni generazione host, questo rapporto si riassume, rappresentando così un processo prevedibile che può essere valutata in dettaglio vari stadi di sviluppo simbiotico. In laboratorio, del minore calamari sportello aposymbiotically (colonizzati), e, se raccolti entro i primi 30-60 minuti e trasferito al simbionte priva di acqua, non possono essere colonizzati se non lo sperimentale inoculo 6. Questa interazione fornisce pertanto un sistema utile modello in cui per valutare i singoli passaggi che portano alla acquisizione specifico di un microbo simbiotico dall'ambiente 11,12.
Qui si descrive un metodo per valutare il grado di colonizzazione che si verifica quando appena schiusi aposymbiotic E. scolopes sono esposti a (artificiale) contenenti acqua di mare V. fischeri. Questo saggio descrive semplice inoculazione, l'infezione naturale, e il recuperodel simbionte batterico dall'organo luce nascente E. scolopes. cura è presa per fornire un ambiente coerente per gli animali durante lo sviluppo simbiotico, con particolare riguardo alla qualità dell'acqua e segnali luminosi. Metodi per caratterizzare la popolazione simbiotica descritta includono (1) misura della bioluminescenza batteri-derivati, e (2) colonia diretta conteggio di simbionti recuperati.
Protocollo
1. Preparazione di inoculi batterica
- Giorno 0
Due giorni prima calamari inoculazione, la piastra dei ceppi batterici rilevanti su LBS 13 agar. - Incubare batteri a 25-28 ° C durante la notte.
- Giorno 1
Inoculare 3 LBS ml di media cultura in un tubo di vetro con una colonia di ogni V. ceppo fischeri per l'infezione. Preparare duplicare i tubi come backup. - Giorno 2
(Coordinate passi batteriche 1,4-1,6 con passo calamari 3.7-3.10)
1 h prima dell'inoculo, batteri subcultura 1:80 (37,5 pl) in 3 ml LBS in una provetta di vetro e crescere per 1 h con aerazione. - Misurare la OD 600 del campione prima dell'inoculo. Misurazioni tipiche sono 0,3-0,6 seconda del ceppo.
- Per un inoculo bersaglio di 3-5 x 10 3 UFC / ml calcolare il volume di inoculo come segue: volume di inoculo (pl) = 1,25 / 60 OD0 (ad esempio, per OD 600 = 0.5, il volume di inoculo calcolato = 1.25/0.5 = 2,5 microlitri). Tale importo è aggiunto direttamente l'acqua di mare contenenti calamari al punto 4.1. Questo calcolo può essere necessario regolare per diversi ceppi di V. fischeri o per l'inoculazione a livelli inferiori o superiori a quelli indicati qui.
2. Preparazione di piastre di agar per il conteggio del inoculi
- Per ogni trattamento, LBS etichette piastre (2 per il trattamento) a campioni piastra del inoculo nel passaggio 4.1.
- Aggiungere 5 perline placcatura sterili per piastra.
3. Raccolta dei minori Squid
- Misurare la salinità dell'Oceano istantanea con il rifrattometro e regolare a 35 ‰.
- Filtrare 1 L di Ocean istantaneo utilizzando l'unità di filtrazione e una linea a vuoto allegato o pompa del vuoto, per generare filtro sterilizzato istantanea Ocean (UFAS). Ossigenare l'acqua agitando vigorosamente prima di ogni erogazione. The unità di filtro può essere riutilizzato per 2 giorni.
- Aliquotare 40-50 ml di UFAS in ciascuno di due (2) ciotole campione usa e getta. Etichetta uno come Earlies e una come timelies.
- Preparare un eccesso di pipette di trasferimento in plastica per acquisire calamari giovanile tagliando la pipetta circa 1 cm dalla punta, sopra le creste più bassi (vedi Figura 3). Questo facilita una zona più ampia attraverso la quale il calamaro può passare al momento della raccolta. Eliminare le pipette di trasferimento in cui vi è una superficie ruvida esposta.
- Utilizzo di pipette di trasferimento preparati, raccogliere E. scolopes che nati durante la notte e trasferire alla ciotola Earlies di UFAS. Hatchlings I primi sono stati nel sistema di uova per oltre 1 ora e sono suscettibili di colonizzazione da parte di contaminanti V. fischeri nel sistema uovo. Non utilizzare per gli esperimenti di colonizzazione Earlies sensibili.
- Controllare i serbatoi d'uovo ogni 30-45 min per hatchlings nuovi. Assicurarsi che tutti i neonati vengono eliminati nel corso di ogni check. Rimuovere hatchlings con una pipetta di trasferimento, e il deposito nella ciotola timelies di UFAS. Gli animali raccolti in modo tempestivo sono disponibili per gli esperimenti di colonizzazione.
- Quando la raccolta è terminata (~ 45 min dopo il tramonto), trasferire il calamaro al laboratorio principale. Empiricamente è vantaggioso a colonizzare gli animali in condizioni di luce ininterrotta di laboratorio per 3 vaccinazioni h.
- Per ogni trattamento, preparare una ciotola con 40 ml UFAS. Aggiungi Squid per le ciotole per il saggio (massimo n = 40 per ciotola).
- Preparare una ciotola aggiuntiva come aposymbiotic controllo (negativo).
- Preparare una pipetta di trasferimento dedicato per ciascun trattamento.
- Euthanize calamari extra in 2% di etanolo.
4. Squid Colonization
- Giorno 2 - Utilizzando una Pipetman P10, dispensare l'aliquota calcolata di batteri (Step 1.5) in ogni ciotola calamari (Step 3.8) per ogni trattamento. Avviare un timer 3 ore subito dopola prima inoculazione.
- Per ogni trattamento, creare un "vortice" nel contenitore con la pipetta di trasferimento dedicato posizionando la pipetta vicino al bordo della tazza e pipettando su e giù ripetutamente per miscelare l'acqua e calamari per circa 10 sec. Accurata miscelazione è fondamentale.
- Tavola 50 microlitri da ogni ciotola su una piastra di agar LBS dal punto 2.2 (per il tecnico replica, due piastre 50 piastre pl per ogni trattamento). Incubare a 25-28 ° C durante la notte.
- Preparare catino (100 ml UFAS / bis) per ogni trattamento.
- Preparare fiale Drosophila (4 ml UFAS / bis) per ogni calamari.
- Dopo esattamente 3 ore, trasferire i calamari ai loro rispettivi catino (completa per tutti i trattamenti). Ciò arresta l'inoculazione.
- Procedere al trasferimento di ogni singolo calamari al suo flacone con il proprio Drosophila UFAS. Utilizzare una pipetta di trasferimento designato per ogni trattamento.
- Spostare vassoi di fiale Drosophila alla struttura calamari per tornare al giorno / night ciclo di luce gli animali sperimentato durante l'embriogenesi.
- Giorno 3 - Prepare fiale Drosophila (4 ml UFAS / bis) per ogni calamari.
- Prima del tramonto a 22-24 ore dopo l'inoculazione, trasferire ogni calamari in un nuovo flacone Drosophila. Utilizzare una pipetta di trasferimento designato per ogni trattamento.
- Giorno 4 - Preparare microcentrifuga etichettata provette da 1,5 ml (1/squid).
- Prima del tramonto a 46-48 ore dopo l'inoculazione, misurare e registrare la luminescenza di ogni calamari nel flaconcino Drosophila (set luminometro 6 s per l'integrazione e l'auto-lettura in chiusura del coperchio).
- Come controllo negativo per luminescenza sfondo, misurare un flaconcino con UFAS che non contiene alcun calamari.
- Trasferire ciascun calamari in un volume di circa 700 pl di una provetta per microcentrifuga 1,5 ml dalla Fase 4,12. Spostarsi in una scatola di cartone freezer. Una volta che il coperchio è posto sulla scatola, non rimuoverlo, come i segnali di luce per l'espulsione i batteri non sono well-compreso.
- Congelare provette da microcentrifuga a -80 ° C per una notte.
5. Determinazione dei livelli di colonizzazione
- Per ogni calamari, preparare due (2) microprovette, ognuna con 475 microlitri UFAS (o in autoclave 70% Instant Ocean).
- Preparare pestelli in primo luogo utilizzando un Kimwipe per pulire il pestello e rimuovere i detriti lordo e / o tessuto.
- Luogo pestelli tip-down in un bicchiere da 50 ml contenente etanolo al 95%. Etanolo deve essere aggiunto ad una altezza di circa 3 cm.
- Per ogni pestello, togliere dal bicchiere e pulire la punta con un Kimwipe.
- Immergere pestello di nuovo nel bagno di etanolo, rimuovere e inserire (punta verso l'alto) in un rack provetta e lasciare asciugare completamente per circa 15 minuti.
- Scongelare calamari in un portaprovette microcentrifuga (massimo n = 8).
- Se necessario, regolare il volume a 700 microlitri.
- Utilizzo di un pestello dal punto 5.5, a distruggere il tessuto animale finché l'inchiostro sac RUPTures (l'acqua diventa torbida un colore grigio).
- Rimuovere il pestello e garantire tutti tessuto rimane nel tubo.
- Vortex brevemente il tessuto per esattamente 10 secondi utilizzare un timer).
- Lasciare il tessuto riposare per 10 min. Il tessuto si sistemerà ed i batteri e l'inchiostro rimane in soluzione. Per i calcoli che seguono, i batteri o la soluzione di inchiostro è la [A] diluizione (cioè la luce E. scolopes omogenato organo in 700 pl). Diluizioni seriali 1:20 ([B], [C]) sono descritti di seguito.
- Per la [B] diluizione, aggiungere 25 pl [A] alla uno dei tubi da microcentrifuga preparata al punto 5.1. Vortex.
- Per la [C] diluizione, aggiungere 25 pl [B] a uno dei tubi da microcentrifuga preparata al punto 5.1. Vortex.
- Tavola 50 microlitri di ciascuna diluizione su agar LBS, 2 repliche per trattamento.
- Incubare le piastre a 25-28 ° C per una notte.
6. Analisi dei dati
- Per calcolare il CFU / organo luce (LO), i paesit colonie sulla piastra per ogni trattamento, in cui 10-400 colonie sono presenti, e usare la seguente formula:
CFU / LO = (colonie su [A] piastra) x 14;
CFU / LO = (colonie su [B] piastra) x 280, oppure
CFU / LO = (colonie su [C] piastra) x 5600. - Tracciare i singoli punti dati e le mediane su una scala logaritmica.
- I dati spesso non sono normalmente distribuiti, con diverse varianze, e gli outliers possono contenere informazioni biologicamente significativo. Pertanto, non parametrici fornire un metodo utile per determinare se i trattamenti differiscono in modo significativo.
- Utilizzare software Prism GraphPad per l'analisi statistica. Per i due trattamenti, utilizzare il Wilcoxon rank test Sum. Per i confronti tra più di due trattamenti, utilizzare il Kruskal-Wallis test con appropriato post-test.
7. Risultati rappresentativi
I risultati di un saggio di colonizzazione campione sono mostrati nella Figura 4. Due ceppi di V. fischeri, che presentano diversi livelli relativi di luminescenza sono stati inoculati in ogni sei calamari, insieme a sei calamari che è servito come aposymbiotic (non colonizzata) i controlli. Il E. scolopes simbionte, ES114 14 e brillante è il Sepiola robusta simbionte, SR5 15,16. Livelli di inoculo simili (Fig. 4A) portano al 100% colonizzazione nel raggio di 3 h. A 48 ore, i livelli di luminescenza (Fig. 4B) e conta CFU (Fig. 4C) sono stati determinati per valutare la competenza colonizzazione del ceppo. Determinazione della luminescenza specifico (Fig. 4D; batterio per) consente di determinare la luminosità di ogni ceppo batterico durante la simbiosi.

Figura 1. Diagramma di flusso della procedura di colonizzazione. Batteri e calamari vengono raccolte separatamente, poi mixato presso l'inoculo specificato. Squid vengono lavate, poi trasferito acqueo a 3 ore, 24 ore, e 4 8 h dopo l'inoculazione. Al 48 h la luminescenza è misurata e gli animali vengono congelati, che serve a superficie sterilizzare gli animali. Light-organo colonizzato i batteri rimangono vitali a -80 ° C attraverso un disgelo (senza ulteriori cicli gelo-disgelo).
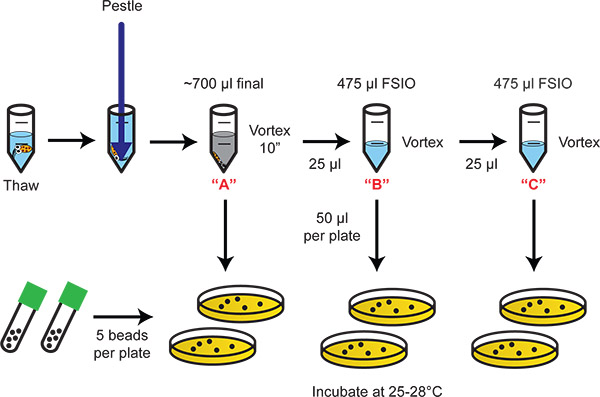
Figura 2. Diagramma di flusso illustrante omogeneizzazione e placcatura diluizione dei batteri. Seriali 20-diluizioni fornire la gamma dinamica adeguata per il conteggio dei batteri colonizzati.

Figura 3. Trasferire pipette con un cono albero opportunamente stretto un foro stretto (A) che danneggerebbero calamari giovanile. Pretrattamento, tagliando parte più stretta con le forbici o una lametta si ottiene uno strumento adeguato (B) per il trasferimento di calamari giovanile.
s/ftp_upload/3758/3758fig4.jpg "/>
Figura 4. I dati di esempio per un test di colonizzazione. (A) i livelli di batteri nelle ciotole inoculo. (B) Luminescence di calamari individuale. (C) il conteggio delle colonie di calamari individuale. (D) luminescenza specifico di calamari individuale. Apo, Aposymbiotic (non colonizzata controllo negativo).
Discussione
Il dosaggio colonizzazione descritto permette l'analisi di un processo naturale simbiotico in un ambiente di laboratorio controllato. Come tale, può essere utilizzato per valutare colonizzazione da ceppi mutanti mediante diversi isolati naturali, e sotto regimi chimici differenti. Variazioni su gli esperimenti descritti sono comunemente usati per valutare diversi aspetti della simbiosi. La cinetica di colonizzazione può essere misurata esaminando luminescenza durante le prime 24 ore, che può essere rilevata autom...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori ringraziano per il supporto Mattias Gyllborg impianto di calamari e dei commenti a questo manoscritto, Michael Hadfield e il Laboratorio Kewalo Marine per l'assistenza durante la raccolta campo, ei membri del Laboratorio di Ruby e McFall-Ngai per i contributi a questo protocollo. Il lavoro nel laboratorio di Mandel è supportato da NSF IOS-0843633.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome di reagente | Azienda | Numero di catalogo | Comments |
| Tubi di vetro Cultura, diametro 16 mm | VWR | 47729-580 | |
| Tappi per Tubi cultura del vetro | Pescatore | NC9807998 | |
| Spettrofotometro visibile per la determinazione di OD 600 | Biowave | CO8000 | Qualsiasi spettrofotometro in grado di misurare OD 600 funzionerà. Questa unità può misurare la OD 600 di liquido direttamente in provette di coltura di vetro. Qualche aggiustamento del calcolo inoculo può essere necessario a seconda dello strumento utilizzato. |
| Glomax 20/20 Singolo-Tube Luminometro | Promega | E5311 | Equivalente al BioSystems Turner 20/20n luminometro. Include il supporto provetta. |
| Glomax 20/20 standard Luce | Promega | E5341 | Per la calibrazione luminometro. |
| Rifrattometro, Handheld | Foster e Smith Aquatics | CD-14.035 | Calibrare prima di ogni utilizzo con acqua deionizzata. Risciacquare dopo ogni uso con acqua deionizzata per evitare l'accumulo di sale. |
| Istantanea Ocean (artificiale concentrato di mare) | Foster & Smith Aquatics | CD-16.881 | Preparare a 35 ‰ in acqua deionizzata, utilizzando il rifrattometro, quindi filtrare attraverso un 0,2 micron SFCA filtro. |
| Unità di filtraggio | Nalgene | 158-0020 | Tensioattivo-free di acetato di cellulosa (SFCA) membrana, 0,2 micron. Abbiamo osservato risultati variabili con qualche tensioattivo contenenti filtri PES. |
| Pipette di trasferimento | Pescatore | 13-711 -09:00 | Utilizzando forbici o lametta, tagliare la punta nettamente al di sopra della cresta prima per aumentare il diametro della punta della pipetta ed evitare che si schiaccino i piccoli calamari. |
| Bocce campione monouso (bicchieri di plastica) | Cometa | T9s (9 oz.) | Ciotole per inoculazione, con diametro superiore 3 ¼ ", diametro inferiore 2 ¼", altezza 3 ". Bocce creare un ambiente omogeneo in quanto non hanno margine di fondo, in cui i calamari possono rimanere intrappolati in un basso di ossigeno di nicchia. La dimensione è ottimizzata per 40 ml di inoculo. Disponibile all'indirizzo webstaurantstore.com, # 619PI9. |
| Drosophila Fiale | VWR | 89092-720 | Diametro Vial corrisponde l'apertura sul PMT luminometro. |
| Provette da microcentrifuga da 1,5 ml | ISC Bioexpress | C-3217-1CS | I tubi devono adattarsi alla forma dei pestelli. |
| Etanolo, 200 Proof | Pescatore | BP2818-100 | |
| Pestelli | Kimble Chase / Kontes | 749521-1500 | |
| Beads placcatura, 5 mm di diametro | Kimble Chase | 13500 5 | Preparare 5 per tubo e autoclave. |
Riferimenti
- Aas, J. A., Paster, B. J., Stokes, L. N., Olsen, I., Dewhirst, F. E. Defining the normal bacterial flora of the oral cavity. J. Clin. Microbiol. 43, 5721-5732 (2005).
- Mandel, M. J., Wollenberg, M. S., Stabb, E. V., Visick, K. L., Ruby, E. G. A single regulatory gene is sufficient to alter bacterial host range. Nature. 458, 215-218 (2009).
- Grice, E. A., Segre, J. A. The skin microbiome. Nat. Rev. Microbiol. 9, 244-253 (2011).
- Malic, S. Detection and identification of specific bacteria in wound biofilms using peptide nucleic acid fluorescent in situ hybridization (PNA FISH). Microbiology. 155, 2603-2611 (2009).
- Turnbaugh, P. J. The human microbiome project. Nature. 449, 804-810 (2007).
- Nyholm, S. V., McFall-Ngai, M. J. The winnowing: establishing the squid-Vibrio symbiosis. Nat. Rev. Microbiol. 2, 632-642 (2004).
- Ruby, E. G. Lessons from a cooperative, bacterial-animal association: the Vibrio fischeri-Euprymna scolopes light organ symbiosis. Annu. Rev. Microbiol. 50, 591-624 (1996).
- McFall-Ngai, M. J., Ruby, E. G. Symbiont recognition and subsequent morphogenesis as early events in an animal-bacterial mutualism. Science. 254, 1491-1494 (1991).
- Jones, B., Nishiguchi, M. Counterillumination in the Hawaiian bobtail squid, Euprymna scolopes Berry (Mollusca: Cephalopoda). Marine Biology. 144, 1151-1155 (2004).
- Graf, J., Ruby, E. G. Host-derived amino acids support the proliferation of symbiotic bacteria. Proc. Natl. Acad. Sci. U.S.A. 95, 1818-1822 (1998).
- Ruby, E. G., McFall-Ngai, M. J. A squid that glows in the night: development of an animal-bacterial mutualism. J. Bacteriol. 174, 4865-4870 (1992).
- Lee, P. N., McFall-Ngai, M. J., Callaerts, P., de Couet, H. G. The Hawaiian bobtail squid (Euprymna scolopes): a model to study the molecular basis of eukaryote-prokaryote mutualism and the development and evolution of morphological novelties in cephalopods. Cold Spring Harbor Protocols. , (2009).
- Stabb, E., Visick, K., Millikan, D., Corcoran, A. The Vibrio fischeri-Euprymna scolopes symbiosis: a model marine animal-bacteria interaction. Recent Advances in Marine Science and Technology. , (2001).
- Boettcher, K. J., Ruby, E. G. Depressed light emission by symbiotic Vibrio fischeri of the sepiolid squid Euprymna scolopes. J. Bacteriol. 172, 3701-3706 (1990).
- Fidopiastis, P. M., von Boletzky, S., Ruby, E. G. A new niche for Vibrio logei, the predominant light organ symbiont of squids in the genus Sepiola. J. Bacteriol. 180, 59-64 (1998).
- Bose, J. L. Contribution of rapid evolution of the luxR-luxI intergenic region to the diverse bioluminescence outputs of Vibrio fischeri strains isolated from different environments. Appl. Environ. Microbiol. 77, 2445-2457 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon