Method Article
El estudio de puesto de control mitótico, ilustrando comportamiento dinámico de proteínas cinetocoro y el movimiento de cromosomas en vivo
En este artículo
Resumen
El cinetocoro es donde el SAC inicia su señal de control de la segregación mitótica de las cromátidas hermanas. Se describe un método para visualizar la contratación y la rotación de una de las kinetochore proteínas y su coordinación con el movimiento de los cromosomas en Drosophila Embriones utilizando un sistema láser de Leica confocal de barrido.
Resumen
El conjunto del eje puesto de control (SAC) el mecanismo es una señal activa, que controla la interacción entre los cinetocoros de los cromosomas y los microtúbulos del huso para prevenir la aparición de la anafase hasta que los cromosomas están correctamente conectados. Las células utilizan este mecanismo para evitar la inestabilidad genómica o la aneuploidía, y por lo tanto, los cánceres y otras enfermedades humanas tales como defectos de nacimiento y la enfermedad de Alzheimer 1. Varios de los componentes del SAC como Mad1, Mad2, Bub1, BubR1, Bub3, Mps1, ZW10, Rod y Aurora quinasa B han sido identificados y que son todas las proteínas dinámicas kinetochore 2. La evidencia sugiere que el cinetocoro es donde la señal de SAC se inicia. El objetivo del SAC es el primer regulador Cdc20. Cdc20 es uno de los esenciales de APC / C (A naphase P romoción C omplejo o yclosome C) activadores 3 y es también una proteína cinetocoro dinámico 4-6. Cuando se activa, el SAC inhibe la actividad de la UnPC / C para evitar la destrucción de dos sustratos clave, la ciclina B y securin, evitando así la metafase a anafase transición de 7,8. Exactamente cómo la señal de SAC se inicia y montados en los cinetocoros y se informará sobre el APC / C para inhibir su función sigue siendo difícil de alcanzar.
Drosophila es un sistema experimental extremadamente tratable; un organismo mucho más simple y mejor entendida en comparación con la humana, pero una que comparte procesos fundamentales en común. Es, quizás, uno de los mejores organismos a utilizar para los estudios de bio-imágenes de células vivas, especialmente para la visualización de los eventos mitóticos en el espacio y el tiempo, ya que el embrión temprano va a través de 13 ciclos rápidos de la división nuclear de forma sincrónica (8-10 minutos para cada ciclo a 25 ° C) y gradualmente organiza los núcleos en una sola monocapa justo debajo de la corteza 9.
Aquí, presentamos un método bio-imágenes con expresión transgénica de Drosophilacantan las buenas prácticas agrarias (Green Fluorescent Protein) o de sus dirigidos variante de las proteínas de interés y una Leica TCS SP2 confocal de barrido láser sistema de microscopio para estudiar la función del SAC en las moscas, mostrando imágenes de las proteínas de fusión GFP de algunos de los componentes SAC, Cdc20 y Mad2 , como el ejemplo.
Protocolo
1. Las moscas transgénicas y Mantenimiento
- El moscas transgénicas que se utiliza en esta demostración: UBQ-GFP-Cdc20 (II), UBQ-RFP-His2B (X *); UBQ-GFP-Cdc20 (II *), UBQ-GFP-Cdc20 (II *); MAD2 EY ( III *) y UBQ-GFP-Cdc20 moscas transgénicas se han generado previamente en el laboratorio a través de un enfoque estándar mediada por P-elemento transgénico 10,11 y UBQ-RFP-His2B es una especie de regalo Yohanns Belaïche en UMR 144 CNRS / Instituto Curie, París, Francia. Se introdujeron en un fondo Mad2 mutante vía estándar Genética de Drosophila. El MAD2 EY mutante línea original fue comprado en el centro de Bloomington de valores. No vamos a discutir el procedimiento utilizado para elevar los transformantes en este protocolo.
Nota: * representa el número de cromosomas. - Mantenimiento: las moscas transgénicas que se mantuvieron a 25 ° C en frascos de plástico containing volar alimentos y con polvo de levadura seca adicional en la parte superior. El vial se sustituye rutinariamente cada 3-4 semanas, dependiendo de las condiciones de crecimiento (Figura 1).
2. Fly Preparación de Alimentos (escala de laboratorio)
- Una cantidad apropiada de la mezcla de alimentos mosca se calentó con agitación constante para disolver los componentes.
- Acerca de 8-10 ml de este medio se distribuye como suspensión en cada vial de plástico (2,5 cm de diámetro x 8 cm de longitud) utilizando un Jencons Scientific Ltd. bomba peristáltica.
- Cuando la suspensión de alimentos se fijó y se ha enfriado a temperatura ambiente, el vial es entonces conectado con un tapón de espuma de algodón. Estos viales se colocan los alimentos en una bandeja que luego se sella en una bolsa de plástico y se mantuvo a 4 ° C para uso posterior.
3. En pequeña escala de recolección de huevos
- Alrededor de 50 pares de moscas adultas 2-3 días de edad se transfirieron a un vial de mosca alimento fresco suministrado con polvo adicional levadura seca sobre su superficie a 25 ° C durante laicoIng embriones.
- Las moscas son luego transferidos a un vial nuevo cada hora y dejar los embriones en el vial durante 30 minutos para asegurar algunos de los embriones recogidos se envejecen en torno a 8-10 nucleares división del ciclo cuando los núcleos están migrando gradualmente a la corteza y organizada como una monocapa clave. La colección de primera hora normalmente se desecha, ya que a menudo contiene embriones de edad que fueron retenidos en los cuerpos femeninos, cuando las condiciones no eran adecuadas para la colocación.
4. Preparación Cubreobjetos y diapositivas
- Sacar un 50 x 22 mm cubreobjetos y ligeramente húmedo de sus cuatro esquinas, por un lado con una cantidad muy pequeña de agua con un pincel húmedo pluma fina y ponerla en un portaobjetos para que el cubreobjetos no se mueve debido a la tensión de la superficie capilar causada por la película líquida delgada.
- Aplicar una tira delgada de cola heptano a través del centro del cubreobjetos, el heptano debe evaporarse en segundos para dejar que el pegamento sobre el cubreobjetos.
- Corte otro cubreobjetos con una pluma de diamantes en pequeños cuadrados (~ 1,5 mm 2), recoge una y colocarla en un extremo de la línea de cola (esto se usa para abrir la punta de la aguja cuando la microinyección se requiere) y salvar a los demás para el futuro utilizar.
- Tome otro portaobjetos de microscopio y pegar un trozo de cinta de doble cara adhesiva de aproximadamente 2 cm de largo a la misma y retire la cubierta de papel. (Ver Figura 2 A y B).
5. Los embriones Dechorionate
- Transferir las moscas a un vial de alimentos frescos y utilizar un cepillo humedecido pluma fina para transferir alrededor de 50 huevos sobre la cinta adhesiva de doble cara en el portaobjetos con una cantidad adecuada de líquido para permitir que los huevos que se extendió a cabo. Cuando el líquido se haya evaporado los huevos se adhieren a la cinta.
- Bajo un microscopio de disección toque los huevos varias veces a lo largo de su eje longitudinal utilizando el lado exterior de una media de un par de pinzas suavemente hasta el corion es rota y abierta, pero deja el embrión en el anclaiones de depósito para evitar una rápida deshidratación. Continuar este proceso hasta 10-20 de los huevos ha sido tratado (dependiendo del número de los huevos necesarios para un solo experimento).
- Los embriones puede entonces ser recogidos y retirados de la cáscara corion y coloca suavemente sobre la tira de pegamento una por una. Los huevos pueden ser colocados y alineados ya sea con el lado largo del paralelo embrión o anti-paralelo al lado largo de la tira de pegamento dependerá de si han de ser microinyectados.
- Los embriones o bien puede ser cubierto inmediatamente con una cantidad apropiada de aceite Voltalef 10S (una mezcla 5:1 de Holocarbon 700 y aceite 27, Sigma) para evitar la desecación adicional para obtener imágenes de inmediato o se colocan en una cámara de desecación durante 3-8 minutos a deshidratar ellos más dependiendo de la humedad del ambiente y el propósito del experimento. Los embriones deshidratados se deben cubrir con aceite de 10S, cuando proceda, para impedir el exceso de deshidratación si la microinyección se requiere. (Ver Figura. 2C, DY E).
6. Los embriones de imagen
- Imágenes de Time-lapse o individual de embriones vivos se recopilaron mediante un Leica TCS SP2 invertida sistema de microscopía confocal con un HCX PL APO CS 40X 1,25 objetivo de inmersión en aceite (60 u objetivos 100X se puede utilizar también en función del propósito del experimento, la más alta el aumento que se usa la foto más blanqueo se producirá).
- Cuando fluoróforos imágenes múltiples, que se superponen y los espectros son co-expresados en el embrión mismo, cada longitud de onda proteína emisión fluorescente se recogió secuencialmente. Las longitudes de onda de excitación y emisión disponibles en el sistema Leica TCS SP2 son: las buenas prácticas agrarias, λ Ejemplo: 488 nm y λ Em: 500-600 nm. RFP, λ Ejemplo: 543 nm y λ Em: 555-700 nm.
- Una sola imagen se obtuvo comúnmente como un promedio de 2 líneas de exploración con un promedio de 2 marco de exploraciones. Esto requiere un mínimo de 6,3 segundos para escanear una página 512x512imagen Ixel en un modo de exploración simultánea, y segundo 15.44 para un modo de exploración secuencial y produce una buena relación señal-ruido. Estos tiempos deben ser tenidos en cuenta al establecer los plazos para la recolección de la imagen de lapso de tiempo.
- El agujero se fijó normalmente a 1-2 UA (unidad aireado), y la potencia del láser se ajustó al nivel más bajo posible para evitar cualquier fotoblanqueo significativa.
7. Provocar el SAC por microinyección de los embriones con los reactivos adecuados
- Preparar la aguja antes del experimento. Nosotros preferimos tirar de la aguja de capilares de vidrio siliconado (GC-100-10, la Universidad de Harvard), utilizando el flamante / marrón micropipeta extractor (Instrumento de Sutter, Modelo: P-97) con los parámetros: calor = 600, tire = 90, vel = 70 , del = 150.
- Rellene la aguja con 1-2 ml de una concentración apropiada del reactivo en tampón de inyección utilizando una punta fina de carga (20 l lote de Eppendorf: W215818J).
- Monte la aguja en la aguja de hoLDER en el microscopio con el tubo de presión conectado al sistema de control de Eppendorf inyección.
- Encontrar un embrión bajo el objetivo 40X y encontrar la sombra aguja sin cambiar el plano focal moviendo la aguja en el centro del campo de visión y gradualmente bajando hasta el plano focal derecha.
- Mueva el embrión lejos suavemente para encontrar el pequeño cuadrado de la cubreobjetos roto pre-montado en un extremo de la tira de pegamento. Con mucho cuidado retire la punta de la aguja hasta que llegue al borde del cubreobjetos pequeña plaza y rompe suavemente abrirla.
- Mueva los embriones de nuevo en la vista y seleccionar el embrión de la edad adecuada para la inyección. Normalmente me inyecte el embrión en el ciclo de división nuclear en el 5-7 ya que esto es antes de migrar hacia el exterior del núcleo a la corteza. Las etapas del ciclo de división nuclear puede ser determinada por un análisis rápido de las señales fluorescentes de la GFP-Cdc20 o la señal nuclear de la RFP-2B histona antes de la inyección 9.
- Cuidadosamente mueva la Embryo cerca de la aguja y reajustar el plano focal, tanto para el embrión y la aguja. Mueva el embrión en la aguja e inyectar una gota del reactivo en la posición deseada y mover el embrión de distancia (o siga las instrucciones para el sistema de microinyección). El embrión puede ser inyectado desde su posterior o desde el lado dependiendo de la finalidad del experimento.
- Una vez inyectado el embrión está listo para ser reflejado en el momento apropiado. (Ver Figura 2F & G)
8. Los resultados representativos
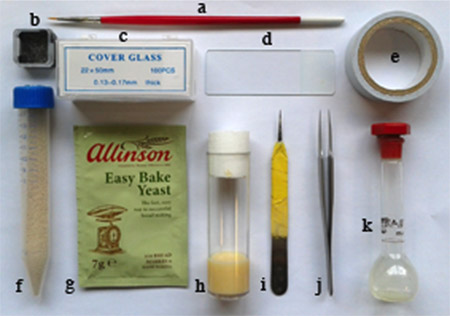
Figura 1. Materiales necesarios: a. cepillo de pluma fina, b. plazoleta de contenedores rotos los vidrios, c. 22 x 50 mm cubreobjetos, d. portaobjetos de microscopio, e. cinta de doble cara adhesiva, f. levadura en polvo seco en tubo de ensayo con los orificios en la tapa, g. levaduragránulos utilizados para el mantenimiento de la mosca, h. volar vial alimentos, i. un medio de unas pinzas utilizadas para los embriones dechorionate, j. unas pinzas par, k. heptano pegamento recipiente de líquido (matraz aforado).

Figura 2. Los diagramas muestran la preparación de los cubreobjetos y diapositivas en el paso 4, dechorionation embrión en el paso 5 y los preparativos para la microinyección de agujas en el paso 7. Una. La imagen superior muestra un cubre con una tira de pegamento heptano a través de su centro y un pequeño cuadrado de un cubreobjetos roto pegado a un extremo. La imagen inferior muestra un portaobjetos de microscopio con una delgada capa de agua en sus cuatro esquinas para sostener un cubreobjetos. La razón para usar una diapositiva para mantener el cubreobjetos es mantener aproximadamente la misma distancia focal que la que se encuentra cuando se tiene cinta de doble cara en las diapositivas y así evitar la reorientación del microscopio mientras are disección y la transferencia de los embriones entre la cinta y el cubreobjetos. B. Una diapositiva con una longitud corta de cinta adhesiva de doble cara aplicarse antes de despegar el papel de la cubierta utilizada para dechorionating el embrión. C. La imagen de la izquierda muestra los embriones con conchas de corion intactos marcados con extremos anterior y posterior, la imagen de la derecha muestra los embriones en las conchas rotas corion antes de que fueran transferidos en el cubreobjetos con la tira de cola de D & E diagramas que muestran dos.. maneras de transferir, la colocación y la alineación de los embriones dechorionated en tiras de pegamento. Los embriones fueron cubiertos por aceite 10S después de un período de desecación adecuada. Diagramas F y G. que muestran cómo se abre la punta de la aguja y la posición de modo como para inyectar.
Las imágenes individuales o lapso de tiempo obtenidos de los experimentos descritos anteriormente pueden ser directamente analizados mediante el software Leica o se guardan en los archivos TIF como un proceso abierto fodisponibles para la cuantificación más o análisis con otros programas de edición comunes de análisis de imagen como la imagen J, Photoshop y MetaMorph etc Dos ejemplos para ilustrar este rmat se discuten a continuación:
Ejemplo 1: Una película de lapso de tiempo (Figura 3) muestra la dinámica de contratación cinetocoro GFP-Cdc20 y el movimiento de los cromosomas en los embriones vivos Drosophila sincicial. La región de interés por parte de las imágenes originales de la secuencia de time-lapse se determinó / editar y convertir por lotes automatizado utilizando el software Photoshop. La película fue ensamblada utilizando el software QuickTime.
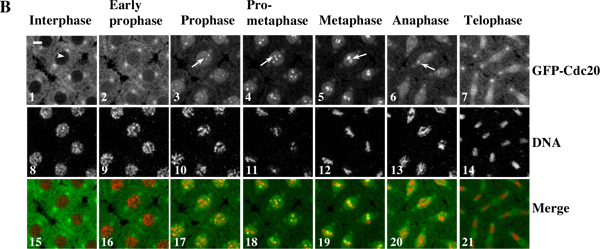
Figura 3. Una película de lapso de tiempo muestra la dinámica de contratación cinetocoro GFP-Cdc20 y el movimiento de los cromosomas en los embriones vivos Drosophila sincicial. (A) Time-lapse imágenes fueron tomadas de un embrión transgénico sincitial co-expresión de GFP-Cdc20 (en verde)y el PP-2B histona (en rojo) las proteínas de fusión y se registraron con una Leica TCS SP2 confocal sistema a 18 ° C durante los ciclos de la división nuclear 8.7. Los marcos fueron tomadas cada 10 segundos. El marco con las células que ya están en la profase se trata como el punto cero del tiempo 10. Haga clic aquí para ver la película de la figura 3A . (B) las buenas prácticas agrarias-Cdc20 se puede observar fácilmente en la profase y prometafase cinetocoros (B3 y 4, flechas blancas) y persiste en la metafase y anafase cinetocoros (B5 y 6, flechas blancas). GFP-Cdc20 se excluye de la interfase núcleo (punta de flecha blanca), en el núcleo por la profase temprana. Morfologías cromatina se determinaron utilizando co-expresó His2BmRFP como marcadores (B8-14). Barras = 5 mm.
Ejemplo 2: Las funciones del SAC puede ser estudiado mediante la manipulación de los embriones por los anticuerpos, proteínas microinyección de la etiqueta fluorescente o Chemical compuestos de interés que potencialmente dar lugar a la SAC. Por ejemplo colchicina inyección para despolimerizar los microtúbulos así provocar la SAC como se indica en la Figura 4 10.
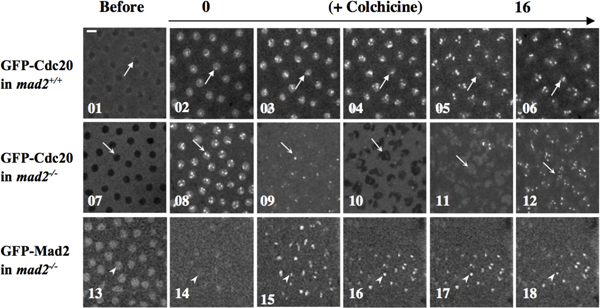
Figura 4. Mad2 es esencial para la colchicina invocada por la función SAC 10. GFP-Cdc20, MAD2 + / +, GFP-Cdc20, MAD2 EY (MAD2 - / - mutante nulo) y las buenas prácticas agrarias MAD2; MAD2 EY embriones fueron tratados con colchicina por microinyección. Time-lapse confocal de imágenes fueron tomadas antes (01, 07 y 13) o después de la inyección (02-06, 08-12, paneles superiores, los paneles centrales, 14-18, paneles inferiores). GFP-Cdc20 (paneles superiores y medios) o GFP-Mad2 (panel inferior) señales kinetochore fueron utilizados como marcadores de progresión del ciclo celular. El panel superior, las flechas indican los cinetocoros detenidos en 02-06. El área marcada por una flecha en 01 indica que antes del tratamiento con colchicina, GFP-CDC20 está excluido del núcleo en interfase tarde. Panel central, en ausencia de endógeno Mad2, GFP-Cdc20 señales siguen a oscilar dentro y fuera del núcleo, y dentro y fuera de los cinetocoros, aunque citocinesis parece ser defectuoso, como se esperaría en embriones que carecen de los microtúbulos, en presencia de colchicina (indicado por flechas en 07-12) que sugiere una función SAC fallado en la detención de las células en respuesta al tratamiento colchicina. La separación de núcleo hijo no en la foto 10. Panel inferior, puntas de flecha en 14-18 indican cinetocoros arrestados junto con las buenas prácticas agrarias MAD2 acumulada proteínas de fusión para sugerir la GFP-funcional Mad2 en el rescate del fenotipo defecto de SAC en Mad2 embrión mutante. Punta de flecha en el 13 indica las buenas prácticas agrarias Mad2 acumulación en un núcleo en interfase tarde. Bar = 5 mm. Los embriones se microinyectaron con ~ volumen del huevo 1% de una solución stock de colchicina 100mg/ml en 1 x PBS.
Discusión
El protocolo se describe aquí es un método genérico para obtener imágenes de volar embriones sincitiales utilizando una Leica TCS SP2 microscopio confocal de barrido láser y puede ser modificado para adaptarse a otros sistemas de microscopio y también se puede adaptar para estudiar otras funciones de genes utilizando embriones de Drosophila sincitiales. Hemos utilizado este protocolo para estudiar muchos aspectos del puesto de control conjunto del eje, la dinámica de proteínas y la proteólisis de proteínas utilizando moscas transgénicas o anticuerpos policlonales para visualizar la localización de la proteína en muestras de vida o fijo 4,6,12-14.
Lo más simple es mantener a las moscas en los alimentos frescos viales mosca en la recogida de pequeñas cantidades (~ 10 - 100) de los huevos. Esto reduce la molestia de hacer y la preparación de manzanas adicionales placas de agar jugo y las cámaras de recolección de huevos como se ha descrito en otras publicaciones 15,16. La adición de un pequeño cuadrado de vidrio cubreobjetos rota en un extremo de la tira de pegamento sobre el cubreobjetos hace mucho más fácilpara abrir la aguja y determinar el volumen de inyección mediante el ajuste de la configuración del sistema de microinyección, mientras que la aguja se sumerge en el aceite de 10S. El grado de desecación del embrión es importante para el éxito de la inyección para evitar fugas y mantener la viabilidad embriones especialmente para aquellos experimentos que requieren un largo período de tiempo o cuando elevar transformantes después de la inyección. Sin embargo, no existe una regla de oro para exactamente el tiempo desecación se requiere. Esto varía de experimento a experimento y depende de la cantidad de la solución inyectada y la humedad del ambiente de trabajo.
Las funciones de una proteína específica de interés pueden ser manipulados por microinyección de inhibidores específicos de la proteína, mono o poli-clonales anticuerpos contra una proteína específica, el ARN mensajero o péptidos marcados con fluorescencia en fondos de tipo salvaje o de mutación genética. Muchas de estas líneas mutantes o GFP-etiquetados líneas transgénicas son públicamente avhay una disponible de Drosophila centros de población y la mayoría de ellos están listados en Flybase ( http://flybase.org/~~V ) y se pueden buscar en línea.
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Este protocolo fue desarrollado gracias a una subvención del Wellcome Trust. Agradecemos a la Sra. Maureen Sinclair para el mantenimiento de las poblaciones de moscas y preparar la comida con mosca en los últimos años. También nos gustaría dar las gracias al Sr. Michael Aitchison por su ayuda y apoyo técnico en el desarrollo de este protocolo.
Materiales
Equipo esencial y reactivos:
Sistema de imagen confocal: El sistema de imagen se describe en este protocolo es una Leica TCS SP2 de escaneo láser confocal sistema de microscopio invertido. El método descrito es también adecuado tal vez con algunas modificaciones menores para otros sistemas de imagen.
Microscopio de disección: Utilizamos un SZX7 Olympus con DF PLAPO 1X-4 de la lente.
Aguja extractor: Flaming / marrón micropipeta extractor (Instrumento de Sutter, Modelo: P-97).
Sistema de microinyección: Un sistema de microinyección Eppendorf se describe pero cualquier otro sistema apropiado puede ser utilizado.
Fly distribuidor de alimentos: Jencons Scientific Ltd bomba peristáltica.
Reactivos:
| Name | Company | Catalog Number | Comments |
| Ingredientes | Pesos | Recursos | Lote N º |
| La harina de maíz | 100,0 g | SUMA, el Reino Unido | |
| El azúcar moreno | 50,0 g | Billington, Reino Unido | |
| La levadura seca | 25,0 g | DCL LEVADURA Ltd. del Reino Unido | |
| Agar | 12,5 g | Fisher Scientific | 106556 |
| El ácido sórbico | 0,4 g | BDH, VWR International Ltd. del Reino Unido | 8829310 |
| El ácido benzoico | 2,9 g | Fisher Scientific | 1019599 |
| Nipagin (Metil-4-Hydro xybenzoate) | 0,9 g | BDH, VWR International Ltd. del Reino Unido | K35969015 |
| H 2 O hasta 1 litro | |||
Holocarbon 700 y 27 aceites comprados en Sigma.
De levadura seca: Allison Thomas, del Reino Unido.
Preparación de la cola de heptano: Tomar alrededor de 1,5 metros de cinta adhesiva de doble cara, lo puso en un tubo de 15 ml Falcon con 5 ml de heptano y gire durante 3-5 horas o toda la noche. Después de ese tiempo se dividió en 4 partes alícuotas iguales en tubos de 1,5 ml de centrífuga eppendorf y centrifugar durante 5 minutos a una velocidad rápida en una centrífuga de mesa para eliminar los residuos. Guarde la solución del pegamento heptano en un matraz aforado de 10 ml y guardar para su uso. La fuerza pegamento variará de acuerdo con la concentración y las cantidades de la cola utilizada. Normalmente, la cola más fina produce menos fondo ruidoso cuando se escanea con un microscopio confocal.
- Cubreobjetos: BDH, VWR International Ltd. del Reino Unido
- Portaobjetos de microscopio: BDH, VWR International Ltd. del Reino Unido
- Capilares de vidrio siliconizado: GC-100-10, la Universidad de Harvard
- Punta de carga Fina: 20ul muchos eppendorf: W215818J
- Pinzas
- Cepillo de pluma fina
Referencias
- Holland, A. J., Cleveland, D. W. Boveri revisited: chromosomal instability, aneuploidy and tumorigenesis. Nat. Rev. Mol. Cell Biol. 10, 478-4787 (2009).
- Zekanowski, C., Wojda, U. Aneuploidy, chromosomal missegregation, and cell cycle reentry in Alzheimer's disease. Acta Neurobiol. Exp. (Wars). 69, 232-253 (2009).
- Buffin, E., Emre, D., Karess, R. E. Flies without a spindle checkpoint. Nat. Cell Biol. 9, 565-572 (2007).
- Tang, Z., Shu, H., Oncel, D., Chen, S., Yu, H. Phosphorylation of Cdc20 by Bub1 provides a catalytic mechanism for APC/C inhibition by the spindle checkpoint. Mol. Cell. 16, 387-397 (2004).
- Huang, J., Raff, J. W. The disappearance of cyclin B at the end of mitosis is regulated spatially in Drosophila cells. EMBO Journal. 18, 2184-2195 (1999).
- Xia, G. Conformation-specific binding of p31(comet) antagonizes the function of Mad2 in the spindle checkpoint. Embo. J. 23, 3133-3143 (2004).
- Lorca, T. Fizzy is required for activation of the APC/cyclosome in Xenopus egg extracts. Embo. J. 17, 3565-3575 (1998).
- Howell, B. J. Cytoplasmic dynein/dynactin drives kinetochore protein transport to the spindle poles and has a role in mitotic spindle checkpoint inactivation. J. Cell Biol. 155, 1159-1172 (2001).
- Foe, V. E., Alberts, B. M. Studies of nuclear and cytoplasmic behaviour during the five mitotic cycles that precede gastrulation in Drosophila embryogenesis. Journal of cell science. 61, 31-70 (1983).
- Li, D., Morley, G., Whitaker, M., Huang, J. Y. Recruitment of Cdc20 to the kinetochore requires BubR1 but not Mad2 in Drosophila melanogaster. Mol. Cell Biol. 30, 3384-3395 (2010).
- Karess, R. E., Glover, D. P element mediated germ line transformation of Drosophila. DNA cloning: A practical approach. 2, 121-141 (1985).
- Wakefield, J. G., Huang, J. Y., Raff, J. W. Centrosomes have a role in regulating the destruction of cyclin B in early Drosophila embryos. Current Biology. 10, 1367-1370 (2000).
- Huang, J. Y., Raff, J. W. The dynamic localisation of the Drosophila APC/C: evidence for the existence of multiple complexes that perform distinct functions and are differentially localised. Journal of Cell Science. 115, 2847-2856 (2002).
- Raff, J. W., Jeffers, K., Huang, J. Y. The roles of Fzy/Cdc20 and Fzr/Cdh1 in regulating the destruction of cyclin B in space and time. Journal of Cell Biology. 157, 1139-1149 (2002).
- Brust-Mascher, I., Scholey, J. M. Microinjection Techniques for Studying Mitosis in the Drosophila melanogaster Syncytial Embryo. J. Vis. Exp. (31), e1382 (2009).
- Figard, L., Sokac, A. M. Imaging Cell Shape Change in Living Drosophila Embryos. J. Vis. Exp. (49), e2503 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados