Method Article
Etudier Checkpoint mitotique en illustrant le comportement dynamique des protéines Kinetochore et Motion chromosomique chez Vivre
Dans cet article
Résumé
Le kinétochore est où le SAC lance son signal de contrôle de la ségrégation mitotique des chromatides sœurs. Une méthode est décrite pour visualiser le recrutement et le roulement de l'une des protéines du kinétochore et sa coordination avec le mouvement des chromosomes dans les Drosophila Embryons en utilisant un système laser à balayage Leica confocale.
Résumé
L'assemblée checkpoint du fuseau (SAC) mécanisme est un signal actif, qui surveille l'interaction entre les kinétochores des chromosomes et les microtubules broche pour prévenir l'apparition anaphase jusqu'à ce que les chromosomes sont correctement connectés. Les cellules utilisent ce mécanisme pour éviter une instabilité génomique aneuploïdie ou, et, partant, les cancers et autres maladies humaines telles que des malformations congénitales et la maladie d'Alzheimer 1. Un certain nombre des composantes du CSC comme Mad1, Mad2, BUB1, BUBR1, Bub3, Mps1, Zw10, Rod et la kinase Aurora B ont été identifiés et ils sont tous les protéines du kinétochore dynamiques 2. Les preuves suggèrent que le kinétochore est l'endroit où le signal SAC est initiée. La cible privilégiée SAC réglementaire est Cdc20. Cdc20 est l'un des essentiels APC / C (A naphase P romouvoir C omplex ou C yclosome) activateurs et 3 est également une protéine kinétochore dynamique 4-6. Lorsqu'il est activé, le SAC inhibe l'activité de l'UnPC / C pour empêcher la destruction de deux substrats clés, la cycline B et securin, empêchant ainsi la métaphase anaphase de transition 7,8. Exactement comment le signal SAC est initié et monté sur les kinétochores et relayé sur le APC / C pour inhiber sa fonction reste encore difficile à atteindre.
Drosophile est un système extrêmement souple expérimentale; un organisme beaucoup plus simple et mieux compris par rapport à l'humain, mais celui qui partage les processus fondamentaux en commun. Il est, peut-être, l'un des meilleurs organismes à utiliser pour la bio-imagerie des études dans les cellules vivantes, en particulier pour la visualisation des événements mitotiques dans l'espace et le temps, comme l'embryon précoce passe par 13 rapides cycles de division nucléaire de façon synchrone (8-10 minutes pour chaque cycle de moins 25 ° C) et organise les noyaux progressivement dans une seule monocouche juste en dessous du cortex 9.
Ici, je présente une méthode de bio-imagerie à l'aide transgénique expression chez la drosophilechanter la GFP (Green Fluorescent Protein) ou ses variantes ciblées des protéines d'intérêt et un Leica TCS SP2 confocale système laser microscope à balayage pour étudier la fonction SAC chez les mouches, en montrant des images de protéines de fusion GFP de certaines des composantes du SAC, Cdc20 et Mad2 , comme par exemple l'.
Protocole
1. Les mouches transgéniques et de maintenance
- Le mouches transgéniques utilisées dans cette démonstration: UBQ-gfp-Cdc20 (II), UBQ-DP-His2B (X *); UBQ-gfp-Cdc20 (II *), UBQ-gfp-Cdc20 (II *); MAD2 EY ( III *) et UBQ-GFP-Cdc20 mouches transgéniques ont été générées précédemment dans le laboratoire par l'intermédiaire d'une approche médié par la P-élément standard transgénique 10,11 et UBQ-DP-His2B est un cadeau unique à partir Yohanns Belaiche à l'UMR 144 CNRS / Institut Curie, Paris, France. Ils ont été introduits dans un fond Mad2 mutant via le standard génétique de la Drosophile. Le MAD2 EY lignée mutante originale a été acheté à partir du centre Bloomington stock. Nous n'allons pas discuter de la procédure utilisée pour remonter les transformants dans ce protocole.
Note: * représente le nombre de chromosomes. - Entretien: les mouches transgéniques ont été maintenues à 25 ° C dans des flacons en plastique containing voler la nourriture et avec de la poudre de levure sèche supplémentaire sur le dessus. Le flacon a été systématiquement remplacé tous les 3-4 semaines en fonction des conditions de croissance (figure 1).
2. Fly Préparation des aliments (échelle de laboratoire)
- Une quantité appropriée du mélange des aliments à la mouche a été chauffé avec agitation constante pour dissoudre les composants.
- À propos de 8-10 ml de ce milieu a été distribué sous forme de boue dans chaque flacon en plastique (2,5 cm de diamètre x longueur de 8 cm) en utilisant un Jencons Scientific Ltd pompe péristaltique.
- Lorsque la bouillie alimentaire a été fixé et a refroidi à température ambiante, le flacon est ensuite bouché avec un bouchon de mousse de coton. Ces flacons sont les aliments placés dans un plateau qui est ensuite scellée dans un sac en plastique et conservés à 4 ° C pour une utilisation ultérieure.
3. Collection d'oeufs à petite échelle
- Environ 50 paires de 2-3 mouches de jour pour adultes anciens ont été transférés dans un flacon de nourriture volée frais fourni avec de la poudre de levure sèche supplémentaire sur sa surface à 25 ° C pour les laïcsIng embryons.
- Les mouches sont ensuite transférés à un nouveau flacon à chaque heure et de laisser les embryons dans le flacon pendant 30 minutes afin d'assurer une partie des embryons collectés sont âgés d'environ 8-10 nucléaires cycle de division lorsque les noyaux sont progressivement migrer vers le cortex et organisée comme un monocouche. La collection première heure est normalement mis au rebut car elle contient souvent des embryons âgés qui ont été retenues dans les corps féminins lorsque les conditions ne se prêtaient pas à la ponte.
4. Préparation Lamelles et Diapositives
- Prenez une lamelle de 50 x 22 mm et légèrement humide de ses quatre coins d'un côté avec une très petite quantité d'eau à l'aide d'un pinceau stylo humide amende et le mettre sur une lame de microscope de telle sorte que la lamelle ne se déplace pas en raison de la tension de surface capillaire causé par le film liquide mince.
- Appliquer une fine bande de colle heptane à travers le milieu de la lamelle, l'heptane doit s'évaporer en quelques secondes pour laisser la colle sur la lamelle.
- Coupez une autre lamelle avec un stylo de diamants en petits carrés (~ 1,5 mm 2), ramasser un et placez-le sur un bout de la bande de colle (ce qui est utilisé pour ouvrir le bout de l'aiguille lors de la micro-injection est nécessaire) et sauver les autres pour l'avenir utiliser.
- Prenez une autre lame de microscope et coller un morceau de ruban adhésif double face collante environ 2 cm de long pour le et retirez le papier de couverture. (Voir Figure 2A et B).
5. Embryons Dechorionate
- Transférer les mouches dans un flacon de nourriture fraîche et utilisez une brosse plume humectée amende de transférer environ 50 œufs sur le ruban adhésif double face collante sur la diapositive avec une quantité appropriée de liquide pour permettre aux oeufs à étaler. Lorsque le liquide s'est évaporé des oeufs en tiendrons à la bande.
- Sous une touche loupe binoculaire les œufs plusieurs fois le long de leur axe longitudinal à l'aide du côté extérieur de la moitié d'une paire de pinces à épiler en douceur jusqu'à la chorion est brisé et ouvert, mais laisser l'embryon dans le chorions shell pour prévenir la déshydratation rapide. Continuer ce processus jusqu'à 10-20 de la oeufs a été traitée (en fonction du nombre des œufs requis pour une expérience unique).
- Les embryons peuvent alors être ramassé et éliminé de la coquille chorion et posa doucement sur la bande de colle, un par un. Les oeufs peut être placé et aligné avec l'autre côté long de l'embryon ou parallèlement anti-parallèle au côté long de la bande de colle dépendent s'ils doivent être microinjectées.
- Les embryons peuvent être immédiatement recouvert d'une quantité appropriée de Voltalef 10S huile (un mélange 5:1 de l'huile halocarbures 700 et 27 l'huile, Sigma) pour éviter la dessiccation en outre pour l'imagerie immédiate ou placé dans une chambre de dessiccation pendant 3-8 minutes à les déshydrater en outre en fonction de l'humidité de la chambre et le but de l'expérience. Les embryons déshydratés devraient être couverts avec de l'huile 10S, le cas échéant pour éviter une sur-la déshydratation si la micro-injection est nécessaire. (Voir Figure. 2C, D& E).
6. Les embryons d'imagerie
- Images time-lapse ou simple d'embryons vivants sont recueillies en utilisant un Leica TCS SP2 système inversé microscopie confocale avec un HCX PL CS APO 40X 1,25 objectif à immersion d'huile (60 ou objectifs 100X peut être utilisé aussi en fonction du but de l'expérience, le plus élevé le grossissement utilisé le plus de photos de blanchiment se produit).
- Lorsque fluorophores imagerie multiples, qui ont des spectres se chevauchent et sont co-exprimés dans la même embryon, chaque longueur d'onde d'émission protéine fluorescente a été prélevés de manière séquentielle. Les longueurs d'onde d'excitation et d'émission disponibles sur le système Leica TCS SP2 sont les suivantes: GFP, λ Ex: 488 nm et λ Em: 500-600 nm. DP, λ Ex: 543 nm et λ Em: 555-700 nm.
- Une seule image a été souvent obtenu une moyenne de 2 lignes de balayage avec une moyenne de 2 châssis-scans. Cela prend un minimum de 6,3 secondes pour numériser une page 512x512l'image Ixel dans un mode de balayage simultané, et 15.44 secondes pour un mode de balayage séquentiel et produit un signal de bon-sur-bruit. Ces temps doivent être prises en compte lors de la mise en place des échéanciers pour la collecte d'image time-lapse.
- Le sténopé est normalement fixé à 1-2 UA (unité aérienne), et la puissance du laser a été ajusté à son plus bas niveau possible afin d'éviter toute photoblanchiment significative.
7. Provoquer la SAC par micro-injection des embryons avec des réactifs appropriés
- Préparer l'aiguille avant l'expérience. Nous préférons pour tirer l'aiguille de capillaires en verre siliconé (GC-100-10, Harvard) en utilisant la flamme / brun micropipette extracteur (Instrument Sutter, Modèle: P-97) avec des paramètres: la chaleur = 600, tirez = 90, vel = 70 , del = 150.
- Remblayer l'aiguille avec 1-2 ml d'une concentration appropriée du réactif dans un tampon d'injection en utilisant une pointe de chargement fine (20 pi beaucoup Eppendorf: W215818J).
- Montez l'aiguille dans le ho aiguillelder sur le microscope avec le tuyau de pression raccordé au système de commande d'injection Eppendorf.
- Trouver un embryon dans le but 40X et trouver l'ombre d'aiguille sans changer le plan focal en déplaçant l'aiguille dans le centre du champ de vue et de l'abaisser progressivement au plan focal droit.
- Déplacez l'embryon de suite en douceur pour trouver le petit carré de la lamelle brisée pré-monté à une extrémité de la bande de colle. Très doucement déplacer le bout de l'aiguille jusqu'à ce qu'elle atteigne le bord de la lamelle petit carré et se casse en douceur de l'ouvrir.
- Déplacez les embryons de retour en vue et sélectionner l'embryon de l'âge pour l'injection. Je normalement injecter l'embryon au cycle de la division nucléaire à 5-7 car c'est avant les noyaux migrent vers l'extérieur pour le cortex. Les étapes nucléaires cycle de division peut être déterminée par une analyse rapide des signaux fluorescents de la GFP-Cdc20 ou le signal nucléaire de la 2B DP-Histone avant l'injection 9.
- Déplacer délicatement la Embryo près de l'aiguille et de réajuster le plan focal à la fois pour l'embryon et l'aiguille. Déplacez l'embryon dans l'aiguille et injecter une goutte de réactif dans la position désirée et déplacer l'embryon de suite (ou suivez les instructions pour le système de micro-injection). L'embryon peut être injecté à partir de son postérieur ou du côté en fonction du but de l'expérience.
- Une fois injecté l'embryon est prêt à être visualisé en temps opportun. (Voir Figure 2F & G)
8. Les résultats représentatifs
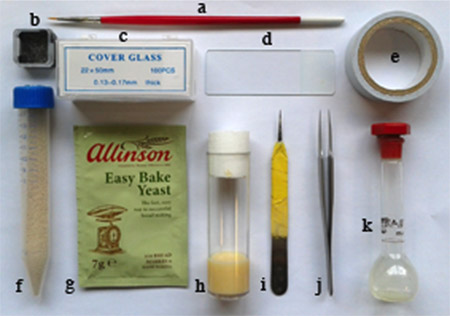
Figure 1. Matériel requis: a. brosse plume fine, b. petit carré cassé verres contenant, c. 22 x 50 mm lamelle, d. lame de microscope, e. ruban adhésif double face collante, f. Poudre sèche de levure dans le tube d'essai avec les trous sur le couvercle, g. levureGranule utilisé pour la maintenance mouche, h. voler flacon alimentaire, i. une moitié d'un pinces utilisées pour les embryons dechorionate, j. des brucelles paire, k. contenant heptane liquide colle (fiole jaugée).

Figure 2. Les diagrammes montrent la préparation des lamelles et des diapositives à l'étape 4, dechorionation embryon à l'étape 5 et les préparations de seringues pour la micro-injection dans l'étape 7. Une. L'image du haut montre une lamelle avec une bande de colle heptane à travers son milieu et un petit carré d'une lamelle brisée collée à une extrémité. L'image du bas montre une lame de microscope avec une mince couche d'eau à ses quatre coins de tenir une lamelle. La raison pour utiliser une lame de tenir la lamelle est de garder à peu près la même distance focale que celle trouvée lorsque vous avez un adhésif double face sur les toboggans et évitant ainsi de recentrer le microscope pendant que vous are dissection et le transfert des embryons entre la bande et la lamelle. B. Une diapositive avec une courte longueur de scotch double-face appliqué avant se décolle de son papier de couverture utilisés pour dechorionating l'embryon. C. L'image de gauche montre des embryons avec des coquilles intactes chorion avec marqués extrémités antérieure et postérieure; l'image de droite montre les embryons dans les coquilles brisées chorion avant qu'ils ont été transférés sur la lamelle avec la bande de colle D & E diagrammes montrant deux.. des moyens pour transférer, en plaçant et en alignant les embryons dechorionated sur bandes de colle. Les embryons ont été couverts par de l'huile 10S après une période de dessiccation appropriée. Diagrammes F et G. montrant comment ouvrir la pointe de l'aiguille et la position qu'il manière à injecter.
Images simples ou time-lapse obtenus à partir des expériences décrites ci-dessus peuvent être directement analysées à l'aide du logiciel Leica ou sauvegardées dans des fichiers TIF. Tant que société ouverte fodisponibles pour la quantification supplémentaire ou des analyses d'édition en utilisant d'autres programmes communs d'analyse d'images telles que Image J, Photoshop et MetaMorph etc Deux exemples pour illustrer ce RMAT sont discutés ci-dessous:
Exemple 1: Un film time-lapse (figure 3) montre le recrutement kinétochore dynamique de la GFP-Cdc20 et le mouvement des chromosomes des embryons vivants chez la drosophile syncytial. La région d'intérêt à partir des images originales de séquences time-lapse est déterminée / édité et automatisé par lots convertis en utilisant le logiciel Photoshop. Le film a été assemblé à l'aide du logiciel QuickTime.
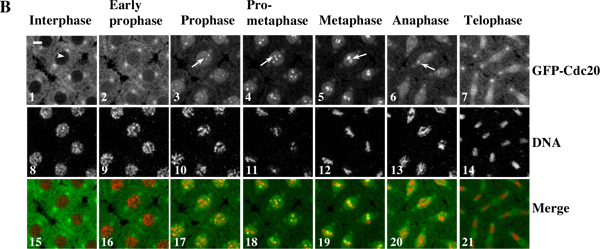
Figure 3. Un film en accéléré montre le recrutement kinétochore dynamique de la GFP-Cdc20 et le mouvement des chromosomes des embryons vivants chez la drosophile syncytial. (A) time-lapse images ont été prises à partir d'un embryon transgénique syncytial co-exprimant GFP-Cdc20 (en vert)et DP-Histone 2B (en rouge) et des protéines de fusion ont été enregistrés en utilisant un Leica TCS SP2 système confocal à 18 ° C pendant les cycles de la division nucléaire 7-8. Cadres ont été prises toutes les 10 secondes. Le cadre avec les cellules déjà en prophase est considéré comme le point de temps zéro 10. Cliquez ici pour voir le film pour la figure 3A . (B)-GFP Cdc20 peut être facilement observée sur la prophase et prométaphase kinétochores (B3 & 4, flèches blanches) et persiste sur la métaphase et anaphase kinétochores (B5 et 6, flèches blanches). GFP-Cdc20 est exclu de l'interphase noyau (Tête de flèche blanche), entrer dans le noyau par prophase précoce. Morphologies chromatine ont été déterminés en utilisant la co-exprimée His2BmRFP en tant que marqueurs (B8-14). Barres = 5mm.
Exemple 2: fonctions SAC peut être étudiée par la manipulation des embryons par des anticorps, des protéines micro-injection marquées par fluorescence ou chemicacomposés de l 'intérêt qui pourraient déclencher le sac. Pour la colchicine par exemple l'injection de dépolymériser les microtubules afin de provoquer la SAC comme indiqué dans la figure 4 10.
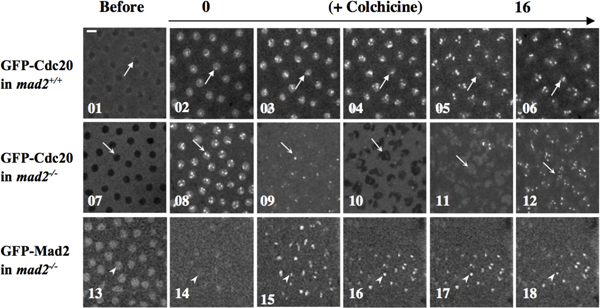
Figure 4. Mad2 est essentielle pour la colchicine invoqué SAC fonction 10. gfp-Cdc20; MAD2 + / +, GFP-Cdc20; MAD2 EY (MAD2 - / - mutant nul) et gfp-MAD2; MAD2 embryons EY ont été traités à la colchicine par microinjection. Time-lapse images confocales ont été prises avant (01, 07 & 13) ou après l'injection (02-06, 08-12; panneaux supérieurs, des panneaux intermédiaires, les 14-18, les panneaux de fond). GFP-Cdc20 (panneaux du haut et du milieu) ou GFP-Mad2 (panneau inférieur) signaux kinétochore ont été utilisés comme marqueurs du cycle cellulaire de progression. Le panneau supérieur, les flèches indiquent les kinétochores arrêtés en 02-06. La zone marquée par une flèche dans 01 indique que, avant traitement par la colchicine, la GFP-CDC20 est exclue du noyau d'interphase fin. Panneau central, en l'absence de Mad2 endogène, GFP-Cdc20 signaux continuer à osciller dans et hors du noyau, et sur et hors des kinétochores, bien que la cytokinèse semble être défectueuse, comme on pouvait s'y attendre dans des embryons de défaut microtubules, en présence de la colchicine (indiqué par des flèches dans 07 à 12), suggérant une fonction SAC a échoué à arrêter les cellules en réponse à un traitement de colchicine. Séparation du noyau fille ne dans l'image 10. Panneau inférieur, pointes de flèches en 14-18 indiquent kinétochores arrêtés avec la GFP-MAD2 accumulée protéines de fusion pour suggérer la fonctionnelle GFP-Mad2 dans le sauvetage du phénotype défaut SAC en Mad2 embryon mutant. Arrowhead dans 13 indique GFP-Mad2 accumulation dans un noyau interphasique tard. Bar = 5mm. Les embryons ont été micro-injecté avec ~ volume des oeufs 1% d'une solution stock colchicine 100mg/ml dans du 1 x PBS.
Discussion
Le protocole décrit ici est une méthode générique pour l'imagerie voler embryons syncytial l'aide d'un microscope Leica TCS SP2 confocale à balayage laser et peuvent être modifiés pour les adapter aux systèmes de microscope autres et peut également être adapté pour étudier les fonctions des gènes d'autres en utilisant des embryons de drosophile syncytial. Nous avons utilisé ce protocole pour étudier de nombreux aspects du poste de contrôle l'assemblage du fuseau, la dynamique des protéines et la protéolyse des protéines en utilisant des mouches transgéniques ou des anticorps polyclonaux de visualiser la localisation des protéines dans des échantillons vivants ou fixe 4,6,12-14.
Il est plus simple pour éloigner les mouches dans les frais flacons alimentaires mouche lors de la collecte de petits nombres (~ 10 - 100) d'œufs. Cela réduit les tracas de la fabrication et la préparation des plaques supplémentaires de pommes de gélose de jus et les chambres de collecte d'œufs, comme décrit dans d'autres publications 15,16. L'ajout d'un petit carré de verre brisé la lamelle à une extrémité de la bande de colle sur la lamelle, il est beaucoup plus facilepour ouvrir l'aiguille et de déterminer le volume d'injection en ajustant les paramètres du système de microinjection tandis que l'aiguille est l'immersion dans l'huile 10S. Le degré de dessiccation de l'embryon est important pour le succès de l'injection pour éviter les fuites et le maintien de la viabilité des embryons en particulier pour les expériences qui nécessitent une longue période de temps ou en soulevant des transformants après l'injection. Cependant, il n'ya pas de règle d'or pour exactement combien de temps la dessiccation est nécessaire. Cela varie d'une expérience à et dépend de la quantité de la solution injectée et l'humidité de l'environnement de travail.
Les fonctions d'une protéine d'intérêt spécifique peut être manipulé par micro-injection des inhibiteurs spécifiques des protéines, des mono-ou poly-clonales des anticorps contre une protéine spécifique, l'ARN messager ou des peptides marqués par fluorescence sous de type sauvage ou de milieux de mutation génétique. Beaucoup de ces lignées mutantes ou GFP-tagged lignées transgéniques sont publiquement avDISPONIBLES de la drosophile centres de stock et la plupart d'entre eux sont répertoriés sur FlyBase ( http://flybase.org/~~V ) et peuvent être recherchés en ligne.
Déclarations de divulgation
Nous n'avons rien à communiquer.
Remerciements
Ce protocole a été élaboré grâce à une subvention du Wellcome Trust. Nous remercions Mme Maureen Sinclair pour maintenir les stocks de mouches et de la préparation de la nourriture volée au fil des ans. Nous tenons également à remercier M. Michael Aitchison pour son aide et de soutien technique pour l'élaboration de ce protocole.
matériels
L'équipement essentiel et réactifs:
Système d'imagerie confocale: Le système d'imagerie décrite dans ce protocole est un Leica TCS SP2 à balayage laser confocal système microscope inversé. La méthode décrite convient également peut-être avec quelques modifications mineures pour les systèmes d'imagerie.
Microscope à dissection: Nous utilisons un SZX7 Olympus avec DF PLAPO 1X-4 de l'objectif.
Aiguille extracteur: Flaming / brun micropipette extracteur (de l'Instrument Sutter, Modèle: P-97).
Système de micro-injection: Un système de micro-Eppendorf est décrite, mais tout autre système approprié peut être utilisé.
Fly distributeur alimentaire: Jencons Scientific Ltd pompe péristaltique.
Réactifs:
| Name | Company | Catalog Number | Comments |
| Ingrédients | Poidss | Ressources | Lot n o |
| Farine de maïs | 100.0g | SUMA, Royaume-Uni | |
| Le sucre brun | 50.0g | Billington, au Royaume-Uni | |
| La levure sèche | 25.0g | DCL LEVURE UK Ltd | |
| Gélose | 12.5g | Fisher Scientific | 106556 |
| L'acide sorbique | 0.4g | BDH, VWR International Ltd au Royaume-Uni | 8829310 |
| L'acide benzoïque | 2.9g | Fisher Scientific | 1019599 |
| Nipagin (Méthyl-4-Hydro xybenzoate) | 0.9g | BDH, VWR International Ltd au Royaume-Uni | K35969015 |
| H 2 O jusqu'à 1L | |||
Halocarbures 700 et 27 huiles achetées chez Sigma.
La levure sèche: Thomas Allison, du Royaume-Uni.
Préparation de la colle heptane: Prendre environ 1,5 mètres de scotch double-face, le mettre dans un tube de 15ml Falcon avec 5ml d'heptane et faire tourner pendant 3-5 heures ou jusqu'au lendemain. Après ce moment-là divisé en 4 fractions égales dans des tubes eppendorf de 1,5 ml à centrifuger et centrifuger pendant 5 min à une vitesse rapide dans une centrifugeuse de paillasse pour enlever les débris. Stocker la solution de colle heptane dans une fiole jaugée de 10 ml et de garder à l'emploi. La force de la colle varie en fonction de la concentration et les montants de la colle utilisée. Normalement, le plus mince de la colle produit moins de fond bruyant quand balayé par microscope confocal.
- Lamelle: BDH, VWR International Ltd au Royaume-Uni
- Lame de microscope: BDH, VWR International Ltd au Royaume-Uni
- Siliconé capillaires en verre: GC-100-10, Harvard
- Pointe de chargement Fine: 20 pi eppendorf beaucoup: W215818J
- Pince à épiler
- Pinceau fin
Références
- Holland, A. J., Cleveland, D. W. Boveri revisited: chromosomal instability, aneuploidy and tumorigenesis. Nat. Rev. Mol. Cell Biol. 10, 478-4787 (2009).
- Zekanowski, C., Wojda, U. Aneuploidy, chromosomal missegregation, and cell cycle reentry in Alzheimer's disease. Acta Neurobiol. Exp. (Wars). 69, 232-253 (2009).
- Buffin, E., Emre, D., Karess, R. E. Flies without a spindle checkpoint. Nat. Cell Biol. 9, 565-572 (2007).
- Tang, Z., Shu, H., Oncel, D., Chen, S., Yu, H. Phosphorylation of Cdc20 by Bub1 provides a catalytic mechanism for APC/C inhibition by the spindle checkpoint. Mol. Cell. 16, 387-397 (2004).
- Huang, J., Raff, J. W. The disappearance of cyclin B at the end of mitosis is regulated spatially in Drosophila cells. EMBO Journal. 18, 2184-2195 (1999).
- Xia, G. Conformation-specific binding of p31(comet) antagonizes the function of Mad2 in the spindle checkpoint. Embo. J. 23, 3133-3143 (2004).
- Lorca, T. Fizzy is required for activation of the APC/cyclosome in Xenopus egg extracts. Embo. J. 17, 3565-3575 (1998).
- Howell, B. J. Cytoplasmic dynein/dynactin drives kinetochore protein transport to the spindle poles and has a role in mitotic spindle checkpoint inactivation. J. Cell Biol. 155, 1159-1172 (2001).
- Foe, V. E., Alberts, B. M. Studies of nuclear and cytoplasmic behaviour during the five mitotic cycles that precede gastrulation in Drosophila embryogenesis. Journal of cell science. 61, 31-70 (1983).
- Li, D., Morley, G., Whitaker, M., Huang, J. Y. Recruitment of Cdc20 to the kinetochore requires BubR1 but not Mad2 in Drosophila melanogaster. Mol. Cell Biol. 30, 3384-3395 (2010).
- Karess, R. E., Glover, D. P element mediated germ line transformation of Drosophila. DNA cloning: A practical approach. 2, 121-141 (1985).
- Wakefield, J. G., Huang, J. Y., Raff, J. W. Centrosomes have a role in regulating the destruction of cyclin B in early Drosophila embryos. Current Biology. 10, 1367-1370 (2000).
- Huang, J. Y., Raff, J. W. The dynamic localisation of the Drosophila APC/C: evidence for the existence of multiple complexes that perform distinct functions and are differentially localised. Journal of Cell Science. 115, 2847-2856 (2002).
- Raff, J. W., Jeffers, K., Huang, J. Y. The roles of Fzy/Cdc20 and Fzr/Cdh1 in regulating the destruction of cyclin B in space and time. Journal of Cell Biology. 157, 1139-1149 (2002).
- Brust-Mascher, I., Scholey, J. M. Microinjection Techniques for Studying Mitosis in the Drosophila melanogaster Syncytial Embryo. J. Vis. Exp. (31), e1382 (2009).
- Figard, L., Sokac, A. M. Imaging Cell Shape Change in Living Drosophila Embryos. J. Vis. Exp. (49), e2503 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon