Method Article
Изучение митоза Checkpoint, иллюстрируя динамического поведения белков кинетохора и хромосомы движения в живых
В этой статье
Резюме
Кинетохора где SAC инициирует его сигнал контроля митотической сегрегации сестринских хроматид. Описан способ визуализировать набор и оборот одного из кинетохора белков и ее координации с хромосомой движения Drosophila Эмбрионов с использованием лазерного сканирования Leica конфокальной системы.
Аннотация
КПП шпиндельного узла (SAC) механизм активного сигнала, который контролирует взаимодействие между хромосомой кинетохоры и микротрубочки веретена, чтобы предотвратить наступление анафазы до хромосом подключены правильно. Клетки используют этот механизм для предотвращения анеуплоидия или геномной нестабильности и, следовательно, рака и других заболеваний человека, как врожденные пороки и болезни Альцгеймера 1. Число SAC компоненты, такие как Mad1, Mad2, Bub1, BubR1, Bub3, Mps1, Zw10, Род и Aurora B киназы были определены, и все они кинетохора динамический белков 2. Опыт показывает, что кинетохора где сигнал SAC начинается. SAC премьер нормативных цель Cdc20. Cdc20 является одним из основных APC / C (P naphase romoting C или C омплекс yclosome) активаторов 3 и также кинетохора динамические белок 4-6. При активации SAC ингибирует активностьPC / C, чтобы предотвратить разрушение двух ключевых субстратов, циклин B и securin, тем самым предотвращая метафазы к анафазе переход 7,8. Точно, как сигнал SAC инициируется и собран на кинетохоры и передал на APC / C для подавления ее функции по-прежнему остается неуловимым.
Дрозофилы является чрезвычайно послушный экспериментальной системы, гораздо проще и лучше понятных организма по сравнению с человека, кроме одного, который разделяет фундаментальные процессы, в общем. Это, пожалуй, один из лучших организмов для использования био-визуальных исследований в живых клетках, особенно для визуализации событий митоза, в пространстве и времени, так как раннего эмбриона идет по 13 быстрых ядерных циклов деление синхронно (8-10 минут для каждого цикла при 25 ° С) и постепенно организует ядер в одном монослое только под корой 9.
Здесь я представляю био-изображений методом с использованием трансгенных Drosophila выраженияпоют GFP (зеленого флуоресцентного белка) или его вариант-целевых белков интереса и Leica TCS SP2 конфокальной лазерной сканирующей микроскопии для изучения системы SAC функции мух, показывая изображение GFP слитых белков некоторых компонентов ЦОД, Cdc20 и Mad2 , в качестве примера.
протокол
1. Трансгенные мухи и обслуживание
- Трансгенных мух, используемые в этой демонстрации: Ubq-GFP-Cdc20 (II), Ubq-ЗП-His2B (X *); Ubq-GFP-Cdc20 (II *), Ubq-GFP-Cdc20 (II *); mad2 Е.Ю. ( III *) и Ubq-GFP-Cdc20 трансгенных мух ранее созданный в лаборатории с помощью стандартного Р-элемент опосредованного трансгенный подход 10,11 и Ubq-ЗП-His2B это своего рода подарок от Yohanns Belaïche в UMR 144 CNRS / Институт Кюри, Париж, Франция. Они были введены в Mad2 мутант фона с помощью стандартных дрозофилы генетики. Mad2 EY оригинальных мутантов линии было закуплено в Блумингтон фондового центра. Мы не будем обсуждать процедура, используемая для повышения трансформантов в этом протоколе.
Примечание: * представляет собой число хромосом. - Обслуживание: трансгенные мухи были сохранены при 25 ° C в пластиковых флаконах containinг летать питания и дополнительные сухой порошок дрожжи на вершине. Флакон был регулярно менять каждые 3-4 недели в зависимости от условий выращивания (рис. 1).
2. Лети приготовления пищи (Лаборатория шкале)
- Соответствующее количество лету смесь еда нагревается при постоянном помешивании до растворения компонентов.
- О 8-10 мл этой среде был распространен в качестве раствора в каждый пластиковый флакон (диаметром 2,5 см х 8 см длиной) с помощью Jencons научно ООО перистальтического насоса.
- Когда пища суспензия была создана и охлаждают до комнатной температуры, затем флакон подключен с вилкой пена хлопка. Эти продукты флаконы помещаются в лоток, который затем запечатанный в полиэтиленовый пакет и хранить при температуре 4 ° C для дальнейшего использования.
3. Мелкое яйцо коллекции
- Около 50 пар 2-3 дня по старой мухи взрослых были переведены в новый флакон пищу муха снабжена дополнительными сухой порошок дрожжей на поверхности при температуре 25 ° C для мирянв G эмбрионы.
- Мух, которые затем передаются новому флакон каждый час и оставить эмбрионов во флаконе в течение 30 минут, чтобы некоторые из собранных эмбрионы в возрасте 8-10 вокруг ядерной цикл разделения, когда ядра постепенно переходят на кору и организован монослоя. Первая коллекция часов обычно уничтожается, как это часто содержит возраста эмбрионов, которые были сохранены в женских тел, когда условия не подходят для укладки.
4. Подготовка Покровные и слайды
- Возьмите 50 х 22 мм, покровного и слегка смочите ее четырех углов с одной стороны, с очень небольшим количеством воды с помощью влажной мягкой щеткой ручку и положил его на предметное стекло так, чтобы покровное не двигается из-за капиллярного поверхностного натяжения вызваны тонкой жидкой пленки.
- Нанесите тонкую полоску гептан клея посередине покровного стекла, гептан должна испариться за несколько секунд, чтобы оставить клей на покровное.
- Вырезать другой покровное с алмазным пером на небольшие квадраты (~ 1,5 мм 2), выбрать один и разместить его на одном конце полосы клея (это используется для открытия иглы при микроинъекции требуется) и сохранить для будущих другие использовать.
- Возьмем другой предметное стекло и наклеить кусочек двусторонней клейкой ленты длиной около 2 см к нему и снимите крышку бумаги. (См. Рисунок 2А и В).
5. Dechorionate эмбрионов
- Передача мухи на свежий флакон пищи и использовать смоченные тонкой кистью пера передать около 50 яиц на двустороннюю липкую ленту на слайд с соответствующим количеством жидкости, чтобы яйца должны быть распространено. Когда жидкость испарится яйца прилипают к ленте.
- При вскрытии микроскоп сенсорным яйца несколько раз вдоль длинной оси использованием внешней стороне половину пинцетом осторожно до хориона нарушается и открытым, но оставить эмбриона в хорионной оболочки, чтобы предотвратить быстрое обезвоживание. Продолжайте этот процесс до 10-20 яиц была обработана (в зависимости от числа яиц, необходимых для одного эксперимента).
- Эмбрионы могут быть подобраны и удаляется из корпуса и хорион осторожно положил на клей полосы одну за другой. Яйца могут быть размещены и приведены в соответствие либо с длинной стороной параллельно эмбриона или анти-параллельно длинной стороне полосы клея зависит от того, если они будут microinjected.
- Эмбрионы могут быть либо покрыты сразу с соответствующим количеством масла Voltalef 10S (5:1 смесь Holocarbon 700 нефтяных и 27 нефть, Sigma), чтобы предотвратить дальнейшее усыхание для немедленного изображений или помещают в камеру высыхания в течение 3-8 минут обезвоживает их дальше в зависимости от влажности помещения и цель эксперимента. Обезвоженный эмбрионов должна быть покрыта маслом 10S в случае необходимости, чтобы предотвратить чрезмерное обезвоживание, если микроинъекции не требуется. (См. Рис. 2С, D& E).
6. Изображения эмбрионов
- Покадровый или одного изображения живых эмбрионов собранные с помощью Leica TCS SP2 перевернутой конфокальной микроскопии с системой HCX PL APO CS 40X 1,25 иммерсионным цель (60 или 100X целей может быть использована также в зависимости от цели эксперимента, тем выше Увеличение использовали еще фото отбеливание будет происходить).
- Когда несколько изображений флуорофоров, которые перекрытия спектров и совместно выражается в тех же эмбрионов, каждый флуоресцентный белок длиной волны излучения была собрана последовательно. Возбуждения и излучения волн доступных в системе Leica TCS SP2 являются: GFP, λ Ex: 488 нм и λ Em: 500-600 нм. ППП, λ Ex: 543 нм и λ Em: 555-700 нм.
- Одно изображение часто получается как в среднем на 2 растровые строки в среднем по 2 кадра-сканирование. Это займет минимум 6,3 секунд для сканирования 512x512 рixel изображение в режиме одновременного сканирования и 15,44 секунды последовательном режиме сканирования и производит хорошее отношение сигнал-шум. Это время необходимо учитывать при создании временных рамок для покадровой изображение коллекционирования.
- Отверстие было обычно устанавливается в 1-2 а.е. (воздушные единицы), а мощность лазера доводят до максимально низкого уровня, чтобы избежать любого значительного фотообесцвечивания.
7. Спровоцировать SAC по Microinjecting Эмбрионы с соответствующими реагентами
- Подготовка иглы до начала эксперимента. Мы предпочитаем, чтобы вытащить иглу из силиконизированная стеклянных капилляров (GC-100-10, Гарвард), используя пламенный / коричневый микропипетки съемник (Саттер инструмент, модель: Р-97) с параметрами: тепло = 600, вытащить = 90, Vel = 70 , Дель = 150.
- Засыпки иглу с 1-2 мл соответствующей концентрации реагента в инъекции буфера с помощью тонкого кончика загрузкой (20 мкл много Эппендорф: W215818J).
- Установите иглу в иглу хоlder на микроскопе с давлением труба, связанных с управлением системой впрыска Эппендорф.
- Найти эмбриона в 40х цель и найти иголку тень без изменения фокальной плоскости путем перемещения иглы в центр поля зрения и постепенно снижая его вправо фокальной плоскости.
- Перемещение эмбрион от нежно, чтобы найти небольшую площадь нарушенных покровное предварительно установлен на одном из концов полосы клея. Очень осторожно двигаться кончик иглы, пока не достигнет края небольшой площади покровного и аккуратно разбивает его открыть.
- Перемещение эмбрионов обратно в поле зрения и выбрать эмбрион подходящего возраста для инъекций. Я обычно вводят эмбриона на ядерном цикле разделения на 5-7, как это до ядра мигрируют наружу в кору головного мозга. Ядерные этапах цикла разделение может быть определена быстрого сканирования флуоресцентных сигналов GFP-Cdc20 или сигнал ядерной ППП-гистонов 2B перед инъекцией 9.
- Тщательно перемещать Эмбрио близких к игле и скорректировать в фокальной плоскости и для эмбриона и иглы. Перемещение эмбриона в иглу и вводят капли реагента в нужное положение и двигаться от эмбриона (или следуйте инструкциям по микроинъекции системы). Эмбрион может быть введен с его задней или боковой в зависимости от цели эксперимента.
- После инъекции эмбрион готовы быть отображены в соответствующее время. (См. рис 2F & G)
8. Представитель Результаты
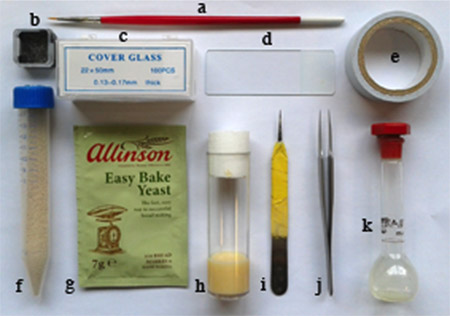
Рисунок 1. Необходимые материалы:. штраф кисть, б. небольшой площади разбитого стекла контейнера, с. 22 х 50 мм, покровного, г. предметное стекло микроскопа, электронного. двусторонняя клейкая лента, ф. сухой порошок дрожжей в пробирку с отверстиями в крышке, г. дрожжигранулы для мух обслуживания, час. летать еда флаконе, я. половина пинцет для dechorionate эмбрионов, у. пару пинцет, к. гептан клей жидкости контейнер (мерную колбу).

Рисунок 2. Диаграммы показывают подготовки покровные и слайды в шаге 4, эмбрион dechorionation в шаге 5 и иглы подготовки к микроинъекции в шаге 7. . Верхняя картинка показывает, покровное с полосой гептан клей по всей средней и небольшой площади сломанной покровное застряли на одном конце. В итоге картина показывает стекле тонким слоем воды при ее четырех углов провести покровное. Причина для использования слайд провести покровное это держать примерно на том же расстоянии, как найти, когда у вас двухсторонний скотч на слайдах, и таким образом избежать переориентации микроскоп во время арэлектронной рассечения и передачи эмбрионов между лентой и покровное. B. Слайд с короткой длиной двусторонний скотч применяется до отшелушивающим обложке бумага, используемая для dechorionating эмбриона. C. На рисунке слева показан эмбрионы с неповрежденной оболочек хориона с выраженным передним и задним концами, картинка справа показывает эмбрионов в разбитая скорлупа хориона, прежде чем они были переведены на покровное с клеем полосы D и E диаграммы, показывающие два.. пути передачи, размещения и согласования dechorionated эмбрионов на клей полосы. Эмбрионы были покрыты маслом 10S после соответствующего периода высыхания. F и G. диаграммы, показывающий, как открыть кончик иглы и позиции, таким образом, чтобы инъекцию.
Одно-или замедленной изображений, полученных из описанных выше экспериментов может быть непосредственно анализировали с помощью программного обеспечения Leica или сохраняются в формате. TIF файлов, открытых лРМАТ для дальнейшего количественного анализа и редактирования с помощью других общий анализ изображения программ, таких как изображения J, Photoshop и т.д. метаморфизма два примера для иллюстрации этого приведены ниже:
Пример 1: временной промежуток фильма (рис. 3) показывает, динамический набор кинетохора из GFP-Cdc20 и хромосомные движения в живых дрозофил синцитиальный эмбрионов. Область интересов от оригинального покадровой последовательности изображений было определено / Под ред-и автоматизированных партия преобразуется с помощью Photoshop программного обеспечения. Фильм был собран с использованием QuickTime программного обеспечения.
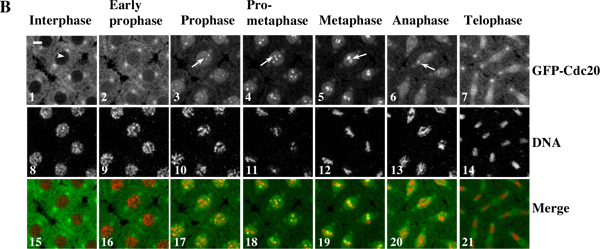
Рисунок 3. Покадровой фильм показывает динамический набор кинетохора из GFP-Cdc20 и хромосомные движения в живых дрозофил синцитиальный эмбрионов. (A) Покадровый изображения были взяты из трансгенных эмбрионов синцитиальный совместного выражения GFP-Cdc20 (зеленый цвет)и RFP-гистонов 2B (в красном) белков слияния и были записаны с помощью Leica TCS SP2 конфокальной системе при 18 ° С при ядерных циклов деление 7-8. Кадры были сделаны каждые 10 секунд. Кадр с клетками уже в профазе рассматривается как нулевой момент времени 10. Щелкните здесь для просмотра фильмов на 3А . (B) GFP-Cdc20 можно легко наблюдать на профазы и прометафазе кинетохоры (B3 и 4, белые стрелки) и сохраняется на метафазе и анафазе кинетохоры (B5 и 6, белые стрелки). GFP-Cdc20 исключен из интерфазных ядер (белая стрелка), входящих в ядро в начале профазы. Хроматина морфологии определяли с помощью со-выраженный His2BmRFP в качестве маркеров (B8-14). Бары = 5мм.
Пример 2: SAC функции могут быть изучены с помощью манипулирования эмбрионов microinjecting антител, флуоресцентно меченых белков или Chemicaл соединений, представляющих интерес, который потенциально вызвать SAC. Например инъекционных колхицин в деполимеризоваться микротрубочек чтобы спровоцировать SAC, как показано на рисунке 4, 10.
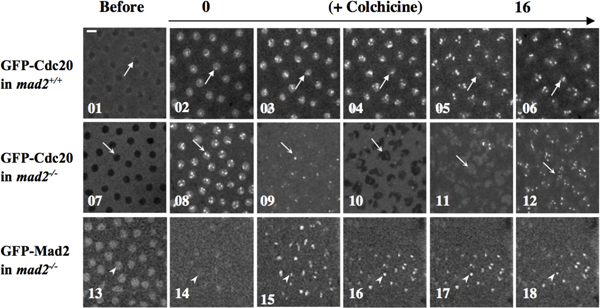
Рисунок 4. Mad2 имеет важное значение для колхицина, вызванной функции SAC 10. GFP-cdc20; mad2 + / +, GFP-cdc20; mad2 Е.Ю. (mad2 - / - нулевой мутанта) и GFP-mad2; mad2 эмбрионов EY лечили колхицин методом микроинъекции. Покадровый конфокальной снимки были сделаны до (01, 07 и 13) или после введения (02-06, верхние панели, 08-12, средние панели, 14-18, нижняя панель). GFP-Cdc20 (высшего и среднего панели) или GFP-Mad2 (нижняя панель) кинетохора сигналы были использованы в качестве клеточных маркеров прогрессии цикла. Верхняя панель, стрелки указывают арестован кинетохоры в 02-06. Области отмечен стрелкой в 01 указывает, что до колхицина, GFP-CDC20 исключен из ядра конце интерфазы. Средние панели, в отсутствие эндогенного Mad2, GFP-Cdc20 сигналы продолжают колебаться в и из ядра, и на и от кинетохоры, хотя цитокинеза оказывается дефектной, как и следовало ожидать в отсутствие эмбрионов микротрубочки, в присутствии колхицина (указано стрелками на 07-12), что свидетельствует о не удалось SAC функции арест клеток в ответ на прием колхицина. Разделение дочернего ядра не удалось в картине 10. Нижняя панель, наконечники стрел в 14-18 показывают арестован кинетохоры с накопленными GFP-Mad2 белков слияния, чтобы предложить функциональные GFP-Mad2 в спасательных фенотип SAC дефект мутант Mad2 эмбриона. Arrowhead в 13 указывает GFP-Mad2 накоплением в ядре конце интерфазы. Бар = 5мм. Эмбрионы microinjected с ~ 1% яичного объем 100мг/мл маточного раствора колхицина в 1 х PBS.
Обсуждение
Протокол, описанный здесь, является универсальным методом для работы с изображениями летать синцитиальный эмбрионов с использованием Leica TCS SP2 конфокальной лазерной сканирующей микроскопии и может быть изменен в соответствии с другими системами микроскоп, а также может быть адаптирована для изучения других функций генов дрозофилы синцитиальный использованием эмбрионов. Мы использовали этот протокол для изучения многих аспектов контрольно-пропускном пункте шпиндельного узла, динамики белков и белков протеолиза использованием трансгенных мух или поликлональных антител для визуализации белка локализация в живых или фиксированных образцов 4,6,12-14.
Проще всего мух в свежих флаконах пищи лету, собирая небольшое количество (~ 10 - 100) яиц. Это снижает хлопот решений и подготовке дополнительных яблочного сока агаром и камеры сбора яиц, как это описано в других изданиях 15,16. Помимо небольшого квадратного битого стекла покровного на одном конце полосы клея на покровное делает его намного прощеЧтобы открыть иглу и определения объема впрыска, регулируя настройки микроинъекции системы, а игла погружения в масло 10С. Степень высыхания эмбрион имеет важное значение для успешного введения в предотвращении утечек и поддержания жизнеспособности эмбрионов, особенно для тех экспериментов, которые требуют длительного периода времени или при повышении трансформантов после инъекции. Однако, нет золотого правила, сколько времени высыхания требуется. Это зависит от эксперимента к эксперименту и зависит от количества раствора вводят и влажность рабочей среды.
Функции специфического белка интереса можно манипулировать microinjecting специфические ингибиторы белка, моно-или поли-клональных антител против специфического белка, РНК или флуоресцентно меченых пептидов в дикого типа или генетической мутации фона. Многие из этих мутантных линий или GFP с метками трансгенных линий публично пр.ailable от дрозофилы фондовых центров и большинство из них котируются на Flybase ( http://flybase.org/~~V ) и может быть найден в Интернете.
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Этот протокол был разработан в рамках Wellcome Trust грант. Мы благодарим г-жа Морин Sinclair для поддержания лету запасов и подготовке лету пищу на протяжении многих лет. Мы также хотели бы поблагодарить г-на Майкла Aitchison за помощь и техническую поддержку в разработке этого протокола.
Материалы
Необходимое оборудование и реактивы:
Конфокальной системы визуализации: изображение системы, описанной в этом протокол Leica TCS SP2 лазерной сканирующей конфокальной микроскопии перевернутой системе. Описанный метод также подходит, возможно, с некоторыми незначительными изменениями для других систем визуализации.
Анатомический микроскоп: Мы используем Olympus SZX7 с DF PLAPO 1X-4 объектива.
Иглы съемник: Горячие / коричневый микропипетки съемник (от Саттер инструмент, модель: Р-97).
Микроинъекция системы: система Эппендорф микроинъекции описано, но любая другая соответствующая система может быть использована.
Лети дистрибьютор продуктов питания: Jencons научно ООО перистальтического насоса.
Реагенты:
| Name | Company | Catalog Number | Comments |
| Ингредиенты | Весс | Ресурсы | Лот № |
| Кукурузной муки | 100,0 г | SUMA, Великобритания | |
| Коричневый сахар | 50.0g | Биллингтон, в Великобритании | |
| Сухие дрожжи | 25.0g | DCL дрожжей ООО Великобритании | |
| Агар | 12.5g | Fisher Scientific | 106556 |
| Сорбиновая кислота | 0,4 г | BDH, VWR International ООО Великобритании | 8829310 |
| Бензойная кислота | 2.9g | Fisher Scientific | 1019599 |
| Нипагин (Метил-4-Hydro xybenzoate) | 0.9g | BDH, VWR International ООО Великобритании | K35969015 |
| H 2 O до 1л | |||
Holocarbon 700 и 27 Масла приобрести Sigma.
Сухие дрожжи: Томас Эллисон, Великобритания.
Подготовка гептан клея: Возьмите около 1,5 метров двухсторонний скотч, положите его в 15 мл трубку Сокол с 5 мл гептана и вращать в течение 3-5 часов или на ночь. После этого разделить на 4 равные порции в пробирки на 1,5 мл Eppendorf центрифугу и крутить в течение 5 мин на высокой скорости в настольные центрифуги для удаления мусора. Хранить раствор клея гептана в 10 мл мерную колбу и сохранить для использования. Клей сила будет варьироваться в зависимости от концентрации и количества клея. Как правило, чем тоньше клей производит меньше шумовой фон при сканировании с помощью конфокальной микроскопии.
- Покровные: BDH, VWR International ООО Великобритании
- Микроскоп слайдов: BDH, VWR International ООО Великобритании
- Силиконизированная стеклянных капилляров: GC-100-10, Гарвардский
- Изобразительное кончик нагрузка: 20 мкл Эппендорф много: W215818J
- Пинцет
- Изобразительное кисть
Ссылки
- Holland, A. J., Cleveland, D. W. Boveri revisited: chromosomal instability, aneuploidy and tumorigenesis. Nat. Rev. Mol. Cell Biol. 10, 478-4787 (2009).
- Zekanowski, C., Wojda, U. Aneuploidy, chromosomal missegregation, and cell cycle reentry in Alzheimer's disease. Acta Neurobiol. Exp. (Wars). 69, 232-253 (2009).
- Buffin, E., Emre, D., Karess, R. E. Flies without a spindle checkpoint. Nat. Cell Biol. 9, 565-572 (2007).
- Tang, Z., Shu, H., Oncel, D., Chen, S., Yu, H. Phosphorylation of Cdc20 by Bub1 provides a catalytic mechanism for APC/C inhibition by the spindle checkpoint. Mol. Cell. 16, 387-397 (2004).
- Huang, J., Raff, J. W. The disappearance of cyclin B at the end of mitosis is regulated spatially in Drosophila cells. EMBO Journal. 18, 2184-2195 (1999).
- Xia, G. Conformation-specific binding of p31(comet) antagonizes the function of Mad2 in the spindle checkpoint. Embo. J. 23, 3133-3143 (2004).
- Lorca, T. Fizzy is required for activation of the APC/cyclosome in Xenopus egg extracts. Embo. J. 17, 3565-3575 (1998).
- Howell, B. J. Cytoplasmic dynein/dynactin drives kinetochore protein transport to the spindle poles and has a role in mitotic spindle checkpoint inactivation. J. Cell Biol. 155, 1159-1172 (2001).
- Foe, V. E., Alberts, B. M. Studies of nuclear and cytoplasmic behaviour during the five mitotic cycles that precede gastrulation in Drosophila embryogenesis. Journal of cell science. 61, 31-70 (1983).
- Li, D., Morley, G., Whitaker, M., Huang, J. Y. Recruitment of Cdc20 to the kinetochore requires BubR1 but not Mad2 in Drosophila melanogaster. Mol. Cell Biol. 30, 3384-3395 (2010).
- Karess, R. E., Glover, D. P element mediated germ line transformation of Drosophila. DNA cloning: A practical approach. 2, 121-141 (1985).
- Wakefield, J. G., Huang, J. Y., Raff, J. W. Centrosomes have a role in regulating the destruction of cyclin B in early Drosophila embryos. Current Biology. 10, 1367-1370 (2000).
- Huang, J. Y., Raff, J. W. The dynamic localisation of the Drosophila APC/C: evidence for the existence of multiple complexes that perform distinct functions and are differentially localised. Journal of Cell Science. 115, 2847-2856 (2002).
- Raff, J. W., Jeffers, K., Huang, J. Y. The roles of Fzy/Cdc20 and Fzr/Cdh1 in regulating the destruction of cyclin B in space and time. Journal of Cell Biology. 157, 1139-1149 (2002).
- Brust-Mascher, I., Scholey, J. M. Microinjection Techniques for Studying Mitosis in the Drosophila melanogaster Syncytial Embryo. J. Vis. Exp. (31), e1382 (2009).
- Figard, L., Sokac, A. M. Imaging Cell Shape Change in Living Drosophila Embryos. J. Vis. Exp. (49), e2503 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены