Method Article
Living Görselleştirilmesi Dinamik Kinetochore Protein Davranış ve Kromozom Hareket tarafından Mitotik Checkpoint incelenmesi
Bu Makalede
Özet
SAC kardeş kromatidler arasında mitotik segregasyon izlenmesi, sinyali başlatır nerede kinetochore olduğunu. A metodunda kromozom hareketi ile kinetochore proteinler ve koordinasyon birinin seçilmesi ve devir görselleştirme tarif edilmektedir Drosophila Leica lazer tarama konfokal sistemi kullanılarak embriyo.
Özet
Mili montaj kapısı (SAC) mekanizması kromozomlar düzgün bağlanana kadar anafaz başlangıcını önlemek için kromozom çekirdek zarı ve iğ mikrotübüller arasındaki etkileşimi izler aktif bir sinyali vardır. Hücreler anöploidi veya genomik kararsızlığa ve dolayısıyla kanser ve doğum kusurları ve Alzheimer 1 gibi diğer insan hastalıkları önlemek için bu mekanizmayı kullanın. Gibi Mad1 gibi SAC birçok parça, Mad2, Bub1, BubR1, Bub3, Mps1, Zw10, Çubuk ve Aurora B kinaz tespit ve 2 tüm kinetochore dinamik proteinlerdir edilmiştir. Kanıt SAC sinyal başlatılan nerede kinetochore olduğunu göstermektedir. SAC ana düzenleyici hedef Cdc20 olduğunu. Cdc20 esansiyel APC / C (A naphase P romoting C omplex veya C yclosome) aktivatörleri 3 biridir ve aynı zamanda bir kinetochore dinamik bir protein olduğu 4-6. Aktive edildiğinde, SAC A aktivitesini inhibePC / C böylece geçiş 7,8 metafaz için metafaz engelleyen iki temel yüzeyler, siklin B ve securin yıkımı önlemek için. SAC sinyal başlatılan ve monte çekirdek zarı ve onun işlevini hala sürüncemede kalır inhibe APC / C üzerine aktarılır tam olarak nasıl.
Drosophila son derece uysal deneysel sistemi; çok daha basit ve daha iyi anlaşılmış organizmanın insan ama bir oranla ortak hisse temel süreçler. Erken embriyo eşzamanlı 13 hızlı nükleer bölünmede döngüleri (8-10 dakika geçer gibi, özellikle uzay ve zaman içinde mitotik olayların görüntülenmesi için, belki de, canlı hücreler biyo-görüntüleme çalışmaları için kullanılacak en iyi organizmalardan biri olduğu 25 ° C) her döngü için ve yavaş yavaş sadece korteks 9 altında tek tek tabaka içinde çekirdekleri düzenler.
Burada, transgenik Drosophila ekspresyonist kullanarak biyo-görüntüleme yöntemi sunmaksing GFP (Yeşil floresan proteini) veya faiz ve SAC bileşenlerin bazı GFP füzyon proteinleri, Cdc20 ve Mad2 görüntüleri göstererek, sinekler de SAC işlevini incelemek için bir Leica TCS SP2 konfokal lazer tarama mikroskop sistemi onun türevi hedefli proteinler , örnek olarak kullanılabilir.
Protokol
1. Transgenik Sinekler ve Bakım
- Transjenik Bu tanıtım kullanılan sinekleri: Ubq-gfp-Cdc20 (II), Ubq-RFP-His2B (X *); Ubq-gfp-Cdc20 (II *), Ubq-gfp-Cdc20 (II *); mad2 EY ( III *) ve Ubq-gfp-Cdc20 transgenik sinekler önce, standart bir P-eleman aracılı transgenik yaklaşım 10,11 ve Ubq-rfp-His2B UMR 144 CNRS / Enstitü Curie de Yohanns Belaïche bir tür hediye yoluyla laboratuarda üretildi Paris, Fransa. Onlar standart Drosophila genetiği üzerinden Mad2 mutant arka plan girmiştir. Mad2 EY orijinal mutant hattı Bloomington stok merkezi satın alındı. Bu protokolde transformantlar yükseltmek için kullanılan prosedür ele olmayacaktır.
Not: * kromozom sayısını temsil eder. - Bakım: Transgenik sinekler 25 tutuldu plastik şişeler containin ° Cg gıda sinek ve üstüne ek kuru maya tozu ile. Flakon rutin yetişme koşulları (Şekil 1) bağlı olarak her 3-4 haftada değiştirildi.
2. (Laboratuar ölçekli) Gıda Hazırlama Fly
- Uçucu gıda karışımı, uygun bir miktarda bileşenleri çözünmesi için sürekli karıştırılarak ısıtıldı.
- Bu orta yaklaşık 8-10 ml Jencons Bilimsel Ltd peristaltik pompa kullanarak her bir plastik şişeye (2.5 cm çap x 8 cm uzunluğunda) içine bulamaç olarak dağıtıldı.
- Gıda bulamaç ayarlandı ve oda sıcaklığına kadar soğuduktan sonra, şişe bir pamuk köpük fişli takılı. Bu besinler şişeleri sonra plastik bir torbaya mühürlü ve ° C daha sonra kullanılmak üzere 4 tutulur bir tepsiye yerleştirilir.
3. Küçük ölçekli Yumurta Toplama
- 2-3 günlük ergin sinek yaklaşık 50 çift lay için 25 yüzeyinde ek kuru maya tozu ile birlikte taze bir sinek gıda flakon ° C aktarılmıştırembriyolar ing.
- Sinekler sonra taze bir şişeye her saat aktarılır ve çekirdekler yavaş yavaş kortekse göç zaman toplanan embriyoların bazı nükleer bölünme döngüsü 8-10 yaş civarındaki emin olmak için 30 dakika şişe içinde embriyo bırakıp olarak düzenlenen Tek tek tabakalı. Genellikle koşulları döşenmesi için uygun olmadığı zaman erkek vücudunda tutuldu yaşlı embriyolar içerdiğinden ilk bir saat koleksiyonu normal atılır.
4. Lameller ve Slaytlar hazırlanması
- 50 x 22 mm coverslip dışarı atın ve hafif nemli bir ince kalem fırça ve bir mikroskop lamı üzerine koydu kullanarak suyun çok küçük bir miktar ile bir tarafında dört köşe ıslak böylece coverslip çünkü kılcal yüzey gerilimi hareket etmiyor ince sıvı film tarafından neden oldu.
- Lameller ortasında boyunca heptan tutkal ince bir şerit uygulayın, heptan coverslip üzerine tutkal bırakmak saniye içinde buharlaşmasına gerekir.
- Küçük kareler (~ 1.5 mm 2) bir elmas kalemle başka coverslip Kes, bir pick up ve tutkal şeridin bir ucunu (bu mikroenjeksiyon gerektiğinde iğne ucu açmak için kullanılır) üzerine yerleştirin ve gelecek için diğerleri kaydetmek kullanın.
- Başka bir mikroskop lamı alın ve kapak kağıdı kapalı yaklaşık 2 cm ona uzun ve soyma çift taraflı yapışkan bir bant yapıştırın. (Şekil 2A ve B bakınız).
5.. Dechorionate Embriyolar
- Bir taze gıda şişeye aktarın ve sinekler yumurta yaymak izin vermek için uygun bir sıvı miktarı ile slayt üzerinde çift taraflı yapışkan bant üzerine yaklaşık 50 yumurta transferi için nemlendirilmiş ince kalem fırça kullanın. Sıvı buharlaşmış erdiğinde yumurta bandı sadık olacaktır.
- Bir mikroskop altında dokunmatik uzun ekseni boyunca yumurta birkaç kez koryon kadar yavaşça cımbız yarısı dış tarafına kullanılarak kırık ve açık olan fakat Chor içinde embriyo terkHızlı su kaybını önlemek için iyon kabuk. Yumurta 10-20 (tek bir deney için gerekli olan yumurta sayısına bağlı olarak) muameleye tabi tutulmuş olan kadar bu işlemi devam eder.
- Embriyolar daha sonra kaldırdım ve koryon kabuk kaldırılır ve yavaşça tek yapıştırıcı şerit birine yerleştirilebilir. Yumurta yerleştirilir ve embriyo paralel ya da bunların mikroenjeksiyon edilecekse bağlıdır tutkal şeridinin uzun yan, anti-paralel uzun kenarı ile ya uyum edilebilir.
- Embriyosu ya hemen görüntüleme için daha da kurumaya önlemek için Voltalef 10S yağı, uygun bir miktarda (Holocarbon 700 yağ ve 27 bir yağ 05:01 karışım, Sigma) ile hemen kapalı veya 3-8 dakika boyunca kurumaya haznesi yerleştirilebilir daha fazla oda ve deney amacı neme bağlı olarak bunları kurutmak. Mikroenjeksiyon gerekli ise aşırı su kaybını önlemek için uygun olduğunda kurutulmuş embriyolar 10S yağı ile kaplanmış olmalıdır. (Bkz: Şekil. 2C, D& E).
6. Görüntüleme Embriyolar
- Yaşayan embriyoların Time-lapse veya tek görüntüleri HCX PL APO CS 40X 1.25 immersiyon yağı objektif (60 veya 100X hedefleri çok yüksek, deney amacına bağlı olarak kullanılabilecek bir Leica TCS SP2 ters konfokal mikroskop sistemi kullanılarak toplanan büyütme meydana gelecek beyazlatma fazla fotoğraf) kullanılır.
- Görüntüleme birden spektrumları örtüşen florofor ve aynı embriyo içinde bir arada ifade edilir, her floresan proteini emisyon dalgaboyu sırayla toplanmıştır. Leica TCS SP2 sisteminizde bulunan eksitasyon ve emisyon dalga boyları şunlardır: GFP, λ Ex: 488 nm ve λ Em: 500-600 nm. TÇD, λ Ex: 543 nm ve λ Em: 555-700 nm.
- A tek görüntü genellikle çerçevenin 2-taramalar ortalama ile 2 scanlines bir ortalama olarak elde edildi. Bu 512x512 p taramak için 6.3 saniye minimum alırsıralı tarama modu için eşzamanlı bir tarama modu, 15.44 saniye ve artış görülebilir görüntü iyi bir sinyal-gürültü oranı üretir. Bu kez hızlandırılmış görüntü toplama için zaman çerçeveleri kurarken dikkate alınması gerekir.
- Iğne deliği normalde 1-2 AU (havadar birim) kuruldu ve lazer güç önemli photobleaching önlemek için mümkün olan en düşük seviyede ayarlandı.
7. Uygun reaktifler ile Embriyolar Microinjecting tarafından SAC provoke
- Deneyden önce iğne hazırlayın. Parametreleri ile: ısı = 600, = 90, vel = 70 çekin: Biz alev / kahverengi mikropipet çektirmenin (P-97 Sutter Enstrüman, Modeli) kullanılarak silikonlu cam kapilerleri (GC-100-10, Harvard) gelen iğne çekmek için tercih , del = 150.
- Enjeksiyon tampon içinde, uygun bir reaktif konsantrasyonu 1-2 ml ince bir yükleme ucu (: W215818J 20 ul Eppendorf çok) kullanılarak iğne Dolgu.
- İğne Ho iğne monteEppendorf enjeksiyon kontrol sistemine bağlı basınçlı boru ile mikroskop lder.
- 40X objektif altında bir embriyo bulun ve görüş alanının ortasına iğne hareket eden ve yavaş yavaş sağ odak düzlemi onu düşürerek odak düzlemi değiştirmeden iğne gölge bulabilirsiniz.
- Kırık coverslip yapıştırıcı şerit bir ucunda önceden monte edilmiş küçük kare bulmak için nazikçe uzak embriyo taşıyın. Bu küçük kare lameller kenarına vurur ve yavaşça açın kalıncaya kadar çok nazikçe iğne ucu hareket ettirin.
- Görünümüne geri embriyolar taşıyın ve enjeksiyon için doğru yaş embriyo seçin. Çekirdekler kortekse dışarıya göç önce bu gibi normalde 5-7 nükleer bölünme döngüsünde embriyo enjekte edin. Nükleer bölünmesi döngüsü aşamaları GFP-Cdc20 veya önceden enjeksiyon için 9 RFP-histon 2B Nükleer sinyalinin flüoresan sinyalleri hızlı bir tarama ile tespit edilebilir.
- Dikkatle Embry hareketo iğne yakın ve embriyo ve iğne hem de odak düzlemi tekrar ayarlayın. Iğne içine embriyo hareket ettirin ve istenilen pozisyon içine reaktif bir damla enjekte ve uzak embriyo hareket (veya mikroenjeksiyon sistemi için yönergeleri izleyin). Embriyo posterior veya deney amacına bağlı taraftan enjekte edilebilir.
- Bir kez embriyo uygun zamanda yansıması hazır enjekte edilir. (Şekil 2F & G'ye bakınız)
8. Temsilcisi Sonuçlar
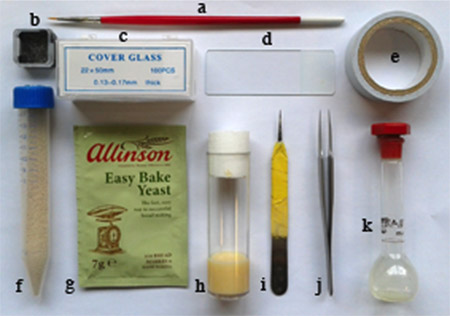
Şekil 1.. Gerekli malzemeler: a. ince kalem fırça, b. küçük kare kırık gözlük kabı, c. 22 x 50 mm coverslip, d. mikroskop lamı, e. çift taraflı yapışkan bant, f. kapağı, g delikli test tüpünde kuru maya toz. mayaGranül sineği bakım, s için kullanılır. gıda flakon, ben uçuyorum. dechorionate embriyosu için kullanılan bir cımbız bir buçuk, j. bir çift cımbız, k. heptan tutkal sıvı kabı (ölçülü balona).

Şekil 2. Diyagramları adım 4 adım 5 ve 7. adımda mikroenjeksiyon için iğne hazırlıklarına embriyo dechorionation yılında lamelleri ve slaytların hazırlanması göstermektedir. A. Üst resmi ortasından arasında heptan tutkal bir şerit ve bir ucuna yapışmış kırık lameller küçük bir kare ile bir coverslip gösterir. Alt resim coverslip tutmak için dört köşesine ince bir su tabakası ile bir mikroskop lamı gösterir. Coverslip tutmak için bir slayt kullanma nedeni slaytlar üzerinde çift taraflı bant var ve böylece mikroskop refocusing kaçınarak zaman bulundu kabaca aynı odak mesafesi tutmak size ar isee Anatomi ve teyp ve kapak arasında embriyo transferi. B. Çift taraflı bant kısa bir uzunluğu ile slayt embriyo. C dechorionating için kullanılan kapağı kağıt soyulmuştu önce uygulanır. Soldaki resimde işaretlenmiş ön ve arka uçları sağlam koryon kabukları ile embriyoları gösterir, onlar yapıştırıcı şerit ile coverslip üzerine transfer edilmeden önce sağdaki resim kırık koryon kabuklarında embriyoların gösteren D & E Diyagramları iki gösteriyor.. , transfer yerleştirerek ve tutkal şeritlerin üzerine dechorionated embriyolar hizalamak için yollar. Embriyoların uygun bir kuruma süresinden sonra 10S yağı ile örtülmüştür. Bu şekilde enjekte etmek için iğne ve pozisyon ucu nasıl açılacağını gösteren F & G. Diyagramları.
Yukarıda açıklanan deneylerde elde Tek veya zaman atlamalı görüntüleri doğrudan Leica yazılımı kullanılarak analiz ya da açık bir fo olarak. TIF dosyalarını kaydedilebilirBu göstermek için böyle Görüntü J, Photoshop ve Metamorph vb iki örnek gibi diğer genel görüntü analiz programları kullanarak daha fazla miktar ya da düzenleme analizler için kullanılabilir rmat aşağıda tartışılmıştır:
Örnek 1: Bir kez-lapse (Şekil 3) GFP-Cdc20 ve Drosophila sinsityal embriyolar yaşayan kromozom hareket dinamik kinetochore işe gösterir. Orijinal time-lapse dizisi görüntülerden ilgi Bölgede tespit / Saat ve otomatik-toplu Photoshop yazılımı kullanılarak dönüştürülür. Film QuickTime yazılımı kullanılarak toplandı.
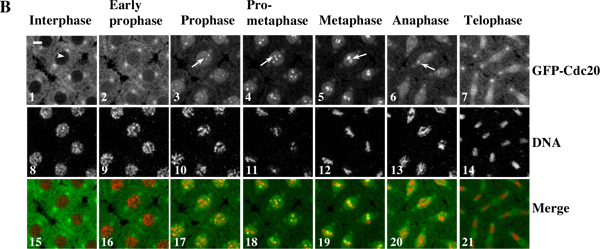
Şekil 3. Bir zaman-lapse GFP-Cdc20 ve Drosophila sinsityal embriyolar yaşayan kromozom hareket dinamik kinetochore işe gösterir. (A) Zaman aralıklı görüntüleri GFP-Cdc20 (yeşil) co-ifade eden bir transgenik sinsityal embriyo alındıve TTT-Histon 2B (kırmızı) füzyon proteinleri ve ° C nükleer bölünmede döngüleri sırasında 7-8 18 Leica TCS SP2 konfokal sistemi kullanılarak kaydedildi. Çerçeveler her 10 saniyede çekildi. Zaten profaz hücreleri ile çerçeve sıfır zaman noktası 10 olarak kabul edilir. Şekil 3A için filmi görmek için buraya tıklayın . (B) GFP-Cdc20 kolayca profaz ve prometafaz çekirdek zarı (B3 & 4, beyaz oklar) gözlenen ve olabilir metafaz ve anafaz çekirdek zarı (B5 ve 6, beyaz oklar) devam etmektedir. GFP-Cdc20 erken profaz tarafından çekirdeği girerek, interfaz çekirdeği (beyaz ok) çıkarılmıştır. Kromatin morfolojileri belirteçleri (B8-14) gibi ortak dile getirdikleri His2BmRFP kullanılarak belirlenmiştir. Barlar 5mm =.
Örnek 2: SAC fonksiyonları microinjecting antikorlar, floresan ile işaretlenmiş proteinler veya kimya tarafından embriyoların manipüle ederek ele alınabilirPotansiyel SAC tetikleyecek bu ilgi l bileşikleri. Örneğin enjekte kolşisin için mikrotübüllerin depolymerize Şekil 4. 10 belirtildiği gibi SAC provoke öyle.
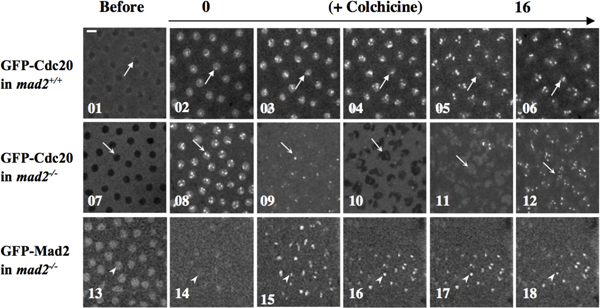
Şekil 4. Mad2 kolşisin-çağrılan SAC fonksiyonu 10 için gereklidir. gfp-cdc20; mad2 + / +, gfp-cdc20; mad2 EY (mad2 - / - boş mutant) ve gfp-mad2; mad2 EY embriyolar mikroenjeksiyon tarafından kolşisin ile tedavi edildi. Time-lapse konfokal görüntüleri (; 08-12, orta panelleri; 14-18, alt paneller 02-06, üst paneller) önce (01, 07 ve 13) veya enjeksiyon sonrasında alındı. GFP-Cdc20 (üst ve orta panelleri) veya GFP-Mad2 (alt panel) kinetochore sinyalleri hücre döngüsü ilerleme işaretleri olarak kullanılmıştır. Üst panel, oklar 02-06 yılında tutuklandı çekirdek zarı göstermektedir. 01 yılında bir okla işaretli alan kolşisin, GFP-C önce olduğunu gösterirDC20 geç interfaz çekirdeği çıkarılmıştır. Orta paneli varlığında, endojen Mad2 yokluğunda, GFP-Cdc20 sinyalleri çekirdek içinde ve dışında gidip gelmeye devam ve sitokinez arızalı olduğunu ancak çekirdek zarı açıp, gibi mikrotübüllerin yoksun embriyolarda beklenir kolşisin (07-12 yılında oklarla gösterilen) Kolşisin tedavisine yanıt hücreleri yakalamada başarısız bir SAC fonksiyonu düşündürmektedir. Kızı çekirdeğin ayrılması resim 10 başarısız oldu. Alt panel, 14-18 içinde ok uçları Mad2 mutant embriyo kurtarma SAC defekti fenotipi fonksiyonel GFP-Mad2 önermek birikmiş GFP-Mad2 füzyon proteinleri ile tutuklanan çekirdek zarı göstermektedir. 13 Arrowhead geç bir interfaz çekirdeğinde GFP-Mad2 birikimi gösterir. = 5mm Bar. Embriyolar 1 x PBS bir 100mg/ml kolşisin stok solüsyonu ~% 1 yumurta hacmi ile mikroenjeksiyon yapıldı.
Tartışmalar
Burada açıklanan protokol görüntüleme Leica TCS SP2 konfokal lazer tarama mikroskobu kullanılarak sinsityal embriyo sinek ve diğer mikroskop sistemleri uygun modifiye edilebilir ve aynı zamanda Drosophila sinsityal embriyoları kullanılarak diğer gen fonksiyonlarını incelemek için adapte edilebilir için genel bir yöntemdir. Biz mili montaj kontrol noktasında, protein dinamiği ve yaşam veya sabit örnekleri 4,6,12-14 protein yerelleştirme görselleştirmek için transgenik sinekleri ya da poliklonal antikorları kullanarak protein proteolizin birçok açıdan incelemek için bu protokolü kullandık.
Yumurta - Küçük numaraları (100 ~ 10) alırken taze sinek gıda flakonlarda sinekler tutmak kolay olandır. Bu verme ve diğer yayınlar 15,16 açıklandığı gibi ek elma suyu agar ve yumurta toplama odaları hazırlanması gereksinimini azaltır. Coverslip üzerine yapıştırıcı şeridinin bir ucunda kırık coverslip cam küçük bir kare Ayrıca bu çok daha kolay hale getirirİğne açmak ve iğne 10S yağı daldırma iken mikroenjeksiyon sistemi ayarları ayarlayarak enjeksiyon hacmi belirlenmesi. Embriyonun kuruma derecesi kaçaklarının önlenmesi ve özellikle uzun bir süre gerektiren veya enjeksiyon sonrasında transformantlar kaldırırken bu deneyler için embriyo canlılığı sürdürmek enjeksiyon başarısı için önemlidir. Ancak, kuruma gerekli tam olarak ne kadar süre için bir altın kural yoktur. Bu deneyden deney değişir ve enjekte çözüm ve çalışma ortamının nem miktarına bağlıdır.
Ilgi belirli bir proteinin işlevlerini mono-veya poli-klonal antikor yabani tip ya da genetik mutasyon arka altında belirli bir proteinin, mesajcı RNA veya floresan ile işaretlenmiş peptidler karşı, spesifik protein inhibitörleri microinjecting tarafından manipüle edilebilir. Bu mutant hatları veya GFP-etiketli transgenik hatlarının çoğu kamuya av vardırDrosophila stok merkezleri ve bunların çoğundan ailable Flybase (listelenmiştir http://flybase.org/~~V ) ve online olarak aranabilir.
Açıklamalar
Biz ifşa hiçbir şey yok.
Teşekkürler
Bu protokol, Wellcome Trust hibe kapsamında geliştirilmiştir. Biz sinek stoklarının muhafaza edilmesi ve yıl içinde sinek yemek pişirirken Bayan Maureen Sinclair teşekkür ederim. Biz de bu protokolün gelişmekte onun yardım ve teknik destek için Sayın Michael Aitchison teşekkür etmek istiyorum.
Malzemeler
Temel ekipman ve reaktifler:
Konfokal görüntüleme sistemi: Bu protokolün açıklanan görüntüleme sistemi konfokal inverted mikroskop tarama sistemi sayesinde Leica TCS SP2 lazer. Açıklanan yöntemin başka bir görüntüleme sistemleri için bazı küçük değişikliklerle belki de uygundur.
Mikroskop Kesme: Biz DF PLAPO 1X-4 lens ile Olympus SZX7 kullanın.
İğne çektirmesi: / kahverengi mikropipet çektirmenin (: P-97 Sutter Enstrüman, Model itibaren) Flaming.
Mikroenjeksiyon sistem: bir Eppendorf mikroenjeksiyon sistemi tarif edilmektedir fakat herhangi bir diğer uygun sistemi kullanılabilir.
Jencons Bilimsel Ltd peristaltik pompa: gıda distribütörü Fly.
Reaktifler:
| Name | Company | Catalog Number | Comments |
| Malzemeler | Ağırlıks | Kaynaklar | Lot No |
| Mısırda yemek | 100.0g | SUMA, Birleşik Krallık | |
| Esmer şeker | 50.0g | Billington s, Birleşik Krallık | |
| Kuru maya | 25.0g | DCL MAYA Ltd Birleşik Krallık | |
| Agar | 12.5g | Fisher Scientific | 106556 |
| Sorbik asit | 0.4g | BDH, VWR International Ltd Birleşik Krallık | 8829310 |
| Benzoik asit | 2.9g | Fisher Scientific | 1019599 |
| Nipagin (Metil-4-Hydro xybenzoate) | 0.9g | BDH, VWR International Ltd Birleşik Krallık | K35969015 |
| 1L H 2 O kadar | |||
Holocarbon 700 ve Sigma satın alınan 27 yağlar.
Kuru maya: Thomas Allison, Birleşik Krallık.
Heptan tutkal hazırlama:, çift taraflı bant yaklaşık 1.5 metre atın heptan 5ml ile 15 ml Falcon tüp içine koyup 3-5 saat veya gece boyunca döndürün. O zaman 1,5 ml Eppendorf santrifüj tüpleri içinde 4 eşit kısma bölünerek ve herhangi bir enkaz kaldırmak için bir masaüstü santrifüj hızlı bir hızda 5 dakika sonra dönerler. Bir 10 ml ölçülü balonda heptan tutkal çözüm saklayın ve kullanım için saklayınız. Tutkal mukavemeti konsantrasyonu ve kullanılan tutkal miktarlarına göre değişecektir. Normalde, ince tutkal konfokal mikroskop ile taranarak daha az gürültülü arka plan üretir.
- Coverslip: BDH, VWR International Ltd Birleşik Krallık
- Mikroskop slayt: BDH, VWR International Ltd Birleşik Krallık
- Silikonlu cam kapilerleri: GC-100-10, Harvard
- Güzel yükleme ipucu: 20μl eppendorf lot: W215818J
- Cımbız
- Güzel kalem fırça
Referanslar
- Holland, A. J., Cleveland, D. W. Boveri revisited: chromosomal instability, aneuploidy and tumorigenesis. Nat. Rev. Mol. Cell Biol. 10, 478-4787 (2009).
- Zekanowski, C., Wojda, U. Aneuploidy, chromosomal missegregation, and cell cycle reentry in Alzheimer's disease. Acta Neurobiol. Exp. (Wars). 69, 232-253 (2009).
- Buffin, E., Emre, D., Karess, R. E. Flies without a spindle checkpoint. Nat. Cell Biol. 9, 565-572 (2007).
- Tang, Z., Shu, H., Oncel, D., Chen, S., Yu, H. Phosphorylation of Cdc20 by Bub1 provides a catalytic mechanism for APC/C inhibition by the spindle checkpoint. Mol. Cell. 16, 387-397 (2004).
- Huang, J., Raff, J. W. The disappearance of cyclin B at the end of mitosis is regulated spatially in Drosophila cells. EMBO Journal. 18, 2184-2195 (1999).
- Xia, G. Conformation-specific binding of p31(comet) antagonizes the function of Mad2 in the spindle checkpoint. Embo. J. 23, 3133-3143 (2004).
- Lorca, T. Fizzy is required for activation of the APC/cyclosome in Xenopus egg extracts. Embo. J. 17, 3565-3575 (1998).
- Howell, B. J. Cytoplasmic dynein/dynactin drives kinetochore protein transport to the spindle poles and has a role in mitotic spindle checkpoint inactivation. J. Cell Biol. 155, 1159-1172 (2001).
- Foe, V. E., Alberts, B. M. Studies of nuclear and cytoplasmic behaviour during the five mitotic cycles that precede gastrulation in Drosophila embryogenesis. Journal of cell science. 61, 31-70 (1983).
- Li, D., Morley, G., Whitaker, M., Huang, J. Y. Recruitment of Cdc20 to the kinetochore requires BubR1 but not Mad2 in Drosophila melanogaster. Mol. Cell Biol. 30, 3384-3395 (2010).
- Karess, R. E., Glover, D. P element mediated germ line transformation of Drosophila. DNA cloning: A practical approach. 2, 121-141 (1985).
- Wakefield, J. G., Huang, J. Y., Raff, J. W. Centrosomes have a role in regulating the destruction of cyclin B in early Drosophila embryos. Current Biology. 10, 1367-1370 (2000).
- Huang, J. Y., Raff, J. W. The dynamic localisation of the Drosophila APC/C: evidence for the existence of multiple complexes that perform distinct functions and are differentially localised. Journal of Cell Science. 115, 2847-2856 (2002).
- Raff, J. W., Jeffers, K., Huang, J. Y. The roles of Fzy/Cdc20 and Fzr/Cdh1 in regulating the destruction of cyclin B in space and time. Journal of Cell Biology. 157, 1139-1149 (2002).
- Brust-Mascher, I., Scholey, J. M. Microinjection Techniques for Studying Mitosis in the Drosophila melanogaster Syncytial Embryo. J. Vis. Exp. (31), e1382 (2009).
- Figard, L., Sokac, A. M. Imaging Cell Shape Change in Living Drosophila Embryos. J. Vis. Exp. (49), e2503 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır