Method Article
Estudar checkpoint mitótico por Ilustrando comportamento dinâmico cinetocoro Proteína e Movimento de cromossomos em Viver
Neste Artigo
Resumo
O cinetocoro é onde o SAC inicia seu sinal de monitoramento da segregação mitótica das cromátides irmãs. Um método é descrito para visualizar o recrutamento e de rotação de uma das proteínas cinetocoro e pela sua coordenação com o movimento cromossoma em Drosophila Embriões usando uma Leica sistema laser confocal.
Resumo
O eixo de montagem checkpoint mecanismo (SAC) é um sinal activo, que monitora a interação entre cinetócoros cromossômicas e microtúbulos do fuso para prevenir o surgimento anáfase até que os cromossomos estão conectados corretamente. As células usam este mecanismo para evitar a instabilidade genômica ou aneuploidia, e, portanto, cânceres e outras doenças humanas, como defeitos de nascimento e de Alzheimer 1. Um certo número de componentes, tais como SAC Mad1, Mad2, Bub1, BubR1, Bub3, MPS1, Zw10, Rod e Aurora B quinase têm sido identificados e são todas as proteínas cinetocoro dinâmicos 2. A evidência sugere que a cinetocoro é onde o sinal de SAC é iniciada. O SAC é o principal alvo de regulamentação Cdc20. Cdc20 é um dos essenciais APC / C (A naphase P ROMOVER C omplex ou C yclosome) activadores 3 e é também uma proteína cinetocoro dinâmica 4-6. Quando ativado, o SAC inibe a atividade da APC / C para evitar a destruição de dois substratos de chave, a ciclina B e securin, impedindo assim a metáfase para anáfase transição 7,8. Exatamente como o sinal de SAC é iniciada e montados sobre os cinetócoros e retransmitido para a APC / C para inibir a sua função ainda permanece indefinida.
Drosophila é um sistema extremamente tratável experimental; um organismo muito mais simples e mais bem entendido, em comparação com o humano, mas um que partilha processos fundamentais em comum. É, talvez, um dos melhores organismos para uso de bio-imagem estudos em células vivas, especialmente para a visualização dos eventos de mitose no espaço e no tempo, como o embrião passa por 13 ciclos rápidos de divisão nuclear de forma síncrona (8-10 minutos para cada ciclo a 25 ° C) e, gradualmente, organiza os núcleos em uma monocamada único, imediatamente abaixo do córtex 9.
Aqui, eu apresento um método bio-imagem usando transgênicos Drosophila expressãosing GFP (proteína verde fluorescente) ou sua variante segmentados proteínas de interesse e uma Leica TCS SP2 confocal de laser sistema de microscópio de digitalização para estudar a função SAC em moscas, mostrando imagens de proteínas de fusão GFP de alguns dos componentes SAC, Cdc20 e Mad2 , como o exemplo.
Protocolo
1. Moscas transgênicas e Manutenção
- O transgénico moscas utilizado nesta demonstração: UBQ-GFP-Cdc20 (II), UBQ-rfp-His2B (X *); UBQ-GFP-Cdc20 (II *), UBQ-GFP-Cdc20 (II *); Mad2 EY ( III *) e UBQ-GFP-Cdc20 moscas transgênicas foram previamente gerado em laboratório através de uma abordagem mediada padrão P-elemento transgênico 10,11 e UBQ-rfp-His2B é um presente tipo de Yohanns Belaïche em UMR 144 CNRS / Instituto Curie, Paris, França. Eles foram introduzidos em um fundo Mad2 mutante através de padrão de Drosophila genética. O Mad2 EY linha original mutante foi comprada do estoque Bloomington centro. Nós não vamos discutir o procedimento utilizado para elevar os transformantes neste protocolo.
Nota: * representa o número de cromossomos. - Manutenção: moscas transgénicas foram mantidas a 25 ° C em frascos de plástico containing voar alimentos e de pó de levedura seco adicional no topo. O frasco foi rotineiramente substituído a cada 3-4 semanas, dependendo das condições de crescimento (Figura 1).
2. Fly Preparação de Alimentos (escala de laboratório)
- Uma quantidade apropriada da mistura alimentar mosca foi aquecida com agitação constante para dissolver os componentes.
- Cerca de 8-10 ml deste meio foi distribuído como lama em cada frasco de plástico (2,5 cm de diâmetro x comprimento de 8 cm) utilizando um Jencons Scientific Ltd bomba peristáltica.
- Quando a lama alimento foi definido e ter arrefecido até à temperatura ambiente, o frasco é então ligado com um tampão de espuma de algodão. Estes frascos alimentos são colocados em uma bandeja que é então selado num saco de plástico e mantida a 4 ° C para utilização posterior.
3. Pequena escala coleta de ovos
- Cerca de 50 pares de 2-3 dias de idade moscas adultas foram transferidos para um frasco fresco mosca alimento fornecido com pó de levedura adicional sobre a sua superfície seca a 25 ° C durante leigoção embriões.
- As moscas são então transferidos para um frasco fresco a cada hora e deixar os embriões no frasco durante 30 minutos para assegurar a alguns dos embriões recolhidos são envelhecidas de cerca de 8-10 ciclo nuclear de divisão, quando os núcleos são gradualmente migrar para o córtex e organizada como uma monocamada único. A coleção de primeira hora são normalmente descartados, pois muitas vezes contém embriões idade que foram retidos nos corpos femininos quando as condições não eram adequadas para o assentamento.
4. Preparando Lamelas e slides
- Retire uma lamela de 50 x 22 mm e ligeiramente molhado seus quatro cantos de um lado com uma quantidade muito pequena de água utilizando uma escova de caneta húmido fina e colocá-la numa lâmina de microscópio de modo a que a lamela não se move por causa da tensão superficial capilar causada pela película fina de líquido.
- Aplicar uma tira fina de cola heptano através do meio da lamela, o heptano deve evaporar em segundos para deixar a cola sobre a lamela.
- Corte outra lamela com uma caneta de diamante em quadrados pequenos (~ 1,5 mm 2), pegar um e colocá-lo em uma extremidade da tira de cola (isto é usado para abrir a ponta da agulha quando microinjeção é necessária) e salvar os outros para o futuro usar.
- Pegue outra lâmina de microscópio e enfiar um pedaço de fita dupla face adesiva cerca de 2 cm de comprimento para ele e retire o papel da capa. (Veja a Figura 2A e B).
5. Embriões Dechorionate
- Transferir as moscas para um frasco de alimentos frescos e usar uma escova de caneta humedecido fina para transferir cerca de 50 ovos na fita de dupla face adesiva na lâmina com uma quantidade apropriada de líquido, para permitir que os ovos de ser espalhada. Quando o líquido se evapore os ovos vai ficar com a fita.
- De acordo com um toque estereomicroscópio os ovos várias vezes ao longo de seu eixo longitudinal usando o lado externo da metade de um par de pinças suavemente até que o córion é quebrado e aberto, mas deixar o embrião no chorion shell para evitar a desidratação rápida. Continue este processo até 10-20 dos ovos foi tratado (dependendo do número de ovos necessários para uma única experiência).
- Os embriões podem então ser levantado e retirado do reservatório cório e colocado suavemente sobre a tira de cola, um por um. Os ovos pode ser colocado e alinhado tanto com o lado comprido do paralelo embrião ou anti-paralela ao lado longo da tira de cola depender se eles estão a ser microinjeção.
- Os embriões podem ser coberta imediatamente com uma quantidade apropriada de Voltalef óleo 10S (uma mistura 5:1 de óleo de Holocarbon 700 e 27 óleo, Sigma) para evitar a dessecação ainda mais para imagiologia imediata ou colocado numa câmara de dessecação por 3-8 minutos para desidratar-los ainda mais, dependendo da umidade da sala eo propósito do experimento. Os embriões desidratados deve ser coberta com óleo de 10S, quando apropriado para evitar excesso de desidratação-se microinjecção é necessária. (Veja a figura. 2C, D& E).
6. Embriões de imagem
- Imagens lapso de tempo ou único de embriões vivos são coletados por meio de uma Leica TCS SP2 sistema de microscopia confocal invertido com uma APO PL HCX CS 40X 1,25 objetiva de imersão em óleo (60 ou objetivos 100X pode ser usado também, dependendo da finalidade do experimento, o maior a ampliação usou a foto mais de branqueamento irá ocorrer).
- Quando fluoróforos de imagem múltiplos, que se sobrepõem espectros e são co-expressas no mesmo embrião, cada comprimento de onda de emissão fluorescente de proteína foi recolhido sequencialmente. Os comprimentos de onda de excitação e emissão disponíveis no sistema Leica SP2 TCS são: GFP, λ Ex: 488 nm e λ Em: 500-600 nm. RFP, λ Ex: 543 nm e λ Em: 555-700 nm.
- Uma única imagem foi geralmente obtido como uma média de 2 scanlines com uma média de 2 moldura-scans. Isso leva um mínimo de 6,3 segundos para digitalizar uma p 512x512Ixel imagem num modo de varrimento simultâneo, e 15,44 segundos para um modo de busca sequencial e produz uma relação sinal-ruído boa. Estes tempos precisam ser levados em conta quando configurar os prazos para lapso de tempo de coleta de imagem.
- O furo foi normalmente ajustado para 1-2 UA (unidade arejado), ea potência do laser foi ajustado para o nível mais baixo possível, para evitar qualquer fotobranqueamento significativa.
7. Provocar o SAC por Microinjecting os embriões com reagentes apropriados
- Preparar a agulha antes da experiência. Nós preferimos retirar a agulha da siliconada capilares de vidro (GC-100-10, de Harvard), utilizando o flamejante / marrom micropipeta extrator (Instrumento Sutter, Modelo: P-97) com os parâmetros: calor = 600, puxe = 90, vel = 70 , del = 150.
- Aterrar a agulha com 1-2 ml de uma concentração apropriada do reagente em tampão de injecção utilizando uma ponta de carregamento fina (20 lote Eppendorf uL: W215818J).
- Montar a agulha na agulha holder no microscópio com o tubo de pressão ligado ao sistema de controlo de injecção Eppendorf.
- Encontrar um embrião sob a objectiva de 40x e encontrar a sombra agulha sem alterar o plano focal, movendo a agulha no centro do campo de vista e, gradualmente, reduzindo-a para o plano focal direita.
- Mover o embrião fora suavemente para encontrar o pequeno quadrado da lamela quebrada pré-montado numa extremidade da tira de cola. Muito gentilmente mover a ponta da agulha até atingir a borda da lamínula quadrado pequeno e delicadamente quebra-lo aberto.
- Mova os embriões de volta em exibição e selecione o embrião da idade certa para injeção. Eu normalmente injetar o embrião no ciclo de divisão nuclear em 5-7 como este é antes de os núcleos migram para o exterior para o córtex. As fases do ciclo de divisão nuclear pode ser determinada por uma análise rápida dos sinais de fluorescência da GFP-Cdc20 ou o sinal nuclear do 2B RFP-Histona antes da injecção 9.
- Mover cuidadosamente o EmbryO próximo da agulha e reajustar o plano focal para ambos o embrião e da agulha. Mova o embrião para a agulha e injetar uma gota do reagente para a posição desejada e mova o embrião de distância (ou siga as instruções para o sistema de microinjeção). O embrião pode ser injectado a partir da sua posterior ou a partir do lado, dependendo da finalidade da experiência.
- Uma vez injetado o embrião está pronto para ser trabalhada no momento apropriado. (Veja a Figura 2F & G)
8. Os resultados representativos
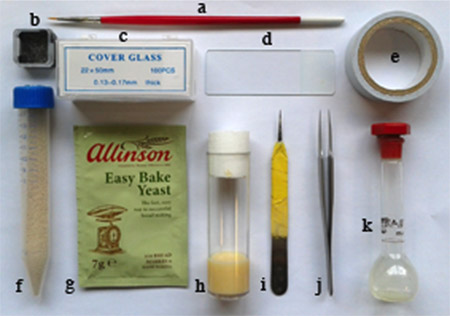
Figura 1. Materiais necessários: a. escova de caneta fina, b. pequeno recipiente quebrados óculos quadrado, c. 22 x 50 mm lamela, d. lâmina de microscópio, e. fita dupla face adesiva, f. pó de levedura seca, em tubo de ensaio com orifícios na tampa, g. leveduragrânulo usado para a manutenção da mosca, h. voar frasco de alimentos, i. uma metade de uma pinça utilizados para embriões dechorionate, j. uma pinça par, k. heptano recipiente de líquido de cola (balão volumétrico).

Figura 2. Os diagramas mostram a preparação de as lamelas e slides no passo 4, dechorionation embrião no passo 5 e preparações de agulhas para microinjecção no passo 7. Uma. A imagem acima mostra uma lamela com uma tira de cola heptano em toda a sua média e uma pequena praça de uma lamela quebrado preso a uma extremidade. A imagem inferior mostra uma lâmina de microscópio com uma fina camada de água nos seus quatro cantos para segurar uma lamela. A razão para usar uma lâmina para segurar a lamela é manter mais ou menos a mesma distância focal como a encontrada quando você tem fita dupla face nos slides e evitando assim a recentragem do microscópio enquanto você are dissecando e transferindo os embriões entre fita e lamela. B. Um slide com um pequeno pedaço de fita dupla face Scotch aplicado antes de descascar seu papel da capa usada para dechorionating o embrião. C. A imagem da esquerda mostra embriões com conchas intactas córion com marcados extremidades anterior e posterior; a imagem à direita mostra os embriões nas cascas córion quebrados antes de serem transferidos para a lamela com a tira cola D & E Diagramas mostrando dois.. formas de transferência, colocação e alinhamento dos embriões dechorionated em tiras de cola. Os embriões foram cobertos por óleo 10S após um período de dessecação apropriado. F e G. diagramas mostrando como para abrir a ponta da agulha e posicioná-lo de modo a injectar.
Imagens individuais ou lapso de tempo obtidos a partir das experiências descritas acima podem ser diretamente analisados usando o software Leica ou salvos em arquivos TIF como fo abertormat disponíveis para a quantificação mais ou análises usando outros programas de edição de imagem comuns de análise, tais como Imagem J, Photoshop e etc MetaMorph Dois exemplos para ilustrar isso são discutidos abaixo:
Exemplo 1: Um filme de lapso de tempo (Figura 3) mostra o recrutamento cinetocoro dinâmica da GFP Cdc20 e movimento cromossomo em viver embriões de Drosophila sinciciais. A região de interesse a partir de imagens originais do lapso de tempo foi determinada seqüência / editado e convertido de lote automatizado utilizando o software Photoshop. O filme foi montado utilizando o software QuickTime.
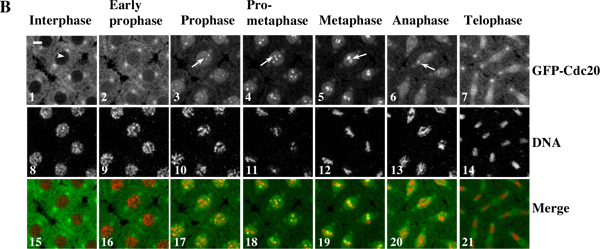
Figura 3. Um filme de lapso de tempo mostra o recrutamento cinetocoro dinâmica da GFP Cdc20 e movimento cromossomo em viver embriões de Drosophila sinciciais. (A) lapso de tempo as imagens foram retiradas de um embrião transgênico sincicial co-expressando GFP-Cdc20 (em verde)e RFP-histona 2B (em vermelho) e proteínas de fusão foram gravados usando uma Leica TCS sistema SP2 confocal a 18 ° C durante os ciclos de divisão nuclear 7-8. Quadros foram realizadas a cada 10 segundos. O quadro com as células já em prófase é tratada como o ponto de tempo zero 10. Clique aqui para ver filme para Figura 3A . (B) GFP-Cdc20 pode ser facilmente observada na prófase e cinetócoros prometáfase (B3 e 4, setas brancas) e persiste em metáfase e anáfase cinetócoros (B5 e 6, setas brancas). GFP-Cdc20 é excluído da interfase núcleo (seta branca), entrar no núcleo por prófase. Morfologias de cromatina foram determinados usando co-expressa His2BmRFP como marcadores (B8-14). Bares = 5mm.
Exemplo 2: funções do SAC pode ser estudada através da manipulação dos embriões por anticorpos, proteínas microinjecting fluorescente etiquetado ou chemical compostos de interesse que, potencialmente, desencadear o SAC. Para a colchicina exemplo injecção para despolimerizar os microtúbulos de modo a provocar o SAC, tal como indicado na Figura 4 10.
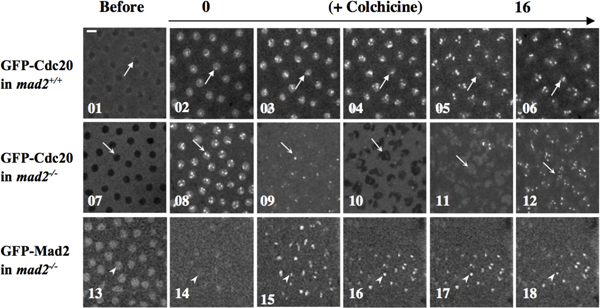
Figura 4. Mad2 é essencial para colchicina-invocado função SAC 10. GFP-cdc20; Mad2 + / +, GFP-cdc20; Mad2 EY (Mad2 - / - nula mutante) e GFP-Mad2; Mad2 embriões EY foram tratados com colchicina por microinjecção. Lapso de tempo imagens confocal foram tomadas antes (01, 07 e 13) ou após a injeção (02-06, painéis de topo; 08-12, painéis de média; 14-18, painéis de fundo). GFP-Cdc20 (painéis superior e meio) ou GFP-Mad2 (painel inferior) sinais de cinetocoro foram utilizados como marcadores de células a progressão do ciclo. Painel superior, as setas indicam os cinetócoros presos em 02-06. A área marcada por uma seta em 01 indica que antes do tratamento colchicina, GFP-CDC20 está excluído do núcleo interfase tarde. Painel do meio, na ausência de Mad2 endógena, GFP-Cdc20 sinais continuar a oscilar para dentro e para fora do núcleo, e ligado e desligado os cinetócoros, embora citocinese parece ser defeituoso, como seria de esperar em embriões que faltam os microtúbulos, na presença de colchicina (indicado pelas setas na 07-12), sugerindo uma função SAC falhou em prender as células em resposta ao tratamento colchicina. Separação do núcleo filha não na imagem 10. Painel de fundo, pontas de seta em 14-18 indicam cinetócoros presos com GFP-Mad2 acumulado proteínas de fusão para sugerir a funcional GFP-Mad2 no resgate do fenótipo defeito SAC em Mad2 embrião mutante. Arrowhead em 13 indica GFP-Mad2 acumulação em um núcleo interfásico tarde. Bar = 5mm. Os embriões foram microinjeção com ~ volume de ovo de 1% de uma solução de 100mg/ml colchicina estoque em 1 x PBS.
Discussão
O protocolo aqui descrito é um método genérico para imagiologia voar embriões sinciciais utilizando uma Leica TCS SP2 microscópio confocal de laser e pode ser modificada para se adequar sistemas de microscópio e outros podem também ser adaptados para estudar as funções de outros genes, utilizando embriões de Drosophila sinciciais. Nós temos usado esse protocolo para estudar vários aspectos do checkpoint do fuso, dinâmica de proteínas e proteólise da proteína usando moscas transgénicas ou anticorpos policlonais para visualizar a localização de proteínas em amostras vivas ou fixo 4,6,12-14.
É mais simples para manter as moscas em frascos de alimentos frescos mosca aquando da recolha números pequenos (~ 10 - 100) de ovos. Isso reduz o incômodo de fazer e preparar adicionais maçã placas de ágar suco e câmaras de coleta de ovos, conforme descrito em outras publicações 15,16. A adição de um pequeno quadrado de vidro quebrado lamela em uma extremidade da tira de cola sobre a lamela torna muito mais fácilpara abrir a agulha e determinar o volume de injecção, ajustando as configurações do sistema microinjecção, enquanto a agulha é imersão no óleo 10S. O grau de dessecação do embrião é importante para o sucesso da injecção em evitar fugas e manter a viabilidade dos embriões especialmente para aquelas experiências que requerem um longo período de tempo ou quando elevar transformantes após a injecção. No entanto, não existe uma regra de ouro para exactamente quanto tempo a dessecação é necessária. Isto varia de experiência para experiência e depende da quantidade da solução injectada ea humidade do ambiente de trabalho.
As funções de uma proteína específica de interesse pode ser manipulado por microinjecting inibidores da proteína específicas, mono ou poli-clonais anticorpos contra uma proteína específica, o RNA mensageiro ou péptidos marcados fluorescentemente sob tipo selvagem ou fundos mutação genética. Muitas dessas linhagens mutantes ou GFP linhagens transgênicas são publicamente avdisponív eis de Drosophila estoque centros ea maioria deles estão listados no Flybase ( http://flybase.org/~~V ) e podem ser pesquisados on-line.
Divulgações
Não temos nada a divulgar.
Agradecimentos
Este protocolo foi desenvolvido no âmbito de um Wellcome Trust subvenção. Agradecemos a Sra. Maureen Sinclair para manter os estoques de moscas e preparar a comida mosca ao longo dos anos. Gostaríamos também de agradecer ao Sr. Michael Aitchison por sua ajuda e apoio técnico no desenvolvimento deste protocolo.
Materiais
Equipamento essencial e reagentes:
Sistema de imagem confocal: O sistema de imagem descritos neste protocolo é uma Leica TCS SP2 sistema de varredura a laser microscópio confocal invertido. O método descrito é também adequado talvez com algumas pequenas modificações para sistemas de imagens outros.
Microscópio de dissecção: Usamos um SZX7 Olympus com DF PLAPO 1X-4 lente.
Agulha extrator: Flaming / marrom micropipeta puxador (de Instrumento Sutter, modelo: P-97).
Sistema de microinjecção: Um sistema de microinjecção Eppendorf é descrito, mas qualquer outro sistema adequado pode ser usado.
Fly distribuidora de alimentos: Jencons Scientific Ltd bomba peristáltica.
Reagentes:
| Name | Company | Catalog Number | Comments |
| Ingredientes | Pesos | Recursos | N. º de Lote |
| Farinha de milho | 100,0 g | SUMA, Reino Unido | |
| Açúcar mascavo | 50,0 g | Billington, UK | |
| A levedura seca | 25,0 g | DCL LEVEDURA Ltd. do Reino Unido | |
| Agar | 12,5 g | Fisher Scientific | 106556 |
| O ácido sórbico | 0,4 g | BDH, VWR International Ltd. no Reino Unido | 8829310 |
| O ácido benzóico | 2,9 g | Fisher Scientific | 1019599 |
| Nipagin (Metil-4-Hidro xybenzoate) | 0,9 g | BDH, VWR International Ltd. no Reino Unido | K35969015 |
| H 2 O até 1L | |||
Holocarbon 700 e 27 óleos adquiridos de Sigma.
A levedura seca: Thomas Allison, Reino Unido.
Preparar a cola heptano: Pegue cerca de 1,5 metros de fita dupla face Scotch, colocá-lo em um tubo Falcon 15ml com 5 ml de heptano e rodar por 3-5 horas ou durante a noite. Após esse tempo dividido em 4 alíquotas iguais em 1,5 ml tubos de centrífuga eppendorf e girar durante 5 min a uma velocidade rápida numa centrífuga de bancada para remover todos os detritos. Armazenar a solução de cola de heptano num balão volumétrico de 10 ml e manter para utilização. A força de cola irá variar de acordo com a concentração e as quantidades de a cola utilizada. Normalmente, a mais fina de cola produz menor ruído de fundo quando verificado pelo microscópio confocal.
- Lamela: BDH, VWR International Ltd. no Reino Unido
- Lâmina de microscópio: BDH, VWR International Ltd. no Reino Unido
- Siliconizado capilares de vidro: GC-100-10, Harvard
- Ponta de carga Fina: 20 uL muito eppendorf: W215818J
- Pinça
- Escova caneta fina
Referências
- Holland, A. J., Cleveland, D. W. Boveri revisited: chromosomal instability, aneuploidy and tumorigenesis. Nat. Rev. Mol. Cell Biol. 10, 478-4787 (2009).
- Zekanowski, C., Wojda, U. Aneuploidy, chromosomal missegregation, and cell cycle reentry in Alzheimer's disease. Acta Neurobiol. Exp. (Wars). 69, 232-253 (2009).
- Buffin, E., Emre, D., Karess, R. E. Flies without a spindle checkpoint. Nat. Cell Biol. 9, 565-572 (2007).
- Tang, Z., Shu, H., Oncel, D., Chen, S., Yu, H. Phosphorylation of Cdc20 by Bub1 provides a catalytic mechanism for APC/C inhibition by the spindle checkpoint. Mol. Cell. 16, 387-397 (2004).
- Huang, J., Raff, J. W. The disappearance of cyclin B at the end of mitosis is regulated spatially in Drosophila cells. EMBO Journal. 18, 2184-2195 (1999).
- Xia, G. Conformation-specific binding of p31(comet) antagonizes the function of Mad2 in the spindle checkpoint. Embo. J. 23, 3133-3143 (2004).
- Lorca, T. Fizzy is required for activation of the APC/cyclosome in Xenopus egg extracts. Embo. J. 17, 3565-3575 (1998).
- Howell, B. J. Cytoplasmic dynein/dynactin drives kinetochore protein transport to the spindle poles and has a role in mitotic spindle checkpoint inactivation. J. Cell Biol. 155, 1159-1172 (2001).
- Foe, V. E., Alberts, B. M. Studies of nuclear and cytoplasmic behaviour during the five mitotic cycles that precede gastrulation in Drosophila embryogenesis. Journal of cell science. 61, 31-70 (1983).
- Li, D., Morley, G., Whitaker, M., Huang, J. Y. Recruitment of Cdc20 to the kinetochore requires BubR1 but not Mad2 in Drosophila melanogaster. Mol. Cell Biol. 30, 3384-3395 (2010).
- Karess, R. E., Glover, D. P element mediated germ line transformation of Drosophila. DNA cloning: A practical approach. 2, 121-141 (1985).
- Wakefield, J. G., Huang, J. Y., Raff, J. W. Centrosomes have a role in regulating the destruction of cyclin B in early Drosophila embryos. Current Biology. 10, 1367-1370 (2000).
- Huang, J. Y., Raff, J. W. The dynamic localisation of the Drosophila APC/C: evidence for the existence of multiple complexes that perform distinct functions and are differentially localised. Journal of Cell Science. 115, 2847-2856 (2002).
- Raff, J. W., Jeffers, K., Huang, J. Y. The roles of Fzy/Cdc20 and Fzr/Cdh1 in regulating the destruction of cyclin B in space and time. Journal of Cell Biology. 157, 1139-1149 (2002).
- Brust-Mascher, I., Scholey, J. M. Microinjection Techniques for Studying Mitosis in the Drosophila melanogaster Syncytial Embryo. J. Vis. Exp. (31), e1382 (2009).
- Figard, L., Sokac, A. M. Imaging Cell Shape Change in Living Drosophila Embryos. J. Vis. Exp. (49), e2503 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados