Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Métodos de ensayo a Drosophila Comportamiento
En este artículo
Resumen
Drosophila melanogaster es un sistema de genética y de comportamiento modelo manejable que se ha utilizado para entender las bases moleculares y celulares de muchos procesos biológicos importantes para más de un siglo 1. Drosophila ha sido bien aprovechado para hacerse una idea de la base genética del comportamiento de las moscas.
Resumen
Drosophila melanogaster, la mosca de la fruta, se ha utilizado para estudiar los mecanismos moleculares de una amplia gama de enfermedades humanas tales como cáncer, enfermedades cardiovasculares y diversas enfermedades neurológicas 1. Hemos optimizado los ensayos de comportamiento simples y robustos para determinar la locomoción de larvas, la capacidad de escalada para adultos (ensayo anillo), y comportamientos de cortejo de Drosophila. Estos ensayos de comportamiento son ampliamente aplicables para el estudio del papel de los factores genéticos y ambientales en el comportamiento de la mosca. Capacidad de rastreo de las larvas puede utilizarse de manera fiable para determinar los cambios en las primeras etapas de las habilidades que se arrastran de las larvas de Drosophila y también para examinar el efecto de las drogas o los genes de enfermedades humanas (en moscas transgénicas) en su locomoción. El ensayo de rastreo de las larvas es más aplicable si la expresión o la supresión de un gen que causa la letalidad de la pupa o adulto, ya que estas moscas no sobreviven a la edad adulta que de otro modo podría ser evaluada. Este básico de unssay también puede ser utilizado en conjunción con la luz brillante o estrés adicionales para examinar las respuestas de comportamiento en larvas de Drosophila. El comportamiento de cortejo ha sido ampliamente utilizado para investigar las bases genéticas de la conducta sexual, y también se puede utilizar para examinar la actividad y la coordinación, así como el aprendizaje y la memoria. El comportamiento de cortejo de Drosophila implica el intercambio de diferentes estímulos sensoriales como visuales, auditivas, y las señales de quimiosensoriales entre hombres y mujeres que llevan a una compleja serie de conductas motoras bien caracterizados que culminaron en la cópula exitosa. Los ensayos tradicionales para adultos de escalada (geotaxis negativas) son el trabajo tedioso, intensiva, y requiere mucho tiempo, con una variación significativa entre los diferentes ensayos 2-4. El rápido iterativo geotaxis negativos (RING) ensayo de 5 tiene muchas ventajas sobre los protocolos más ampliamente utilizados, proporcionando un enfoque de rendimiento reproducible, sensible y de alta para cuantificar la locomotora de adultos y negativos b geotaxisehaviors. En el ensayo de ANILLO, varios genotipos o tratamientos de drogas se puede probar de forma simultánea con gran número de animales, con el enfoque de alto rendimiento por lo que es más susceptible para los experimentos de detección.
Protocolo
A. Ensayo de larvas Crawling
1. Las larvas Colección
- Establecer una botella de 8 onzas de moscas (machos + 10-15 10-15 hembras).
- Que las moscas ponen sus huevos durante 24 horas, luego de botella clara de las moscas. (Transferencia de los adultos en una nueva botella y repita si es necesario).
- Incubar la botella durante 3-4 días, o hasta que las larvas son visibles.
- Agregar 50 a 100 ml de sacarosa al 20% de la botella con las larvas y deje reposar durante 20 minutos. Las larvas flotan en la parte superior.
- Recoger las larvas con una pipeta serológica de 25 ml con la punta cortada, y el lugar en una cesta de malla.
- Lávese las larvas en la cesta de malla dos veces con agua desionizada H 2 O. Las larvas están listas para los experimentos.
2. Para el tratamiento de las larvas con las drogas
- Utilizar un pincel para transportar el número deseado de las larvas a un vaso de precipitados de 5 ml que contiene una solución de sacarosa al 5% + fármaco.
- Que las larvas se alimentan por lo menos 15 minutos.
- Vierta tratados con el fármaco larvas en una cesta de malla y enjuague. Ahora están listos para usar.
3. Ensayo de locomotora (medida de la distancia total recorrida o las contracciones de la pared corporal)
- Use un cepillo para el transporte de larvas de individuo a un:
- 15 cm de placa de Petri que contenía 2% de agarosa (previamente vertió y se deja endurecer) sobre papel milimetrado con un 0,2 cm 2 cuadrícula.
- Contar el número de líneas de la cuadrícula cruzado en 1 minuto.
- Bien de un plato de vidrio que contiene una disección solución de levadura pasta diluida.
- Cuente las contracciones peristalsis (anterior pleno movimiento posterior contracción = 1) en un minuto mientras se observa bajo un microscopio de disección.
- 15 cm de placa de Petri que contenía 2% de agarosa (previamente vertió y se deja endurecer) sobre papel milimetrado con un 0,2 cm 2 cuadrícula.
- Repita hasta que los números deseados de las larvas han sido contados.
B. rápido iterativo geotaxis negativos (ARO) del Protocolo
Este ensayo fue De originalmentedescrito por Gargano et al 5.
- Recoger las moscas recién emergidas adultos de sexo masculino menores de CO 2 anestesia ligera y el lugar en un alimento vial estándar que contiene (o comida + drogas).
- Mantener a las moscas a temperatura ambiente (en la parte superior del banco. ~ 22 ° C) durante 2-3 días para permitir la recuperación de CO 2 (y la acumulación de los niveles del fármaco en estado estacionario en su caso).
- Transferir aproximadamente 25 moscas sin anestesiar a viales de poliestireno preparadas.
- Montar viales con moscas en el aparato de anillo (Figura 1).
- Permita que las moscas se adapte al medio ambiente, sin ser molestado, durante 15-20 minutos.
- En este lugar la cámara digital de tiempo ~ 1 m por delante del aparato (en una plataforma, si es necesario para alinear el centro de la lente a media altura de los viales), el enfoque y zoom con la cámara en el aparato, y establecer un temporizador para 3,0 segundos.
- Con cuidado, sujete el aparato de anillo de modo que no con la mano izquierda a la disturb las moscas, y sostienen que el temporizador con la mano derecha.
- Fuertemente toque el aparato hacia abajo sobre la superficie del banco de tres veces, asegurándose de que el grifo es lo suficientemente duro para tumbar todas las moscas a la parte inferior de los viales.
- Simultáneamente con la terminación de la llave en tercer lugar, iniciar el temporizador de cuenta atrás de 3 segundos.
- En tres segundos, tomar una fotografía.
- Restablecer el temporizador de 1 minuto y comenzar. Durante este tiempo, reajustar la cámara y se centran en el aparato, y establecer otro canal del temporizador durante tres segundos.
- Después de 1 minuto, repita los pasos 1.7-1.10
- Después de un total de 5-6 ensayos, subir imágenes a un ordenador y usar el visor de imágenes preferida para abrir y marcar la altura promedio subió para cada vial.
- Realizar análisis estadístico de los diferentes grupos que comparan la altura media subió.
C. El cortejo y apareamiento de ensayo
- A primera hora de la mañana, claros y productoras de botellas de FLIes para ser utilizado.
- En el transcurso del día (cada 3-4 horas), recoger recién emergidas machos sexualmente ingenuos y mujeres:
- Coloque los hombres individualmente en frascos o tubos con el medio.
- Coloque 5-6 hembras juntos por vial / tubo.
- Aislar las moscas recolectadas a 25 ° C en 12 h luz / oscuridad durante 5 días.
- Transferencia de una mujer dentro de la cámara de una rueda de apareamiento.
- Transferencia de un macho en la cámara de una rueda de apareamiento.
- Observar par bajo un microscopio de disección de los siguientes comportamientos:
- Orientación (los varones se orienta hacia la mujer)
- Al tocar (el macho golpea a la hembra)
- Canción del ala (el macho se extiende y hace vibrar un ala)
- Licking (lame los varones los genitales femeninos)
- Curling (el macho se curva su abdomen debajo de sí mismo)
- Intento de cópula (Curling la actividad al intentar montar a la hembra)
- Observe si hay una0 minutos o hasta que la copulación con éxito, teniendo en cuenta el momento en que cada comportamiento se produce (latencia), el tiempo total involucrado en el comportamiento de cortejo hasta la copulación (para calcular el índice de noviazgo), así como el número de pares que realizar con éxito un determinado comportamiento ( frecuencia). 100% de pares de tipo salvaje generalmente se aparean dentro de los 5 minutos.
- Calcular un índice de cortejo (IC) al dividir el tiempo en el cortejo, dividido por el tiempo total hasta la cópula. Para los pares de tipo salvaje esto por lo general oscila entre 0.6-0.8.
D. Representante Resultados
Rastreo de ensayo
Larva normal de tipo salvaje vagará ~ 3 cm / minuto, y exhibición del ~ 40-50 contracciones de la pared del cuerpo en un minuto. Recientemente hemos desarrollado un modelo de Drosophila FUS / TLS relacionada con la esclerosis lateral amiotrófica que muestra defecto de larvas arrastrándose, esperanza de vida reducida y adultos escalada deterioro 6. Nos centramos en la expresión of de tipo salvaje y formas mutantes de FUS / TLS para las neuronas motoras (OK-371-GAL4 conductor) y realizó un ensayo de rastreo de las larvas. Como se muestra a continuación, las larvas de tipo salvaje arrastran hasta 12 cm, mientras que la expresión de la FUS de tipo salvaje disminución de la capacidad de las larvas arrastrándose de unos 6 cm. Los animales que expresan la mutación R521C ALS causando en FUS / TLS demostrar un deterioro muy grave en su movimiento de rastreo (Figura 1), el rastreo sólo aproximadamente 1 cm por minuto.
Geotaxis negativo del ensayo ANILLO
Jóvenes de tipo salvaje moscas adultas deben tener una altura media de subida de ~ 4-5 cm en un período de tiempo de 3 segundos (el tiempo se puede ajustar de 3 segundos para dar cabida a diferentes cepas o los niveles de actividad para definir una altura promedio determinado para una determinada cepa / tratamiento). Las moscas que se mantienen en la parte inferior se le asigna un valor de 0. No se recomienda usar más de 25 moscas por vial, ya que entonces se hace difícil determinar la ubicación de cada individuo mosca para medir la altura. Ndesensibilización o se ha observado menos hasta los 6 ensayos consecutivos espaciados 1 minuto, aparte de que hemos empleado. Es crítico no reutilizar los viales de ensayo de poliestireno en este ensayo después de los conjuntos iniciales de datos son recogidos por moscas nuevas colocadas en viales utilizados no subirá a la misma medida en viales frescos.
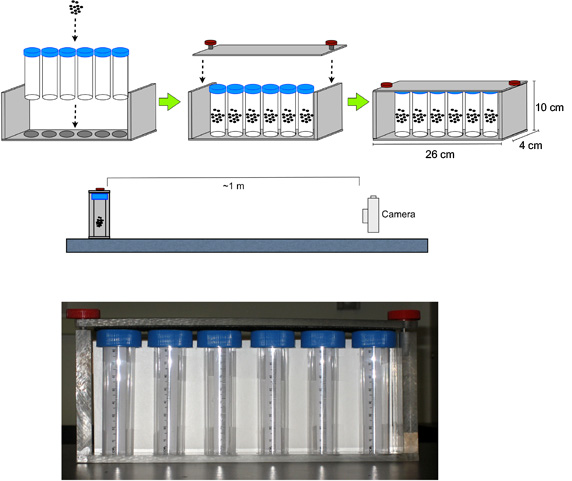
Figura 1. De instalación para el ensayo de ANILLO. La cámara digital se coloca aproximadamente 1 m por delante del aparato que contiene las moscas en los viales de poliestireno, el enfoque y zoom con la cámara en el aparato, y establecer un temporizador de 3.0 segundos.
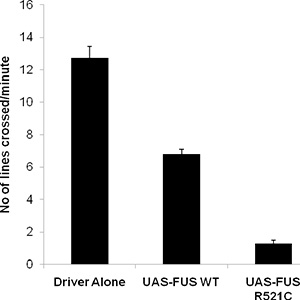
Datos de la figura 2. Representativos de la prueba de rastreo utilizando larvas moscas ectópica expresar UAS-FUS WT, y UAS-FUS R521C bajo el control de un controlador de la neurona motora (OK371-GAL4).
Discusión
El comportamiento de Drosophila está estrechamente regulada por factores genéticos y ambientales. Nosotros, y otros, han utilizado previamente los ensayos descritos aquí para recoger datos para examinar los genes relacionados a volar a los comportamientos y las enfermedades neurodegenerativas humanas modeladas en Drosophila 5-19. Para la prueba de rastreo, la selección cuidadosa de 3 de las larvas es un paso crítico. Si el tratamiento con un fármaco, se tardará 10-15 minuto...
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Nos gustaría dar las gracias a Astha Maltare para la generación de los datos se arrastran larvas. Nos gustaría agradecer al Dr. Nicolás Lanson Jr. para dar sus comentarios sobre el manuscrito. Este trabajo fue apoyado por el Centro Robert Packard para la ELA en la Universidad Johns Hopkins (para UBP) y la Asociación de Esclerosis Lateral Amiotrófica (UBP), y R01MH083689 de los Institutos Nacionales de Salud Mental (CDN).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
| Sacarosa | Fisher Scientific | S5-500 | |
| Agarosa | Invitrogen | 16500-500 | |
| 6 oz botella de Drosophila | Genesee Científico | 32-130 | |
| Paint Brush (# 1) | Ted Pella, Inc. | 11859 | |
| Fly componentes de los alimentos | |||
| Harina de maíz | Fisher Scientific | NC9109741 | |
| Agar | Genesee Científico | 66-104 | |
| Melaza | Fisher Scientific | NC9349176 | |
| El ácido propiónico | Acros | 14930-0010 | |
| Tegosept | Ápice | 20-258 | |
| Etanol | PescadorCientífico | BP2818-4 | |
| Levadura | Genesee Científico | 62-107 |
Referencias
- Pandey, U. B., Nichols, C. D. Human disease models in Drosophila melanogaster and the role of the fly in therapeutic drug discovery. Pharmacol. Rev. 63 (2), 411-436 (2011).
- Feany, M. B., Bender, W. W. A Drosophila model of Parkinson's disease. Nature Mar. 23 (6776), 394-398 (2000).
- Auluck, P. K., Bonini, N. M. Pharmacological prevention of Parkinson disease in Drosophila. Nat. Med. 8 (11), 1185-1186 (2000).
- Whitworth, A. J., Theodore, D. A., Greene, J. C., Benes, H., Wes, P. D., Pallanck, L. J. Increased glutathione Stransferase activity rescues dopaminergic neuron loss in a Drosophila model of Parkinson's disease. Proc. Natl. Acad. Sci. U.S.A. 102 (22), 8024-8029 (2005).
- Gargano, J. W., Martin, I., Bhandari, P., Grotewiel, M. S. Rapid iterative negative geotaxis (RING): a new method for assessing age-related locomotor decline in Drosophila. Exp. Gerontol. 40 (5), 386-395 (2005).
- Lanson, N. A., Maltare, A., King, H., Smith, R., Kim, J. H., Taylor, J. P., Lloyd, T. E., Pandey, U. B. A Drosophila model of FUS-related neurodegeneration reveals genetic interaction between FUS and TDP-43. Hum. Mol. Genet. 20 (13), 2510-2523 (2011).
- Batlevi, Y., Martin, D. N., Pandey, U. B., Simon, C. R., Powers, C. M., Taylor, J. P., Baehrecke, E. H. Dynein light chain 1 is required for autophagy, protein clearance, and cell death in Drosophila. Proc. Natl. Acad. Sci. U.S.A. 107 (2), 742-747 (2010).
- Sang, T. K., Chang, H. Y., Lawless, G. M., Ratnaparkhi, A., Mee, L., Ackerson, L. C., Maidment, N. T., Krantz, D. E., Jackson, G. R. A Drosophila model of mutant human parkin-induced toxicity demonstrates selective loss of dopaminergic neurons and dependence on cellular dopamine. J. Neurosci. 27 (5), 981-992 (2007).
- Stacey, S. M., Muraro, N. I., Peco, E., Labbé, A., Thomas, G. B., Baines, R. A., van Meyel, D. J. Drosophila glial glutamate transporter Eaat1 is regulated by fringe-mediated notch signaling and is essential for larval locomotion. J. Neurosci. 30 (43), 14446-14457 (2010).
- Repnikova, E., Koles, K., Nakamura, M., Pitts, J., Li, H., Ambavane, A., Zoran, M. J., Panin, V. M. Sialyltransferase regulates nervous system function in Drosophila. J. Neurosci. 30 (18), 6466-6476 (2010).
- Repnikova, E., Koles, K., Nakamura, M., Pitts, J., Li, H., Ambavane, A., Zoran, M. J., Panin, V. M. Sialyltransferase regulates nervous system function in Drosophila. J. Neurosci. 30 (18), 6466-6476 (2010).
- Nedelsky, N. B., Pennuto, M., Smith, R. B., Palazzolo, I., Moore, J., Nie, Z., Neale, G., Taylor, J. P. Native functions of the androgen receptor are essential to pathogenesis in a Drosophila model of spinobulbar muscular atrophy. Neuron. 67 (6), 936-952 (2010).
- Lorenzo, D. N., Li, M. G., Mische, S. E., Armbrust, K. R., Ranum, L. P., Hays, T. S. Spectrin mutations that cause spinocerebellar ataxia type 5 impair axonal transport and induce neurodegeneration in Drosophila. J. Cell Biol. 189 (1), 143-158 (2010).
- Wang, J. W., Brent, J. R., Tomlinson, A., Shneider, N. A., McCabe, B. D. The ALS-associated proteins FUS and TDP-43 function together to affect Drosophila locomotion and life span. J. Clin. Invest. , (2011).
- Choi, J. K., Jeon, Y. C., Lee, D. W., Oh, J. M., Lee, H. P., Jeong, B. H., Carp, R. I., Koh, Y. H., Kim, Y. S. A Drosophila model of GSS syndrome suggests defects in active zones are responsible for pathogenesis of GSS syndrome. Hum. Mol. Genet. 19 (22), 4474-4489 (2010).
- Ruan, H., Wu, C. F. Social interaction-mediated lifespan extension of Drosophila Cu/Zn superoxide dismutase mutants. Proc. Natl. Acad. Sci. U.S.A. 105 (21), (2008).
- Slawson, J. B., Kim, E. Z., Griffith, L. C. High-resolution video tracking of locomotion in adult Drosophila melanogaster. J. Vis. Exp. (24), (2009).
- Becnel, J., Johnson, O., Luo, J., Nässel, D. R., Nichols, C. D. The serotonin 5-HT7 Dro receptor is expressed in the brain of Drosophila, and is essential for normal courtship and mating. PLoS One. 6 (6), e20800 (2011).
- Johnson, O., Becnel, J., Nichols, C. D. Serotonin 5-HT(2) and 5-HT(1A)-like receptors differentially modulate aggressive behaviors in Drosophila melanoga- ster. Neuroscience. 158 (2), 1292-1300 (2009).
- Bastock, M., Manning, A. The Courtship of Drosophila Melanogaster. Behaviour. , 85-111 (1955).
- Greenspan, R. J., Ferveur, J. F. Courtship in Drosophila. Annu. Rev. Genet. 34, 205-232 (2000).
- Villella, A., Hall, J. C. Neurogenetics of courtship and mating in Drosophila. Adv. Genet. 62, 67-184 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados