このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
アッセイのメソッドショウジョウバエ行動
要約
キイロショウジョウバエでは、世紀の1以上にわたり、多くの重要な生物学的過程の分子および細胞基盤を理解するために使用されている遺伝的に行動的に扱いやすいモデル系である。 ショウジョウバエがよく飛ぶ行動の遺伝的洞察を得るために利用されてきた。
要約
キイロショウジョウバエ 、ショウジョウバエは、例えば癌、心血管疾患や様々な神経疾患1などのヒト疾患の広い範囲の分子機構を研究するために使用されています。私たちは、幼虫の移動、大人のクライミング能力(リングアッセイ)、 ショウジョウバエの求愛行動を決定するためのシンプルかつ堅牢な行動アッセイを最適化した。これらの行動のアッセイは、ハエの行動に関する遺伝的要因と環境要因の役割を研究するために広く適用されます。幼虫のクロール能力は確実にショウジョウバエの幼虫のクロール能力の早期の変化を決定するため、また、それらの運動に薬やヒト疾患遺伝子の効果を(トランスジェニックハエの)を調べるために使用することができます。彼らがそうでなければ評価することができたところこれらのハエが大人に生きていけないように遺伝子の発現または廃止は、蛹の大人の段階で致死性が発生した場合に幼虫のクロールアッセイは、より適切になります。この基本的なssayは、 ショウジョウバエの幼虫で追加行動反応を調べるために、明るい光やストレスと組み合わせて使用することもできます。求愛行動は広く性的行動の遺伝的基礎を調査するために使用されており、また同様に学習や記憶など、活動との調整を調べるために使用することができます。 ショウジョウバエの求愛行動は、視覚、聴覚、および嗅覚信号を含む様々な感覚刺激の交換を伴う成功した交尾で絶頂に達する十分に特徴付けられ、モータの動作の複雑な一連につながる男女の間に。伝統的な成人登山のアッセイは、(負の走地性)は、異なる試験2月4日の間には有意な変化で、退屈な、労働集約的で、時間がかかります。急速(RING)負の走地性を反復アッセイ図5に示すように 、再現性に敏感な、高スループットのアプローチ大人の運動を定量化すると負の走地性bを提供し、より広く用いられてプロトコルを介して多くの利点がありますehaviors。リングアッセイでは、いくつかの遺伝子または薬物治療は、ハイスループットスクリーニングのアプローチは、実験のほうが従順することで、同時に動物の多数を使用してテストすることができます。
プロトコル
A.幼虫クロールアッセイ
1。幼虫コレクション
- ハエの8オンスボトル(10-15男性+女性10月15日)を設定します。
- ハエの明確な瓶その後、ハエは24時間の卵を産むしましょう。 (新しいボトルに大人を転送し、必要に応じて繰り返します)。
- 3-4日のためにボトルをインキュベートし、または3齢幼虫になるまで表示されます。
- 幼虫のボトルに20%ショ糖の100 mlを、20分間放置 - 50を追加します。幼虫は上にフロートします。
- チップと25ミリリットル血清ピペットを用いて収集した幼虫は、カットオフ、およびメッシュバスケットに場所。
- 2倍の脱イオンH 2 Oでメッシュバスケットに幼虫を洗う幼虫は現在の実験の準備が整いました。
2。薬で幼虫を治療する
- 溶液5%スクロース+薬剤を含む5 mlのビーカーに幼虫の希望数を輸送するためにブラシを使用しています。
- 少なくとも15分間幼虫してみましょう。
- メッシュバスケットに薬剤処理した幼虫を入れ、すすいでください。彼らは今、使用する準備が整いました。
3。運動アッセイ(測定総走行距離や体壁の収縮)
- に個々の幼虫を輸送するためにブラシを使用します。
- 0.2センチメートル2グリッドとグラフ用紙の上に、2%アガロース(以前に注ぎ、硬化さ)を含む15センチメートルペトリ皿。
- 1分で交差するグリッド線の数をカウントします。
- 希薄酵母糊液を含有するガラス解剖皿のよく。
- 解剖顕微鏡下で観察しながら1分で蠕動収縮を(後方移動= 1収縮への完全な前方)カウントされます。
- 0.2センチメートル2グリッドとグラフ用紙の上に、2%アガロース(以前に注ぎ、硬化さ)を含む15センチメートルペトリ皿。
- 幼虫の希望する番号がカウントされるまで繰り返します。
B.ラピッド負の走地性(RING)プロトコルを反復
このアッセイは、もともとドでしたガルガーノら 5によってスクライブ。
- 食品(または食品+薬)を含む標準バイアルに光CO 2麻酔と場所の下に新たに浮上して成人男性のハエを収集します。
- CO 2(定常状態薬物濃度の蓄積が適切であれば)からの回復を可能にするために2〜3日室温(ベンチの上に。〜22°C)でハエを維持しています。
- 準備されたポリスチレンバイアルに麻酔なしで 25ハエについて転送します。
- リング装置(図1)にハエのバイアルを組み立てる。
- ハエは15〜20分間、邪魔されず、環境に順応することができます。
- この時間の場所にデジタルカメラの間に装置の前に〜1メートル(プラットフォームバイアルの中間の高さでレンズの中心を揃えるために必要な場合に)、フォーカス、装置の上にカメラをズームし、タイマーを設定する3.0秒。
- 慎重にdistにならないように左手でリング装置のホールドを取るURBは、ハエ、そして右手でタイマーを保持します。
- 急激にタップが難しいバイアルの底にすべてのハエをノックダウンするのに十分であることを保証する、ベンチの表面に三回に装置をシャットダウン]をタップします。
- 第三タップの完成と同時に、3秒のカウントダウンタイマーを起動します。
- 3秒で写真を撮る。
- 1分間タイマーをリセットして起動します。この時間の間にカメラの電源をリセットして装置に焦点を当て、3秒のタイマーの別のチャネルを設定します。
- 1分は、手順1.7から1.10の後に
- 5月6日の試験の合計した後、コンピュータに画像をアップロードして開くようにお気に入りの画像ビューアを使用して、平均身長のスコアは各バイアルのため登った。
- 登った高さの平均を比較して、異なるグループの統計分析を実行します。
Cの求愛と交尾アッセイ
- 午前中にまず最初に、FLIの明確なだけでなく生産のボトルESは、使用することができます。
- 一日のコース(3〜4時間毎)を介して、新たに浮上して性的にナイーブな雄と雌を収集します。
- 媒体とバイアルまたはチューブ内で個別に男性を配置します。
- バイアル/チューブあたり一緒に行われ5-6の女性。
- 5日間暗12時間の明/下25°Cで収集されたハエを分離します。
- 交配ホイールの室に一人の女性を転送します。
- 交配ホイールのチャンバーに1男性を転送します。
- 次の動作のために解剖顕微鏡下でペアを守ってください。
- オリエンテーション(女性に向かって男性向き)
- (男性が女性をタップする)をタップ
- 翼の歌(男性が拡張し、片翼を振動させる)
- (男性が女性の性器を舐める)ブーツ
- カーリング(オス自体は下で腹部をカール)
- 交尾の試み(女性をマウントしようとしたときに、アクティビティをカーリング)
- 1の観察0分または成功した交尾まで、交尾(求愛指数を計算するための)と同様に、首尾よく与えられた動作を実行ペアの数になるまで求愛行動に従事し、それぞれの現象が発生した時刻(待ち時間)、合計時間を記録(周波数)。野生型のペアの100%が一般的に5分以内に交尾します。
- 計算する 交尾までの合計時間で割った求愛で費やされた時間を割って求愛指数(CI)。野生型のペアの場合、これは通常0.6から0.8の間の範囲。
D.描写結果
アッセイをクロール
通常の野生型幼虫は約3センチメートル/分、展示〜1分間に40から50体壁の収縮をさまよいます。我々は最近、障害6を登る幼虫のクロール欠陥の減少寿命と成人を示しています。FUS / TLS関連の筋萎縮性側索硬化症のショウジョウバエモデルを開発した。我々は表現oを対象とし運動ニューロン(OK-371-GAL4ドライバー)へとf野生型とFUS / TLSの変異体は、幼虫のクロールアッセイを行った。以下に示すように、野生型のFUSの発現が約6cmの幼虫のクロール能力が低下し、一方、野生型幼虫は、最大12 cmまでクロールします。 FUS / TLSのALSの原因となる変異R521Cを発現している動物は約1 cm /分をクロールし、それらのクロールの動き(図1)は非常に重度の障害を示しています。
負の走地性リングアッセイ
若い野生型の成虫は、3秒の時間で〜4,5センチ(時間が与えられたために与えられた平均の高さを定義するには、異なる株または活性レベルに対応するために3秒から調整することができ、平均登山高さを持つべきひずみ/処理)。下部に残っているハエは、0の値が割り当てられています。それがその後の高さを測定するために、個々のフライの位置を決定することが困難になるので、バイアルあたり25以上のハエを使用することをお勧めされていません。 NOの脱感作は、我々が採用していることを離れて1分間隔で6つの連続した試験までに観察されている。それは、使用されるバイアルに入れ、新しいハエは新鮮なバイアルと同程度に上昇しないので、収集されたデータの初期セットの後に、このアッセイにおけるポリスチレンのテストバイアルを再使用しないことが重要です。
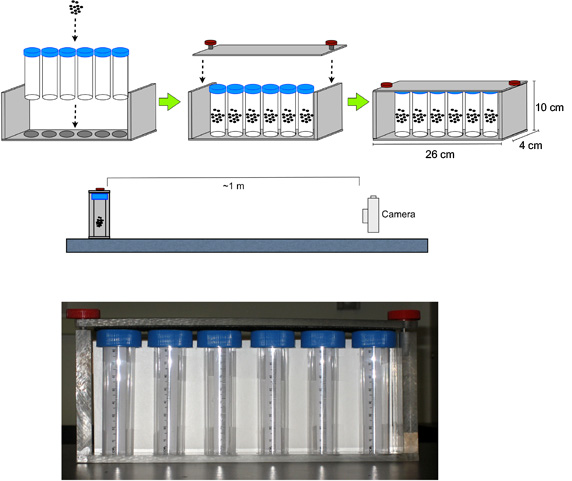
図1。リングアッセイのセットアップ。デジタルカメラは、ポリスチレンバイアル中にハエを含む装置の前に〜1メートルに配置されています。装置の上にカメラをフォーカスとズーム、および3.0秒にタイマーを設定します。
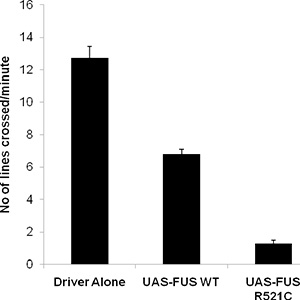
図2。を使用して幼虫のクロールアッセイからの代表的なデータは、異所性運動ニューロンドライバ(OK371-GAL4)の制御下にUAS-FUS WTと、UAS-FUS R521Cを表現飛ぶ。
ディスカッション
ショウジョウバエの行動は密接に遺伝的要因と環境要因によって調節される。我々は、他のものは、以前の行動やショウジョウバエ 5-19にモデル化する人間の神経変性疾患への飛行に関連する遺伝子を調べるためにデータを収集するためにここで説明するアッセイを使用しています。クロールアッセイのために、第3齢幼虫の慎重な選択が重要なステップです。?...
開示事項
我々は、開示することは何もありません。
謝辞
私たちは、幼虫のクロールデータを生成するためAstha Maltareに感謝します。私たちは、原稿上の彼のコメントを与えるために博士はニコラス·ランソン·ジュニアに感謝します。この作品は、ジョンズホプキンス大学でALSのためにロバートパッカードセンター(UBP)および筋萎縮性側索硬化症協会(UBP)がサポートされていました。と国立精神衛生研究所(CDN)からR01MH083689。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | |
| スクロース | フィッシャー·サイエンティフィック | S5-500 | |
| アガロース | インビトロジェン | 16500-500 | |
| 6オンスショウジョウバエのボトル | ジェネシー科学 | 32から130 | |
| ペイントブラシ(#1) | テッド·ペラ社 | 11859 | |
| 食品成分を飛ぶ | |||
| コーンミール | フィッシャー·サイエンティフィック | NC9109741 | |
| 寒天 | ジェネシー科学 | 66から104 | |
| 糖蜜 | フィッシャー·サイエンティフィック | NC9349176 | |
| プロピオン酸 | アクロス | 14930-0010 | |
| Tegosept | 頂点 | 20から258 | |
| エタノール | フィッシャー科学的な | BP2818-4 | |
| 酵母 | ジェネシー科学 | 62から107 |
参考文献
- Pandey, U. B., Nichols, C. D. Human disease models in Drosophila melanogaster and the role of the fly in therapeutic drug discovery. Pharmacol. Rev. 63 (2), 411-436 (2011).
- Feany, M. B., Bender, W. W. A Drosophila model of Parkinson's disease. Nature Mar. 23 (6776), 394-398 (2000).
- Auluck, P. K., Bonini, N. M. Pharmacological prevention of Parkinson disease in Drosophila. Nat. Med. 8 (11), 1185-1186 (2000).
- Whitworth, A. J., Theodore, D. A., Greene, J. C., Benes, H., Wes, P. D., Pallanck, L. J. Increased glutathione Stransferase activity rescues dopaminergic neuron loss in a Drosophila model of Parkinson's disease. Proc. Natl. Acad. Sci. U.S.A. 102 (22), 8024-8029 (2005).
- Gargano, J. W., Martin, I., Bhandari, P., Grotewiel, M. S. Rapid iterative negative geotaxis (RING): a new method for assessing age-related locomotor decline in Drosophila. Exp. Gerontol. 40 (5), 386-395 (2005).
- Lanson, N. A., Maltare, A., King, H., Smith, R., Kim, J. H., Taylor, J. P., Lloyd, T. E., Pandey, U. B. A Drosophila model of FUS-related neurodegeneration reveals genetic interaction between FUS and TDP-43. Hum. Mol. Genet. 20 (13), 2510-2523 (2011).
- Batlevi, Y., Martin, D. N., Pandey, U. B., Simon, C. R., Powers, C. M., Taylor, J. P., Baehrecke, E. H. Dynein light chain 1 is required for autophagy, protein clearance, and cell death in Drosophila. Proc. Natl. Acad. Sci. U.S.A. 107 (2), 742-747 (2010).
- Sang, T. K., Chang, H. Y., Lawless, G. M., Ratnaparkhi, A., Mee, L., Ackerson, L. C., Maidment, N. T., Krantz, D. E., Jackson, G. R. A Drosophila model of mutant human parkin-induced toxicity demonstrates selective loss of dopaminergic neurons and dependence on cellular dopamine. J. Neurosci. 27 (5), 981-992 (2007).
- Stacey, S. M., Muraro, N. I., Peco, E., Labbé, A., Thomas, G. B., Baines, R. A., van Meyel, D. J. Drosophila glial glutamate transporter Eaat1 is regulated by fringe-mediated notch signaling and is essential for larval locomotion. J. Neurosci. 30 (43), 14446-14457 (2010).
- Repnikova, E., Koles, K., Nakamura, M., Pitts, J., Li, H., Ambavane, A., Zoran, M. J., Panin, V. M. Sialyltransferase regulates nervous system function in Drosophila. J. Neurosci. 30 (18), 6466-6476 (2010).
- Repnikova, E., Koles, K., Nakamura, M., Pitts, J., Li, H., Ambavane, A., Zoran, M. J., Panin, V. M. Sialyltransferase regulates nervous system function in Drosophila. J. Neurosci. 30 (18), 6466-6476 (2010).
- Nedelsky, N. B., Pennuto, M., Smith, R. B., Palazzolo, I., Moore, J., Nie, Z., Neale, G., Taylor, J. P. Native functions of the androgen receptor are essential to pathogenesis in a Drosophila model of spinobulbar muscular atrophy. Neuron. 67 (6), 936-952 (2010).
- Lorenzo, D. N., Li, M. G., Mische, S. E., Armbrust, K. R., Ranum, L. P., Hays, T. S. Spectrin mutations that cause spinocerebellar ataxia type 5 impair axonal transport and induce neurodegeneration in Drosophila. J. Cell Biol. 189 (1), 143-158 (2010).
- Wang, J. W., Brent, J. R., Tomlinson, A., Shneider, N. A., McCabe, B. D. The ALS-associated proteins FUS and TDP-43 function together to affect Drosophila locomotion and life span. J. Clin. Invest. , (2011).
- Choi, J. K., Jeon, Y. C., Lee, D. W., Oh, J. M., Lee, H. P., Jeong, B. H., Carp, R. I., Koh, Y. H., Kim, Y. S. A Drosophila model of GSS syndrome suggests defects in active zones are responsible for pathogenesis of GSS syndrome. Hum. Mol. Genet. 19 (22), 4474-4489 (2010).
- Ruan, H., Wu, C. F. Social interaction-mediated lifespan extension of Drosophila Cu/Zn superoxide dismutase mutants. Proc. Natl. Acad. Sci. U.S.A. 105 (21), (2008).
- Slawson, J. B., Kim, E. Z., Griffith, L. C. High-resolution video tracking of locomotion in adult Drosophila melanogaster. J. Vis. Exp. (24), (2009).
- Becnel, J., Johnson, O., Luo, J., Nässel, D. R., Nichols, C. D. The serotonin 5-HT7 Dro receptor is expressed in the brain of Drosophila, and is essential for normal courtship and mating. PLoS One. 6 (6), e20800 (2011).
- Johnson, O., Becnel, J., Nichols, C. D. Serotonin 5-HT(2) and 5-HT(1A)-like receptors differentially modulate aggressive behaviors in Drosophila melanoga- ster. Neuroscience. 158 (2), 1292-1300 (2009).
- Bastock, M., Manning, A. The Courtship of Drosophila Melanogaster. Behaviour. , 85-111 (1955).
- Greenspan, R. J., Ferveur, J. F. Courtship in Drosophila. Annu. Rev. Genet. 34, 205-232 (2000).
- Villella, A., Hall, J. C. Neurogenetics of courtship and mating in Drosophila. Adv. Genet. 62, 67-184 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved