È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Metodi per test Drosophila Comportamento
In questo articolo
Riepilogo
Drosophila melanogaster è un sistema genetico e comportamentale del modello trattabile che è stato utilizzato per comprendere le basi molecolari e cellulari di molti importanti processi biologici per oltre un secolo 1. Drosophila è stata ben sfruttata per acquisire conoscenze in base genetica del comportamento mosca.
Abstract
Drosophila melanogaster, il moscerino della frutta, è stato utilizzato per studiare i meccanismi molecolari di una vasta gamma di malattie umane come il cancro, malattie cardiovascolari e le varie malattie neurologiche 1. Abbiamo ottimizzato i test comportamentali semplici e robuste per la determinazione locomozione larvale, la capacità di arrampicata per adulti (test RING), e comportamenti di corteggiamento di Drosophila. Questi test comportamentali sono ampiamente applicabile per studiare il ruolo dei fattori genetici e ambientali sul comportamento fly. Capacità di scansione larvale può essere attendibilmente utilizzato per determinare i cambiamenti nelle fasi iniziali nelle abilità di larve striscianti Drosophila e anche per l'esame effetto di farmaci o geni di malattie umane (in mosche transgeniche) sul loro locomozione. Il saggio scansione larvale diventa più applicabile se l'espressione o la soppressione di un gene provoca mortalità negli stadi pupa o adulto, in quanto queste mosche non riescono a sopravvivere fino all'età adulta, dove altrimenti potrebbero essere valutati. Questo di base unssay può essere utilizzato anche in combinazione con la luce o di stress per esaminare ulteriori risposte comportamentali in larve di Drosophila. Comportamento di corteggiamento è stato ampiamente usato per studiare le basi genetiche del comportamento sessuale, e può essere utilizzato anche per esaminare l'attività e il coordinamento, così come l'apprendimento e la memoria. Corteggiamento Drosophila comporta la sostituzione di diversi stimoli sensoriali tra visivo, uditivo, e segnali chemosensoriali tra maschi e femmine che portano a una complessa serie di comportamenti motori ben caratterizzati che culminano in copula di successo. Saggi di arrampicata per adulti tradizionali (geotassi negativi) sono noiosi, lavoro intensivo, e richiede tempo, con variazioni significative tra i diversi studi 2-4. La rapida iterativo geotassi negativi (RING) saggio 5 ha molti vantaggi rispetto a protocolli più ampiamente impiegati, fornendo un approccio velocità riproducibile, sensibile, e di alta quantificare locomotore adulti e negative geotassi behaviors. Nel saggio RING, genotipi diversi o trattamenti farmacologici possono essere testati contemporaneamente utilizzando gran numero di animali, con l'high-throughput approccio rende più suscettibili per gli esperimenti di screening.
Protocollo
A. larvale Crawling Assay
1. Le larve Collection
- Impostare un 8 once bottiglia di mosche (10-15 maschi + femmine 10-15).
- Lasciate che le mosche depongono le uova per 24 ore, poi bottiglia trasparente di mosche. (Trasferire gli adulti in una nuova bottiglia e ripetere se necessario).
- Incubare bottiglia per 3-4 giorni, o fino terzo stadio larve sono visibili.
- Aggiungere 50 - 100 ml di 20% saccarosio alla bottiglia con larve e lasciate riposare per 20 minuti. Le larve saranno a galla.
- Raccogliere le larve con una pipetta 25 ml sierologico con la punta tagliata, e posto in un cesto in rete.
- Lavare larve nel cesto maglia due volte con acqua deionizzata H 2 O. Le larve sono ora pronti per gli esperimenti.
2. Per il trattamento di larve con la droga
- Utilizzare un pennello per trasportare il numero desiderato di larve in un becher 5 ml contenente una soluzione al 5% di saccarosio + farmaco.
- Lasciate che le larve si nutrono per almeno 15 minuti.
- Versare droga trattata con larve in un cesto in rete e risciacquare. Ora sono pronto per l'uso.
3. Assay Locomotore (misurando la distanza totale percorsa o contrazioni parete del corpo)
- Utilizzare un pennello per il trasporto individuale ad una larva:
- 15 centimetri capsula Petri contenente il 2% agarosio (precedentemente versato e lasciato indurire) su carta millimetrata di cm 0,2 2 griglia.
- Contare il numero di linee della griglia incrociate in 1 minuto.
- Beh dissezione di un piatto di vetro contenente una soluzione diluita di pasta di lievito.
- Contare le contrazioni peristalsi (anteriore posteriore completo di movimento = 1 contrazione) in un minuto, osservando al microscopio di dissezione.
- 15 centimetri capsula Petri contenente il 2% agarosio (precedentemente versato e lasciato indurire) su carta millimetrata di cm 0,2 2 griglia.
- Ripetere fino a quando i numeri desiderati delle larve sono stati contati.
B. Rapid iterativo geotassi negativi (RING) Protocol
Questo saggio è stato originariamente disinstallatidescritto dal Gargano et al 5.
- Raccogliere appena emerse le mosche maschio adulto sotto la luce CO 2 anestesia e il luogo di un alimento standard contenente flacone (o cibo + farmaci).
- Mantenere le mosche a temperatura ambiente (in alto panchina. ~ 22 ° C) per 2-3 giorni per consentire il recupero di CO 2 (e l'accumulo di steady-state i livelli di farmaco se del caso).
- Trasferire circa 25 mosche, senza anestesia in fiale polistirolo preparati.
- Assemblare flaconcini con mosche nell'apparecchiatura ANELLO (Figura 1).
- Lasciare mosche di acclimatarsi all'ambiente, indisturbato, per 15-20 minuti.
- Durante questa fotocamera digitale in tempo luogo ~ 1 m di fronte dell'apparecchio (su una piattaforma, se necessario, per allineare il centro della lente a metà altezza del fiale), mettere a fuoco e zoom la fotocamera sulla apparato, e impostare un timer per 3.0 secondi.
- Cura prendere in mano l'apparato ANELLO con la mano sinistra in modo da non disturb le mosche, e tengono il timer con la mano destra.
- Una drastica toccare l'apparecchio verso il basso sulla superficie del banco di tre volte, assicurando che il rubinetto è difficile da abbattere tutte le mosche al fondo dei flaconi.
- Contemporaneamente con il completamento del terzo rubinetto, inizia il conto alla rovescia 3 secondi.
- A tre secondi scatta una foto.
- Ripristinare il timer per 1 minuto e iniziare. Durante questo tempo ripristinare la fotocamera e mettere a fuoco l'apparato, e impostare un altro canale del timer per tre secondi.
- Dopo 1 minuto, ripetere i passaggi da 1,7-1,10
- Dopo un totale di 5-6 prove, caricare le immagini su un computer e utilizzare il vostro preferito visualizzatore di immagini per aprire, e segnare l'altezza media si arrampicò per ogni flacone.
- Effettuare analisi statistiche sui vostri gruppi diversi a confronto l'altezza media salito.
C. corteggiamento e di accoppiamento test
- La prima cosa al mattino, ben chiari che producono bottiglie di FLIES da utilizzare.
- Nel corso della giornata (ogni 3-4 ore), la raccolta di recente è emerso maschi sessualmente ingenui e femmine:
- Mettere i maschi singolarmente in fiale o provette con terreno.
- Mettere 5-6 femmine insieme per flacone / provetta.
- Isolare mosche raccolti a 25 ° C sotto i 12 hr luce / buio per 5 giorni.
- Trasferire uno femmina nella camera di una ruota di accoppiamento.
- Trasferire un maschio nella camera di una ruota di accoppiamento.
- Osservare coppia sotto un microscopio per dissezione i seguenti comportamenti:
- Orientamento (orienta maschio verso la femmina)
- Tapping (il maschio batte la femmina)
- Canzone Wing (il maschio si estende e vibra un'ala)
- Licking (i maschi lecca i genitali femminili)
- Curling (il maschio si arriccia suo addome sotto se stesso)
- L'accoppiamento tentativo (Leggendo l'attività durante il tentativo di montare la femmina)
- Osservare per 10 minuti o fino copulazione successo, rilevando il tempo in cui ogni comportamento si verifica (latenza), il tempo totale impegnata in corteggiamento fino accoppiamento (per calcolare l'indice corteggiamento), nonché il numero di coppie di eseguire correttamente un dato comportamento ( frequenza). 100% delle coppie di tipo selvatico generalmente accoppiano entro 5 minuti.
- Calcolare un indice corteggiamento (CI) dividendo il tempo trascorso in corteggiamento diviso per il tempo totale fino copulazione. Per le coppie di questo tipo selvatico varia di solito tra i 0,6-0,8.
D. Risultati rappresentativi
Crawling test
Normale larva di tipo selvatico vagheranno ~ 3 cm / minuto, e presentano ~~~HEAD=NNS 40-50 contrazioni del corpo a parete in un minuto. Abbiamo recentemente sviluppato un modello Drosophila di FUS / TLS-correlato sclerosi laterale amiotrofica che mostra larvale difetto di scansione, durata di vita ridotta e adulti salendo impairment 6. Avevamo l'obiettivo di espressione of wild type e forme mutanti di FUS / TLS per i motoneuroni (OK-371-GAL4 driver) ed eseguito un test di scansione larvale. Come mostrato di seguito, le larve di tipo selvaggio strisciare fino a 12 cm, mentre l'espressione del FUS di tipo selvatico diminuita la capacità delle larve strisciando a circa 6 cm. Gli animali che esprimono il ALS-R521C causando mutazione FUS / TLS dimostrare un danno molto grave nel loro movimento crawling (Figura 1), la scansione solo circa 1 cm al minuto.
Negative geotassi test ANELLO
Giovani wild-type mosche adulte devono avere un'altezza media salendo di ~ 4-5 cm in hotel 3 secondo periodo di tempo (il tempo può essere regolato da 3 secondi per ospitare diversi ceppi o livelli di attività per definire una determinata altezza media per un dato ceppo / trattamento). Mosche che rimangono sul fondo viene assegnato un valore di 0. Non si consiglia di utilizzare più di 25 mosche per flaconcino, perché allora diventa difficile determinare la posizione di ogni singolo volo per misurare l'altezza. Ndesensibilizzazione o è stata osservata fino alle 6 prove consecutive distanziate 1 minuto a parte che abbiamo impiegato. È critico non riutilizzare i flaconi prova polistirene in questo saggio, dopo gli insiemi iniziali di dati sono raccolti perché le mosche nuovi collocati in fiale utilizzati non salirà nella stessa misura in fiale freschi.
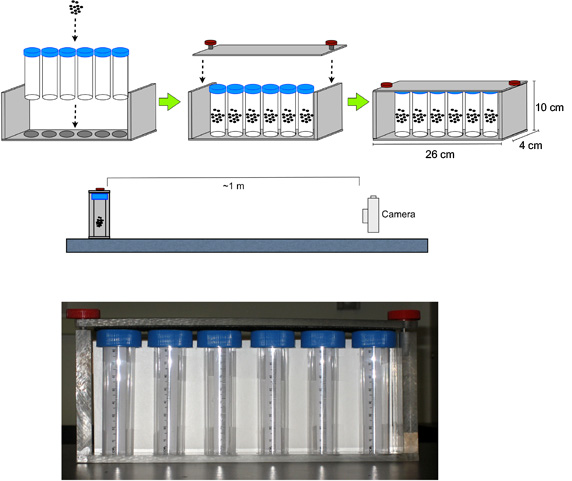
Figura 1. Di installazione per il saggio RING. La fotocamera digitale è posto ~ 1 m di fronte al apparecchi contenenti mosche nelle fiale polistirolo, mettere a fuoco e lo zoom sul dispositivo, e impostare un timer a 3,0 secondi.
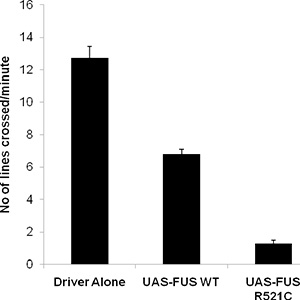
Dati rappresentativi Figura 2. Dal saggio di scansione delle larve con la mosca ectopicamente esprimere UAS FUS-WT e UAS-FUS R521C sotto il controllo di un driver motor neuron (OK371-GAL4).
Discussione
Drosophila comportamento è strettamente regolato da fattori genetici e ambientali. Noi, e altri, hanno già utilizzato i saggi descritti qui per raccogliere i dati per esaminare i geni legati a volare comportamenti e per la salute umana le malattie neurodegenerative modellati in Drosophila 5-19. Per il saggio strisciando, attenta selezione di 3 rd instar larve è un passo fondamentale. Se il trattamento con un farmaco, ci vorranno 10-15 minuti (o più a seconda del tipo e natura ...
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Vorremmo ringraziare Astha Maltare per generare i dati crawling larvali. Vorremmo ringraziare il Dott. Nicholas Lanson Jr. per dare i suoi commenti sul manoscritto. Questo lavoro è stato sostenuto dal Centro Robert Packard per la SLA presso la Johns Hopkins (a UBP) e la sclerosi laterale amiotrofica Association (UBP) e R01MH083689 dal National Institutes of Mental Health (CDN).
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | |
| Saccarosio | Fisher Scientific | S5-500 | |
| Agarosio | Invitrogen | 16500-500 | |
| 6 oz Drosophila bottiglia | Genesee Scientific | 32-130 | |
| Pennello (# 1) | Ted Pella, Inc. | 11859 | |
| Vola componenti alimentari | |||
| Farina di mais | Fisher Scientific | NC9109741 | |
| Agar | Genesee Scientific | 66-104 | |
| Melassa | Fisher Scientific | NC9349176 | |
| L'acido propionico | Acros | 14930-0010 | |
| Tegosept | Apice | 20-258 | |
| Etanolo | PescatoreScientifico | BP2818-4 | |
| Lievito | Genesee Scientific | 62-107 |
Riferimenti
- Pandey, U. B., Nichols, C. D. Human disease models in Drosophila melanogaster and the role of the fly in therapeutic drug discovery. Pharmacol. Rev. 63 (2), 411-436 (2011).
- Feany, M. B., Bender, W. W. A Drosophila model of Parkinson's disease. Nature Mar. 23 (6776), 394-398 (2000).
- Auluck, P. K., Bonini, N. M. Pharmacological prevention of Parkinson disease in Drosophila. Nat. Med. 8 (11), 1185-1186 (2000).
- Whitworth, A. J., Theodore, D. A., Greene, J. C., Benes, H., Wes, P. D., Pallanck, L. J. Increased glutathione Stransferase activity rescues dopaminergic neuron loss in a Drosophila model of Parkinson's disease. Proc. Natl. Acad. Sci. U.S.A. 102 (22), 8024-8029 (2005).
- Gargano, J. W., Martin, I., Bhandari, P., Grotewiel, M. S. Rapid iterative negative geotaxis (RING): a new method for assessing age-related locomotor decline in Drosophila. Exp. Gerontol. 40 (5), 386-395 (2005).
- Lanson, N. A., Maltare, A., King, H., Smith, R., Kim, J. H., Taylor, J. P., Lloyd, T. E., Pandey, U. B. A Drosophila model of FUS-related neurodegeneration reveals genetic interaction between FUS and TDP-43. Hum. Mol. Genet. 20 (13), 2510-2523 (2011).
- Batlevi, Y., Martin, D. N., Pandey, U. B., Simon, C. R., Powers, C. M., Taylor, J. P., Baehrecke, E. H. Dynein light chain 1 is required for autophagy, protein clearance, and cell death in Drosophila. Proc. Natl. Acad. Sci. U.S.A. 107 (2), 742-747 (2010).
- Sang, T. K., Chang, H. Y., Lawless, G. M., Ratnaparkhi, A., Mee, L., Ackerson, L. C., Maidment, N. T., Krantz, D. E., Jackson, G. R. A Drosophila model of mutant human parkin-induced toxicity demonstrates selective loss of dopaminergic neurons and dependence on cellular dopamine. J. Neurosci. 27 (5), 981-992 (2007).
- Stacey, S. M., Muraro, N. I., Peco, E., Labbé, A., Thomas, G. B., Baines, R. A., van Meyel, D. J. Drosophila glial glutamate transporter Eaat1 is regulated by fringe-mediated notch signaling and is essential for larval locomotion. J. Neurosci. 30 (43), 14446-14457 (2010).
- Repnikova, E., Koles, K., Nakamura, M., Pitts, J., Li, H., Ambavane, A., Zoran, M. J., Panin, V. M. Sialyltransferase regulates nervous system function in Drosophila. J. Neurosci. 30 (18), 6466-6476 (2010).
- Repnikova, E., Koles, K., Nakamura, M., Pitts, J., Li, H., Ambavane, A., Zoran, M. J., Panin, V. M. Sialyltransferase regulates nervous system function in Drosophila. J. Neurosci. 30 (18), 6466-6476 (2010).
- Nedelsky, N. B., Pennuto, M., Smith, R. B., Palazzolo, I., Moore, J., Nie, Z., Neale, G., Taylor, J. P. Native functions of the androgen receptor are essential to pathogenesis in a Drosophila model of spinobulbar muscular atrophy. Neuron. 67 (6), 936-952 (2010).
- Lorenzo, D. N., Li, M. G., Mische, S. E., Armbrust, K. R., Ranum, L. P., Hays, T. S. Spectrin mutations that cause spinocerebellar ataxia type 5 impair axonal transport and induce neurodegeneration in Drosophila. J. Cell Biol. 189 (1), 143-158 (2010).
- Wang, J. W., Brent, J. R., Tomlinson, A., Shneider, N. A., McCabe, B. D. The ALS-associated proteins FUS and TDP-43 function together to affect Drosophila locomotion and life span. J. Clin. Invest. , (2011).
- Choi, J. K., Jeon, Y. C., Lee, D. W., Oh, J. M., Lee, H. P., Jeong, B. H., Carp, R. I., Koh, Y. H., Kim, Y. S. A Drosophila model of GSS syndrome suggests defects in active zones are responsible for pathogenesis of GSS syndrome. Hum. Mol. Genet. 19 (22), 4474-4489 (2010).
- Ruan, H., Wu, C. F. Social interaction-mediated lifespan extension of Drosophila Cu/Zn superoxide dismutase mutants. Proc. Natl. Acad. Sci. U.S.A. 105 (21), (2008).
- Slawson, J. B., Kim, E. Z., Griffith, L. C. High-resolution video tracking of locomotion in adult Drosophila melanogaster. J. Vis. Exp. (24), (2009).
- Becnel, J., Johnson, O., Luo, J., Nässel, D. R., Nichols, C. D. The serotonin 5-HT7 Dro receptor is expressed in the brain of Drosophila, and is essential for normal courtship and mating. PLoS One. 6 (6), e20800 (2011).
- Johnson, O., Becnel, J., Nichols, C. D. Serotonin 5-HT(2) and 5-HT(1A)-like receptors differentially modulate aggressive behaviors in Drosophila melanoga- ster. Neuroscience. 158 (2), 1292-1300 (2009).
- Bastock, M., Manning, A. The Courtship of Drosophila Melanogaster. Behaviour. , 85-111 (1955).
- Greenspan, R. J., Ferveur, J. F. Courtship in Drosophila. Annu. Rev. Genet. 34, 205-232 (2000).
- Villella, A., Hall, J. C. Neurogenetics of courtship and mating in Drosophila. Adv. Genet. 62, 67-184 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon