Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Methoden zum Test Drosophila Verhalten
In diesem Artikel
Zusammenfassung
Drosophila melanogaster ist eine genetisch und auf der Verhaltensebene praktische Zwecke geeigneten Modells, das verwendet wurde, um die molekularen und zellulären Grundlagen von vielen wichtigen biologischen Prozessen seit über einem Jahrhundert ein zu verstehen. Drosophila wurde auch genutzt, um Einblicke in die genetischen Grundlagen der Fliege Verhalten zu gewinnen.
Zusammenfassung
Drosophila melanogaster, der Fruchtfliege, wurde genutzt, um molekulare Mechanismen von einer breiten Palette von menschlichen Krankheiten wie Krebs, Herz-Kreislauferkrankungen und verschiedenen neurologischen Erkrankungen ein zu studieren. Wir haben einfache und robuste Verhaltensstörungen Assays zur Bestimmung Larven Fortbewegung, erwachsenen Steigfähigkeit (RING-Assay) und Werbeverhalten von Drosophila optimiert. Diese Verhaltens-Assays sind allgemein anwendbar für die Untersuchung der Rolle von genetischen und umweltbedingten Faktoren auf Fly Verhalten. Larven kriechen Fähigkeit zuverlässig für die Bestimmung frühzeitig Veränderungen in den kriechenden Fähigkeiten von Drosophila-Larven und auch für die Prüfung Wirkung von Medikamenten oder Erkrankungen des Menschen Genen (in transgenen Fliegen) auf ihrer Fortbewegung verwendet werden. Die Larven kriechen Assay wird immer anwendbar, wenn die Expression oder Abschaffung eines Gens verursacht Letalität im Puppenstadium oder adulte Stadien, da diese Fliegen nicht bis ins Erwachsenenalter überleben kann, wo sie sonst könnte beurteilt werden. Dieses BASICssay kann auch in Verbindung mit hellem Licht oder Stress zusätzliche Verhaltensreaktionen in Drosophila-Larven untersucht werden. Balzverhalten wurde weithin verwendet, um genetische Basis der sexuellen Verhaltens zu untersuchen, und kann auch verwendet werden, um die Aktivität und die Koordination zu untersuchen, ebenso wie Lernen und Gedächtnis werden. Drosophila Balzverhalten der Austausch von verschiedenen Sinnesreizen einschließlich visueller, auditiver und chemosensorischen Signale zwischen Männern und Frauen, die zu einer komplexen Reihe von gut charakterisierten Motor Verhaltensweisen die ihren Höhepunkt in erfolgreiche Kopulation führen. Traditionelle Erwachsenen klettern Assays (negative Geotaxis) sind langwierig, arbeitsintensiv und zeitaufwendig, mit signifikanten Unterschiede zwischen den einzelnen Studien 2-4. Die schnelle iterative negativen Geotaxis (RING)-Assay 5 hat viele Vorteile gegenüber größerem Umfang eingesetzten Protokolle und bietet eine reproduzierbare, sensibel und mit hohem Durchsatz Ansatz zur Erwachsenen-und Bewegungsapparat negativ Geotaxis b quantifizierenehaviors. In der RING-Assay kann mehrere Genotypen oder medikamentöse Behandlungen getestet gleichzeitig unter Verwendung der großen Anzahl von Tieren, mit der High-Throughput-Ansatz macht es zugänglicher für Screening-Experimenten.
Protokoll
A. Larven Crawling-Test
1. Larven Sammlung
- Richten Sie eine 8 Unzen Flasche fliegt (10-15 + 10-15 Männchen Weibchen).
- Lassen Fliegen legen ihre Eier für 24 Stunden, dann klare Flasche fliegt. (Übertragen Sie die Erwachsenen in eine neue Flasche und wiederholen wie nötig).
- Inkubieren Flasche für 3-4 Tage, oder bis zum dritten Larvenstadium sichtbar sind.
- In 50 bis 100 ml 20% Saccharose in die Flasche mit Larven und lassen Sie sich für 20 Minuten. Die Larven werden auf der Oberfläche schwimmen.
- Sammle Larven mit einem 25 ml serologische Pipette mit der Spitze abgeschnitten, und in einen Gitterkorb.
- Waschen Sie Larven im Gitterkorb zweimal mit deionisiertem H 2 O. Die Larven sind jetzt bereit für die Experimente.
2. Um Larven mit Medikamenten behandeln
- Verwenden Sie eine Bürste, um die gewünschte Anzahl der Larven zu einem 5-ml-Becher, die eine Lösung von 5% Saccharose + Droge transportieren.
- Lassen Larven ernähren sich mindestens 15 Minuten.
- Gießen Medikament behandelten Larven in einen Gitterkorb und spülen. Sie sind jetzt einsatzbereit.
3. Bewegungsapparat Assay (Messung insgesamt zurückgelegte Entfernung oder Körperwand Kontraktionen)
- Mit einer Bürste, einzelne Larve bis ein Transport:
- 15 cm Petrischale mit 2% Agarose (zuvor gegossen und ausgehärtet) über Millimeterpapier mit einer 0,2 cm 2 Rasters.
- Count Anzahl der Gitterlinien in 1 Minute überschritten.
- Nun von einem Glas Dissektion Schale mit einer verdünnten Lösung Hefepaste.
- Count Peristaltik Kontraktionen (von vorne nach hinten voller Bewegung = 1 Kontraktion) in einer Minute unter Beobachtung unter einem Dissektionsmikroskop.
- 15 cm Petrischale mit 2% Agarose (zuvor gegossen und ausgehärtet) über Millimeterpapier mit einer 0,2 cm 2 Rasters.
- Wiederholen, bis die gewünschte Anzahl von Larven gezählt worden.
B. Schnelle iterative negativen Geotaxis (RING) Protokoll
Dieser Test wurde ursprünglich debeschrieben durch Gargano et al 5.
- Sammeln frisch geschlüpften erwachsenen männlichen Fliegen unter leichtem CO 2-Betäubung und in einen Standard-Fläschchen mit Nahrungsmitteln (+ Arzneimittel oder Lebensmittel).
- Halten Sie Fliegen bei Raumtemperatur (auf der Tischplatte. ~ 22 ° C) für 2-3 Tage auf die zur Verwertung von CO 2 (und Akkumulation von Steady-State-Plasmaspiegel gegebenenfalls) zu ermöglichen.
- Übertragen Sie etwa 25 Fliegen ohne Betäubung zu Polystyrol vorbereiteten Fläschchen.
- Montieren Fläschchen mit Fliegen in den RING Apparatur (Abbildung 1).
- Erlauben Sie fliegt in die Umwelt, ungestört, für 15-20 Minuten akklimatisieren.
- Während dieser Zeit Platz Digitalkamera ~ 1 m vor dem Gerät (auf einer Plattform, wenn notwendig, das Zentrum der Linse auf halber Höhe des Vials ausrichten), Fokus und Zoom der Kamera auf das Gerät, und einen Timer einstellen, um 3,0 Sekunden.
- Entfernen Sie vorsichtig von der RING-Apparat zu halten mit der linken Hand, um nicht zu disturb die Fliegen, und halten Sie den Timer mit der rechten Hand.
- Scharf tippen Sie auf das Gerät nach unten auf der Oberfläche der Bank dreimal, sicherzustellen, dass das Leitungswasser hart genug, um knock down all die Fliegen auf den Boden der Fläschchen ist.
- Gleichzeitig mit Fertigstellung des dritten Hahn, starten Sie die 3 Sekunden Countdown-Timer.
- Bei 3 Sekunden ein Bild aufnehmen.
- Setzen Sie den Timer für 1 Minute und starten. Während dieser Zeit setzen Sie die Kamera und Fokus auf das Gerät, und stellen Sie einen anderen Kanal des Timers für drei Sekunden.
- Nach 1 Minute, wiederholen Sie die Schritte 1,7-1,10
- Nach insgesamt 5-6 Versuche, laden Sie Bilder auf einen Computer und nutzen Sie Ihre Lieblings-Bildbetrachter zu öffnen, zu punkten und die durchschnittliche Höhe kletterten für jedes Fläschchen.
- Statistische Analysen auf Ihrer verschiedenen Gruppen einen Vergleich der mittleren Höhe geklettert.
C. Balz und Paarung Assay
- Als erstes am Morgen, klar, gut-produzierenden Flaschen FLIes verwendet werden soll.
- Im Laufe des Tages (alle 3-4 Stunden), sammeln neu entstandenen sexuell naive Männchen und Weibchen:
- Platzieren Sie Männchen einzeln in Fläschchen oder Röhrchen mit Medium.
- Platzieren Sie 5-6 Weibchen zusammen pro Fläschchen / Tube.
- Isolieren Sie gesammelt Fliegen bei 25 ° C unter 12 Stunden Licht / Dunkel für 5 Tage.
- Übertragen Sie eine Frau in die Kammer eines Gegenrad.
- Übertragen Sie ein Männchen in die Kammer eines Gegenrad.
- Beachten Paar unter einem Dissektionsmikroskop für die folgenden Verhaltensweisen:
- Orientierung (die männlichen orientiert sich an den weiblichen)
- Tapping (klopft das Männchen das Weibchen)
- Flügel Lied (das männliche erstreckt und schwingt einen Flügel)
- Lecken (die männlichen leckt die weiblichen Genitalien)
- Curling (das Männchen seinen Bauch rollt unter sich)
- Kopulation Versuch (Curling Tätigkeit beim Versuch, den weiblichen montieren)
- Beachten Sie für 10 Minuten oder bis zum erfolgreichen Kopulation, in Anbetracht der Zeit, zu der jedes Verhalten auftritt (Latenzzeit), (die gesamte Zeit in Balzverhalten bis Kopulation (die Brautwerbung Index zu berechnen), sowie die Anzahl der Paare, die erfolgreich ein bestimmtes Verhalten auszuführen engagiert Frequenz). 100% der Wildtyp-Paare werden in der Regel innerhalb von 5 Minuten zu paaren.
- Berechnen Balz ein Index (CI) durch Division der Zeitaufwand bei der Balz durch die gesamte Zeit bis Kopulation unterteilt. Für Wildtyp-Paaren dies in der Regel im Bereich zwischen 0,6 bis 0,8.
D. Repräsentative Ergebnisse
Crawling-Assay
Normale Wildtyp-Larve wird wandern ~ 3 cm / min und Ausstellungsflächen ~ 40-50 Körperwand Kontraktionen in einer Minute. Wir haben kürzlich eine Drosophila-Modell FUS / TLS-bezogenen amyotrophe Lateralsklerose, die Larven kriechen Defekt, verminderte Lebensdauer und Erwachsenen klettern Beeinträchtigung 6 zeigt entwickelt. Wir gezielte Expression of Wildtyp und mutierte Formen von FUS / TLS zu den Motoneuronen (OK-371-GAL4-Treiber) und führte eine Larven-Crawling-Assay. Wie unten dargestellt, Wildtyp-Larven bis zu 12 cm zu kriechen, während die Expression von Wildtyp-FUS verringerte die Larven kriechen Fähigkeit, etwa 6 cm. Tiere Ausdruck des ALS-Mutation R521C in FUS / TLS zeigen eine sehr starke Beeinträchtigung in ihrem kriechenden Bewegung (Abbildung 1), Crawling nur etwa 1 cm / min.
Negativ Geotaxis RING-Assay
Junge Wildtyp-erwachsenen Fliegen sollten einen mittleren Steighöhe von ~ 4-5 cm in einem 3-Sekunden-Zeit (die Zeit zwischen 3 Sekunden und kann eingestellt werden, um verschiedene Stämme oder Aktivität aufnehmen, um eine gegebene durchschnittliche Höhe für eine gegebene Definition Dehnung / Behandlung). Fliegen, die am Boden bleiben, wird ein Wert von 0 zugewiesen. Es ist nicht ratsam, mehr als 25 Fliegen pro Fläschchen zu verwenden, da wird es dann schwierig, die Lage jeder einzelnen Fliege an Höhe messen zu bestimmen. No Desensibilisierung hat bei eingerichtet, um die 6 aufeinander folgenden Versuchen Abstand von 1 Minute auseinander, dass wir beschäftigt beobachtet. Es ist wichtig, nicht die Prüfung Polystyrol Fläschchen in diesem Assay nach den ersten Sätzen von Daten verwertet werden gesammelt, weil neue Fliegen in Glasfläschchen verwendet nicht im gleichen Maße steigt, wie in frische Röhrchen.
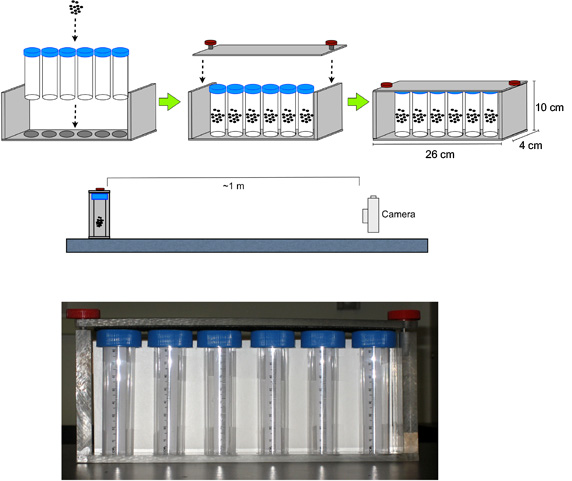
Abbildung 1. Setup für das RING-Assay. Die Digitalkamera wird ca. 1 m vor dem Gerät mit Fliegen in den Polystyrol-Röhrchen platziert; konzentrieren und zoomen Sie die Kamera auf das Gerät, und einen Timer einstellen, um 3,0 Sekunden.
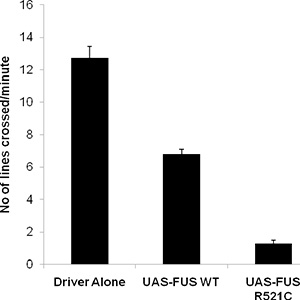
2. Repräsentative Daten aus der Larven Crawling-Assay unter Verwendung Fliegen ektopisch UAS-FUS WT und UAS-FUS R521C unter der Kontrolle einer motoneuronalen Treiber (OK371-Gal4).
Diskussion
Drosophila Verhalten wird streng von genetischen und umweltbedingten Faktoren reguliert. Wir und andere haben vorher beschriebenen Assays hier verwendet, um Daten zu sammeln, um Gene in Bezug auf Verhalten und zu menschlichen neurodegenerativen Erkrankungen in Drosophila 19.05 modelliert fliegen zu untersuchen. Für das Crawling-Assay ist eine sorgfältige Auswahl der 3 rd Larven ein entscheidender Schritt. Wenn die Behandlung mit einem Arzneimittel, dauert es 10-15 Minuten (oder ...
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Wir möchten Astha Maltare zur Erzeugung der Larven kriechen Daten danken. Wir möchten Dr. Nicholas Lanson Jr. für das Geben seiner Anmerkungen zum Manuskript danken. Diese Arbeit wurde von der Robert-Packard Zentrum für ALS an der Johns Hopkins (bis UBP) und die Amyotrophe Lateralsklerose Association (UBP) unterstützt; und R01MH083689 von den National Institutes of Mental Health (CDN).
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
| Saccharose | Fisher Scientific | S5-500 | |
| Agarose | Invitrogen | 16500-500 | |
| 6 Unzen Drosophila Flasche | Genesee Scientific | 32-130 | |
| Pinsel (# 1) | Ted Pella, Inc. | 11859 | |
| Fly Nahrungsbestandteile | |||
| Maismehl | Fisher Scientific | NC9109741 | |
| Agar | Genesee Scientific | 66-104 | |
| Melasse | Fisher Scientific | NC9349176 | |
| Propionsäure | Acros | 14930-0010 | |
| Tegosept | Spitze | 20-258 | |
| Ethanol | FischerWissenschaftlich | BP2818-4 | |
| Hefe | Genesee Scientific | 62-107 |
Referenzen
- Pandey, U. B., Nichols, C. D. Human disease models in Drosophila melanogaster and the role of the fly in therapeutic drug discovery. Pharmacol. Rev. 63 (2), 411-436 (2011).
- Feany, M. B., Bender, W. W. A Drosophila model of Parkinson's disease. Nature Mar. 23 (6776), 394-398 (2000).
- Auluck, P. K., Bonini, N. M. Pharmacological prevention of Parkinson disease in Drosophila. Nat. Med. 8 (11), 1185-1186 (2000).
- Whitworth, A. J., Theodore, D. A., Greene, J. C., Benes, H., Wes, P. D., Pallanck, L. J. Increased glutathione Stransferase activity rescues dopaminergic neuron loss in a Drosophila model of Parkinson's disease. Proc. Natl. Acad. Sci. U.S.A. 102 (22), 8024-8029 (2005).
- Gargano, J. W., Martin, I., Bhandari, P., Grotewiel, M. S. Rapid iterative negative geotaxis (RING): a new method for assessing age-related locomotor decline in Drosophila. Exp. Gerontol. 40 (5), 386-395 (2005).
- Lanson, N. A., Maltare, A., King, H., Smith, R., Kim, J. H., Taylor, J. P., Lloyd, T. E., Pandey, U. B. A Drosophila model of FUS-related neurodegeneration reveals genetic interaction between FUS and TDP-43. Hum. Mol. Genet. 20 (13), 2510-2523 (2011).
- Batlevi, Y., Martin, D. N., Pandey, U. B., Simon, C. R., Powers, C. M., Taylor, J. P., Baehrecke, E. H. Dynein light chain 1 is required for autophagy, protein clearance, and cell death in Drosophila. Proc. Natl. Acad. Sci. U.S.A. 107 (2), 742-747 (2010).
- Sang, T. K., Chang, H. Y., Lawless, G. M., Ratnaparkhi, A., Mee, L., Ackerson, L. C., Maidment, N. T., Krantz, D. E., Jackson, G. R. A Drosophila model of mutant human parkin-induced toxicity demonstrates selective loss of dopaminergic neurons and dependence on cellular dopamine. J. Neurosci. 27 (5), 981-992 (2007).
- Stacey, S. M., Muraro, N. I., Peco, E., Labbé, A., Thomas, G. B., Baines, R. A., van Meyel, D. J. Drosophila glial glutamate transporter Eaat1 is regulated by fringe-mediated notch signaling and is essential for larval locomotion. J. Neurosci. 30 (43), 14446-14457 (2010).
- Repnikova, E., Koles, K., Nakamura, M., Pitts, J., Li, H., Ambavane, A., Zoran, M. J., Panin, V. M. Sialyltransferase regulates nervous system function in Drosophila. J. Neurosci. 30 (18), 6466-6476 (2010).
- Repnikova, E., Koles, K., Nakamura, M., Pitts, J., Li, H., Ambavane, A., Zoran, M. J., Panin, V. M. Sialyltransferase regulates nervous system function in Drosophila. J. Neurosci. 30 (18), 6466-6476 (2010).
- Nedelsky, N. B., Pennuto, M., Smith, R. B., Palazzolo, I., Moore, J., Nie, Z., Neale, G., Taylor, J. P. Native functions of the androgen receptor are essential to pathogenesis in a Drosophila model of spinobulbar muscular atrophy. Neuron. 67 (6), 936-952 (2010).
- Lorenzo, D. N., Li, M. G., Mische, S. E., Armbrust, K. R., Ranum, L. P., Hays, T. S. Spectrin mutations that cause spinocerebellar ataxia type 5 impair axonal transport and induce neurodegeneration in Drosophila. J. Cell Biol. 189 (1), 143-158 (2010).
- Wang, J. W., Brent, J. R., Tomlinson, A., Shneider, N. A., McCabe, B. D. The ALS-associated proteins FUS and TDP-43 function together to affect Drosophila locomotion and life span. J. Clin. Invest. , (2011).
- Choi, J. K., Jeon, Y. C., Lee, D. W., Oh, J. M., Lee, H. P., Jeong, B. H., Carp, R. I., Koh, Y. H., Kim, Y. S. A Drosophila model of GSS syndrome suggests defects in active zones are responsible for pathogenesis of GSS syndrome. Hum. Mol. Genet. 19 (22), 4474-4489 (2010).
- Ruan, H., Wu, C. F. Social interaction-mediated lifespan extension of Drosophila Cu/Zn superoxide dismutase mutants. Proc. Natl. Acad. Sci. U.S.A. 105 (21), (2008).
- Slawson, J. B., Kim, E. Z., Griffith, L. C. High-resolution video tracking of locomotion in adult Drosophila melanogaster. J. Vis. Exp. (24), (2009).
- Becnel, J., Johnson, O., Luo, J., Nässel, D. R., Nichols, C. D. The serotonin 5-HT7 Dro receptor is expressed in the brain of Drosophila, and is essential for normal courtship and mating. PLoS One. 6 (6), e20800 (2011).
- Johnson, O., Becnel, J., Nichols, C. D. Serotonin 5-HT(2) and 5-HT(1A)-like receptors differentially modulate aggressive behaviors in Drosophila melanoga- ster. Neuroscience. 158 (2), 1292-1300 (2009).
- Bastock, M., Manning, A. The Courtship of Drosophila Melanogaster. Behaviour. , 85-111 (1955).
- Greenspan, R. J., Ferveur, J. F. Courtship in Drosophila. Annu. Rev. Genet. 34, 205-232 (2000).
- Villella, A., Hall, J. C. Neurogenetics of courtship and mating in Drosophila. Adv. Genet. 62, 67-184 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten