Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Méthodes de dosage à Drosophila Comportement
Dans cet article
Résumé
Drosophila melanogaster est un système modèle génétiquement et comportemental souple qui a été utilisée pour comprendre la base moléculaire et cellulaire de nombreux processus biologiques importants pour plus d'un siècle 1. Drosophile a été bien exploitée afin de mieux comprendre la base génétique du comportement à la mouche.
Résumé
Drosophila melanogaster, la mouche des fruits, a été utilisé pour étudier les mécanismes moléculaires d'un large éventail de maladies humaines comme le cancer, les maladies cardiovasculaires et de diverses maladies neurologiques 1. Nous avons optimisé simples et robustes tests comportementaux pour déterminer locomotion de la larve, la capacité d'escalade adulte (dosage RING), et les comportements de séduction de la drosophile. Ces tests comportementaux sont largement applicables pour étudier le rôle des facteurs génétiques et environnementaux sur le comportement à la mouche. La capacité de ramper larvaire peut être utilisé de manière fiable pour déterminer les changements à un stade précoce dans les capacités rampants de larves de drosophile et aussi pour examiner l'effet de médicaments ou de gènes de maladies humaines (des mouches transgéniques) sur leur locomotion. Le dosage des larves rampant devient plus applicable si l'expression ou la suppression d'un gène provoque une létalité à un stade nymphal ou adulte, que ces mouches ne survivent pas à l'âge adulte où ils pourraient par ailleurs être évalué. Cette base, unssay peut également être utilisé en conjonction avec la lumière vive ou le stress d'examiner d'autres réponses comportementales chez les larves de Drosophila. Comportement de cour a été largement utilisée pour étudier les bases génétiques du comportement sexuel, et peut également être utilisé pour examiner l'activité et de la coordination, ainsi que l'apprentissage et la mémoire. Comportement de cour chez la drosophile implique l'échange de divers stimuli sensoriels, y compris visuelles, auditives, et les signaux chimiosensoriels entre les hommes et les femmes qui mènent à une série complexe de comportements moteurs bien caractérisés ont abouti à la copulation avec succès. Dosages adultes traditionnels d'escalade (géotaxie négatifs) sont fastidieux, de main-d'œuvre, et prend du temps, avec une variation significative entre les différents essais 2-4. Le itératif rapide géotaxie négative (RING) test 5 a de nombreux avantages sur des protocoles plus largement utilisés, en fournissant une approche débit reproductible, sensible, et de haute de quantifier locomotrice des adultes et négatifs géotaxie behaviors. Dans le test RING, plusieurs génotypes ou de traitements médicamenteux peuvent être testés simultanément en utilisant grand nombre d'animaux, à l'approche à haut débit rend plus propice pour des expériences de dépistage.
Protocole
Essai A. Crawling larvaire
1. Collection larves
- Mettre en place une bouteille de 8 oz de mouches (10-15 mâles + femelles 10-15).
- Laissez-mouches pondent leurs œufs pendant 24 heures, puis de bouteilles claire de mouches. (Transfert des adultes dans un nouveau flacon et répéter au besoin).
- Incuber bouteille pendant 3-4 jours, ou jusqu'au troisième stade larvaire sont visibles.
- Ajouter 50 à 100 ml de saccharose à 20% à la bouteille avec les larves et les laisser reposer pendant 20 minutes. Les larves flottent à la surface.
- Recueillir les larves à l'aide d'une pipette de 25 ml sérologique avec la pointe coupée, et le placer dans un panier en treillis.
- Laver les larves dans le panier à maille deux fois avec désionisée H 2 O. Les larves sont maintenant prêts pour les expériences.
2. Pour traiter les larves à la drogue
- Utilisation d'une brosse pour transporter le nombre souhaité de larves à un bécher contenant 5 ml de saccharose une solution à 5% + médicament.
- Laissez les larves se nourrissent pendant au moins 15 minutes.
- Verser la drogue traitée larves dans un panier en treillis et rincer. Ils sont maintenant prêts à utiliser.
3. Essai locomoteur (mesure de la distance totale parcourue ou des contractions paroi du corps)
- Utilisez une brosse pour le transport de larve à un individu:
- 15 cm boîte de Pétri contenant 2% d'agarose (précédemment versé et on laisse durcir) sur du papier millimétré avec une épaisseur de 0,2 cm 2 de grille.
- Compter le nombre de lignes de la grille traversé en 1 minute.
- Eh bien d'un plat de dissection verre contenant une solution de levure diluée pâte.
- Comptez le péristaltisme (contractions antérieure sur le mouvement de contraction postérieure = 1) en une minute tout en observant sous un microscope à dissection.
- 15 cm boîte de Pétri contenant 2% d'agarose (précédemment versé et on laisse durcir) sur du papier millimétré avec une épaisseur de 0,2 cm 2 de grille.
- Répétez jusqu'à ce que les chiffres désirés de larves ont été comptés.
B. itératif rapide géotaxie négative (RING) Protocole
Cet essai a été à l'origine deprescrite par Gargano et al 5.
- Recueillir nouvellement écloses mouches mâles adultes de moins de CO 2 anesthésie légère et le placer dans un flacon standard contenant des aliments (ou de la nourriture + médicament).
- Maintenir les mouches à la température ambiante (sur la paillasse. ~ 22 ° C) pendant 2-3 jours pour permettre la récupération du CO 2 (et l'accumulation des concentrations de médicament l'état d'équilibre, le cas échéant).
- Transférer environ 25 mouches sans anesthésie dans des flacons en polystyrène préparés.
- Assemblez les flacons avec des mouches dans l'appareil RING (Figure 1).
- Permettez-mouches pour s'acclimater à l'environnement, à l'abri, pendant 15-20 minutes.
- Au cours de cet appareil photo numérique du temps lieu ~ 1 m en avant de l'appareil (sur une plate-forme si nécessaire pour aligner le centre de la lentille à mi-hauteur de la flacons), mise au point et zoom de la caméra sur l'appareil, et régler une minuterie pour 3,0 secondes.
- Soigneusement s'emparer de l'appareil sonner avec votre main gauche afin de ne pas disturb les mouches, et tiennent la minuterie avec votre main droite.
- Fortement appuyez sur l'appareil vers le bas sur la surface du banc à trois reprises, en s'assurant que l'eau du robinet est déjà assez difficile de faire tomber toutes les mouches au fond des flacons.
- Parallèlement à l'achèvement de la troisième prise, démarrez le compte à rebours de 3 secondes.
- A trois secondes de prendre une photo.
- Réinitialiser la minuterie pendant 1 minute et commencer. Pendant ce temps, réinitialiser la caméra et se concentrer sur l'appareil, et fixer un autre canal de la minuterie pendant trois secondes.
- Après 1 minute, répétez les étapes 1.7 à 1.10
- Après un total de 5-6 essais, télécharger des images sur un ordinateur et d'utiliser votre visionneuse d'image préférée pour ouvrir, et marquer la hauteur moyenne a grimpé pour chaque flacon.
- Effectuer une analyse statistique sur vos différents groupes en comparant la hauteur moyenne a grimpé.
Courtship C. et dosage d'accouplement
- La première chose le matin, claires et producteurs de bouteilles de flies à être utilisé.
- Au cours de la journée (toutes les 3-4 heures), de recueillir nouvellement écloses mâles sexuellement naïfs et les femmes:
- Placez les hommes individuellement dans des flacons ou des tubes avec le milieu.
- Placez 5-6 femelles ensemble, par flacon / tube.
- Isoler les mouches recueillies à 25 ° C de moins de 12 heures de lumière / obscurité pendant 5 jours.
- Transfert d'une femelle dans la chambre d'une roue d'accouplement.
- Transférer un mâle dans la chambre d'une roue d'accouplement.
- Observez paire sous un microscope à dissection pour les comportements suivants:
- Orientation (les mâles oriente vers la femelle)
- Tapping (le mâle tape la femme)
- Chanson Wing (le mâle s'étend et vibre d'une aile)
- Lèche (les mâles lèche les organes génitaux féminins)
- Curling (le mâle se recourbe son abdomen sous lui-même)
- Tentative de copulation (curling activité tout en essayant de monter sur la femelle)
- Observer pour 10 minutes ou jusqu'à ce que la copulation, en notant l'heure à laquelle chaque problème se produit (latence), le temps total engagé dans le comportement de cour jusqu'à ce que la copulation (pour calculer l'indice de cour), ainsi que le nombre de paires qui ont réussi à adopter un comportement donné ( fréquence). 100% des paires de type sauvage est généralement s'accoupler dans les 5 minutes.
- Calculer un indice de cour (CI) en divisant le temps passé à faire la cour, divisé par le temps total jusqu'à la copulation. Pour les couples de type sauvage de cette oscille habituellement entre 0.6-0.8.
D. des résultats représentatifs
Crawling test
Normale larve de type sauvage va errer ~ 3 cm / minute, et d'exposition de ~ 40-50 contractions paroi du corps en une minute. Nous avons récemment développé un modèle de drosophile du FUS / TLS liée sclérose latérale amyotrophique qui montre des larves rampant défaut, la durée de vie réduite et des adultes d'escalade dépréciation 6. Nous avons ciblé l'expression of de type sauvage et des formes mutantes de FUS / TLS afin de les neurones moteurs (OK-371-gal4 pilote) et a effectué un test exploration des larves. Comme indiqué ci-dessous, les larves de type sauvage ramper jusqu'à 12 cm, alors que l'expression du FUS de type sauvage a diminué la capacité des larves rampant à environ 6 cm. Animaux exprimant la mutation R521C SLA causant dans FUS / TLS démontrer une déficience très sévère dans leur mouvement rampant (Figure 1), ramper seulement d'environ 1 cm par minute.
Négatif dosage RING géotaxie
Les jeunes mouches adultes de type sauvage doit avoir une hauteur moyenne d'escalade de ~ 4-5 cm dans un délai de 3 secondes (le temps peut être réglé de 3 secondes pour accueillir différentes souches ou des niveaux d'activité pour définir une hauteur moyenne donnée pour une donnée la souche / traitement). Mouches qui restent à la partie inférieure est attribuée une valeur de 0. Il n'est pas conseillé d'utiliser plus de 25 mouches par flacon, car il devient alors difficile de déterminer l'emplacement de chaque individu à la mouche pour mesurer la hauteur. Ndésensibilisation o a été observée à la hauteur des 6 essais consécutifs espacés de 1 minute d'intervalle que nous avons employée. Il est essentiel de ne pas réutiliser les flacons d'essai en polystyrène dans cet essai, après les premières poses de données sont recueillies en raison de nouvelles mouches placées dans des flacons utilisés ne veut pas monter dans la même mesure que dans des flacons frais.
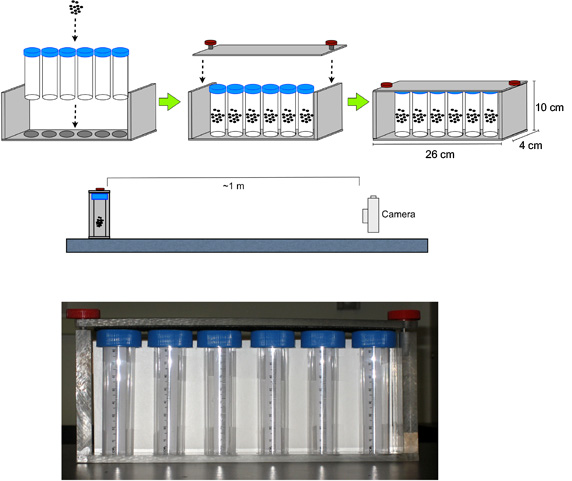
Figure 1. Configuration pour le test RING. L'appareil photo numérique est placé ~ 1 m en avant de l'appareil contenant les mouches dans les tubes en polystyrène; mise au point et zoom de la caméra sur l'appareil et régler une minuterie pour 3,0 secondes.
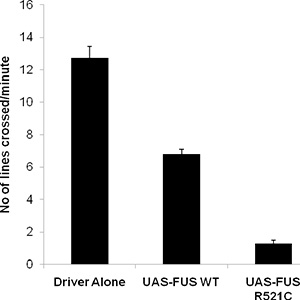
Les données représentatives Figure 2. De l'essai ramper larves à l'aide mouches ectopique exprimer UAS-FUS WT, et UAS-FUS R521C sous le contrôle d'un conducteur du neurone moteur (OK371-Gal4).
Discussion
Comportement chez la drosophile est étroitement régulée par des facteurs génétiques et environnementaux. Nous, et d'autres, ont déjà utilisé les tests décrits ici pour recueillir des données afin d'examiner les gènes liés à voler et à des comportements humains les maladies neurodégénératives modélisés chez la drosophile 5-19. Pour le dosage de l'exploration, la sélection minutieuse de 3 e stade larvaire est une étape critique. Si le traitement avec...
Déclarations de divulgation
Nous n'avons rien à communiquer.
Remerciements
Nous tenons à remercier Astha Maltare pour générer les données crawling larvaires. Nous tenons à remercier le Dr Nicholas Lanson Jr. pour donner ses commentaires sur le manuscrit. Ce travail a été soutenu par le Centre Robert Packard pour la SLA à l'Université Johns Hopkins (à l'UBP) et le Sclérose latérale amyotrophique Association (UBP), et R01MH083689 de la National Institutes of Mental Health (CDN).
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | |
| Saccharose | Fisher Scientific | S5-500 | |
| Agarose | Invitrogen | 16500-500 | |
| 6 oz Drosophila bouteille | Genesee scientifique | 32-130 | |
| Paint Brush (# 1) | Ted Pella, Inc | 11859 | |
| Fly composants alimentaires | |||
| Semoule de maïs | Fisher Scientific | NC9109741 | |
| Gélose | Genesee scientifique | 66-104 | |
| Mélasse | Fisher Scientific | NC9349176 | |
| L'acide propionique | Acros | 14930-0010 | |
| Tegosept | Apex | 20-258 | |
| L'éthanol | PêcheurScientifique | BP2818-4 | |
| Levure | Genesee scientifique | 62-107 |
Références
- Pandey, U. B., Nichols, C. D. Human disease models in Drosophila melanogaster and the role of the fly in therapeutic drug discovery. Pharmacol. Rev. 63 (2), 411-436 (2011).
- Feany, M. B., Bender, W. W. A Drosophila model of Parkinson's disease. Nature Mar. 23 (6776), 394-398 (2000).
- Auluck, P. K., Bonini, N. M. Pharmacological prevention of Parkinson disease in Drosophila. Nat. Med. 8 (11), 1185-1186 (2000).
- Whitworth, A. J., Theodore, D. A., Greene, J. C., Benes, H., Wes, P. D., Pallanck, L. J. Increased glutathione Stransferase activity rescues dopaminergic neuron loss in a Drosophila model of Parkinson's disease. Proc. Natl. Acad. Sci. U.S.A. 102 (22), 8024-8029 (2005).
- Gargano, J. W., Martin, I., Bhandari, P., Grotewiel, M. S. Rapid iterative negative geotaxis (RING): a new method for assessing age-related locomotor decline in Drosophila. Exp. Gerontol. 40 (5), 386-395 (2005).
- Lanson, N. A., Maltare, A., King, H., Smith, R., Kim, J. H., Taylor, J. P., Lloyd, T. E., Pandey, U. B. A Drosophila model of FUS-related neurodegeneration reveals genetic interaction between FUS and TDP-43. Hum. Mol. Genet. 20 (13), 2510-2523 (2011).
- Batlevi, Y., Martin, D. N., Pandey, U. B., Simon, C. R., Powers, C. M., Taylor, J. P., Baehrecke, E. H. Dynein light chain 1 is required for autophagy, protein clearance, and cell death in Drosophila. Proc. Natl. Acad. Sci. U.S.A. 107 (2), 742-747 (2010).
- Sang, T. K., Chang, H. Y., Lawless, G. M., Ratnaparkhi, A., Mee, L., Ackerson, L. C., Maidment, N. T., Krantz, D. E., Jackson, G. R. A Drosophila model of mutant human parkin-induced toxicity demonstrates selective loss of dopaminergic neurons and dependence on cellular dopamine. J. Neurosci. 27 (5), 981-992 (2007).
- Stacey, S. M., Muraro, N. I., Peco, E., Labbé, A., Thomas, G. B., Baines, R. A., van Meyel, D. J. Drosophila glial glutamate transporter Eaat1 is regulated by fringe-mediated notch signaling and is essential for larval locomotion. J. Neurosci. 30 (43), 14446-14457 (2010).
- Repnikova, E., Koles, K., Nakamura, M., Pitts, J., Li, H., Ambavane, A., Zoran, M. J., Panin, V. M. Sialyltransferase regulates nervous system function in Drosophila. J. Neurosci. 30 (18), 6466-6476 (2010).
- Repnikova, E., Koles, K., Nakamura, M., Pitts, J., Li, H., Ambavane, A., Zoran, M. J., Panin, V. M. Sialyltransferase regulates nervous system function in Drosophila. J. Neurosci. 30 (18), 6466-6476 (2010).
- Nedelsky, N. B., Pennuto, M., Smith, R. B., Palazzolo, I., Moore, J., Nie, Z., Neale, G., Taylor, J. P. Native functions of the androgen receptor are essential to pathogenesis in a Drosophila model of spinobulbar muscular atrophy. Neuron. 67 (6), 936-952 (2010).
- Lorenzo, D. N., Li, M. G., Mische, S. E., Armbrust, K. R., Ranum, L. P., Hays, T. S. Spectrin mutations that cause spinocerebellar ataxia type 5 impair axonal transport and induce neurodegeneration in Drosophila. J. Cell Biol. 189 (1), 143-158 (2010).
- Wang, J. W., Brent, J. R., Tomlinson, A., Shneider, N. A., McCabe, B. D. The ALS-associated proteins FUS and TDP-43 function together to affect Drosophila locomotion and life span. J. Clin. Invest. , (2011).
- Choi, J. K., Jeon, Y. C., Lee, D. W., Oh, J. M., Lee, H. P., Jeong, B. H., Carp, R. I., Koh, Y. H., Kim, Y. S. A Drosophila model of GSS syndrome suggests defects in active zones are responsible for pathogenesis of GSS syndrome. Hum. Mol. Genet. 19 (22), 4474-4489 (2010).
- Ruan, H., Wu, C. F. Social interaction-mediated lifespan extension of Drosophila Cu/Zn superoxide dismutase mutants. Proc. Natl. Acad. Sci. U.S.A. 105 (21), (2008).
- Slawson, J. B., Kim, E. Z., Griffith, L. C. High-resolution video tracking of locomotion in adult Drosophila melanogaster. J. Vis. Exp. (24), (2009).
- Becnel, J., Johnson, O., Luo, J., Nässel, D. R., Nichols, C. D. The serotonin 5-HT7 Dro receptor is expressed in the brain of Drosophila, and is essential for normal courtship and mating. PLoS One. 6 (6), e20800 (2011).
- Johnson, O., Becnel, J., Nichols, C. D. Serotonin 5-HT(2) and 5-HT(1A)-like receptors differentially modulate aggressive behaviors in Drosophila melanoga- ster. Neuroscience. 158 (2), 1292-1300 (2009).
- Bastock, M., Manning, A. The Courtship of Drosophila Melanogaster. Behaviour. , 85-111 (1955).
- Greenspan, R. J., Ferveur, J. F. Courtship in Drosophila. Annu. Rev. Genet. 34, 205-232 (2000).
- Villella, A., Hall, J. C. Neurogenetics of courtship and mating in Drosophila. Adv. Genet. 62, 67-184 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon