Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Proteínas de alto rendimiento del generador de expresiones utilizando una plataforma de microfluidos
* Estos autores han contribuido por igual
En este artículo
Resumen
Se presenta un enfoque de microfluidos para la expresión de matrices de proteínas. El dispositivo consiste en miles de cámaras de reacción controladas por micro-mecánicos válvulas. El dispositivo microfluídico está acoplado a una biblioteca de genes de microarrays-impreso. Estos genes se transcribe y se traduce en un chip, lo que resulta en una matriz de proteína listo para su uso experimental.
Resumen
Campos en rápido crecimiento, tales como la biología de sistemas, requieren el desarrollo y la implementación de nuevas tecnologías, lo que permite mediciones de alto rendimiento y alta fidelidad de los grandes sistemas. Microfluídica se compromete a cumplir muchos de estos requisitos, tales como la realización de experimentos de alto rendimiento de cribado en el chip, que abarca ensayos bioquímicos, biofísicos y basados en células-1. Desde los primeros días de los dispositivos de microfluidos, este campo ha evolucionado drásticamente, lo que lleva al desarrollo de microfluidos integración a gran escala 2,3. Esta tecnología permite la integración de miles de válvulas micromecánicos en un único dispositivo con una huella de franqueo de tamaño (Figura 1). Hemos desarrollado una plataforma microfluídica de alto rendimiento para la generación de la expresión in vitro de matrices de proteínas (Figura 2) con nombre PING (interacción proteína Generador de red). Estas matrices pueden servir como una plantilla para muchos experimentostales como la proteína-proteína 4, proteína-ARN 5 o proteína de ADN 6 interacciones.
El dispositivo consiste de miles de cámaras de reacción, que están programados individualmente utilizando una microarrayer. Alineación de estos microarrays impresos a los dispositivos de microfluidos programas de cada cámara con una sola mancha eliminación de la contaminación potencial de reactividad cruzada o más, para generar micromatrices utilizando técnicas estándar de microarrays manchado es también muy modular, lo que permite la arraying de proteínas, ADN 7 8, moléculas pequeñas, e incluso suspensiones coloidales. El impacto potencial de la microfluídica en las ciencias biológicas es importante. Una serie de ensayos basados en microfluídica ya han proporcionado nuevos conocimientos sobre la estructura y función de los sistemas biológicos, y el campo de la microfluídica, seguirá afectando la biología.
Protocolo
1. Fabricación de los dispositivos
- Comprado DTPA-D SU-8 molde de control y SPR220-7 flujo molde de la fundición de Stanford microfluídica ( www.stanford.edu / grupo / fundición ).
- Exponer los moldes de silicona a clorotrimetilsilano (TMCS) de vapor durante 10 min para promover la liberación de elastómero después de los pasos de cocción 9.
- Preparar una mezcla de elastómero a base de silicona y agente de curado (mezclar bien) en dos proporciones distintas 5:1 y 20:1 para el control y moldes de flujo, respectivamente. Las diferentes relaciones son necesarias para la correcta adherencia de capas múltiples.
- Vierta el PDMS 05:01 en la capa de control (aproximadamente 5 mm de altura). Degas el control de la capa y hornear durante 30 minutos a 80 º C. Capa Spin (Laurell, EE.UU.) la mezcla 20:1 de PDMS en la capa de flujo a 2.600 rpm durante 60 segundos y después se hornea a 80 º C durante 30 min. La velocidad recubridora de rotación está optimizado para el accionamiento de la válvula a una presiónde 15 psi. Más rápidas hilatura resultará en una capa delgada con la presión de activación inferior y viceversa. Los dispositivos que usamos tienen un límite de 25 psi en el control y 10 psi en el flujo, encima de la cual la separación del sustrato puede ocurrir.
- Se separa la capa de control del molde. Hazlo despacio y tenga cuidado de no pelar el patrón SU8. A continuación, corte el dispositivo alrededor de su perímetro y perforaciones para acceder a los canales de control.
- Alinear el flujo y capas de control manualmente en un estereoscopio. Iniciar mediante la alineación de la esquina superior izquierda; la válvula de botón (capa de control) debe estar en el centro de la cámara de reacción (capa de flujo). A continuación, alinee la primera fila y suavemente suelte la fila capa de control por fila. Asegúrese de que todas las válvulas de botón están en el medio de las cámaras de reacción y que las válvulas de entrada de direcciones y cruzar los canales de flujo en la posición correcta. El proceso puede ser repetido hasta que todas las filas localmente están alineados. Al final, liberar cualquier tensión en el b PDMSy levantándola cuidadosamente por los lados y las esquinas. No levante demasiado o desalineación puede ocurrir.
- Hornear durante 2 horas a 80 ° C.
- Cortar alrededor del perímetro del dispositivo y pelar el dispositivo de capa dos (chip) del molde de flujo. Perforar agujeros para acceder a los canales de flujo (Figura 1).
2. ADN Arraying y alineación de dispositivos
- Producir genes sintéticos por PCR de ensamblaje. Los genes sintéticos se componen de promotor T7, sitio de unión al ribosoma (RBS), ORF con dos etiquetas de epítopo (uno en cada extremo), y terminador T7 4. Los genes pueden variar en longitud desde 100 pb hasta, al menos, 5.000 pb.
- Preparar los genes sintéticos para formar clusters de: preparar una mezcla de etileno glicol de poli (1,25%) y D-trehalosa dihidrato (125 mg / ml) y prescindir de 2 l por reacción en 384 pocillos de la placa. Esta solución reducirá unión irreversible del ADN al vidrio, así como para la visualización durante la alineación 10.
- Transferir los genes sintéticos a la placa de 384 pocillos. Por lo general, las concentraciones de ADN puede variar de 10 ng / l a 100 ng / l concentración final. Añadir dH 2 O hasta un volumen final de 20 l (depende de microarrayer y tipo pin).
- Detectar una serie de genes sintéticos sobre sustratos de vidrio recubiertos con epoxi utilizando un microarrayer. Usamos MicroGrid 610 (Bio Robotics) con los pernos de silicona SMT-S75 (Síntesis paralela, EE.UU.). Contacto impresión del ADN, con estos pernos específicos, los resultados en los puntos con diámetro de aproximadamente 100 micras sobre la superficie del vidrio. Cada pin de carga es suficiente para aproximadamente 100 plazas. Asegúrese de que los campos de fila y columna se corresponden con el dispositivo específico usado. El dispositivo que utilizamos contiene 16 columnas y 40 filas con una separación de 680 m por 320 m, respectivamente.
- Alinear manualmente el dispositivo de microfluidos para el conjunto de genes en un estereoscopio. La mancha de ADN debería estar en el medio de las cámaras de ADN. Iniciar la alineación mediante la localización de la primera fila de puntos below la primera fila de cámaras de ADN. A continuación, poner en línea el resto de las filas de acabado con ajuste de precisión de todo el dispositivo. Una vez que la matriz está alineado se debe tener cuidado para aliviar cualquier tensión en el PDMS, mediante el levantamiento de forma local. Si hay tensión a la izquierda en el PDMS no pueden unirse así a la micromatriz.
- Por último, el dispositivo de enlace a la placa de vidrio por incubación durante la noche en una placa caliente a 80 ° C.
3. Cebado y activar el dispositivo
- Las válvulas en la capa de control se accionan desde el ordenador utilizando LabVIEW. La secuencia de comandos LabVIEW controla una serie de válvulas de solenoide micro través de una caja de control electrónico (adquirido de Stanford microfluídica Foundry). El colector de la válvula de solenoide está conectada al aire comprimido, que controlan el flujo de aire y la presión en las válvulas de control del aparato.
- Conectar el dispositivo al colector de válvulas de solenoide mediante un tubo de plástico flexible con un diámetro interno de 0,02 "(Tygon) Y acero inoxidable pin (New England pequeños tubos Corporation).
- Llenar los tubos con DDW y se inserte el pasador en los orificios de acceso de la capa de control. Asegúrese de que cada tubo está conectado a su canal de control correspondiente.
- Ejecutar la aplicación de LabVIEW en el equipo para activar los canales de control. Mediante la activación de la válvula de la secuencia de comandos de LabVIEW, se aplica presión de aire, que a su vez empuja el agua en los canales de control de PDMS. Ajustar la presión de aire a 5 psi. Se recomienda para llenar el "sándwich" y las válvulas de la primera dirección, a fin de identificar las conversaciones cruzadas entre canales de control de dispositivos defectuosos. En el caso de las conversaciones cruzadas, el accionamiento de la línea de control 'sandwich' dará lugar a la activación de cualquiera de las líneas del cuello o del botón de control. Esto es similar a un cortocircuito en un circuito eléctrico. Un dispositivo con la diafonía es defectuoso y no se puede utilizar.
- Después de que todos los canales de control y las válvulas están llenos de DDW, las válvulas están preparados y ready para bloquear los canales de flujo por debajo de ellos. Aumentar la presión del aire a 15 psi. Activación de la válvula se controla desde un programa de LabVIEW a través de un conjunto de encendido / apagado interruptores conectados a las válvulas solenoides individuales. Cada interruptor controla una línea de control específico a través de la válvula de solenoide correspondiente. Activando el interruptor de botón (en el guión) se aplique presión de aire en el tubo correspondiente. La presión del aire empujará el DDW en la línea de control y dará lugar a la expansión de las válvulas de microfluidos, bloqueando el canal de debajo. La desactivación de una válvula de control, se liberará la presión del aire y liberar posteriormente el bloqueo del canal de flujo respectivo.
- Para asegurarse de que todas las válvulas están abiertas, conectar un tubo a una de las entradas de flujo y de flujo de aire en el dispositivo en psi 4-5. Esto liberará todas las válvulas pegajosas de la placa de vidrio.
- Finalmente, el dispositivo está preparado y listo. Cierre todas las válvulas de entrada y de "cuello", para iniciar la química de superficie.
- Con el fin de facilitar el auto-ensamblaje de una matriz de proteína de la superficie y evitar la adsorción no específica dentro del dispositivo de microfluidos, la superficie se modifica químicamente:
- Para fluir a través de un componente del dispositivo, conecte un tubo nuevo con la solución requerida para uno de los canales de flujo en el dispositivo. Conectar el lado libre del tubo al colector manual y abrir el flujo de presión de aire (5 psi).
- Cargar 40 l de biotina-BSA (1 mg / l) en un tubo nuevo y el flujo de aproximadamente la mitad de ella durante 20 min a través del dispositivo, la BSA se unen a la superficie de epoxi.
- Use Hepes (50 mM) para el lavado de sustrato sin reaccionar entre cada uno de los pasos de química de superficie diferentes.
- Flujo de 25 l estreptavidina (0,5 mg / l) durante 20 min en la parte superior de la biotinilado-BSA.
- Lavar con Hepes para 5 min.
- Cierre el "botón" de la válvula y fluir el resto de la biotinilado-BSA (de la forma descritacama arriba), pasivación de la superficie que rodea el botón.
- Lavar con Hepes para 5 min.
- Liberar el "botón" de la válvula y el flujo de 30 l de Su penta--biotina (0,16 g / l) durante 20 min. El anticuerpo se unirá a la estreptavidina expuesta; específicamente al área bajo el "botón" crear un anti His-tag de matriz.
5. Expresión de proteínas
- Expresar las proteínas en el dispositivo mediante la transcripción de reticulocitos de conejo acoplado rápido y reacción de traducción. Expresión de proteínas de los genes sintéticos manchas en el dispositivo crea una matriz de proteínas listos para usar. Por ejemplo, uno de tales usos es para una pantalla de unión a proteínas.
- Abrir las válvulas de "cuello" y conejo flujo de reticulocitos rápida acoplado de transcripción y traducción de reacción a través del dispositivo en la cámara de ADN. A continuación, cerrar las válvulas de "sandwich" y separar cada gen a partir de su entorno. Incubar el dispositivo en una placa caliente durante 2,5 horas a 30 ° C. Expresada proteins se difunden desde la cámara de ADN a la cámara de reacción espontánea (válvula de cuello está abierto) y se unen a su anti-anticuerpo bajo el "botón" válvula de inmovilización de la proteína a través de su C-terminal etiqueta.
- Etiquete las proteínas con C-myc anticuerpos Cy3. El anticuerpo se unirá a su epítopo correspondiente, situada en la proteína N-terminal.
- Determinar los niveles de expresión de proteínas con un scanner de microarrays (LS Reloaded, Tecan) utilizando un láser nm 532 y 575 nm filtro de emisión.
6. Los resultados representativos
1. Fabricación de los dispositivos
Un diseño gráfico para el dispositivo fue creado por AutoCAD basado en nuestras necesidades experimentales. El diseño fue impreso en una película de transparencia por un fijador de imágenes de alta resolución. Esta transparencia sirve como una fotomáscara en fotolitografía contacto. Una técnica de micromecanizado de superficie se utilizó para crear plantillas de 3-D en una oblea de silicio determinado por los patrones inscritos en tenmascara utilizado.
El dispositivo microfluídico se fabricó sobre molde de silicona colada de elastómero de silicona de polidimetilsiloxano (PDMS, SYLGARD 184, Dow Corning, EE.UU.) (Figura 1). Cada dispositivo consta de dos capas alineadas PDMS, el flujo y la capa de control. El molde fue expuesto primero a clorotrimetilsilano (TMCS, Aldrich) de vapor durante 10 min para promover la liberación de elastómero después de los pasos de cocción. Una mezcla de elastómero a base de silicona y agente de curado se preparó en dos diferentes proporciones 5:1 y 20:1 para el control y moldes de flujo, respectivamente. La capa de control se desgasificó y se coció durante 30 min a 80 ° C. La capa de flujo fue inicialmente recubrió por centrifugación (Laurell, EE.UU.) a 2.600 rpm durante 60 segundos y se hornea a 80 º C durante 30 min. La capa de control se separó de su molde y de control de los orificios de acceso de canal perforado se. A continuación, las capas de flujo y de control fueron alineados manualmente en un estereoscopio y se cocieron durante 2 horas a 80 ° C. El dispositivo de dos capas se peló fesde el molde de flujo y canales de flujo orificios de acceso fueron perforados.
2. Descripción del dispositivo
La capacidad del dispositivo puede variar desde 500 hasta 10.000 células unitarias (Figura 2). El dispositivo consta de dos capas; capa de flujo (gris) y la capa de control (color). La capa de control contienen una variedad de válvulas con una función diferente. Cada celda unidad, en la capa de flujo, se compone de un ADN y una cámara de reacción y es controlado por tres tipos de válvulas micromecánicas; "cuello", "botón", y "sándwich" (Figura 2A). "Gen sintético 'A manchado depositado dentro de la cámara de ADN es bloqueado de la cámara de reacción por el" cuello "de la válvula (verde). Lavado atrapamiento mecánico y de proteínas de la superficie consolidados en la cámara de reacción se lleva a cabo por el "botón" de la válvula (azul). El "emparedado" válvula permite que cada reacción que se produzca en su propia celda unidad (rojo). Las válvulas de direcciones puede dividir el dispositivo hasta 8 secciones independientes, para diferent ensayo condición. Además, la capa de control contiene válvulas de entrada que permiten el flujo de fluido seleccionado en la capa de flujo. Los canales de control PDMS están llenos con DDW. Cuando una válvula se acciona el aumento de la presión (15 psi) resulta en la expansión de la PDMS. En los lugares donde la membrana es lo suficientemente delgada (es decir, el cruce de control y líneas de flujo), esto es suficiente para bloquear completamente la línea de flujo. La altura media celda unitaria es 10 m, y el volumen promedio de celda unidad es menos de 1 nl.
3. Proteínas de expresión y detección
Las proteínas se expresaron en el dispositivo mediante transcripción rápida de reticulocitos de conejo acoplado y reacción de traducción (Promega). La expresión de las proteínas creado una matriz de proteínas listas para su uso en una pantalla de unión (Figura 3). Una mezcla expresión (12,5 l) se cargó en el dispositivo y, a continuación inundado en las cámaras de ADN mediante la apertura de las válvulas de "cuello". A continuación, los 'sandwich' válvulas erancerró dejando cada celda unidad separada de sus células vecinas y el dispositivo se incubó en una placa caliente durante 2,5 horas a 30 ° C. Las proteínas expresadas difunde a través de la cámara de gen en la cámara de reacción, donde su C-terminal Su etiqueta podría enlazar el anticuerpo anti-His (Qiagen), situados bajo el "botón" válvula de inmovilización de la proteína a la superficie. Las proteínas fueron marcadas con Cy3 un C-myc (Sigma), lo que unido a su epítopo correspondiente situado en la proteína N-terminal y la etiqueta él. Los niveles de expresión de proteínas se determinaron con un escáner de microarrays (LS Reloaded, Tecan) utilizando un láser de 532 nm y 575 nm filtro. La matriz de proteína resultante se compone de diferentes niveles de expresión de la proteína. Por lo general, alrededor de 20% de una biblioteca de genes no expresan a niveles detectables. No hay correlación con el tamaño de la proteína se observó 3. Los niveles de fondo se determinaron utilizando cámaras que no estaban manchados con el ADN. Por lo tanto, las señales de las cámaras de proteína correspondiente se deben a una noise o adsorción no específica de los anticuerpos de etiquetado.
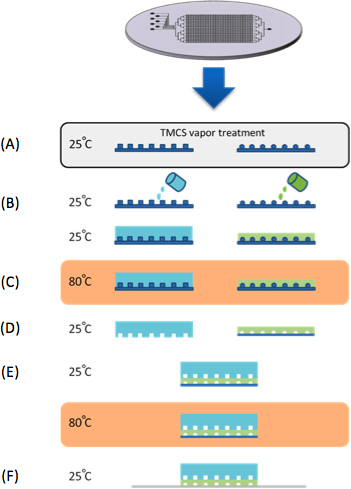
Figura 1. Fabricación de chips. (A) Los moldes fueron tratados con vapores TMCS de 10 min. (B) PDMS es fundido en moldes de flujo de control y de silicio. (C) Los dos moldes de control de flujo y se cuecen al horno en 80 ° C durante 30 min. (D) La capa de control de pelado del molde, cortado a la medida y las entradas de control están perforadas. (E) La capa de control se alinea con la capa de flujo en un estereoscopio y luego al horno en 80 ° C durante 2 horas. En paralelo a la fabricación de dispositivos PDMS, una serie de genes sintéticos se microarrayed sobre sustratos de vidrio recubierto con resina epoxi (CEL Associates). (F) El dispositivo está entonces alineado con el microarray de ADN atrapando los "genes sintéticos" dentro de las cámaras de ADN.

Figura 2. Una foto de los dispositivos PING. (A) El dispositivo consist alineados de dos capas de PDMS (control y flujo). La capa de flujo de trabajo paralelos contiene ADN y reacción (gris) controlados por válvulas micromecánicos ("button", "pan" y "cuello") en la capa de control. (B) Las capas están alineadas a un microarray impreso, que los programas de cada cámara de ADN con un solo punto. Esto elimina cualquier contaminación potencial.

Figura 3. Imágenes fluorescentes de una matriz de proteína creada con un chip de microfluidos. Los genes planas impresas se expresaron a proteínas dentro del dispositivo (en la cámara de ADN) y se tira hacia abajo a la superficie (por debajo de la "botón" de la válvula en la cámara de reacción) a través de su C-terminal de His. Expresión de la proteína se detectó mediante su C-myc N-terminal de etiqueta y un anticuerpo fluorescente específico. Las distintas intensidades de señal indican diferentes niveles de expresión de proteínas. Un-manchado cámaras sirvieron como controles para el fondo leVels.
Discusión
En este trabajo se presenta un método para la generación de matrices de proteínas de alto rendimiento mediante una plataforma de microfluidos. La generación de matriz se basa en la impresión de microarrays de plantillas de ADN y en la expresión de proteínas in vitro a partir del ADN dentro del dispositivo de microfluidos.
Nuestra plataforma de microfluidos novela tiene varias ventajas importantes sobre los métodos actualmente utilizados, que lo convierten en una her...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue apoyado por Marie Curie internacional reintegración subvención.
Materiales
| Name | Company | Catalog Number | Comments |
| Reactivo / Equipo | Empresa | Número de catálogo | |
| PDMS-SYLGARD 184 | Dow Corning EE.UU. | ESSEX-DC | |
| Clorotrimetilsilano (TMCS | Sigma-Aldrich | C72854 | |
| Sustratos de vidrio recubiertos con epoxi | CEL Asociados EE.UU. | VEPO-25C | |
| Poli etilen glicol (PEG) | Sigma-Aldrich | 81260 | |
| D-trehalosa dihidrato | Sigma-Aldrich | T9531 | |
| Biotinilado-BSA | Atravesar | PIR-29130 | |
| Neutravidina | Atravesar | 31050 | |
| penta-His-biotina | Qiagen | 34440 | |
| Hepes | Biological Industries | 03-025-1B | |
| TNT-T7 | Promega | L5540 | |
| C-myc anticuerpo Cy3 | Sigma-Aldrich | ||
| Caja de control | Stanford microfluídica Foundry | ||
| Molde | Stanford microfluídica Foundry | ||
| Pin | Nueva Inglaterra pequeños tubos Corporación | ||
| Tygon microbore tubería | Tygon | S-54-HL | |
| Microarrayer | Bio Robótica | MicroGrid 610 | |
| Pins de silicona | Paralelo Syntesis | SMT-S75 |
Referencias
- Maerkl, S. J. Integration column: Microfluidic high-throughput screening. Integrative biology quantitative biosciences from nano to macro. 1, 19-29 (2009).
- Hong, J. W., Quake, S. R. Integrated nanoliter systems. Nature. 21, 1179-1183 (2003).
- Unger, M. A Monolithic Microfabricated Valves and Pumps by Multilayer Soft Lithography. Science. 288, 113-116 (2000).
- Gerber, D., Maerkl, S. J., Quake, S. R. An in vitro microfluidic approach to generating protein-interaction networks. Nature. 6, 71-74 (2009).
- Einav, S. Discovery of a hepatitis C target and its pharmacological inhibitors by microfluidic affinity analysis. Nature. 26, 1019-1027 (2008).
- Fordyce, P. M. De novo identification and biophysical characterization of transcription-factor binding sites with microfluidic affinity analysis. Nature Biotechnology. 28, 962-967 (2010).
- Zhu, H. Global analysis of protein activities using proteome chips. Science (New York, N.Y.). 293, 2101-2105 (2001).
- Ramachandran, N. Self-assembling protein microarrays. Science (New York, N.Y.). 305, 86-90 (2004).
- Zhong, J. F. A microfluidic processor for gene expression profiling of single human embryonic stem cells. Lab on a chip. 8, 68-74 (2008).
- Kusnezow, W., Hoheisel, J. D. Solid supports for microarray immunoassays. Journal of molecular recognition JMR. 16, 165-176 (2003).
- Lundin, M., Monne, M., Widell, A., Von Heijne, G., Persson, M. A. A. Topology of the membrane-associated hepatitis C virus protein NS4B. Journal of virology. 77, 5428 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados