Method Article
Preparación de las células embrionarias de fibroblastos de ratón adecuados para el cultivo de células estaminales embrionarias humanas pluripotentes inducidas, y
En este artículo
Resumen
La calidad de fibroblastos de embriones de ratón (MEFs) está dictada por la cepa derecha de ratón tal como CF-1. Pluripotencia-MEFs de apoyo y medios de comunicación condicionado (CM) obtenido a partir de éstas debe contener concentraciones óptimas de activina A, Gremlin y Tgfβ1 necesarios para la Activina / Nodal y las vías de FGF de manera cooperativa mantener la auto-renovación y pluripotencialidad.
Resumen
En general, las células madre embrionarias humanas (hESCs) y humanos células madre pluripotentes inducidas (hiPSCs) 1 pueden ser cultivadas bajo condiciones variables. Sin embargo, no es fácil establecer un sistema eficaz para el cultivo de estas células. Dado que las condiciones de cultivo pueden influir en la expresión del gen que confiere la pluripotencia de hESCs y hiPSCs, la optimización y estandarización del método de cultivo es crucial.
El establecimiento de líneas de células madre se describió por primera vez mediante MEFs como células alimentadoras y suero bovino fetal (FBS)-que contiene medio de cultivo 2. A continuación, FBS fue reemplazado con el reemplazo de octavos de final del suero (KSR) y FGF2, lo que aumenta la proliferación de hESCs 3. Finalmente, libres de conexión sistemas de cultivo de permitir el cultivo de células en Matrigel placas recubiertas en KSR-contiene medio condicionado (medio condicionado por MEFs) 4. Posteriormente, las condiciones de cultivo de células madre embrionarias humanas han avanzado hacia la alimentación libre de la cultura en la defi químicamenteed 5-7 condiciones. Además, para evitar la contaminación potencial por patógenos y proteínas animales métodos de cultivo utilizando xeno componentes libres se han establecido 8.
Para obtener mejores condiciones de células de ratón alimentadoras han sido sustituidos con líneas celulares humanas (por ejemplo, músculo y células de la piel del feto 9, las células adultas de la piel 10, fibroblastos de prepucio 11-12, amnióticas células mesenquimales 13). Sin embargo, la eficacia de mantener hESCs indiferenciados utilizando prepucio humano derivados de fibroblastos capas alimentadoras no es tan alta como la de células alimentadoras de ratón debido al nivel inferior de la secreción de activina A 14. Obviamente, hay una diferencia evidente en la producción del factor de crecimiento por células de ratón y humanos alimentadoras.
Los análisis de los transcriptomes de ratón y células humanas de alimentación reveló diferencias significativas entre las células de apoyo y no de apoyo. Exógenos FGF2 es crucial para manteNing auto-renovación de hESCs y hiPSCs, y ha sido identificado como un factor clave en la regulación de la expresión de Tgfβ1, Una activina y Gremlin (un antagonista de BMP) en células alimentadoras. Activina A se ha demostrado que induce la expresión de Oct4, Sox2, y Nanog en hESCs 15-16.
A largo plazo la cultura, y hESCs hiPSCs se puede cultivar en mitóticamente inactivados MEFs o bajo condiciones libres de conexión en el MEF-CM (MEF medio condicionado) en Matrigel placas recubiertas para mantener su estado indiferenciado. El éxito de las dos condiciones de cultivo depende totalmente de la calidad de las células de alimentación, ya que afectan directamente el crecimiento de hESCs.
A continuación, presentamos un algoritmo optimizado para el aislamiento y cultivo de fibroblastos embrionarios de ratón (MEFs), la preparación de medio condicionado (MC) y ligado a enzimas (ELISA) para evaluar los niveles de activina A en los medios de comunicación.
Protocolo
1. El aislamiento de fibroblastos de ratón embrionarias (MEFs)
Los dos pasos siguientes se llevan a cabo bajo condiciones no asépticas.
- Sacrificar un ratón embarazada (CF1, Harlan, EE.UU.) a 13 o 14 dpc (días post-coitum) por dislocación cervical.
- Diseccionar los cuernos uterinos, una breve aclaración en un 70% (v / v) de etanol y colocarlo en un tubo Falcon con PBS sin Ca 2 + Mg 2 + (Gibco, Invitrogen).
Los pasos siguientes se llevan a cabo en una campana de cultivo de tejidos en condiciones asépticas y utilizando instrumentos estériles.
- Coloque cuernos uterinos en una placa de Petri y separar cada embrión a partir de la placenta y el saco embrionario.
- Diseccionar la cabeza y órganos rojos, lavar en PBS y colocar todos los embriones en una placa de Petri limpia. Finamente picada el tejido usando una cuchilla de afeitar estéril hasta que se hace posible pipeta.
- Añadir 1 ml de 0,05% de tripsina / EDTA (Gibco, Invitrogen), inclusiónding Kunitz 100 unidades de DNasa I (USB), por embrión.
- Transferir el tejido en un tubo Falcon de 50 ml y se incuba durante 15 min a 37 ° C. Después de cada 5 min de incubación, las células se disocian pipeteando arriba y hacia abajo a fondo.
- Inactivar la tripsina mediante la adición de aproximadamente 1 volumen de medio MEF recién preparada.
MEF medio de cultivo (componentes para hacer 500 ml de los medios de comunicación, mezclar todos los componentes y el filtro):
450 ml de DMEM, 50 ml de FBS (10% (v / v)), 5 ml de 200 mM de L-glutamina (1/100 (v / v)), 5 ml de penicilina-estreptomicina (1/100 (v / v)). - Centrifugar las células con baja velocidad (300 xg), a 5 minutos, retirar con cuidado el sobrenadante de células y resuspender el pellet en medio de MEF caliente.
- Placa aproximadamente un número de células que es equivalente a 3-4 embriones en cada T150 (TPP) matraz recubiertas con 0,2% de gelatina (gelatina de piel bovina, Tipo B, Sigma) durante 2 h. Los fibroblastos (P0, el paso 0) son las únicas células que tienen la capacidad de unir a los frascos de gelatina recubiertos con película.
- Idealmente, las células son 80-90% confluentes después de 24 horas y en esta etapa una parte importante de P0 células se congela para uso futuro.
- Expanda el restante T150 matraz (s) de células P0 hasta P3 o P4, a continuación, inactivar y utilizar como alimentadores para replate hESCs o para producir medio condicionado (CM).
2. Desactivación y Revestimiento MEFs (Alimentador Preparación células)
Todas las etapas se llevan a cabo en una campana de cultivo de tejidos en condiciones asépticas.
- Capa T150 matraces con 0,2% de gelatina y se incuba a temperatura ambiente durante al menos 2 horas.
- Diluir mitomicina C en PBS (1 mg / ml) y se filtro.
- Aspirar los medios de comunicación de MEFs y lavar con PBS sin Ca 2 + Mg 2 +.
- , 20 ml de medio que contiene 10 mg / ml de mitomicina C en MEFs.
- Incubar durante 2 horas a 37 ° C con mitomicina C que contiene medio lavar dos veces con PBS, trypsinize, se centrifuga (durante 5 minutos a 300 xg) y Resuspender las células en medio caliente.
- Contar las células y la placa a una densidad de 56.000 células / cm 2 en matraces T150 y utilizar para la producción de CM para las siguientes 6 días.
3. Medio condicionado (CM) Preparación
Todas las etapas se llevan a cabo en una campana de cultivo de tejidos en condiciones asépticas.
- El día después de placas inactivada MEFs a una densidad de 56.000 células / cm 2 reemplazar el medio con medio MEF hCME (MU, medio condicionado) (0,5 ml / cm 2) suplementado recién con 4 ng / ml de FGF2.
- Recoger CM de matraces de alimentación después de 24 h de incubación y se añade medio fresco que contiene hCME 4 ng / ml de FGF2 a los alimentadores.
- Repita este procedimiento para los próximos 6 días. Cada almacén de recogida CM días a -20 ° C.
- Después de 6 días mezcle todas las alícuotas del medio y el filtro (Corning, 0,22 micras, PAS). Hacer alícuotas de 50 ml y se almacena a -80 ° C.
- Suplemento CM con más de 4 ng / ml de FGF2 antes de añadir a hESCs cultivadas en Matrigel.
4. Medición de la activina A en los medios condicionados (ELISA) 15
- Lleve todas las muestras y los reactivos a temperatura ambiente.
- Diluir la captura de anticuerpos (Humanos \ Mouse \ Rata activina A MAB, R & D Systems) en PBS con BSA al 1%, se suman a la microplaca (100 l / pocillo) y se incuba durante la noche a temperatura ambiente.
- Después de 24 horas lavar los pocillos tres veces con PBST (PBS con 0,05% de Tween 20) (300 l / pocillo) entonces el bloque (1% de BSA / PBS, 300 l / pocillo) durante 1 hora a temperatura ambiente.
- En este tiempo de preparación Un activina (R & D Systems) curva estándar, incluyendo 7 diluciones (concentración de menos de 30 ng / ml) y la muestra en blanco. El rango lineal de trabajo de la activina A es entre 0,25 y 32 ng / ml.
- Añadir duplicados de patrones y muestras a los pocillos (100 l / pocillo) y se incuba durante 2 horas a temperatura ambiente.
- Lavar los pocillos tres veces (300 l de PBST).
- Añadir el secundario (biotina) de anticuerpos (humano / ratón / rata Biotinylated activina A MAb, R & D Systems) (0.25 ug / ml en 1% BSA / PBS) y se incuba durante 2 horas a temperatura ambiente.
- Lavar los pocillos tres veces (300 l de PBST), añadir estreptavidina-HRP (diluida en 1% BSA / PBS, R & D Systems) y se incuba durante 20 min a temperatura ambiente.
- Lavar los pocillos tres veces (300 l de PBST), añadir 100 ml de solución de sustrato (Quantikine, R & D Systems) y se incuba durante 30 min a temperatura ambiente en la oscuridad.
- Añadir 100 l de solución de parada (Quantikine, R & D Systems) a cada pozo y mezcle suavemente.
- Conjunto Lector de microplacas (Molecular Devices Spectra Max 250, Instrumentación Médica Global, Inc., Minnesota) a 450 nm, con corrección de longitud de onda a 540 o 570 nm, para determinar la densidad óptica de cada pocillo.
5. Los resultados representativos
El esquema general del procedimiento de aislamiento se presenta en la Figura 1. La morfología típica de hESCs y hiPSCs cultivadas bajo condiciones diferentes se presentan en la Figura 2. La morfología de MEFs y células inactivadas alimentadores utilizados para preparar CM se presentan en la Figura 3. En general, las células deben ser confluente 24 horas post-aislamiento y listo para ser congelada o expandido. Sin embargo, a veces puede ser que tome 2-3 días antes de la obtención de cultivos confluentes. El CM debe ser preparado a partir de las células en el paso 4 y no más tarde. Esto es crucial porque las células primarias sólo puede ser ampliado por 4-5 pasajes antes del inicio de la senescencia.
La citoquina, activina A, es considerado como el factor más crítico secretada por las células de conexión para el apoyo del crecimiento indiferenciado de las células pluripotentes 14. La medición del nivel de activina A en CM (Figura 4) es un ensayo cuantitativo muy conveniente para controlar la calidad de MEFs.

Figura 1. Una representación esquemática del procedimiento de aislamiento MEFs.

Figura 2. La morfología típica de hESCs indiferenciados cultivados en la presencia de células alimentadoras (A), (B) medio condicionado y el medio (C) definido. La morfología típica de hiPSCs cultivadas en presencia de células alimentadoras (D, E).
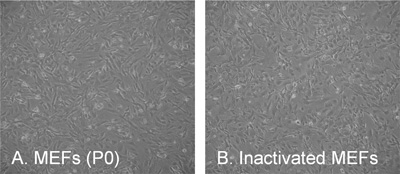
Figura 3. La morfología típica de fibroblastos de embriones de ratón (MEFs). (A) el pasaje 0 (P0) dos días después de placas / aislamiento, (B) de la capa alimentador inactivada a una densidad de 56.000 células / cm. 2

Figura 4. Ligado a enzimas (ELISA)-basados en las mediciones de la concentración de activina A en medio condicionado (CM) prepared con fibroblastos de embriones de ratón derivadas de la cepa de ratón CF1. CM se recogió durante 6 días y se reunieron a continuación. CM "1" y CM "2" se refieren a los diferentes lotes de medios de comunicación y mensajería unificada a los medios de comunicación no acondicionados. Como la función del proceso de acondicionamiento se activina A la secreción en el medio por MEFs, activina A es casi indetectable en la UM.
Discusión
El procedimiento de aislamiento MEFs presentado aquí permite el establecimiento de una condición de cultivo estandarizado para hESCs y hiPSCs. Además, el sistema basado en ELISA utilizado para evaluar la producción de citocinas por células alimentadoras es un indicador útil de la calidad de los medios condicionados MEF-derivados. El mantenimiento de rutina de la cepa de ratón (CF1) proporcionar fibroblastos de apoyo es necesario para evitar lote a lote variación de medios de cultivo. Además, se recomienda para aislar embriones de varios ratones simultáneamente para obtener una calidad uniforme de las células. Ciertamente, recién aisladas MEFs se puede mantener congelada a P0 y P1. También inactiva MEFs se puede mantener congelado en alícuotas de las cantidades apropiadas dependiendo de los requerimientos para el cultivo celular. Por lo general, alrededor de 250.000 células deben ser cultivadas en un solo pozo de una placa de 6 pocillos de hESCs cultura y las células iPS. El método establecido y optimizados pueden ser usados rutinariamente para minimizar la variabilidad entre los difealquiler de experimentos.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Un agradecimiento especial al Dr. Boris Greber para la creación de la activina un protocolo de ELISA que se publica en Greber et al. De 2007. Estamos especialmente agradecidos a la Sra. Mónica Shevack para preparar el resumen gráfico. Estamos muy agradecidos al Dr. Heiko Fuchs por toda la ayuda y sus valiosas sugerencias antes y durante el rodaje. Nos gustaría dar las gracias a todos los miembros del laboratorio de Adjaye, especialmente Elisabeth Socha para mantener un suministro constante de MEFs y CM. También agradecemos a nuestros colegas en las instalaciones de los animales de la MPIMG por su apoyo permanente. Este trabajo fue financiado en parte por la Sociedad Max Planck y el [BMBF, el número de concesión 0315717A], los socios de la ERASysBio + iniciativa apoyada en la UE ERA-NET Plus esquema en el 7PM.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| DMEM (glucosa alta) | Gibco, Invitrogen | 41966-052 | |
| FBS | Biochrom | S0115 | |
| L-glutamina | Gibco, Invitrogen | 25030-024 | |
| La penicilina-estreptomicina | Gibco, Invitrogen | 15140-122 | |
| Vacío filtro sistema | Corning | 431097 | 500 ml, 0,22 m, PAS |
| DMSO | Sigma | D2650 | |
| Knockout DMEM | Gibco, Invitrogen | 10829-018 | |
| Ser golpe de graciaum reemplazo | Gibco, Invitrogen | 10828-028 | |
| No aminoácidos esenciales | Gibco, Invitrogen | 11140-035 | |
| beta-mercaptoetanol | Sigma | M7522 | |
| PBS | Gibco, Invitrogen | 14190-169 | |
| DNasa I | Sigma | D4527 | |
| Mitomicina C | Roche | 10107409001 | |
| Factor básico de crecimiento de fibroblastos | PeproTech | 100-18B | |
| Biotinilado Activina Anti-human/mouse/rat Un anticuerpo | R & D Systems | BAM3381 | |
| Gelatina | Sigma | G9391 | |
| Humano / ratón /Rata activina un MAb | R & D Systems | MAB3381 | |
| 0,05% de tripsina-EDTA | Gibco, Invitrogen | 25300-054 | |
| Extra Fino Tijeras Iris | FST | 14088-10 | |
| Adicionales Pinza Graefe Bellas | FST | 11150-10 | |
| Pinzas de fijación Pierse | FST | 18155-13 |
Referencias
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126, 663-676 (2006).
- Thomson, J. A. Embryonic stem cell lines derived from human blastocysts. Science. 282, 1145-1147 (1998).
- Amit, M. Clonally derived human embryonic stem cell lines maintain pluripotency and proliferative potential for prolonged periods of culture. Dev. Biol. 227, 271-278 (2000).
- Xu, C. Feeder-free growth of undifferentiated human embryonic stem cells. Nat. Biotechnol. 19, 971-974 (2001).
- Ludwig, T. E. Derivation of human embryonic stem cells in defined conditions. Nat. Biotechnol. 24, 185-187 (2006).
- Yao, S. Long-term self-renewal and directed differentiation of human embryonic stem cells in chemically defined conditions. Proc. Natl. Acad. Sci. U.S.A. 103, 6907-6912 (2006).
- Lu, J., Hou, R., Booth, C. J., Yang, S. H., Snyder, M. Defined culture conditions of human embryonic stem cells. Proc. Natl. Acad. Sci. U.S.A. 103, 5688-5693 (2006).
- Skottman, H., Hovatta, O. Culture conditions for human embryonic stem cells. Reproduction. 132, 691-698 (2006).
- Richards, M., Fong, C. Y., Chan, W. K., Wong, P. C., Bongso, A. Human feeders support prolonged undifferentiated growth of human inner cell masses and embryonic stem cells. Nat. Biotechnol. 20, 933-936 (2002).
- Richards, M. Comparative evaluation of various human feeders for prolonged undifferentiated growth of human embryonic stem cells. Stem Cells. 21, 546-556 (2003).
- Amit, M. Human feeder layers for human embryonic stem cells. Biol. Reprod. 68, 2150-2156 (2003).
- Inzunza, J. Derivation of human embryonic stem cell lines in serum replacement medium using postnatal human fibroblasts as feeder cells. Stem Cells. 23, 544-549 (2005).
- Zhang, K. Utilization of Human Amniotic Mesenchymal Cells as Feeder Layers to Sustain Propagation of Human Embryonic Stem Cells in the Undifferentiated State. Cell Reprogram. , (2011).
- Eiselleova, L. Comparative study of mouse and human feeder cells for human embryonic stem cells. Int. J. Dev. Biol. 52, 353-363 (2008).
- Greber, B., Lehrach, H., Adjaye, J. Fibroblast growth factor 2 modulates transforming growth factor beta signaling in mouse embryonic fibroblasts and human ESCs (hESCs) to support hESC self-renewal. Stem Cells. 25, 455-464 (2007).
- Vallier, L., Alexander, M., Pedersen, R. A. Activin/Nodal and FGF pathways cooperate to maintain pluripotency of human embryonic stem cells. J. Cell Sci. 118, 4495-4509 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados