Method Article
Préparation des cellules de souris embryonnaires fibroblastiques conviennent pour la culture embryonnaires humaines et cellules souches pluripotentes induites
Dans cet article
Résumé
La qualité de fibroblastes embryonnaires de souris (MEF) est dicté par la souche de souris droit tel que CF-1. Pluripotence-soutien MEF et des milieux conditionnés (CM) obtenu à partir de ceux-ci devraient contenir des concentrations optimales de l'activine A, Gremlin et Tgfβ1 nécessaires pour la activine / Nodal et des voies FGF à la co-opératoire de maintenir l'auto-renouvellement et la pluripotence.
Résumé
En général, cellules souches embryonnaires humaines (CSEh) et de l'homme cellules souches pluripotentes induites (hiPSCs) 1 peuvent être cultivées dans des conditions variables. Toutefois, il n'est pas facile d'établir un système efficace de culture de ces cellules. Étant donné que les conditions de culture peuvent influencer l'expression des gènes qui confère pluripotence dans les CSEh et hiPSCs, l'optimisation et la standardisation de la méthode de culture est essentiel.
La création de lignées de CSEh a été décrite pour la première en utilisant les FAE comme cellules nourricières et sérum de veau fœtal (FBS) contenant un milieu de culture 2. Ensuite, FBS a été remplacé par le remplacement du sérum KO (KSR) et FGF2, qui augmente la prolifération des CSEh 3. Enfin, les systèmes de culture d'alimentation sans permettre la culture de cellules sur des plaques revêtues Matrigel dans l'affaire KSR-contenant un milieu conditionné (milieu conditionné par les MEF) 4. Par la suite, les conditions de culture des CSEh ont évolué vers d'alimentation sans culture dans Defin chimiquementconditions éd 5-7. En outre, pour éviter la contamination potentielle par des agents pathogènes d'origine animale et les méthodes de culture des protéines en utilisant la xéno-libres les composants ont été mis en place 8.
Pour obtenir de meilleures conditions les cellules nourricières de souris ont été remplacés par des lignées cellulaires humaines (par exemple muscle fœtal et les cellules de la peau 9, cellules cutanées adultes 10, fibroblastes de prépuce 11-12, amniotique des cellules mésenchymateuses 13). Cependant, l'efficacité du maintien de CSEh indifférenciées en utilisant prépuce humain couches nourricières de fibroblastes dérivés n'est pas aussi élevée que celle à partir de cellules nourricières de souris en raison de la faible niveau de sécrétion de l'activine A 14. Évidemment, il ya une différence évidente dans la production de facteur de croissance par la souris et des cellules nourricières de l'homme.
Les analyses des transcriptomes de la souris et des cellules nourricières de l'homme ont révélé des différences significatives entre les cellules de soutien et non de soutien. Exogène FGF2 est cruciale pour entretenir cetNing auto-renouvellement des CSEh et hiPSCs, et a été identifié comme un facteur clé dans la régulation de l'expression de Tgfβ1, activine A et Gremlin (un antagoniste BMP) dans des cellules nourricières. Activine A a été montré pour induire l'expression de OCT4, SOX2, et NANOG en CSEh 15-16.
Pour culture à long terme, les CSEh et hiPSCs peut être cultivé sur mitotiquement inactivé MEF ou sous alimentation sans conditions dans MEF-CM (MEF milieu conditionné) sur Matrigel plaques enduites de maintenir leur état indifférencié. Le succès des deux conditions de culture dépend entièrement de la qualité des cellules nourricières, car ils affectent directement la croissance des CSEh.
Ici, nous présentons une méthode optimisée pour l'isolement et la culture de fibroblastes embryonnaires de souris (MEF), la préparation de milieu conditionné (CM) et de l'enzyme-linked immunosorbent assay (ELISA) afin d'évaluer les niveaux de l'activine A dans les médias.
Protocole
1. Isolement des fibroblastes embryonnaires de souris (MEF)
Les deux étapes suivantes sont effectuées dans des conditions non aseptiques conditions.
- Sacrifiez une souris enceinte (CF1, Harlan, USA) à 13 ou 14 dpc (jours post-coïtum) par dislocation cervicale.
- Disséquer les cornes utérines, rincer rapidement à 70% (v / v) d'éthanol et de le placer dans un tube falcon contenant du PBS sans Ca 2 + Mg 2 + (Gibco, Invitrogen).
Les étapes suivantes sont effectuées dans une hotte de culture tissulaire dans des conditions aseptiques et en utilisant des instruments stérilisés.
- Placez cornes utérines dans une boîte de Petri et séparer chaque embryon à partir de son placenta et le sac embryonnaire.
- Disséquer la tête et les organes rouges, se laver dans du PBS et placer tous les embryons dans un boîte de Petri propre. Émincer finement le tissu en utilisant une lame de rasoir stérile jusqu'à ce qu'il devienne possible de pipeter.
- Ajouter 1 ml de 0,05% de trypsine / EDTA (Gibco, Invitrogen), yDing 100 unités Kunitz de DNase I (USB), par l'embryon.
- Transfert le tissu dans un tube Falcon de 50 ml et incuber pendant 15 min à 37 ° C. Après chaque 5 min d'incubation, les cellules se dissocient par aspiration et refoulement à fond.
- Inactiver la trypsine en ajoutant environ 1 volume de milieu MEF fraîchement préparée.
Milieu de culture MEF (composants pour obtenir 500 ml de milieu, mélanger tous les composants et filtres):
450 ml de DMEM, 50 ml de FBS (10% (v / v)), 5 ml de 200 mM de L-glutamine (1/100 (v / v)), 5 ml de pénicilline-streptomycine (1/100 (v / v)). - Centrifuger les cellules à faible vitesse (300 xg), 5 min, retirer délicatement la cellule surnageant et remettre en suspension dans un milieu à granulés MEF chaud.
- Plaque d'environ un certain nombre de cellules qui est équivalent à 3-4 embryons dans chaque T150 (PPT) flacon recouvertes avec de la gélatine de 0,2% (gélatine de la peau de bovin, de type B, Sigma) pendant 2 heures. Les fibroblastes (P0, le passage 0) sont les seules cellules qui ont la capacité de se fixer des flacons de gélatine enrobés.
- Idéalement, les cellules sont de 80-90% de confluence après 24 h et à ce stade une partie importante de cellules P0 est gelé pour un usage futur.
- Développer le reste T150 flacon (s) de cellules P0 jusqu'à P3 ou P4, alors inactiver et utiliser que les mangeoires à replate CSEh ou de produire un milieu conditionné (CM).
2. L'inactivation et placage MEF (chargeur cellules Préparation)
Toutes les étapes sont réalisées dans un capuchon de culture tissulaire dans des conditions aseptiques.
- Manteau T150 flacons avec de la gélatine de 0,2% et incuber à température ambiante pendant au moins 2 h.
- Diluer la mitomycine C dans du PBS (1 mg / ml) et le filtre.
- Aspirer les médias de les FAE et laver avec du PBS sans Ca 2 + Mg 2 +.
- Placer 20 ml de milieu contenant 10 ug / ml de mitomycine C sur la MEF.
- Incuber pendant 2 heures à 37 ° C avec de la mitomycine C contenant un milieu, puis laver deux fois avec du PBS, trypsiniser, centrifugeuse (5 min à 300 xg) et remettre les cellules en milieu chaud.
- Et compter les cellules de plaque à une densité de 56.000 cellules / cm 2 dans des flacons et T150 utiliser pour la production CM pour les 6 jours suivants.
3. Milieu conditionné (CM) Préparation
Toutes les étapes sont réalisées dans un capuchon de culture tissulaire dans des conditions aseptiques.
- Le jour après étalement inactivé MEF à une densité de 56.000 cellules par cm 2 remplacer le milieu MEF avec le milieu de CSEh (UM, milieu non conditionné) (0,5 ml / cm 2) complétée fraîchement avec 4 ng / ml de FGF2.
- Recueillir CM de flacons d'alimentation après 24 h d'incubation et ajouter du milieu frais contenant CSEh 4 ng / ml de FGF2 aux mangeoires.
- Répétez cette procédure pour les 6 prochains jours. Chaque magasin jours recueillies CM à -20 ° C.
- Après 6 jours mélanger tous les aliquotes de milieu et d'un filtre (Corning, 0,22 um, PAS). Faire des aliquots de 50 ml et conserver à -80 ° C.
- Supplément CM avec supplémentaire de 4 ng / ml de FGF2 avant d'ajouter à CSEh cultivées sur Matrigel.
4. Mesure de l'activine A dans les médias conditionnés (ELISA) 15
- Apportez tous les échantillons et les réactifs à température ambiante.
- Diluer anticorps de capture (de l'homme \ Mouse \ Rat activine un anticorps monoclonal, la R & D Systems) dans du PBS avec 1% de BSA, ajouter à microplaque (100 pl / puits) et incuber une nuit à température ambiante.
- Après 24 h laver les puits trois fois avec du PBST (PBS avec 0,05% de Tween 20) (300 pl / puits) puis bloc (1% de BSA / PBS, 300 pl / puits) pendant 1 heure à température ambiante.
- En ce temps préparez un A activine (R & D Systems) courbe standard, y compris 7 dilutions (concentration inférieure à 30 ng / ml) et l'échantillon vierge. La gamme de travail linéaire de l'activine A est compris entre 0,25 et 32 ng / ml.
- Ajouter les doublons des normes et des échantillons dans les puits (100 pl / puits) et incuber pendant 2 h à température ambiante.
- Laver les puits trois fois (300 pi de PBST).
- Ajouter le secondaire (biotinylé) antibody (Human / souris / rat biotinylé activine A AcM, R & D Systems) (0.25 pg / ml dans 1% de BSA / PBS) et incuber pendant 2 h à température ambiante.
- Laver les puits trois fois (300 pi de PBST), ajoutez streptavidine-HRP (dilué dans 1% de BSA / PBS, R & D Systems) et incuber pendant 20 min à température ambiante.
- Laver les puits trois fois (300 pi de PBST), ajouter 100 ul de solution de substrat (Quantikine, R & D Systems) et incuber pendant 30 min à température ambiante dans l'obscurité.
- Ajouter 100 ul de solution d'arrêt (Quantikine, R & D Systems) à chaque puits et mélanger doucement.
- Ensemble Lecteur de microplaques (Molecular Devices Spectra Max 250, Global Medical Instrumentation, Inc, Minnesota) à 450 nm, avec une correction de longueur d'onde à 540 ou 570 nm, pour déterminer la densité optique de chaque puits.
5. Les résultats représentatifs
Le schéma global de la procédure d'isolement est présenté dans la Figure 1. La morphologie typique de CSEh et hiPSCs cultivées dans des conditions différentes est présentée à la Figure 2. La morphologie de la MEF et des cellules nourricières inactivés utilisés pour préparer CM est présenté dans la Figure 3. En général, les cellules doivent être confluentes 24 heures après l'isolement et prêt à être congelé ou élargi. Cependant, il peut parfois prendre 2-3 jours avant l'obtention de cultures confluentes. Le CM doit être préparé à partir de cellules à passage 4 et au plus tard. Ceci est crucial parce que les cellules primaires ne peuvent être étendus pour 4-5 passages avant le début de la sénescence.
La cytokine, activine A, est considéré comme le facteur le plus critique sécrétée par les cellules nourricières pour le soutien de la croissance indifférenciée de cellules pluripotentes 14. La mesure du niveau de l'activine A CM (figure 4) est un test très pratique quantitative pour contrôler la qualité de la FAE.

Figure 1. Une représentation schématique de la procédure d'isolement MEF.

Figure 2. La morphologie typique de CSEh indifférenciées cultivées en présence de cellules nourricières (A), (B) un milieu conditionné et moyennes (C) défini. La morphologie typique de hiPSCs cultivées en présence de cellules nourricières (D, E).
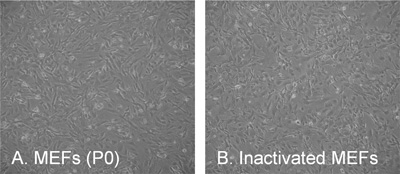
Figure 3. La morphologie typique de fibroblastes embryonnaires de souris (MEF). (A) Passage 0 (P0), deux jours après placage / isolement, (B) couche nourricière inactivé à une densité de 56.000 cellules / cm. 2

Figure 4. Enzyme-linked immunosorbent assay (ELISA) basés sur des mesures de la concentration de l'activine A dans un milieu conditionné (CM) prepared avec des fibroblastes embryonnaires de souris dérivées de la souche de souris CF1. CM ont été recueillies pendant 6 jours, puis regroupés. CM "1" et CM "2" se réfèrent à des lots différents de médias et de messagerie unifiée aux médias conditionnés. Comme la fonction du processus de conditionnement est l'activine A la sécrétion dans le milieu par MEF, activine A est presque indétectable en UM.
Discussion
La procédure d'isolement MEF présentée ici permet la mise en place d'une condition de culture normalisée pour les CSEh et hiPSCs. En outre, le système ELISA basé utilisé pour évaluer la production de cytokines par les cellules nourricières est un indicateur utile de la qualité des médias MEF dérivés climatisées. L'entretien de routine de la souche de souris (CF1) fournissant des fibroblastes de soutien est nécessaire pour éviter de lot à lot variation de milieux de culture. En outre, il est recommandé d'isoler les embryons de souris plusieurs simultanément pour obtenir une qualité constante des cellules. Certes, fraîchement isolés MEF peut être conservé congelé à P0 et P1. En outre inactivé MEF peut être conservé congelé en aliquots de quantités appropriées en fonction des exigences pour la culture cellulaire. Habituellement environ 250.000 cellules devraient être étalées dans un seul puits d'une plaque à 6 puits à la culture et les CSEh cellules iPS. La méthode établie et peut être optimisé régulièrement utilisé pour minimiser la variabilité entre les diffélouer expériences.
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Un merci spécial à M. Boris Greber pour la mise en place de la activine Un protocole ELISA tel que publié dans Greber et al. 2007. Nous sommes particulièrement reconnaissants à Mme Monica Shevack pour la préparation de l'aperçu graphique. Nous sommes très reconnaissants au Dr Fuchs Heiko pour toute l'aide et des suggestions utiles avant et pendant le tournage. Nous tenons à remercier tous les membres du laboratoire Adjaye, en particulier Elisabeth Socha pour maintenir un approvisionnement constant de les FAE et CM. Nous reconnaissons également nos collègues de l'animalerie de l'MPIMG pour leur soutien permanent. Ce travail a été financé en partie par la Société Max Planck et l'[BMBF; numéro de subvention 0315717A], les partenaires de l'initiative soutenue ERASysBio + sous l'UE ERA-NET Plus dans le 7e PC.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| DMEM (glycémie élevée) | Gibco, Invitrogen | 41966-052 | |
| FBS | Biochrom | S0115 | |
| L-glutamine | Gibco, Invitrogen | 25030-024 | |
| La pénicilline-streptomycine | Gibco, Invitrogen | 15140-122 | |
| Aspirateur filtre de système de | Corning | 431097 | 500 ml, 0,22 um, PAS |
| DMSO | Sigma | D2650 | |
| Knockout DMEM | Gibco, Invitrogen | 10829-018 | |
| Ser Knockouteuh remplacement | Gibco, Invitrogen | 10828-028 | |
| Non-acides aminés essentiels | Gibco, Invitrogen | 11140-035 | |
| bêta-mercaptoéthanol | Sigma | M7522 | |
| PBS | Gibco, Invitrogen | 14190-169 | |
| DNase I | Sigma | D4527 | |
| Mitomycine C | Roche | 10107409001 | |
| Basic Fibroblast Growth Factor | PeproTech | 100-18B | |
| Biotinylé Anti-human/mouse/rat activine A Anticorps | R & D Systems | BAM3381 | |
| Gélatine | Sigma | G9391 | |
| Homme / souris /Rat activine A AcM | R & D Systems | MAB3381 | |
| 0,05% de trypsine-EDTA | Gibco, Invitrogen | 25300-054 | |
| Supplémentaires minces Ciseaux Iris | FST | 14088-10 | |
| Supplémentaires Forceps Graefe Beaux- | FST | 11150-10 | |
| Pince de fixation Pierse | FST | 18155-13 |
Références
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126, 663-676 (2006).
- Thomson, J. A. Embryonic stem cell lines derived from human blastocysts. Science. 282, 1145-1147 (1998).
- Amit, M. Clonally derived human embryonic stem cell lines maintain pluripotency and proliferative potential for prolonged periods of culture. Dev. Biol. 227, 271-278 (2000).
- Xu, C. Feeder-free growth of undifferentiated human embryonic stem cells. Nat. Biotechnol. 19, 971-974 (2001).
- Ludwig, T. E. Derivation of human embryonic stem cells in defined conditions. Nat. Biotechnol. 24, 185-187 (2006).
- Yao, S. Long-term self-renewal and directed differentiation of human embryonic stem cells in chemically defined conditions. Proc. Natl. Acad. Sci. U.S.A. 103, 6907-6912 (2006).
- Lu, J., Hou, R., Booth, C. J., Yang, S. H., Snyder, M. Defined culture conditions of human embryonic stem cells. Proc. Natl. Acad. Sci. U.S.A. 103, 5688-5693 (2006).
- Skottman, H., Hovatta, O. Culture conditions for human embryonic stem cells. Reproduction. 132, 691-698 (2006).
- Richards, M., Fong, C. Y., Chan, W. K., Wong, P. C., Bongso, A. Human feeders support prolonged undifferentiated growth of human inner cell masses and embryonic stem cells. Nat. Biotechnol. 20, 933-936 (2002).
- Richards, M. Comparative evaluation of various human feeders for prolonged undifferentiated growth of human embryonic stem cells. Stem Cells. 21, 546-556 (2003).
- Amit, M. Human feeder layers for human embryonic stem cells. Biol. Reprod. 68, 2150-2156 (2003).
- Inzunza, J. Derivation of human embryonic stem cell lines in serum replacement medium using postnatal human fibroblasts as feeder cells. Stem Cells. 23, 544-549 (2005).
- Zhang, K. Utilization of Human Amniotic Mesenchymal Cells as Feeder Layers to Sustain Propagation of Human Embryonic Stem Cells in the Undifferentiated State. Cell Reprogram. , (2011).
- Eiselleova, L. Comparative study of mouse and human feeder cells for human embryonic stem cells. Int. J. Dev. Biol. 52, 353-363 (2008).
- Greber, B., Lehrach, H., Adjaye, J. Fibroblast growth factor 2 modulates transforming growth factor beta signaling in mouse embryonic fibroblasts and human ESCs (hESCs) to support hESC self-renewal. Stem Cells. 25, 455-464 (2007).
- Vallier, L., Alexander, M., Pedersen, R. A. Activin/Nodal and FGF pathways cooperate to maintain pluripotency of human embryonic stem cells. J. Cell Sci. 118, 4495-4509 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon