Method Article
Vorbereitung von embryonalen Maus-Fibroblasten-Zellen zum Kultivieren von humanen embryonalen und induzierten pluripotenten Stammzellen
In diesem Artikel
Zusammenfassung
Die Qualität von embryonalen Maus-Fibroblasten (MEFs) durch die rechte Mausstamm wie CF-1 bestimmt. Pluripotenz-unterstützende MEFs und konditionierte Medien (CM) aus diesen gewonnenen Erkenntnisse sollten den optimalen Konzentrationen von Activin A, Gremlin und TGFß1 für die Activin / Nodal und FGF Signalwege erforderlich, um kooperativ zu halten Selbsterneuerung und Pluripotenz enthalten.
Zusammenfassung
Im allgemeinen menschlichen embryonalen Stammzellen (HES) und humanen induzierten pluripotenten Stammzellen (hiPSCs) 1 kann unter variablen Bedingungen kultiviert werden. Jedoch ist es nicht einfach, ein wirksames System zur Kultivierung dieser Zellen zu etablieren. Da die Kulturbedingungen der Genexpression, die Pluripotenz in hES und hiPSCs verleiht beeinflussen können, ist die Optimierung und Standardisierung der Kultur-Methode von entscheidender Bedeutung.
Die Einrichtung von HES-Linien wurde zuerst unter Verwendung MEFs als Feeder-Zellen und fötalem Rinderserum (FBS) enthaltenden Kulturmedium 2 beschrieben. Als nächstes wurde FBS mit Knockout-Serum-Ersatz (KSR) und FGF2, die Proliferation von hESCs 3 erweitert ersetzt. Schließlich ermöglichen Feeder-freien Kultur-Systemen Kultivierung von Zellen auf Matrigel-beschichteten Platten in KSR-haltige konditionierte Medium (Medium durch MEFs konditioniert) 4. Anschließend haben hESCs Kultur in Richtung Feeder-freien Kultur in chemisch defin bewegted Bedingungen 7.5. Darüber hinaus wurden die möglichen Kontaminierung durch Krankheitserreger und tierische Proteine Kultur Methoden unter Verwendung von xeno-freien Komponenten zu vermeiden, wurden 8 hergestellt.
Um bessere Bedingungen erhalten Maus Feeder-Zellen wurden mit humanen Zelllinien (zB fetale Muskel-und Hautzellen 9, erwachsenen Hautzellen 10, Vorhautfibroblasten 11-12, Fruchtwasser Mesenchymzellen 13) ersetzt worden. Jedoch ist die Effizienz der Wartung undifferenzierten HES mit humaner Vorhaut-Fibroblasten-Feeder-Schichten abgeleiteten nicht so hoch wie die von Maus-Feeder-Zellen aufgrund der niedrigeren Ebene der Sekretion von Activin A 14. Offensichtlich gibt es einen offensichtlichen Unterschied in Wachstumsfaktor durch Maus und menschlichen Feeder-Zellen.
Die Analyse der Transkriptome Maus und Mensch-Feeder-Zellen ergab signifikante Unterschiede zwischen unterstützende und-Stützzellen. Exogene FGF2 ist entscheidend für den UnterhaltNing Selbsterneuerung von hES und hiPSCs, und hat sich als entscheidender Faktor für die Regulation der Expression von TGFß1, Activin A und Gremlin (eine BMP-Antagonist) in Feeder-Zellen identifiziert worden. Activin A wurde gezeigt, dass die Expression von Oct4, Sox2 und NANOG im HES 15-16 induzieren.
Für Langzeit-Kultur, kann HES und hiPSCs auf mitotisch inaktiviert MEFs oder unter Feeder-freien Bedingungen in MEF-CM (MEF-konditioniertem Medium) auf Matrigel-beschichteten Platten gezüchtet werden, um undifferenzierten Zustand aufrecht zu erhalten. Erfolg beider Kulturbedingungen vollständig abhängig von der Qualität der Feeder-Zellen, da sie Auswirkungen auf das Wachstum von HES.
Hier präsentieren wir ein optimiertes Verfahren zur Isolierung und Kultivierung von embryonalen Maus-Fibroblasten (MEFs), Vorbereitung von konditioniertem Medium (CM) und Enzyme Linked Immuno Assay (ELISA) auf das Niveau von Activin A in den Medien zu beurteilen.
Protokoll
1. Isolierung von embryonalen Maus-Fibroblasten (MEFs)
Die folgenden beiden Schritte werden unter nicht-aseptischen Bedingungen durchgeführt.
- Opfere eine schwangere Maus (CF1, Harlan, USA) bei 13 oder 14 DPC (Tag post-coitum) durch Genickbruch.
- Präparieren Sie die Uterushörner, kurz in 70% (v / v) Ethanol und Stelle gründlich in ein Falcon-Röhrchen mit PBS ohne Ca 2 + Mg 2 + (Gibco, Invitrogen).
Die folgenden Schritte werden in einem Gewebekulturabzug unter aseptischen Bedingungen durchgeführt und unter Verwendung von sterilen Instrumenten.
- Platzieren Sie Uterushörner in eine Petrischale und trennen Sie die einzelnen Embryo von seiner Plazenta und embryonalen sac.
- Sezieren Kopf und roten Organen, in PBS waschen und legen Sie alle Embryonen in einem sauberen Petrischale. Fein Blatt das Gewebe unter Verwendung einer sterilen Rasierklinge bis es möglich wird zu pipettieren.
- 1 ml 0,05% Trypsin / EDTA (Gibco, Invitrogen), IncluDing 100 Kunitz-Einheiten DNase I (USB), pro Embryo.
- Übertragen Sie das Gewebe in einem 50 ml-Falcon-Röhrchen und inkubieren Sie für 15 min bei 37 ° C Nach jeweils 5 min Inkubation, distanzieren Zellen durch Auf-und Abpipettieren gründlich.
- Inaktivierung des Trypsin durch Zugabe von ca. 1 Volumen an frisch zubereiteten MEF Medium.
MEF Kulturmedium (Komponenten zu 500 ml Medium zu machen, mischen Sie alle Komponenten und Filter):
450 ml DMEM, 50 ml FBS (10% (v / v)), 5 ml von 200 mM L-Glutamin (1/100 (v / v)), 5 ml Penicillin-Streptomycin (1/100 (v / v)). - Zentrifugieren Sie die Zellen mit Low-Speed (300 xg), 5 min, entfernen Sie vorsichtig den Überstand und resuspendieren Zellpellet in warmen MEF Medium.
- Tafel etwa eine Anzahl von Zellen, die äquivalent zu 3-4 Embryonen in jeder T150 (TPP)-Kolben mit 0,2% Gelatine (Gelatine aus Rinderhaut, Typ B, Sigma) für 2 Stunden beschichtet ist. Die Fibroblasten (P0, Kanal 0) sind die einzigen Zellen, die die Fähigkeit der Gelatine-beschichteten Kolben legen haben.
- Im Idealfall sind die Zellen 80-90% konfluent nach 24 Stunden und in dieser Phase ein großer Teil der P0-Zellen ist für die zukünftige Verwendung eingefroren.
- Erweitern Sie die restlichen T150 Flasche (n) der Zellen P0 bis P3 oder P4, dann inaktiviert und die Verwendung als Zubringer zu hESCs replate oder konditioniertem Medium (CM) zu produzieren.
2. Inaktivierung und Plating MEFs (Feeder-Zellen Vorbereitung)
Alle Schritte werden in einer Gewebekultur Haube unter aseptischen Bedingungen durchgeführt.
- Coat T150 Flaschen mit 0,2% Gelatine und inkubieren bei RT für mindestens 2 Stunden.
- Verdünnte Mitomycin C in PBS (1 mg / ml) und filtriert.
- Saugen Sie Medien aus MEFs und waschen mit PBS ohne Ca 2 + Mg 2 +.
- 20 ml Medium, enthaltend 10 ug / ml Mitomycin C auf MEFs.
- Inkubieren für 2 Stunden bei 37 ° C mit Mitomycin C-haltigem Medium dann zweimal mit PBS gewaschen, trypsinieren, Zentrifuge (für 5 min bei 300 × g) und resuspendieren Zellen in warmes Medium.
- Zählen von Zellen und Platten in einer Dichte von 56,000 Zellen / cm 2 im T150 Flaschen und verwenden Sie für CM-Produktion für die folgenden 6 Tage.
3. Konditioniertem Medium (CM) Herstellung
Alle Schritte werden in einer Gewebekultur Haube unter aseptischen Bedingungen durchgeführt.
- Der Tag nach dem Ausplattieren inaktivierten MEFs bei einer Dichte von 56,000 Zellen / cm 2 ersetzen die MEF-Medium mit hESC Medium (UM, unbedingte Medium) (0,5 ml / cm 2) ergänzt frisch mit 4 ng / ml FGF2.
- Sammle CM von Feeder-Flaschen nach 24 h Inkubation und fügen frische hES-Medium mit 4 ng / ml FGF2 zu den Verteilern.
- Wiederholen Sie diesen Vorgang für die nächsten 6 Tage. Jeden Tag Shop gesammelt CM bei -20 ° C
- Nach 6 Tagen Mischen Sie alle Aliquots von mittel-und Filter (Corning, 0,22 um, PAS). Machen Sie 50 ml Aliquots und lagern bei -80 ° C
- Beilage CM mit zusätzlichen 4 ng / ml vor der Zugabe zu FGF2 HES auf Matrigel gezüchtet.
4. Die Messung von Activin A in konditionierten Medien (ELISA) 15
- Bringen Sie alle Proben und Reagenzien auf Raumtemperatur.
- Verdünnen Sie erfassen Antikörper (Human \ Mouse \ Ratte Activin einem mAb, R & D Systems) in PBS mit 1% BSA, zu ergänzen Mikrotiterplatten (100 ul / Well) und Inkubation über Nacht bei RT.
- Nach 24 Stunden verwerfen, die Vertiefungen dreimal mit PBST (PBS mit 0,05% Tween 20) (300 ul / Vertiefung) dann wird der Block (1% BSA / PBS, 300 ul / Well) für 1 h bei RT.
- In dieser Zeit bereiten eine Activin A (R & D Systems) Standardkurve, darunter 7 Verdünnungen (Konzentration von weniger als 30 ng / ml) und Blindprobe. Die linearen Arbeitsbereich der Activin A zwischen 0,25 und 32 ng / ml.
- Fügen Sie Duplikate von Standards und Proben in die Vertiefungen (100 ul / Well) und Inkubation für 2 h bei RT.
- Die Vertiefungen dreimal (300 ul PBST).
- Fügen Sie die sekundäre (biotinylierten) Antikörper (Human / Mouse / Rat Biotinylierte Activin A MAb, R & D Systems) (0.25 ug / ml in 1% BSA / PBS) und Inkubation für 2 h bei RT.
- Die Vertiefungen dreimal (300 ul PBST), fügen Streptavidin-HRP (verdünnt in 1% BSA / PBS, R & D Systems) und Inkubation für 20 min bei RT.
- Die Vertiefungen dreimal (300 ul PBST), fügen Sie 100 ul Substratlösung (Quantikine, R & D Systems) und Inkubation für 30 min bei RT im Dunkeln.
- Geben Sie 100 ul Stop-Lösung (Quantikine, R & D Systems) in jede Vertiefung geben und vorsichtig mischen.
- Set Mikroplatten-Reader (Molecular Devices Spectra Max 250, Global Medical Instrumentation, Inc., Minnesota) bis 450 nm, mit Korrektur für Wellenlängen von 540 oder 570 nm, um die optische Dichte jeder Vertiefung zu bestimmen.
5. Repräsentative Ergebnisse
Die allgemeine Systematik der Isolation ist in Abbildung 1 dargestellt. Die typische Morphologie von HES und hiPSCs unter verschiedenen Bedingungen kultiviert wird in Abbildung 2 dargestellt. Die Morphologie MEFs und inaktivierten Feeder-Zellen verwendet werden, um CM vorbereiten wird in Abbildung 3 dargestellt. Im Allgemeinen sollten Zellen sein konfluenten 24 Stunden nach der Isolierung und bereit, gefroren oder erweitert werden. Aber manchmal kann es dauern 2-3 Tage vor Erhalt konfluenten Kulturen. Der CM sollte von Zellen bei Passage 4 und nicht später vorbereitet werden. Dies ist entscheidend, da Primärzellen kann nur für 4-5 Passagen vor dem Einsetzen der Seneszenz erweitert werden.
Das Zytokin, Activin A wird als der wichtigste Faktor, der durch Feeder-Zellen für die Unterstützung von undifferenzierten Wachstum von pluripotenten Zellen 14 sezerniert betrachtet. Die Messung des Pegels von Activin A CM (4) ist ein sehr praktisch quantitative Bestimmung der Qualität der MEFs überwachen.

1. Eine schematische Darstellung des MEFs Isolierungsverfahren.

2. Die typische Morphologie von undifferenzierten Zellkulturen in Gegenwart von (A) Feeder-Zellen, (B) konditioniertem Medium und (C) definierten Medium kultiviert. Die typische Morphologie hiPSCs in Gegenwart von (D, E) Feeder-Zellen kultiviert.
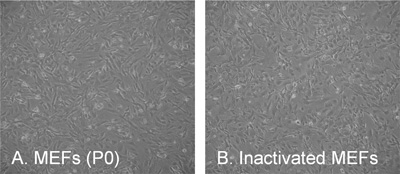
Abbildung 3. Die typische Morphologie der embryonalen Maus-Fibroblasten (MEFs). (A) Passage 0 (P0) 2 Tage nach dem Ausplattieren / Isolation, (B) inaktivierten Feeder-Schicht bei einer Dichte von 56,000 Zellen / cm. 2

4. Enzyme-linked Immunosorbent Assay (ELISA)-basierten Messungen der Konzentration von Activin A in konditioniertem Medium (CM) prepared mit embryonale Maus-Fibroblasten aus dem CF1 Maus-Stamm abgeleitet. CM wurde 6 Tage lang gesammelt und dann vereinigt. CM "1" und CM "2" beziehen sich auf verschiedene Chargen von Medien und UM zu unbedingte Medien. Da die Funktion des Aufbereitungsprozesses ist Activin A Sekretion in das Medium durch MEFs Activin A ist fast nicht nachweisbar in UM.
Diskussion
Die Isolierung MEFs hier vorgestellte Verfahren ermöglicht die Etablierung eines einheitlichen Kultur Voraussetzung für hESCs und hiPSCs. Darüber hinaus ist die ELISA-System verwendet werden, um Cytokin-Produktion durch Feeder-Zellen zu bewerten, ist ein nützlicher Indikator für die Qualität der MEF-abgeleiteten konditionierten Medien. Die laufende Instandhaltung des Mausstamm (CF1) bietet Unterstützung Fibroblasten ist notwendig, um von Charge zu Charge Variation von Kulturmedien zu vermeiden. Darüber hinaus empfiehlt es sich, mehrere Embryonen aus Mäusen isolieren gleichzeitig eine gleichbleibende Qualität der Zellen zu erhalten. Sicherlich frisch isolierten MEFs kann gefroren bei P0 und P1 werden. Auch inaktiviert MEFs kann in Aliquots eingefroren entsprechender Mengen je nach den Anforderungen für die Zellkultur werden. In der Regel ca. 250.000 Zellen in einer einzigen Vertiefung einer 6-Well-Platte zur Kultur hESCs und iPS-Zellen plattiert werden. Die etabliert und optimiert Verfahren kann routinemäßig verwendet werden, um die Variabilität zu minimieren zwischen unterschiedmieten Experimente.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Besonderer Dank geht an Dr. Boris Greber für die Einrichtung des Activin A ELISA-Protokoll wie in Greber et al. 2007 veröffentlicht. Wir sind besonders dankbar, dass Frau Monica Shevack für die Vorbereitung der grafischen Übersicht. Wir sind sehr dankbar, dass Dr. Heiko Fuchs für alle Hilfe und wertvolle Anregungen vor und während der Dreharbeiten. Wir möchten alle Mitglieder der Adjaye Labor, vor allem Elisabeth Socha zur Aufrechterhaltung einer konstanten Zufuhr von MEFs und CM danken. Wir erkennen auch unsere Kollegen in der Tierhaltung des MPIMG für ihre ständige Unterstützung. Diese Arbeit wurde teilweise von der Max-Planck-Gesellschaft und der Finanzierung [BMBF, Förderkennzeichen 0315717A], Partner der ERASysBio + Initiative im Rahmen des EU-ERA-NET-Plus im Rahmen des RP7 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| DMEM (High Glucose) | Gibco, Invitrogen | 41966-052 | |
| FBS | Biochrom | S0115 | |
| L-Glutamin | Gibco, Invitrogen | 25030-024 | |
| Penicillin-Streptomycin | Gibco, Invitrogen | 15140-122 | |
| Vakuum-Filter-System | Corning | 431097 | 500 ml, 0,22 um, PAS |
| DMSO | Sigma | D2650 | |
| Knockout DMEM | Gibco, Invitrogen | 10829-018 | |
| Knockout SerUM-Ersatz | Gibco, Invitrogen | 10828-028 | |
| Nicht-essentielle Aminosäuren | Gibco, Invitrogen | 11140-035 | |
| Beta-Mercaptoethanol | Sigma | M7522 | |
| PBS | Gibco, Invitrogen | 14190-169 | |
| DNase I | Sigma | D4527 | |
| Mitomycin C | Roche | 10107409001 | |
| Basischer Fibroblasten-Wachstumsfaktor | PeproTech | 100-18B | |
| Biotinyliertes Anti-human/mouse/rat Activin A Antikörper | R & D Systems | BAM3381 | |
| Gelatine | Sigma | G9391 | |
| Mensch / Maus /Ratte Activin A MAb | R & D Systems | MAB3381 | |
| 0,05% Trypsin-EDTA | Gibco, Invitrogen | 25300-054 | |
| Extra dünn Iris Schere | FST | 14088-10 | |
| Extra Fine Graefe Pinzette | FST | 11150-10 | |
| Pierse Fixierpinzette | FST | 18155-13 |
Referenzen
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126, 663-676 (2006).
- Thomson, J. A. Embryonic stem cell lines derived from human blastocysts. Science. 282, 1145-1147 (1998).
- Amit, M. Clonally derived human embryonic stem cell lines maintain pluripotency and proliferative potential for prolonged periods of culture. Dev. Biol. 227, 271-278 (2000).
- Xu, C. Feeder-free growth of undifferentiated human embryonic stem cells. Nat. Biotechnol. 19, 971-974 (2001).
- Ludwig, T. E. Derivation of human embryonic stem cells in defined conditions. Nat. Biotechnol. 24, 185-187 (2006).
- Yao, S. Long-term self-renewal and directed differentiation of human embryonic stem cells in chemically defined conditions. Proc. Natl. Acad. Sci. U.S.A. 103, 6907-6912 (2006).
- Lu, J., Hou, R., Booth, C. J., Yang, S. H., Snyder, M. Defined culture conditions of human embryonic stem cells. Proc. Natl. Acad. Sci. U.S.A. 103, 5688-5693 (2006).
- Skottman, H., Hovatta, O. Culture conditions for human embryonic stem cells. Reproduction. 132, 691-698 (2006).
- Richards, M., Fong, C. Y., Chan, W. K., Wong, P. C., Bongso, A. Human feeders support prolonged undifferentiated growth of human inner cell masses and embryonic stem cells. Nat. Biotechnol. 20, 933-936 (2002).
- Richards, M. Comparative evaluation of various human feeders for prolonged undifferentiated growth of human embryonic stem cells. Stem Cells. 21, 546-556 (2003).
- Amit, M. Human feeder layers for human embryonic stem cells. Biol. Reprod. 68, 2150-2156 (2003).
- Inzunza, J. Derivation of human embryonic stem cell lines in serum replacement medium using postnatal human fibroblasts as feeder cells. Stem Cells. 23, 544-549 (2005).
- Zhang, K. Utilization of Human Amniotic Mesenchymal Cells as Feeder Layers to Sustain Propagation of Human Embryonic Stem Cells in the Undifferentiated State. Cell Reprogram. , (2011).
- Eiselleova, L. Comparative study of mouse and human feeder cells for human embryonic stem cells. Int. J. Dev. Biol. 52, 353-363 (2008).
- Greber, B., Lehrach, H., Adjaye, J. Fibroblast growth factor 2 modulates transforming growth factor beta signaling in mouse embryonic fibroblasts and human ESCs (hESCs) to support hESC self-renewal. Stem Cells. 25, 455-464 (2007).
- Vallier, L., Alexander, M., Pedersen, R. A. Activin/Nodal and FGF pathways cooperate to maintain pluripotency of human embryonic stem cells. J. Cell Sci. 118, 4495-4509 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten