Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Colocación de sondas biológicas de biosensores ópticos de silicio mediante agentes de acoplamiento de silano
En este artículo
Resumen
Biosensores interactuar con entornos complejos, biológicos y realizar una detección selectiva mediante la combinación de sensores altamente sensibles con sondas muy específicas que figuran en el sensor a través de modificación de la superficie. Aquí, se demuestra la funcionalización de la superficie de los sensores ópticos de sílice con biotina utilizando agentes de acoplamiento de silano para reducir el sensor y el entorno biológico.
Resumen
Con el fin de interactuar con los entornos biológicos, plataformas de biosensores, como el popular sistema de Biacore (basado en la resonancia plasmón superficial (SPR), la técnica), hacer uso de diversas técnicas de modificación de la superficie, que pueden, por ejemplo, evitar todo exceso de superficie, ajustar el hidrofobicidad / hidrofilicidad de la superficie, adaptarse a una variedad de entornos electrónicos, y más frecuentemente, inducir especificidad hacia un objetivo de interés. 1-5 Estas técnicas extender la funcionalidad de los biosensores de otro modo altamente sensibles a aplicaciones reales en entornos complejos, tales como la sangre, la orina y análisis de aguas residuales. 2,6-7 Aun cuando las plataformas comerciales de biosensores, como Biacore, han entendido bien, las técnicas estándar para la realización de estas modificaciones de la superficie, estas técnicas no se han traducido de una manera estandarizada de otra etiqueta libres de las plataformas de biosensores, como Whispering Gallery Mode (WGM) resonadores. 8-9 menores / P>
WGM resonadores ópticos representan una tecnología prometedora para la realización de la etiqueta sin detección de una amplia variedad de especies en muy bajas concentraciones 6,10-12 La alta sensibilidad de estas plataformas es el resultado de sus únicas óptica geométrica. WGM óptica confinan resonadores de circulación . luz en frecuencias específicas, resonancia integrales 13 Al igual que el plataformas SPR, el campo óptico no está totalmente confinado en el dispositivo sensor, pero agotaría; esta "cola evanescente", entonces puede interactuar con especies en el entorno circundante. Esta interacción hace que el índice de refracción efectivo del campo óptico a cambiar, dando lugar a una ligera, pero detectables, desplazar en la frecuencia de resonancia del dispositivo. Debido a que el campo óptico circula, puede interactuar muchas veces con el medio ambiente, dando como resultado una amplificación inherente de la señal, y la sensibilidad muy alta a los cambios menores en el medio ambiente. 2,14-15 tienda "> Para realizar la detección específica en entornos complejos, estas plataformas debe ser emparejado con una molécula sonda (normalmente una media de un par de unión, por ejemplo, anticuerpos o antígenos) a través de modificación de superficie. 2 Aunque resonadores WGM ópticos pueden ser fabricados en varias geometrías de una variedad de sistemas de materiales, la microesfera de sílice es el más común. Estas microesferas se fabrican generalmente en el extremo de una fibra óptica, que proporciona un "tallo" por el que las microesferas se pueden manejar durante los experimentos de funcionalización y detección. químicas de sílice de superficie pueden aplicarse para unir moléculas de la sonda a su superficie, sin embargo, las técnicas tradicionales generados para sustratos planares a menudo no son adecuados para estas estructuras tridimensionales, como cualquier cambio en la superficie de las microesferas (polvo, contaminación, defectos en la superficie, y revestimientos desiguales) puede tener consecuencias graves y negativas en sus capacidades de detección. este sentido, demuestran un enfoque simplistapara la funcionalización de la superficie de la sílice de microesferas WGM resonadores ópticos utilizando agentes de acoplamiento de silano para cubrir la superficie inorgánica y el entorno biológico, mediante la adición de biotina a la superficie de la sílice. 8,16 A pesar de que utiliza sílice resonadores WGM de microesferas como el sistema de sensores en el presente informe, los protocolos son generales y se puede utilizar para funcionalizar la superficie de cualquier dispositivo de sílice con biotina.
Protocolo
1. Fondo
La biotina se une a la superficie de estos dispositivos a través de un simple proceso de tres pasos (Figura 1). En primer lugar, limpiar la superficie y rellenarla con los grupos hidroxilo mediante la exposición de los dispositivos de plasma de oxígeno ya sea o solución de pirañas. En segundo lugar, se utiliza la deposición de vapor para unir el agente de acoplamiento de silano terminado con una amina primaria a los grupos hidroxilo a través de hidrólisis y reacción de condensación. En tercer lugar, le damos la biotina a la superficie a través de N-hidroxisuccinimida (NHS), la química del éster. Pedimos al lector interesado en nuestro trabajo anterior para obtener más información sobre el desarrollo de estas técnicas, así como una explicación de nuestra motivación para la elección de estas técnicas. 8
El éxito de estas reacciones puede ser evaluada mediante microscopía óptica y de fluorescencia después de la adición de la amina primaria, así como después de la adición de la biotina. Mientras m ópticoicroscopy se puede utilizar para determinar si los protocolos de funcionalización de la superficie provoque daños en la superficie de la microesfera, o incluso la contaminación, la microscopía de fluorescencia se utiliza para verificar la calidad y la uniformidad de la cobertura de la superficie de la molécula de biotina, así como la capacidad de la biotina sobre la superficie para enlazar con (strept) avidina. Para evaluar la cobertura de las aminas en la superficie, se utilizó isotiocianato de fluoresceína (FITC) tinte fluorescente, que reacciona con aminas primarias para formar enlace estable, tiourea covalente a la microesfera. Tejas tinte rojo fluorescente que ha sido conjugado con avidina se utiliza para etiquetar los grupos de biotina en la superficie a través de la interacción biotina-avidina. En ambos casos, los colorantes se eligieron que pueden interactuar (ya sea a través de interacciones ligando-receptor o unión covalente) con los grupos funcionales en la superficie.
Aquí, el agente de acoplamiento de silano, que tiene tres grupos salientes y un grupo funcional, proporciona la apuesta puenteWeen la superficie inorgánica y orgánica molécula sonda. La funcionalidad de amina primaria reacciona cuantitativamente con ésteres de NHS para formar enlaces estables amida. En este caso, se utiliza una molécula sonda biotina cuya cadena lateral valérico se ha modificado con un grupo éster NHS. Realista, cualquier molécula sonda para que un grupo éster NHS se puede añadir a la superficie utilizando los siguientes protocolos. Además, estos protocolos son generales, y se puede utilizar para funcionalizar cualquier superficie del dispositivo de sílice con biotina.
El desafío principal con estos protocolos no está realmente en la misma química, sino más bien en el manejo de la sílice microesferas. Por favor, tenga en cuenta que, a través de los protocolos, las microesferas deben ser manejados por grapsing sus tallos ligeramente con pinzas de punta afilada. Esto mantiene las pinzas bien lejos de los mismos microesferas, y permite un fácil transporte entre los pasos. Muchos de los pasos en el protocolo a continuación están diseñados específicamente para hacer frente a este hechoo.
2. Fabricación de microesferas
- Construir la caja de almacenamiento para las microesferas.
- Usando un cuchillo exacto, corte un pedazo grueso de ¼ de cartón en un 1 x 1 en la plaza, la cinta de este sobre un portaobjetos de vidrio de tamaño normal, y adjuntar un 1 en la sección de cinta adhesiva, con el cumplimiento de sus extremos para formar un rollo , para el cartón.
- Esto crea una plataforma sobre la cual puede ser la microesfera elevado y aislado del entorno circundante, y previene el daño a su superficie.
- Con una tijera, cortar una sección de 3 pulgadas de fibra óptica desde un carrete de fibra óptica.
- El uso de un No-Nik fibra stripper, pelar el recubrimiento polimérico protector de los últimos 0,5 pulgadas del extremo de la pieza cortada de fibra, dejando sólo el núcleo de sílice. Limpiar la superficie de cualquier polímero restante con un Kimwipe humedecido con metanol por limpiando suavemente la fibra con la Kimwipe.
- Usando una fibra desnuda cuchillo, cortar el extremo pelado por lo ªen sólo aproximadamente 1 milímetro de fibra despojado permanece en el extremo de la fibra.
- Coloque el extremo pelado de la fibra óptica en el camino de un láser de CO 2, teniendo cuidado de alinear verticalmente la fibra de manera que su extremo pelado está orientada hacia abajo.
- Encienda el láser de CO 2, y dirigirla a la superficie del extremo pelado de la fibra óptica. El láser se funde el extremo pelado de la fibra en una esfera con un 3,5% de potencia en 2 segundos.
- Utilizando pinzas, cuidadosamente agarre el vástago (la parte no recortada de la fibra óptica) de la microesfera. Coloque el tallo hasta el rollo de cinta en la caja de las microesferas. La lámina de vidrio puede ser almacenada en sí mismo una placa de Petri. Esto permite que para el almacenamiento seguro de la microesfera.
3. Rellenar la superficie con grupos hidroxilo
- Utilizando la solución de pirañas:
- En un vial de polipropileno de 60 ml con una tapa con bisagras, preparar una solución de pirañas (70:30 en volumen fumante H 2 SO 4: H 2 O 2 (30% en peso)) mediante la adición de 5 ml de peróxido de hidrógeno al vial, seguido por 11,6 ml de ácido sulfúrico fumante. PRECAUCIÓN: Utilice guantes resistentes a los ácidos.
- Transferir el portaobjetos de vidrio, manteniendo por lo menos 1 microesfera, al vial. La microesfera debe estar en contacto con el líquido, pero el líquido no debe tocar el cartón. Ajustar el volumen de la solución, si es necesario.
- Retire con cuidado el portaobjetos de vidrio del vial, y la inserta en otro frasco de plástico con DDI H 2 O. Que las muestras sentarse en la solución durante 5 minutos.
- Suavemente quitar la placa de vidrio del vial, y lo coloca una estufa a 80 ° C durante 10 minutos para secar la superficie.
- Utilizando el tratamiento con plasma de oxígeno:
- Transferir el portaobjetos de vidrio que contiene al menos una microesfera a la cámara de plasma de oxígeno.
- Ajustar la presión de oxígeno a 200 mTorr, y el poder de 120 W. Exponer la muestra al plasma de oxígeno durante 2 millasnutos.
- Retirar la placa de vidrio de la cámara de plasma.
4. Colocación de los agentes de acoplamiento de silano a la superficie
- Coloque el portaobjetos de vidrio, que contiene al menos una microesfera, en un desecador de vacío en una campana de humos.
- También en la campana de humos, abrir la botella agente de acoplamiento de silano (en este caso, aminopropiltrimetoxisilano (APTMS) se utiliza), y colocar la botella abierta en el desecador.
- Vuelva a colocar la tapa en el desecador de vacío, y conecte el puerto de salida a un aspirador o la línea de vacío de la casa.
- Encienda el vacío de la casa o la línea de agua y evacuar el desecador de vacío. Una vez que una junta de vacío está formado entre la tapa y la base, comienza a cronometrar la reacción. Esto depositar el agente de acoplamiento de silano a la superficie como una película delgada.
- Después de 15 minutos, apague el vacío, y poco a poco abrir el puerto para que el aire en el desecador. Para este agente de acoplamiento, a 15 minutos es suficiente para formar una unifomonocapa RM en la superficie. Para otros agentes de acoplamiento, el tiempo puede ser necesario ajustar.
5. Colocación de la biotina a la superficie
- Aproximadamente una hora antes de fijar la biotina, preparar una solución 10 mM de N-hydroxylsuccinimide biotina (NHS-biotina) en dimetilsulfóxido anhidro (DMSO) en un vial de polipropileno de 60 ml con una tapa articulada.
- Si el NHS-biotina se ha almacenado en frío, deje que se equilibre a la temperatura ambiente antes de masificación a cabo.
- Soníquelos la solución durante 1 hora para disolver completamente el polvo NHS-biotina en el disolvente.
- Transferir el portaobjetos de vidrio que contenía la microesfera en otro vial de plástico, con las microesferas en la parte inferior, y se deriva en la parte superior del vial.
- Transferencia, utilizando una pipeta de plástico, un volumen adecuado de la solución de NHS-biotina por el lado del vial, detrás de la placa de vidrio (por lo que la solución no toca la microesfera a medida que se añadió al vial). Add suficiente solución para cubrir la superficie de la microesfera.
- Colocar los viales que contienen ahora las microesferas y el NHS-biotina en solución de DMSO en una incubadora oscilante (bandeja de inclinación) durante 30 minutos a temperatura ambiente, con la velocidad y el ángulo de inclinación a 5 rpm y 5 grados, respectivamente.
- Retire con cuidado el portaobjetos de vidrio del vial, y suavemente se desliza a otro frasco lleno de DDI H 2 O. Coloque el vial en la bandeja de inclinación durante otros 10 minutos a la misma velocidad y ángulo de inclinación como antes. Repita este paso dos veces con agua fresca cada vez. Esto ayuda a eliminar el exceso de DMSO de la superficie, y elimina cualquier biotina físicamente adsorbido que en realidad no injerto a la superficie.
- Retirar la placa de vidrio del vial, y lo coloca en un horno a 80 ° C durante 10 minutos, o hasta que todas las gotas de agua se eliminan de la superficie.
6. Etiquetado fluorescente de terminado en amina de sílice
- Para etiquetar los grupos amino presentes después de tratamENT con APTMS, preparar la solución de FITC en un cuarto oscuro por disolución de 1 mg de FITC en 1 ml de DMSO anhidro.
- Se diluye la solución en 6,1 mediante la adición de 50 l de la solución con FITC a 1 ml de tampón 0,1 M de bicarbonato de sodio.
- Colocar la solución en un vial de polipropileno de 60 ml con una tapa articulada, y deslice suavemente las microesferas terminado en amina, que se encuentra de nuevo en el portaobjetos de vidrio, en el vial.
- Coloque el vial en un baño de hielo, y dejar que la muestra reacciona con la solución de FITC para un mínimo de 4 horas en la oscuridad.
- Eliminar el exceso de fluoróforo a través de dos minutos, 10 enjuagues de las microesferas en tampón de carbonato de sodio. Como antes, llenar un vial de polipropileno de 60 ml con una tapa articulada con el tampón, y deslice suavemente el portaobjetos de vidrio en la solución, teniendo cuidado de que la solución sólo cubre la microesfera, y no la caja de cartón. Cubrir el vial con papel de aluminio y coloque el frasco en una bandeja de inclinación fija en 5 grados y 5 rpm, como antes.
- Retire con cuidado el portaobjetos de vidrio del vial, y suavemente se desliza a otro frasco lleno de DDI H 2 O y se cubre con papel de aluminio. Coloque el vial en la bandeja de inclinación durante otros 10 minutos a la misma velocidad y ángulo de inclinación como antes. Repita este paso dos veces con agua fresca cada vez. Esto ayuda a eliminar el exceso de tinte de la superficie.
- Suavemente retirar el portaobjetos de vidrio de la ampolla, y seca en un horno a 80 ° C durante 10 minutos antes de imágenes.
7. Etiquetado fluorescente de biotina-terminado sílice
- Preparar una solución 10 mg / mL de Texas-Roja avidina en tampón fosfato salino.
- Añadir la solución a un vial de polipropileno de 60 ml con una tapa articulada, y deslice suavemente el portaobjetos de vidrio que contiene una microesfera biotina-terminado en la solución, de modo que la microesfera apenas es cubierto por la solución.
- Reaccionar durante 30 minutos a temperatura ambiente en la oscuridad.
- Retire el exceso de fluoróforo a través de dos, 10 minutos de enjuagues de las microesferas en tampón PBS.
- Como antes, llenar un vial de polipropileno de 60 ml con una tapa articulada con el tampón, y deslice suavemente el portaobjetos de vidrio en la solución, teniendo cuidado de que la solución sólo cubre la microesfera, y no la caja de cartón.
- Cubrir el vial con papel de aluminio y coloque el frasco en una bandeja de inclinación fija en 5 grados y 5 rpm, como antes.
- Retire con cuidado el portaobjetos de vidrio del vial, y suavemente se desliza a otro frasco lleno de DDI H 2 O y se cubre con papel de aluminio. Coloque el vial en la bandeja de inclinación durante otros 10 minutos a la misma velocidad y ángulo de inclinación como antes. Repita este paso dos veces con agua fresca cada vez. Esto ayuda a eliminar el exceso de tinte de la superficie.
- Suavemente retirar el portaobjetos de vidrio de la ampolla, y seca en un horno a 80 ° C durante 10 minutos antes de imágenes.
8. Los resultados representativos
Microesferas correctamente funcionalizadas se puede identificar mediante microscopía óptica y de fluorescencia. Si la superficie de funcionalización se hace correctamente, debe resultar en una cobertura densa y uniforme de las moléculas de biotina en la superficie, y la superficie debe permanecer defectos y libre de contaminantes después de funcionalización a fin de mantener sus altas sensibilidades de detección durante los experimentos. Microscopía óptica se puede utilizar para sondear el último, mientras fluorescente microscopía puede probar la calidad y la uniformidad de la cobertura de la superficie. En la Figura 2, se muestran ejemplos de correcta funcionalizados microesferas. Estas imágenes muestran que no hay daños en la superficie o la contaminación debido a funcionalización (fig. 2a), y que las microesferas muestran una cobertura uniforme y consistente de grupos amino o bien (fig. 2b) o grupos de biotina (Fig. 2c) en la superficie .
Si las microesferas no han sido funcionalizados correctamente, la microesfera óptico imágenes will exhiben contaminación de la superficie, la cobertura de aglutinación o no uniforme, y defectos obvios en la superficie, como grietas en la superficie (Figura 3). Aquí vemos un ejemplo común de contaminación de la superficie, como resultado de la aglutinación de los reactivos en la superficie.
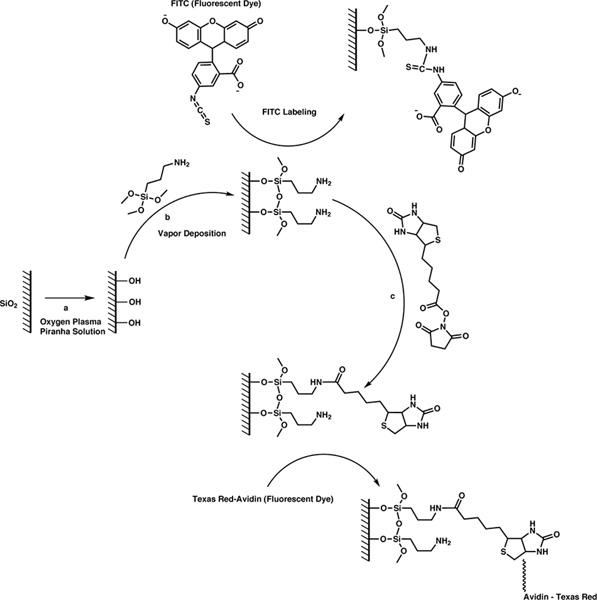
Figura 1. 3-paso esquema de reacción para unir moléculas de la sonda a la superficie de microesferas de sílice. Haga clic aquí para ampliar la figura .
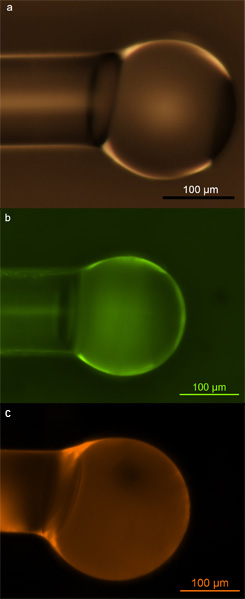
Figura 2. Microesferas de sílice. una micrografía) óptico de microesferas de sílice rellena con grupos hidroxilo a través de la exposición al plasma de oxígeno, b) micrografía fluorescente de microesferas de sílice rellena con aminas primarias y marcado con FITC colorante, c) micrografía fluorescente de sílice millascrosphere poblada con biotina y etiquetados con Texas Red-avidina conjugada. Reproducido con permiso del Soteropulos, CE, Hunt, Hong Kong y Armani, AM Determinación de la cinética de unión utilizando susurrando microcavidades modo de galería. Appl. Phys.. Lett. 99, 103,703 a 103.703 (2011). Copyright 2011, Instituto Americano de Física. 17

Figura 3. Micrografía óptica de la esfera de mal funcionalizados. Aquí, se puede ver polvo en la superficie superior derecha, así como la contaminación que se extiende fuera de la superficie. Además, el lado derecho de la microesfera óptico muestra una pequeña chuleta en la superficie.
Discusión
Como se describe en los protocolos, se creó una plataforma de vivienda por el cual para el transporte de la sílice microesferas por sus tallos en todo el proceso de funcionalización. Esta plataforma de vivienda fue creado como una solución a la contaminación de la superficie y el daño que resultó de la microesfera que entren en contacto con las paredes de los diversos recipientes utilizados en el proceso de funcionalización. Nos dimos cuenta de la principal dificultad surgió de forma constante y el desprendimie...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores agradecen Prof. Andrea Armani en la Universidad del Sur de California para el apoyo durante el tiempo que se ha desarrollado este protocolo. El financiamiento para el desarrollo inicial de este trabajo fue proporcionado por la National Science Foundation [085281 y 1028440] y el Instituto Nacional de Salud a través de Nueva director del NIH, el Programa Premio a la Innovación [1DP2OD007391-01]. Información adicional está disponible en http://web.missouri.edu/ hunthk ~ / .
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| El metanol | Pescador | 67-56-1 | Grado ACS |
| Ácido sulfúrico | Pescador | 8014-95-7 | Echando humo |
| Peróxido de hidrógeno | Pescador | 7722-84-1 | 30% en peso |
| Aminopropiltrimetoxisilano | Pescador | 13822-56-5 | |
| NHS-biotina EZ enlazador | Atravesar | 20217 | |
| Dimetilsulfóxido | Pescador | 67-68-5 | Anhidro |
| Isotiocianato de fluoresceína | Atravesar | 46425 | |
| Tampón fosfato salino | Pescador | 7647-14-5 | Polvo concentrado |
| Un amortiguador de bicarbonato de sodio | Pescador | NC0099321 | |
| Texas Red - avidina conjugada | Atravesar | A820 | |
| Fibra óptica | Newport | F-SC | |
| La fibra Stripper | Las ventas de fibra de instrumentos | NN-175 | No-Nik 175 um separador |
| Kimwipes | Pescador | 06666A | |
| Bare Cleaver fibra | Ilsintech | Cl-03A | |
| Portaobjetos de vidrio | Pescador | 12-550B | |
| Los viales de polipropileno | Pescador | 03 a 341-75A | 60 ml, tapa de bisagra |
| La incubación de Rocker | VWR | 12620-910 | |
| Desecador de vacío | Pescador | 08 a 594-15B |
Referencias
- Datar, R. Cantilever Sensors: Nanomechanical Tools for Diagnostics. MRS Bull. 34, 449-454 (2009).
- Hunt, H. K., Armani, A. M. Label-free biological and chemical sensors. Nanoscale. 2, 1544-1559 (2010).
- Sundberg, F., Karlsson, R. Rapid detection and characterization of immune responses using label-free biacore immunoassays. Immunology. 120, 46-47 (2007).
- Hermanson, G. T. . Bioconjugate Techniques. , (2008).
- Bernards, M. T., Cheng, G., Zhang, Z., Chen, S. F., Jiang, S. Y. Nonfouling polymer brushes via surface-initiated, two-component atom transfer radical polymerization. Macromolecules. 41, 4216-4219 (2008).
- Fan, X. D. Sensitive optical biosensors for unlabeled targets: A review. Anal. Chim. Acta. 620, 8-26 (2008).
- Qavi, A. J., Washburn, A. L., Byeon, J. Y., Bailey, R. C. Label-free technologies for quantitative multiparameter biological analysis. Analytical and Bioanalytical Chemistry. 394, 121-135 (2009).
- Hunt, H. K., Soteropulos, C., Armani, A. M. Bioconjugation Strategies for Microtoroidal Optical Resonators. Sensors. 10, 9317-9336 (2010).
- Kalia, J., Raines, R. T. Advances in Bioconjugation. Curr. Org. Chem. 14, 138-147 (2010).
- Matsko, A. B., Savchenkov, A. A., Strekalov, D., Ilchenko, V. S., Maleki, L. Review of Applications of Whispering-Gallery Mode Resonators in Photonics and Nonlinear Optics. IPN Progress Report. , 42-162 (2005).
- Armani, A. M., Kulkarni, R. P., Fraser, S. E., Flagan, R. C., Vahala, K. J. Label-free, single-molecule detection with optical microcavities. Science. 317, 783-787 (2007).
- Zhu, J. On-chip single nanoparticle detection and sizing by mode splitting in an ultrahigh-Q microresonator. Nat. Photon. 4, 122-122 (2010).
- Armani, D. K., Kippenberg, T. J., Spillane, S. M., Vahala, K. J. Ultra-high-Q toroid microcavity on a chip. Nature. 421, 925-928 (2003).
- Vollmer, F., Arnold, S. Whispering-gallery-mode biosensing: label-free detection down to single molecules. Nat. Methods. 5, 591-596 (2008).
- Vollmer, F., Arnold, S., Keng, D. Single virus detection from the reactive shift of a whispering gallery mode. Proc. Natl. Acad. Sci. U.S.A. 105, 20701-20704 (2008).
- Hunt, H. K., Armani, A. M. Recycling microcavity optical biosensors. Opt. Lett. 36, 1092-1094 (2011).
- Soteropulos, C. E., Hunt, H. K., Armani, A. M. Determination of binding kinetics using whispering gallery mode microcavities. Appl. Phys. Lett. 99, 103703-103703 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados