Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Anbringen biologischen Sonden zur Silica Optische Biosensoren Mit Silane Coupling Agents
In diesem Artikel
Zusammenfassung
Biosensoren Verbindung mit komplexen, biologischen Umgebungen und führen gezielte Erkennung durch die Kombination von hochempfindlichen Sensoren mit sehr spezifischen Sonden, die an dem Sensor über Oberflächenmodifizierung. Hier zeigen wir die Funktionalisierung der Oberfläche von Silica optische Sensoren mit Biotin mit Silankupplungsmittel, um den Sensor und die biologische Umwelt zu überbrücken.
Zusammenfassung
Zur Schnittstelle mit biologischen Umgebungen, Biosensor-Plattformen, wie die beliebten Biacore-System (basierend auf der Surface Plasmon Resonance (SPR)-Technik), nutzen verschiedene Techniken Oberflächenmodifizierung, die zum Beispiel verhindern kann Oberflächenverschmutzung, stimmen die Hydrophobie / Hydrophilie der Oberfläche, auf eine Vielzahl von elektronischen Umgebungen anzupassen, und am häufigsten, induzieren Spezifität gegenüber einem Ziel von Interesse. 5.1 Diese Techniken erweitern die Funktionalität von sonst hoch empfindliche Biosensoren zu realen Anwendungen in komplexen Umgebungen, wie z. wie Blut, Urin, Abwasser und Analyse. 2,6-7 Während kommerzielle Biosensorik Plattformen wie Biacore, gut verstanden haben, Standard-Techniken zur Durchführung solcher Oberflächenmodifikationen, haben diese Techniken nicht in standardisierter Form wurden auf andere übersetzte Bezeichnung- frei Biosensorik Plattformen wie Whispering Gallery Mode (WGM) optischen Resonatoren. 9.8 < / P>
WGM optischen Resonatoren stellen eine vielversprechende Technologie für die Durchführung markierungsfreie Detektion einer Vielzahl von Arten, bei extrem niedrigen Konzentrationen 6,10-12 Die hohe Empfindlichkeit dieser Plattformen ist ein Ergebnis ihrer einzigartigen geometrischen Optik:. WGM optischen Resonatoren beschränken zirkulierenden . Licht an speziellen, Resonanzfrequenzen 13 Wie der SPR-Plattformen wird das optische Feld nicht völlig mit der Sensoreinrichtung beschränkt, sondern evanesces; diese "evaneszenten" kann dann mit Arten, die in der Umgebung zu interagieren. Diese Wechselwirkung führt zu dem effektiven Brechungsindex des optischen Feldes zu verändern, was zu einer leichten, aber nachweisbare, der Resonanzfrequenz der Vorrichtung zu verschieben. Da der optische Bereich zirkuliert, kann er viele Male mit der Umwelt interagieren, was zu einer inhärenten Verstärkung des Signals, und eine sehr hohe Empfindlichkeiten zu geringfügigen Änderungen in der Umwelt. 2,14-15 Zelt "> Zur gezielten Erkennung in komplexen Umgebungen ausführen zu können, müssen diese Plattformen mit einer Sonde Molekül (in der Regel die Hälfte eines Bindepaares, z. B. Antikörper / Antigene) durch Oberflächenmodifizierung. 2 gekoppelt werden zwar WGM optischen Resonatoren in mehreren Geometrien hergestellt werden können, von eine Vielzahl von Materialsystemen, ist das Silika Mikrokügelchen die häufigste. Diese Mikrokügelchen werden in der Regel am Ende einer optischen Faser, die einen "Stamm", mit dem die Mikrokügelchen bei der Funktionalisierung und Detektion Versuche gehandhabt werden kann, gibt hergestellt. Silica Oberflächenchemie kann Anwendung an Sondenmoleküle an deren Oberflächen zu befestigen, jedoch sind traditionelle Techniken zur ebenen Substraten erzeugt wurden, oft nicht für diese dreidimensionalen Strukturen ausreichend, da Änderungen an der Oberfläche der Mikrosphären (Staub, Schmutz, Oberflächendefekte und unebene Beschichtungen) kann schwerwiegende negative Folgen für ihre Erkennung Fähigkeiten haben. Hier zeigen wir einen einfachen Ansatzfür die Funktionalisierung der Oberfläche von Siliciumdioxid-Mikrokügelchen WGM optischen Resonatoren mit Silankupplungsmittel, um die anorganischen Oberfläche und die biologische Umwelt zu überbrücken, durch das Anbringen Biotin an die Silica-Oberfläche. 8,16 Obwohl wir verwenden Kieselsäure Mikrosphäre WGM-Resonatoren als Sensor-System in diesem Bericht, die Protokolle allgemein und kann verwendet werden, um die Oberfläche jedes Siliciumdioxid Vorrichtung mit Biotin zu funktionalisieren.
Protokoll
1. Hintergrund
Das Biotin ist an der Oberfläche dieser Geräte durch eine einfache Drei-Schritt-Verfahren (1) befestigt ist. Zuerst reinigen wir die Oberfläche und füllen Sie es mit Hydroxyl-Gruppen, indem die Geräte entweder Sauerstoff-Plasma oder Piranha-Lösung. Zweitens verwenden wir Dampfabscheidung, um das Silan-Kupplungsmittel mit einem primären Amin zu den Hydroxylgruppen durch Hydrolyse und Kondensation Reaktion beendet befestigen. Drittens legen wir Biotin an die Oberfläche über N-Hydroxysuccinimid (NHS)-Ester Chemie. Wir weisen den interessierten Leser zu unserer bisherigen Arbeit für mehr Informationen über die Entwicklung dieser Techniken, sowie eine Erklärung der unsere Motivation für die Wahl dieser Techniken. 8
Der Erfolg dieser Reaktionen kann durch optische und Fluoreszenzmikroskopie nach der Zugabe des primären Amins ausgewertet werden, als auch nach der Zugabe des Biotin. Während optische microscopy verwendet werden, um festzustellen, ob die Funktionalisierung der Oberfläche Protokolle in Folge Schäden zur Oberfläche der Mikrokugeln, oder Verunreinigungen, die Fluoreszenz-Mikroskopie verwendet werden, um die Qualität und Gleichmäßigkeit der Flächendeckung des Biotin-Molekül zu überprüfen sowie die Fähigkeit des Biotin auf die Oberfläche mit (Strept) Avidin binden. Um die Abdeckung von Aminen auf der Oberfläche zu beurteilen, verwendeten wir Fluoresceinisothiocyanat (FITC) Fluoreszenz-Farbstoff, die mit primären Aminen reagiert, um stabile, kovalente Thioharnstoffbindung der Mikrosphären zu bilden. Texas Red Fluoreszenzfarbstoff konjugiert an Avidin hat, verwendet wird, um die Biotin-Gruppen auf der Oberfläche durch die Biotin-Avidin-Wechselwirkung kennzeichnen. In beiden Fällen wurden Farbstoffe gewählt, die in Wechselwirkung treten kann (entweder durch Rezeptor-Ligand-Wechselwirkungen oder kovalente Bindung) mit den funktionellen Gruppen auf der Oberfläche.
Hier stellt das Silan-Kupplungsmittel, das drei Abgangsgruppen und eine funktionelle Gruppe hat, die Brücke Wetteschen dem anorganischen und organischen Oberfläche Sondenmolekül. Das primäre Amin-Funktionalität reagiert quantitativ mit NHS-Ester, stabile Amidbindungen zu bilden. In diesem Fall verwenden wir eine Biotin-Sondenmolekül, deren Valeriansäure Seitenkette mit einem NHS-Ester modifiziert sind. Realistisch einem Sondenmolekül, dem ein NHS-Ester-Gruppe kann an der Oberfläche mit den folgenden Protokollen zugesetzt werden. Zusätzlich sind diese Protokolle allgemein und kann mit einer beliebigen Vorrichtung Siliciumdioxid mit Biotin zu funktionalisieren.
Die größte Herausforderung mit diesen Protokollen ist tatsächlich nicht in der Chemie selbst, sondern in der Handhabung der Siliciumdioxid-Mikrokugeln. Bitte beachten Sie, dass überall in den Protokollen, die Mikrokugeln durch grapsing ihre Stiele leicht mit scharfer Spitze Pinzette behandelt werden sollen. Dies hält die Pinzette weit weg von den Mikrosphären selbst, und ermöglicht den einfachen Transport zwischen den Schritten. Viele Schritte im Protokoll unten sind speziell darauf ausgerichtet, diese Tatsache zu adressierenoder.
2. Microsphere Fabrication
- Erstellen Sie das Speicher-Gehäuse für die Mikrosphären.
- Mit einem exacto Messer, schneiden Sie ein ¼ Zoll dicken Karton in eine 1 x 1 in in eckigen; diese Band auf eine normal große Glasplatte und befestigen Sie eine 1 im Schnitt von Tesafilm, mit seinen Enden Treffen zu einer Rolle , auf den Karton.
- Dies schafft eine Plattform, auf der die Mikrokügelchen erhöht und kann von der Umgebung isoliert werden, und verhindert eine Beschädigung ihrer Oberfläche.
- , Mit einer Schere geschnitten ein 3 Zoll Abschnitt der optischen Faser von einer Spule der optischen Faser.
- Mit einem No-Nik Faser-Stripper, Absetzen des schützenden Polymerbeschichtung aus den letzten 0,5 cm von dem Ende des geschnittenen Stücks der Faser, so dass nur die Siliciumdioxid-Kern. Reinigen Sie die Oberfläche von jedem verbleibenden Polymer mit einem Kimwipe gedämpft mit Methanol durch leichtes Abwischen der Faser mit dem Kimwipe.
- Mit einer nackten Faser Cleaver, schneiden Sie das abisolierte Ende so thnur zu etwa 1 Millimeter abgezogenen Faser verbleibt auf dem Ende der Faser.
- Legen Sie das abisolierte Ende der optischen Faser in der Bahn eines CO 2-Laser, wobei darauf geachtet senkrecht ausrichten Faser, so daß die abisolierten Ende nach unten zeigt.
- Schalten der CO 2-Laser, und weist sie an der Oberfläche des abisolierten Endes der optischen Faser. Der Laser wird das abisolierte Ende der Faser in eine Kugel mit etwa 3,5% Leistung innerhalb von 2 Sekunden zu schmelzen.
- Mit einer Pinzette, zu erfassen sorgfältig den Schaft (die nicht abisolierten Teil der optischen Faser) der Mikrokügelchen. Befestigen Sie den Vorbau auf das Band rollen auf der Mikrosphäre Gehäuse. Der Objektträger kann sich in einer Petrischale gespeichert werden. Dies ermöglicht eine sichere Lagerung der Mikrosphären.
3. Füllen Sie die Oberfläche mit Hydroxylgruppen
- Mit Piranha-Lösung:
- In einem 60 ml Polypropylen-Röhrchen mit einem Klappdeckel, bereiten Sie einen Piranha-Lösung (70:30 Vol. rauchender H 2 SO 4: H 2 O 2 (30 Gew.%)) durch Zugabe von 5 ml Wasserstoffperoxid in das Fläschchen, gefolgt von 11,6 ml rauchende Schwefelsäure. ACHTUNG: Tragen säurebeständige Handschuhe.
- Übertragen Sie die Objektträger aus Glas und hält mindestens 1 Mikrosphäre, in das Fläschchen geben. Die Mikrokügelchen sollten in Kontakt mit der Flüssigkeit ist, aber die Flüssigkeit nicht berühren Karton. Die Lautstärke der Lösung, wenn nötig.
- Entfernen Sie vorsichtig die Objektträger aus Glas aus der Flasche, und stecken Sie sie in einem anderen Kunststoff-Fläschchen mit DDI H 2 O. Lassen Sie die Proben sitzen in der Lösung für 5 Minuten.
- Entfernen Sie vorsichtig die Objektträger aus Glas aus der Flasche, und legen Sie sie einem Ofen bei 80 ° C für 10 Minuten die Oberfläche zu trocknen.
- Mit Sauerstoff-Plasma-Behandlung:
- Übertragen der Glasplatte, die mindestens eine Mikrokügelchen zu dem Sauerstoff Plasmakammer.
- Stellen Sie den Sauerstoffdruck bis 200 mTorr, und die Leistung bis 120 W. Setzen Sie die Probe auf die Sauerstoff-Plasma für 2 minuten.
- Nehmen Sie die Objektträger aus der Plasmakammer.
4. Anbringen Silane Coupling Agents an die Oberfläche
- Das Glas Folie, mit mindestens einer Mikrokugel, in einem Vakuum-Exsikkator in einem Abzug.
- Auch in der Abzugshaube, öffnen Sie das Silankupplungsmittel Flasche (in diesem Fall, Aminopropyltrimethoxysilan (APTMS) verwendet wurde), und legen Sie die geöffnete Flasche im Exsikkator.
- Setzen Sie den Deckel auf dem Vakuumexsikkator, und befestigen Sie den Auslass zu einem Aspirator oder Haus Vakuumleitung.
- Schalten Sie das Haus oder Vakuum der Wasser-Linie, und evakuieren Vakuumexsikkator. Sobald eine Vakuumdichtung zwischen dem Deckel und der Basis ausgebildet ist, beginnt das Timing der Reaktion. Dies wird das Silan-Kupplungsmittel auf die Oberfläche als dünne Schicht abzuscheiden.
- Nach 15 Minuten schalten Sie das Vakuum, und langsam den Port öffnen, um Luft in den Exsikkator lassen. Aus diesem Haftvermittler, sind 15 Minuten ausreichend, um eine unifo bildenrm Monoschicht auf der Oberfläche. Für andere Haftmittel, kann die Zeit angepasst werden muss.
5. Anbringen Biotin an die Oberfläche
- Etwa eine Stunde vor dem Anbringen des Biotin, bereiten eine 10 mM Lösung von N-Hydroxylsuccinimid Biotin (NHS-Biotin) in wasserfreiem Dimethylsulfoxid (DMSO) in einem 60 ml Polypropylen-Röhrchen mit einem aufklappbarem Deckel.
- Wenn der NHS-Biotin gespeichert worden ist Kälte, damit sie auf Raumtemperatur Massierung es sich ausgleichen lassen.
- Beschallen die Lösung für 1 Stunde, um Auflösung der NHS-Biotin-Pulver in dem Lösungsmittel.
- Übertragen der Objektträger mit der Mikrokügelchen in einem anderen Kunststoff-Röhrchen, mit den Mikrosphären an der Unterseite, und Stielen von der Oberseite des Fläschchens.
- Übertragen, mit einem Kunststoff-Pipette, ein geeignetes Volumen des NHS-Biotin-Lösung an der Seite der Ampulle hinter der Glasplatte (so dass die Lösung nicht berührt Mikrokügelchen, wie es zu dem Fläschchen gegeben wird). Eindd genug Lösung zur Oberfläche der Mikrokugeln zu decken.
- Legen Sie die Fläschchen nun mit den Mikrosphären und NHS-Biotin in DMSO-Lösung auf einem Schaukelstuhl Inkubator (Tilt Tray) für 30 Minuten bei Raumtemperatur, mit der Geschwindigkeit und Neigungswinkel bei 5 Umdrehungen pro Minute und 5 Grad.
- Entfernen Sie vorsichtig die Objektträger aus Glas aus der Flasche, und ziehen Sie sie vorsichtig in ein anderes Gefäß mit DDI H 2 O gefüllt Die Küvette auf der Kippschale für weitere 10 Minuten bei der gleichen Geschwindigkeit und Neigungswinkel wie zuvor. Wiederholen Sie diesen Schritt zweimal mit frischem Wasser aus. Dies hilft bei der Entfernung überschüssigen DMSO von der Oberfläche, und entfernt die physikalisch adsorbierten Biotin, die nicht entweder tatsächlich Implantat an der Oberfläche.
- Nehmen Sie die Objektträger aus Glas aus der Flasche, und legen Sie sie in einem Ofen bei 80 ° C für 10 Minuten, oder bis alle Wassertropfen von der Oberfläche entfernt werden.
6. Fluoreszenzmarkierung von Amin-terminierten Siliciumdioxid
- Um die vorhandenen Amingruppen nach treatm beschriftenHNO mit APTMS, bereiten Sie das FITC-Lösung in einem abgedunkelten Raum durch Lösen von 1 mg FITC in 1 ml wasserfreiem DMSO.
- Verdünnen Sie die Lösung in 6,1 durch Zugabe von 50 ul des FITC-Lösung zu 1 ml 0,1 M Natrium-Bicarbonat-Puffer.
- Legen Sie die Lösung in einem 60 ml Polypropylen-Röhrchen mit einem aufklappbaren Deckel, und schieben Sie die Amin-terminierten Mikrokugeln, wieder auf dem Objektträger aus Glas untergebracht, in das Fläschchen.
- Stellen Sie die Durchstechflasche in einem Eisbad, und lassen Sie die Probe mit dem FITC-Lösung für ein Minimum von 4 Stunden im Dunkeln reagieren.
- Überschüssiges Fluorophor durch zwei, 10 Minuten Spülen der Mikrosphären in Natriumcarbonat-Puffer. Nach wie vor füllen einen 60 ml-Polypropylen-Röhrchen mit einem Klappdeckel mit dem Puffer, und schieben Sie die Objektträger in die Lösung und darauf achten, dass die Lösung deckt nur den Mikrokügelchen, und nicht das Gehäuse Karton. Decken Sie das Fläschchen mit Alufolie und legen Sie die Durchstechflasche auf einer Kippschale bei 5 Grad und 5 Umdrehungen pro Minute eingestellt, wie vorher.
- Entfernen Sie vorsichtig die Objektträger aus Glas aus der Flasche, und ziehen Sie sie vorsichtig in ein anderes Gefäß mit DDI H 2 O gefüllt und mit Alufolie bedeckt. Die Küvette auf der Kippschale für weitere 10 Minuten bei der gleichen Geschwindigkeit und Neigungswinkel wie zuvor. Wiederholen Sie diesen Schritt zweimal mit frischem Wasser aus. Dies hilft bei der Entfernung von überschüssigem Farbstoff von der Oberfläche.
- Entfernen Sie vorsichtig die Objektträger aus Glas aus der Flasche, und trocken in einem Ofen bei 80 ° C für 10 Minuten vor Tomografie ermöglichen.
7. Fluoreszenzmarkierung von Biotin-terminierten Siliciumdioxid
- Bereiten Sie eine 10 pg / ml-Lösung von Texas-Red Avidin in Phosphat-gepufferter Kochsalzlösung.
- In der Lösung auf eine 60 ml Polypropylen Phiole mit einem Klappdeckel, und schieben die Objektträger mit einem Biotin-terminierten Mikrokügelchen in der Lösung, so daß die Mikrokügelchen nur von der Lösung bedeckt.
- Reagieren für 30 Minuten bei Raumtemperatur im Dunkeln.
- Entfernen Sie überschüssiges Fluorophor durch zwei gründlich 10 Minutens der Mikrosphären in PBS-Puffer.
- Nach wie vor füllen einen 60 ml-Polypropylen-Röhrchen mit einem Klappdeckel mit dem Puffer, und schieben Sie die Objektträger in die Lösung und darauf achten, dass die Lösung deckt nur den Mikrokügelchen, und nicht das Gehäuse Karton.
- Decken Sie das Fläschchen mit Alufolie und legen Sie die Durchstechflasche auf einer Kippschale bei 5 Grad und 5 Umdrehungen pro Minute eingestellt, wie vorher.
- Entfernen Sie vorsichtig die Objektträger aus Glas aus der Flasche, und ziehen Sie sie vorsichtig in ein anderes Gefäß mit DDI H 2 O gefüllt und mit Alufolie bedeckt. Die Küvette auf der Kippschale für weitere 10 Minuten bei der gleichen Geschwindigkeit und Neigungswinkel wie zuvor. Wiederholen Sie diesen Schritt zweimal mit frischem Wasser aus. Dies hilft bei der Entfernung von überschüssigem Farbstoff von der Oberfläche.
- Entfernen Sie vorsichtig die Objektträger aus Glas aus der Flasche, und trocken in einem Ofen bei 80 ° C für 10 Minuten vor der Bildgebung.
8. Repräsentative Ergebnisse
Korrekt funktionalisiert Mikrosphäres kann durch optische und Fluoreszenzmikroskopie identifiziert werden. Wenn der Funktionalisierung von Oberflächen richtig gemacht wird, sollte es in einer gleichmäßig dichten Abdeckung der Biotin-Moleküle auf der Oberfläche zur Folge haben, und die Oberfläche sollte bleiben Defekt-und Schadstoff-frei nach der Funktionalisierung, um ihre hohe Empfindlichkeiten bei der Detektion Experimente zu erhalten. Optische Mikroskopie kann die letztere zu sondieren, während die Fluoreszenz-Mikroskopie, die Qualität und Einheitlichkeit der Flächendeckung Sonde kann. In Abbildung 2 zeigen wir Beispiele für korrekt funktionalisierten Mikrosphären. Diese Bilder zeigen, dass es keine Beschädigung der Oberfläche Verunreinigung durch Funktionalisierung (2a), und daß die Mikrokugeln eine einheitliche und konsistente Abdeckung entweder Amingruppen (2b) oder Biotin-Gruppen (2c) für auf der Oberfläche .
Wenn die Mikrosphären nicht korrekt funktionalisiert worden, die optische Bilder Mikrosphäre will Oberflächenkontamination, Verklumpung oder ungleichmäßige Deckung, und offensichtliche Mängel in der Oberfläche, wie Oberflächenrisse (Abbildung 3) zeigen. Hier sehen wir ein typisches Beispiel für Oberflächenkontamination, die sich aus Verklumpung von Reagenzien auf der Oberfläche.
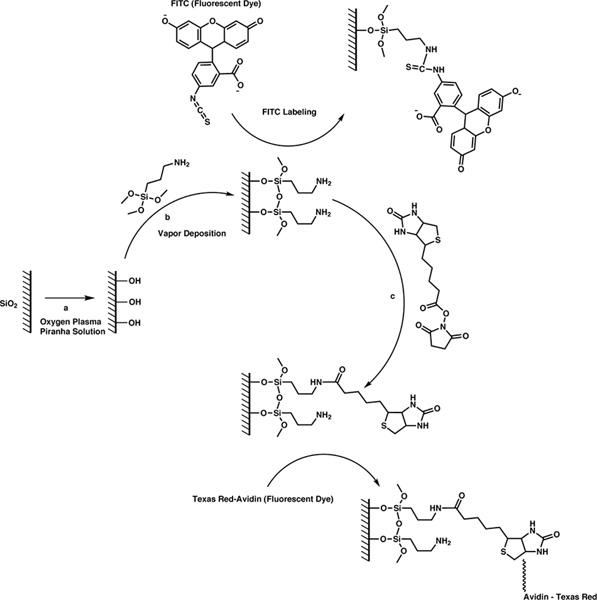
1. 3-Schritt Reaktionsschema zur Befestigung Sondenmoleküle auf die Oberfläche des Siliciumdioxid-Mikrokugeln. Hier klicken, um größere Zahl kommen .
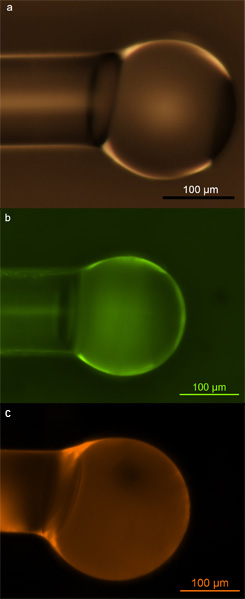
2. Silica-Mikrokugeln. a) Lichtmikroskopische Aufnahme von Silica-Mikrokugeln mit Hydroxyl-Gruppen durch Einwirkung von Sauerstoff-Plasma bevölkert; b) Fluoreszenz-Aufnahme von Silica-Mikrokugeln mit primären Aminen besiedelt und markiert mit FITC Farbstoff; c) Fluoreszenz-Aufnahme von Kieselsäure microsphere mit Biotin besiedelt und markiert mit Texas-Rot-Avidin-Konjugat. Nachdruck mit Genehmigung aus Soteropulos, AM CE, Hunt, HK & Armani, Bestimmung von Bindungskinetiken mit Whispering Gallery-Modus Mikrokavitäten. Appl. Phys. Lett. 99, 103.703 bis 103.703 (2011). Copyright 2011, American Institute of Physics. 17

Abbildung 3. Lichtmikroskopische Aufnahme unsachgemäß funktionalisiert Sphäre. Hier können Sie Staub auf der Oberfläche sehen, oben rechts, sowie Verunreinigungen von der Oberfläche erstreckt. Darüber hinaus zeigt die rechte Seite des optischen Mikrokügelchen einen kleinen Divot auf der Oberfläche.
Diskussion
Wie in den Protokollen beschrieben, haben wir eine Plattform, mit dem Gehäuse, um den Silica-Mikrokugeln durch ihre Stämme zu transportieren in der gesamten Prozess-Funktionalisierung. Dieses Gehäuse Plattform wurde als Lösung auf die Oberfläche Verschmutzung und Beschädigung, die aus der Mikrokügelchen in Kontakt mit den Wänden der verschiedenen Behälter während der Funktionalisierung verwendet in Folge erstellt. Wir erkannten die größte Schwierigkeit ergab sich aus ständig Befestigen und Lösen einzelner ...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Autoren danken Prof. Andrea Armani an der University of Southern California für die Unterstützung während der Zeit, dieses Protokoll entwickelt wurde. Die Finanzierung für die anfängliche Entwicklung dieser Arbeit wurde von der National Science Foundation zur Verfügung gestellt [085281 und 1028440] und dem National Institute of Health NIH durch New Innovator Regiepreis Programm [1DP2OD007391-01]. Weitere Informationen erhalten Sie bei http://web.missouri.edu/ hunthk ~ / .
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| Methanol | Fischer | 67-56-1 | ACS-Qualität |
| Schwefelsäure | Fischer | 8014-95-7 | Wütend |
| Wasserstoffperoxid | Fischer | 7722-84-1 | 30 Gew.% |
| Aminopropyltrimethoxysilan | Fischer | 13822-56-5 | |
| NHS-Biotin EZ Linker | Durchstechen | 20217 | |
| Dimethylsulfoxid | Fischer | 67-68-5 | Wasserfrei |
| Fluoresceinisothiocyanat | Durchstechen | 46425 | |
| Phosphate Buffered Saline | Fischer | 7647-14-5 | Pulver-Konzentrat |
| Natriumbicarbonatpuffer | Fischer | NC0099321 | |
| Texas Red - Avidin-Konjugat | Durchstechen | A820 | |
| Optical Fiber | Newport | F-SC | |
| Fiber Stripper | Fiber-Vertrieb | NN-175 | No-Nik Stripper 175 UM |
| Kimwipes | Fischer | 06666A | |
| Bare Fiber Cleaver | Ilsintech | Cl-03A | |
| Glasobjektträger | Fischer | 12-550B | |
| Polypropylen-Vials | Fischer | 03 bis 341-75A | 60 ml, Klappdeckel |
| Inkubation Rocker | VWR | 12620-910 | |
| Vakuumexsikkator | Fischer | 08 bis 594-15B |
Referenzen
- Datar, R. Cantilever Sensors: Nanomechanical Tools for Diagnostics. MRS Bull. 34, 449-454 (2009).
- Hunt, H. K., Armani, A. M. Label-free biological and chemical sensors. Nanoscale. 2, 1544-1559 (2010).
- Sundberg, F., Karlsson, R. Rapid detection and characterization of immune responses using label-free biacore immunoassays. Immunology. 120, 46-47 (2007).
- Hermanson, G. T. . Bioconjugate Techniques. , (2008).
- Bernards, M. T., Cheng, G., Zhang, Z., Chen, S. F., Jiang, S. Y. Nonfouling polymer brushes via surface-initiated, two-component atom transfer radical polymerization. Macromolecules. 41, 4216-4219 (2008).
- Fan, X. D. Sensitive optical biosensors for unlabeled targets: A review. Anal. Chim. Acta. 620, 8-26 (2008).
- Qavi, A. J., Washburn, A. L., Byeon, J. Y., Bailey, R. C. Label-free technologies for quantitative multiparameter biological analysis. Analytical and Bioanalytical Chemistry. 394, 121-135 (2009).
- Hunt, H. K., Soteropulos, C., Armani, A. M. Bioconjugation Strategies for Microtoroidal Optical Resonators. Sensors. 10, 9317-9336 (2010).
- Kalia, J., Raines, R. T. Advances in Bioconjugation. Curr. Org. Chem. 14, 138-147 (2010).
- Matsko, A. B., Savchenkov, A. A., Strekalov, D., Ilchenko, V. S., Maleki, L. Review of Applications of Whispering-Gallery Mode Resonators in Photonics and Nonlinear Optics. IPN Progress Report. , 42-162 (2005).
- Armani, A. M., Kulkarni, R. P., Fraser, S. E., Flagan, R. C., Vahala, K. J. Label-free, single-molecule detection with optical microcavities. Science. 317, 783-787 (2007).
- Zhu, J. On-chip single nanoparticle detection and sizing by mode splitting in an ultrahigh-Q microresonator. Nat. Photon. 4, 122-122 (2010).
- Armani, D. K., Kippenberg, T. J., Spillane, S. M., Vahala, K. J. Ultra-high-Q toroid microcavity on a chip. Nature. 421, 925-928 (2003).
- Vollmer, F., Arnold, S. Whispering-gallery-mode biosensing: label-free detection down to single molecules. Nat. Methods. 5, 591-596 (2008).
- Vollmer, F., Arnold, S., Keng, D. Single virus detection from the reactive shift of a whispering gallery mode. Proc. Natl. Acad. Sci. U.S.A. 105, 20701-20704 (2008).
- Hunt, H. K., Armani, A. M. Recycling microcavity optical biosensors. Opt. Lett. 36, 1092-1094 (2011).
- Soteropulos, C. E., Hunt, H. K., Armani, A. M. Determination of binding kinetics using whispering gallery mode microcavities. Appl. Phys. Lett. 99, 103703-103703 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten