Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Silan Kaplin Ajanlar kullanarak Silika Optik Biyosensörler için Biyolojik Probları takılması
Bu Makalede
Özet
Biyosensörler karmaşık, biyolojik ortamlar ile arayüz ve yüzey modifikasyonu ile sensör takılı derece spesifik problar ile çok hassas sensörler birleştirerek hedeflenen algılaması gerçekleştirmek. Burada, sensör ve biyolojik çevre köprü silan ajanlar kullanılarak biotin ile silika optik sensör yüzeyi fonksiyonlandırmalar göstermektedir.
Özet
Bu tür popüler BIAcore sistemi (Yüzey Plasmon Rezonans (SPR) tekniği dayalı) gibi biyolojik ortamları, biyosensör platformları ile arabirim için, örneğin, yüzey kirlenme önlemek için çeşitli yüzey modifikasyonu teknikleri, faydalanmak, ayar hidrofobiklik / yüzey hidrofiliklik, elektronik ortamlar çeşitli uyum ve en sık, faiz bir hedefe doğru yol özgüllük. 1-5 Bu teknikler gibi, karmaşık ortamlarda gerçek dünya uygulamaları aksi takdirde son derece hassas biyosensör işlevselliğini kan, idrar ve atık su analizi. 2,6-7 gibi BIAcore gibi ticari Biyoalgılayıcı platformlar, iyi anlaşılmış olmakla beraber, gibi yüzey değişiklikleri gerçekleştirmek için standart teknikler, bu tekniklerin diğer standart bir şekilde tercüme edilmemiştir etiket Böyle Galeri Modu (WGM) optik rezonatörler Whispering gibi ücretsiz biyoalgı platformları. 8-9 < / P>
WGM optik rezonatörler ultra düşük konsantrasyonlarda türlerin çok çeşitli etiket serbest tespiti gerçekleştirmek için umut vaat eden bir teknolojiyi temsil 6,10-12 bu platformların yüksek hassasiyet, benzersiz geometrik optik bir sonucudur. WGM optik rezonatörler loğusa dolaşımdaki . Belirli integral rezonans frekanslarda ışık SPR platformları gibi 13, optik alanında tamamen sensör cihazı ile sınırlı değil, evanesces; bu "fani kuyruk" sonra cevresindeki türleri ile etkileşime girebilir. Bu etkileşimin bir miktar ile sonuçlanan, değiştirmek için optik alanı etkili bir şekilde kırılma indisi neden olur, fakat saptanabilir, cihazın rezonans frekansı içinde kayar. Optik alanında dolaşır, çünkü sinyal içsel bir amplifikasyon sonuçlanan çevre ile birçok kez etkileşim ve edebilirsiniz ortamda küçük değişiklikler çok yüksek ışık hassasiyeti. 2,14-15 çadır "> WGM optik rezonatörler çeşitli geometrilerde imal edilebilir olsa da karmaşık ortamlarda hedef tespiti gerçekleştirmek için, bu platformlar yüzey modifikasyonu ile bir sonda molekülü (bağlayıcı bir çift genellikle yarısı, örneğin antikor / antijen). 2 eşleştirilmesi gerekir gelen malzeme sistemleri, çeşitli silis mikroküre en yaygın olanıdır. Bu mikroküreler genellikle mikrosferlerin fonksiyonlandırmalar ve algılama deneyler sırasında ele alınabilir hangi bir "kök" sağlayan fiber optik kablo, ucunda üretilmektedir. Silika yüzey kimyaları olabilir kendi yüzeylerine prob molekülleri bağlamak için uygulanabilir, fakat, düzlemsel yüzeyler için oluşturulan geleneksel teknikler, bu üç boyutlu yapılar için sık olarak yeterli değildir mikrosferler yüzeyinde herhangi bir değişiklik (toz, kirlenme, yüzey hataları ve düzgün olmayan kaplamalar) onların algılama yetenekleri üzerinde ciddi olumsuz sonuçlara yol açabilir. Burada, basit bir yaklaşım sergilemesilika yüzeye biotin takarak, inorganik yüzey ve biyolojik çevre köprü silan coupling ajanlar kullanılarak silika mikroküre WGM optik rezonatörler yüzey fonksiyonlandırmalar için. 8,16 Biz bu raporda sensör sistemi olarak silika mikroküre WGM rezonatörler kullanmalarına rağmen, protokolleri, genel olarak ve biotin ile herhangi bir silika cihazın yüzeyi fonksiyonalize kullanılabilir.
Protokol
1. Arkaplan
Biyotin, basit bir üç aşamalı bir işlemle (Şekil 1) ile bu cihazların yüzeyine bağlanmıştır. İlk olarak, yüzey temizliği ve oksijen plazma veya piranha çözümü birine cihazlar teşhir ederek hidroksil grupları ile doldurmak. İkinci olarak, hidroliz ve kondansasyon reaksiyonu yoluyla hidroksil grubu için bir primer amin ile sonlandırılır silan ajanı eklemek için buhar çöktürme kullanabilir. Üçüncü olarak, N-hidroksisüksinimid (NHS) esteri kimya yoluyla yüzeye biyotin takın. Biz bu tekniklerin seçiminde daha bu tekniklerin gelişimi hakkında bilgi, hem de bir motivasyon açıklaması için bizim daha önceki çalışmalarla ilgilenen okuyucu yönlendirmek. 8
Bu reaksiyonların başarılı olarak biyotin ilave edildikten sonra, primer amin ilave edildikten sonra, optik ve floresans mikroskobu ile değerlendirilebilir. Iken optik mYüzey fonksiyonlandırmalar protokolleri bile mikrosfer yüzeyinde veya kirlenme hasar görmesine neden halinde icroscopy belirlemek için kullanılabilir, floresans mikroskobu biyotin molekülün yüzey kaplama kalitesini ve tekdüzeliği doğrulamak için kullanılır ve aynı zamanda biyotin yeteneği üzerinde olduğu Yüzey (strept) avidin ile bağlamaya. Yüzey üzerine aminlerin kapsama değerlendirmek için, mikrosfer kararlı, kovalent bağı oluşturacak şekilde tiyoüre primer amin ile reaksiyona floresein izotiosiyanat (FITC) floresanslı boya, kullanılan. Avidin ile konjuge olmuştur Texas Red floresanslı boya biyotin-avidin etkileşimi yoluyla yüzeye biyotin grupları etiketlemek için kullanılır. Her iki durumda da, boyalar, bu yüzey üzerindeki fonksiyonel grupları ile (reseptör-ligand etkileşimler veya kovalent bağ yoluyla ya) etkileşime girebilir seçilmiştir.
Burada, üç ayrılan gruplar ve bir fonksiyonel gruba sahip silan ajanı, köprü bahsi sağlarinorganik ve organik yüzey probu molekül Ween. Primer amin işlevselliği istikrarlı amid bağları oluşturmak için NHS esterleri ile niceliksel reaksiyona girer. Bu durumda, valerik olan yan zincir ester grubu, bir NHS ile modifiye edilmiş bir prob biyotin molekülü kullanabilir. Gerçekçi, herhangi bir prob molekülü bir NHS ester grubu, aşağıdaki protokol kullanılarak yüzey eklenebilir. Ayrıca, bu genel protokol, ve biotin ile herhangi bir silika cihazı yüzeyi fonksiyonalize kullanılabilir.
Bu protokol ile primer meydan ziyade silika mikrosferler ile işleme de, kimyası kendisi aslında değildir. Protokolleri boyunca, mikro keskin uçlu bir cımbız ile hafifçe kendi köklerini grapsing tarafından ele alınması gerektiğini unutmayın. Bu iyi uzakta mikroküreler kendilerini cımbız tutar ve adımlar arasında kolay ulaşım sağlar. Aşağıdaki protokol birçok adımları spesifik olarak, bu gerçeği gidermek üzere tasarlanmışya.
2. Microsphere Fabrikasyon
- Mikroküreler için depolama konut oluşturun.
- Bu normal boyutlu bir cam slayt üzerine bandı, ve onun uçları bir rulo oluşturacak şekilde karşılamakla, seloteyip bölümünde 1 ekleyin; * Işıklı bir bıçak kullanarak, kare x 1 1 içine karton kalın parça ¼ cut , kartona.
- Bu mikroküre çevresiyle yükselmiş ve izole edilebilir bir platform oluşturur ve yüzey hasar görmesini önler.
- Makas kullanarak, fiber optik bir makaradan fiber optik bir 3 inçlik bölümü kesti.
- Bir No Nik-lif-sıyırma kullanılarak, silika çekirdek bırakarak, fiberin kesme parçasının ucu son 0,5 inç arasında koruyucu bir polimer kaplama şerit. Bir Kimwipe ile, kalan herhangi bir polimer yüzeyi temizlemek yavaşça Kimwipe ile fiber silerek metanol ile nemlendirilmiş.
- Bir çıplak fiber balta kullanarak, elimden sonuna kadar inci düzeltinsadece yaklaşık 1 azından sıyrılmıştır lif milimetrenin lif ucu üzerinde kalır.
- Dikey onun elimden ucu aşağı bakacak şekilde bu tür lif hizalamak için özen, bir CO2 lazer yolu içine fiber optik elimden sonuna yerleştirin.
- CO2 lazer açın ve fiber optik elimden sonu yüzeyine yöneltmek. Lazer 2 saniye cinsinden yaklaşık% 3.5 gücü kullanılarak bir küre içine lif sıyrılmış ucu erir.
- Cımbız kullanılarak, mikrosfer bir sap (fiber optik olmayan soyulmuş kısım) dikkatli bir şekilde kavramak. Mikroküre konut bant rulo sapı takın. Cam kayar bir petri tabağına kendisi saklanabilir. Bu mikrosfer güvenli depolama için olanak sağlar.
3. Hidroksil grupları ile Yüzey doldurma
- Piranha çözümü kullanma:
- Menteşeli kapaklı 60 ml polipropilen şişe, H dumanlı Hacimce (70:30 bir piranha solüsyon hazırlanır 2 SO 4: sülfirik asit buharı 11.6 mL, ardından şişeye hidrojen peroksit 5 ml ilave edilerek 2 H O 2 (ağırlıkça% 30)). DİKKAT: aside dayanıklı eldiven giyin.
- Flakon için en az 1 mikroküre tutarak, cam slayt aktarın. Mikroküre sıvı ile temas halinde olmalıdır, ancak sıvı karton temas etmemelidir. Gerekirse çözüm ses seviyesini ayarlayın.
- Yavaşça tüpten cam slayt kaldırmak ve DDI H 2 O içeren başka bir plastik şişe takın Örnekleri 5 dakika boyunca çözelti içinde bekletilir.
- Yavaşça tüpten cam kayar kaldırmak ve 80 de 10 dakika boyunca ° C yüzeyi kuru bir fırın yerleştirin.
- Oksijen plazma tedavisi kullanma:
- Oksijen plazma haznesi için en az bir mikrosfer içeren cam kayar transfer edin.
- 200 mTorr için oksijen basıncı ve gücü 120 W 2 mil için oksijen plazma için örnek hassasiyetini ayarlayınnutes.
- Plazma odasından cam slayt çıkarın.
4. Yüzey için Silan Kaplin Ajanlar takılması
- Bir çeker ocak içinde bir vakum desikatöre en az bir mikroküre içeren cam slayt, yerleştirin.
- Ayrıca çeker ocak içinde, silan ajanı şişesi (bu durumda, aminopropyltrimethoxysilane (APTMS) kullanılmıştır) açmak ve desikatörde açılmış şişe yerleştirin.
- Vakum desikatör kapağı değiştirin ve bir aspiratör veya ev vakum hattına çıkış noktası ekleyin.
- Evin vakum veya su hattı açma ve vakum desikatör boşaltın. Bir vakum conta kapak ve tabanı arasında oluşan edildikten sonra, reaksiyon zamanlama başlar. Bu, ince bir film olarak yüzey üzerine silan ajanı yatırılır.
- 15 dakika sonra, vakum kapatın ve yavaş yavaş desikatöre havanın izin port açın. Bu bağlama ajanının için, 15 dakikalık bir unifo oluşturmak için yeterli olduğuyüzey üzerine RM tek tabakalı. Diğer bağlama ajanları için zaman ayarlanabilir gerekebilir.
5.. Yüzey için Biotin takılması
- Yaklaşık bir saat biyotin eklemeden önce, bir menteşeli kapak ile 60 ml polipropilen şişe içinde, susuz dimetilsülfoksit (DMSO) içerisinde N-hydroxylsuccinimide biyotin (NHS-biotin) bir 10 mM solüsyon hazırlanır.
- NHS-biotin soğuk muhafaza edilmiş ise, onu dışarı toplulaştırma önce oda sıcaklığına gelmesini bekleyin.
- Tamamen bir çözücü içinde NHS-biyotin tozu çözünmesi için 1 saat için çözelti sonikasyon.
- Altta mikrosferler ile, bir başka plastik bir şişeye mikrosfer içeren cam kayar transferi ve şişe üstünde kaynaklanmaktadır.
- Cam slayt (o şişeye ilave ediliyor şekilde çözüm mikroküre dokunmaz) arkasında, flakonun tarafı aşağı bir plastik pipet, NHS-biotin çözümü için uygun bir hacim kullanarak aktar. Amikroküre yüzeyini kapsayacak şekilde dd yeterli bir çözüm.
- , Sırasıyla, 5 rpm ve 5 derecede hız ve eğim açısı ile, oda sıcaklığında 30 dakika süreyle bir çalkalayıcı inkübatöründe üzerine DMSO çözelti içinde mikrosferler ile NHS-biotin ihtiva eden şişeler (eğim tepsi) yerleştirin.
- Yavaşça tüpten cam slayt kaldırın ve yavaşça DDI H 2 O dolu bir başka flakon içine kaydırın Daha önce olduğu gibi aynı hız ve eğim açısı az bir 10 dakika tilt tepsisine şişe yerleştirin. Tatlı su ile iki kez, her zaman bu adımı yineleyin. Bu yüzey aşırı DMSO temizlenmesine yardımcı olur ve yüzey aslında greft vermedi herhangi bir fiziksel adsorbe biotin kaldırır.
- Tüpten cam slayt çıkarın ve bütün su damlacıkları yüzeye çıkarılır ° C'de 10 dakika kadar veya 80 fırında koyun.
6. Amin sonlandırılmış silika Floresan etiketleme
- Treatm sonra mevcut amin grupları etiketlemek içinAPTMS ile ent, 1 ml susuz DMSO 1 mg FITC eriterek karanlık bir odada FITC solüsyon hazırlanır.
- 0.1 M sodyum bikarbonat tampon ile 1 mL çözelti FITC 50 uL ilave edilerek 6.1 'çözeltisi ile seyreltilir.
- Menteşeli kapaklı 60 ml polipropilen şişe içinde çözüm yerleştirin ve yavaşça şişeye cam slayt tekrar ev sahipliği amin sonlandırmalı mikroküreler, kaydırın.
- Bir buz banyosu içinde şişeye yerleştirmek, ve örnek 4 saat karanlık olarak en az FITC çözeltisi ile reaksiyona olanak sağlar.
- Sodyum karbonat tampon içinde mikrosferler iki, 10 dakikalık bir durulama ile aşırı fluorofor çıkarın. Daha önce olduğu gibi, tampon olan menteşeli kapaklı 60 ml polipropilen şişe doldurun ve yavaşça çözüm sadece mikroküre değil, karton konut kapsadığını bakımı, çözüm içine cam slayt kaydırın. Alüminyum folyo ile kapatın flakon ve daha önce olduğu gibi, 5 derece ve 5 devirde ayarlanmış bir eğim tepsisine şişe yerleştirin.
- Yavaşça tüpten cam slayt kaldırın ve yavaşça DDI H 2 O ile dolu ve alüminyum folyo ile kaplanmış başka bir şişe içine kaydırın. Daha önce olduğu gibi aynı hız ve eğim açısı az bir 10 dakika tilt tepsisine şişe yerleştirin. Tatlı su ile iki kez, her zaman bu adımı yineleyin. Bu yüzey ila aşırı boya temizlenmesine yardımcı olur.
- Yavaşça görüntüleme önce 10 dakika süreyle 80 C ayarlanmış fırında tüpten cam slayt çıkarın ve kuru.
7. Biotin sonlandırılmış silika Floresan etiketleme
- Fosfat Teksas-Kırmızı avidin bir 10 mcg / mL tamponlu tuz çözeltisi hazırlayın.
- Menteşeli kapaklı 60 ml polipropilen flakonuna çözüm ekleyin ve hafifçe mikroküre sadece çözüm ile kaplıdır, böylece çözümün bir biotin sonlandırılmış mikroküre içeren cam slayt kaydırın.
- Karanlık oda sıcaklığında 30 dakika süreyle reaksiyona girerler.
- İki sayesinde aşırı fluorofor çıkarın, 10 dakika yıkayınPBS tampon içinde mikro s.
- Daha önce olduğu gibi, tampon olan menteşeli kapaklı 60 ml polipropilen şişe doldurun ve yavaşça çözüm sadece mikroküre değil, karton konut kapsadığını bakımı, çözüm içine cam slayt kaydırın.
- Alüminyum folyo ile kapatın flakon ve daha önce olduğu gibi, 5 derece ve 5 devirde ayarlanmış bir eğim tepsisine şişe yerleştirin.
- Yavaşça tüpten cam slayt kaldırın ve yavaşça DDI H 2 O ile dolu ve alüminyum folyo ile kaplanmış başka bir şişe içine kaydırın. Daha önce olduğu gibi aynı hız ve eğim açısı az bir 10 dakika tilt tepsisine şişe yerleştirin. Tatlı su ile iki kez, her zaman bu adımı yineleyin. Bu yüzey ila aşırı boya temizlenmesine yardımcı olur.
- Yavaşça 80 ayarlanmış fırında ° C görüntüleme önce 10 dakika içinde tüpten cam slayt çıkarın ve kuru.
8. Temsilcisi Sonuçlar
Doğru fonksiyonelleştirilmiş mikroküres optik ve floresan mikroskobu ile tespit edilebilir. Yüzey fonksiyonlandırmalar doğru yapılırsa, bu yüzey üzerinde biyotin molekülleri eşit bir biçimde yoğun kapsama neden olmalı ve yüzey kalmalıdır hatasız ve kirletici içermeyen fonksiyonlandırmalar sonra algılama deneyler sırasında yüksek hassasiyetleri korumak için. Optik mikroskop mikroskop yüzey kaplama kalitesini ve tekdüzeliği yoklamak olurken, ikinci araştırılması için de kullanılabilir. Şekil 2, bu düzgün fonksiyonelleştirilmiş mikrosferler örnekleri gösterirler. Bu görüntüler mikrosferler yüzeyinde amin gruplarının (Şekil 2b) ya da biyotin grupları (Şekil 2C) ya da üniform bir tutarlı kaplama göstermektedir ki herhangi bir yüzey hasarı veya fonksiyonlandırmalar (Şekil 2a) bağlı kirlenme olduğunu göstermektedir, ve .
Mikroküreler doğru fonksiyonelleştirilmiş henüz, optik mikroküre görüntüleri wiyüzey kirliliği, topaklanma veya düzgün olmayan kapsam ve yüzey çatlakları gibi yüzey bariz kusurları, (Şekil 3) sergilerler edeceğiz. Burada, yüzey üzerinde reaktiflerin topaklanma kaynaklanan yüzey kirlenme ortak bir örneği, bkz.
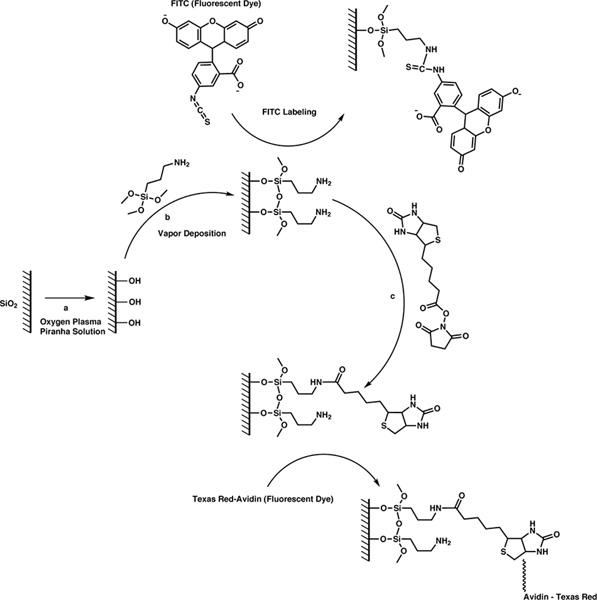
Şekil 1. Silika mikroküre yüzeyine prob moleküllerinin takmak için 3 aşamalı bir reaksiyon şeması. büyük rakam görmek için buraya tıklayın .
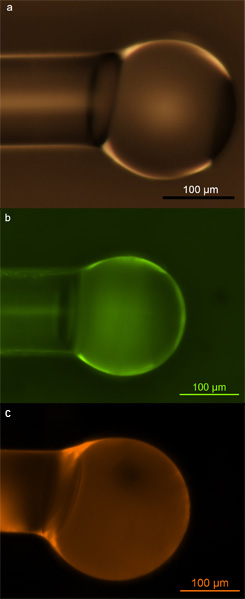
Şekil 2. Silika mikroküreler. silika mikroküre a) Optik mikrografı oksijen plazma maruz kalma yoluyla hidroksil grupları ile doldurulur b) silika mikroküre arasında Floresan mikrografı birincil aminler ile doldurulur ve FITC boya ile işaretlenmiştir; silika mi c) Floresan mikrografıcrosphere biotin ile doldurulur ve Texas Kırmızı-avidin konjuge etiketlenir. Soteropulos izniyle, CE, Hunt, HK ve Armani, fısıldayan galeri modu mikro kavitasyonlar kullanarak bağlama kinetiği AM. Uyg. Fiz. Lett. 99, 103.703-103.703 (2011). Copyright 2011, Fizik Amerikan Enstitüsü. 17

Şekil 3. Yanlış fonksiyonelleştirilmiş kürenin Optik mikrografı. Burada, sağ üst yüzeyinde toz görmek, gibi bulaşma yüzeyinden uzanan olabilir. Buna ek olarak, optik mikrosfer sağ tarafında yüzeyi üzerinde küçük bir çimen gösterir.
Tartışmalar
Protokolleri açıklandığı gibi, biz hangi fonksiyonlandırmalar süreç boyunca kendi saplarla silika mikrosferlerin taşımak için bir yuva platformu oluşturulmuştur. Bu konut platformu fonksiyonlandırmalar sürecinde kullanılan çeşitli kapların duvarları ile temas mikroküre kaynaklanan yüzey kirlenme ve hasar için bir çözüm olarak oluşturuldu. Biz sürekli fonksiyonlandırmalar sürecinde farklı kaplarda bireysel mikroküreler bağlama ve ayırma kaynaklanıyordu ana zorluk gerçekleştirdi. Bu g?...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Yazarlar minnetle bu protokol geliştirilmiştir süre içinde destek için Güney Kaliforniya Üniversitesi'nden Prof Andrea Armani kabul ediyorsunuz. Bu çalışmanın ilk geliştirme finansmanı Ulusal Bilim Vakfı tarafından sağlandı [085.281 ve 1.028.440] ve Ulusal Sağlık Enstitüsü Direktörü Yeni Yenilikçisi Ödülü Programı ile Ulusal Sağlık Enstitüsü [1DP2OD007391-01]. Ek bilgiler mevcuttur http://web.missouri.edu/ ~ hunthk / .
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | Yorumlar |
| Metanol | Balıkçı | 67-56-1 | ACS notu |
| Sülfürik Asit | Balıkçı | 8014-95-7 | Tütsülenmiş |
| Hidrojen peroksit | Balıkçı | 7722-84-1 | Ağırlıkça% 30 |
| Aminopropyltrimethoxysilane | Balıkçı | 13822-56-5 | |
| NHS-biotin EZ linker | Delmek | 20217 | |
| Dimetilsülfoksit | Balıkçı | 67-68-5 | Susuz |
| Floresein izotiyosiyanat | Delmek | 46425 | |
| Fosfat Tamponlu Salin | Balıkçı | 7647-14-5 | Toz konsantre |
| Sodyum Bikarbonat Tampon | Balıkçı | NC0099321 | |
| Texas Kırmızı - Avidin Konjuge | Delmek | A820 | |
| Fiber Optik | Newport | F-SC | |
| Fiber Stripper | Fiber Enstrüman Satış | NN-175 | No-Nik 175 um striptizci |
| Kimwipes | Balıkçı | 06666A | |
| Çıplak Fiber Cleaver | ILSINTECH | Cl-03A | |
| Cam Mikroskop Slaytlar | Balıkçı | 12-550B | |
| Polipropilen Flakon | Balıkçı | 03-341-75A | 60 ml, menteşeli kapak |
| Rocker kuluçkaya | VWR | 12620-910 | |
| Vakum Desikatör | Balıkçı | 08-594-15B |
Referanslar
- Datar, R. Cantilever Sensors: Nanomechanical Tools for Diagnostics. MRS Bull. 34, 449-454 (2009).
- Hunt, H. K., Armani, A. M. Label-free biological and chemical sensors. Nanoscale. 2, 1544-1559 (2010).
- Sundberg, F., Karlsson, R. Rapid detection and characterization of immune responses using label-free biacore immunoassays. Immunology. 120, 46-47 (2007).
- Hermanson, G. T. . Bioconjugate Techniques. , (2008).
- Bernards, M. T., Cheng, G., Zhang, Z., Chen, S. F., Jiang, S. Y. Nonfouling polymer brushes via surface-initiated, two-component atom transfer radical polymerization. Macromolecules. 41, 4216-4219 (2008).
- Fan, X. D. Sensitive optical biosensors for unlabeled targets: A review. Anal. Chim. Acta. 620, 8-26 (2008).
- Qavi, A. J., Washburn, A. L., Byeon, J. Y., Bailey, R. C. Label-free technologies for quantitative multiparameter biological analysis. Analytical and Bioanalytical Chemistry. 394, 121-135 (2009).
- Hunt, H. K., Soteropulos, C., Armani, A. M. Bioconjugation Strategies for Microtoroidal Optical Resonators. Sensors. 10, 9317-9336 (2010).
- Kalia, J., Raines, R. T. Advances in Bioconjugation. Curr. Org. Chem. 14, 138-147 (2010).
- Matsko, A. B., Savchenkov, A. A., Strekalov, D., Ilchenko, V. S., Maleki, L. Review of Applications of Whispering-Gallery Mode Resonators in Photonics and Nonlinear Optics. IPN Progress Report. , 42-162 (2005).
- Armani, A. M., Kulkarni, R. P., Fraser, S. E., Flagan, R. C., Vahala, K. J. Label-free, single-molecule detection with optical microcavities. Science. 317, 783-787 (2007).
- Zhu, J. On-chip single nanoparticle detection and sizing by mode splitting in an ultrahigh-Q microresonator. Nat. Photon. 4, 122-122 (2010).
- Armani, D. K., Kippenberg, T. J., Spillane, S. M., Vahala, K. J. Ultra-high-Q toroid microcavity on a chip. Nature. 421, 925-928 (2003).
- Vollmer, F., Arnold, S. Whispering-gallery-mode biosensing: label-free detection down to single molecules. Nat. Methods. 5, 591-596 (2008).
- Vollmer, F., Arnold, S., Keng, D. Single virus detection from the reactive shift of a whispering gallery mode. Proc. Natl. Acad. Sci. U.S.A. 105, 20701-20704 (2008).
- Hunt, H. K., Armani, A. M. Recycling microcavity optical biosensors. Opt. Lett. 36, 1092-1094 (2011).
- Soteropulos, C. E., Hunt, H. K., Armani, A. M. Determination of binding kinetics using whispering gallery mode microcavities. Appl. Phys. Lett. 99, 103703-103703 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır