È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Collegamento sonde biologiche ai biosensori ottici che utilizza silice agenti di accoppiamento silanici
In questo articolo
Riepilogo
Biosensori interfacciarsi con ambienti complessi e biologici ed eseguire il rilevamento mirato alla combinazione di sensori altamente sensibili con sonde altamente specifici collegati al sensore tramite modifica della superficie. Qui, dimostriamo il funzionalizzazione superficiale di silice sensori ottici con biotina mediante agenti di accoppiamento silanici per colmare il sensore e l'ambiente biologico.
Abstract
Al fine di interfacciarsi con ambienti biologici, piattaforme biosensore, come il sistema popolare Biacore (basata sulla superficie Plasmon Resonance (SPR) tecnica), utilizzare varie tecniche modificazione superficiale, che possono, per esempio, impediscono incrostazione superficie, sintonizzare l' idrofobicità / idrofilicità della superficie, adattarsi ad una varietà di ambienti elettronici, e più frequentemente, inducono specificità verso un obiettivo di interesse. 1-5 Queste tecniche estendere la funzionalità dei biosensori altrimenti altamente sensibili per applicazioni reali in ambienti complessi, tale come il sangue, urine, e l'analisi delle acque reflue. 2,6-7 Mentre biosensori piattaforme commerciali, come Biacore, hanno ben capito, le tecniche standard per l'esecuzione di tali modifiche superficiali, queste tecniche non sono stati tradotti in modo standardizzato per altre etichette libere piattaforme di biosensori, come Whispering Galleria modalità (WGM) risonatori ottici. 8-9 < / P>
Risonatori WGM ottiche rappresentano una tecnologia promettente per l'esecuzione di label-free rilevamento di una grande varietà di specie a ultra-basse concentrazioni 6,10-12 L'elevata sensibilità di queste piattaforme è il risultato delle loro ottiche geometriche uniche:. Ottica risonatori WGM confine circolazione . luce a specifici, frequenze di risonanza integrali 13 Come il piattaforme SPR, il campo ottico non è completamente chiuso al dispositivo sensore, ma evanesces, questa "coda evanescente" può quindi interagire con specie nell'ambiente circostante. Questa interazione provoca l'indice di rifrazione efficace del campo ottico di cambiare, causando un leggero, ma rilevabile, spostare la frequenza di risonanza del dispositivo. Poiché il campo ottico circola, può interagire più volte con l'ambiente, con conseguente amplificazione intrinseca del segnale, e altissima sensibilità alle minime variazioni nell'ambiente. 2,14-15 tenda "> Per eseguire il rilevamento mirato in ambienti complessi, queste piattaforme deve essere abbinata a una molecola sonda (di solito una metà di una coppia di legame, ad esempio gli anticorpi / antigeni) attraverso la modifica della superficie. 2 Sebbene risonatori WGM ottici possono essere fabbricate in geometrie diverse da una varietà di sistemi materiali, la microsfere di silice è la più comune. Queste microsfere sono generalmente fabbricati sull'estremità di una fibra ottica, che fornisce un "gambo" con cui le microsfere possono essere movimentato durante gli esperimenti di funzionalizzazione e di rilevamento. chimiche superficiali silice può essere applicato per attaccare molecole sonda alle loro superfici, tuttavia, le tecniche tradizionali generati per substrati planari spesso non sono sufficienti per queste strutture tridimensionali, eventuali modifiche alla superficie delle microsfere (polvere, contaminazione, difetti superficiali, e rivestimenti irregolari) possono avere gravi, conseguenze negative sulla loro capacità di rilevazione. Qui, dimostriamo un approccio facileper la funzionalizzazione superficiale di microsfere di silice WGM risonatori ottici che utilizzano agenti di accoppiamento silanici per colmare il superficie inorganica e l'ambiente biologico, collegando biotina alla superficie della silice. 8,16 Sebbene usiamo silice risonatori WGM microsfere come il sistema sensore in questa relazione, i protocolli sono generale e può essere utilizzato per funzionalizzare la superficie di qualsiasi dispositivo di silice con biotina.
Protocollo
1. Fondo
La biotina è attaccata alla superficie di questi dispositivi tramite un semplice processo in tre fasi (Figura 1). Per prima cosa, pulire la superficie e popolarlo con gruppi ossidrilici esponendo i dispositivi a uno plasma di ossigeno o di una soluzione piranha. In secondo luogo, usiamo deposizione di vapore per collegare l'agente di accoppiamento di silano terminati con un'ammina primaria ai gruppi ossidrilici mediante idrolisi e reazione di condensazione. In terzo luogo, ci attacchiamo biotina in superficie attraverso N-idrossisuccinimide (NHS) chimica estere. Noi indirizzare il lettore interessato al nostro lavoro precedente per ulteriori informazioni sullo sviluppo di queste tecniche, così come una spiegazione della nostra motivazione per la scelta di queste tecniche. 8
Il successo di queste reazioni può essere valutata mediante microscopia ottica e fluorescenza dopo l'aggiunta di ammina primaria, così come dopo l'aggiunta della biotina. Mentre m otticaicroscopy può essere utilizzato per determinare se i protocolli superficie funzionalizzazione provoca un danno alla superficie microsfere, o contaminazione, la microscopia a fluorescenza viene utilizzato per verificare la qualità ed uniformità di copertura della superficie della molecola biotina, come pure la capacità della biotina sulla la superficie di legarsi con (strept) avidina. Per valutare la copertura di ammine sulla superficie, abbiamo usato isotiocianato di fluoresceina (FITC) colorante fluorescente, che reagisce con ammine primarie per formare stabile, legame covalente tiourea al microsfere. Texas Red colorante fluorescente che è stato coniugato ad avidina viene utilizzato per etichettare i gruppi biotina sulla superficie attraverso l'interazione biotina-avidina. In entrambi i casi, sono stati scelti coloranti che possono interagire (attraverso sia recettore-ligando interazioni o legame covalente) con i gruppi funzionali sulla superficie.
Qui, l'agente di accoppiamento silanico, che ha tre gruppi uscenti e un gruppo funzionale, fornisce la scommessa ponteWeen la superficie inorganica e sonda molecola organica. La funzionalità ammina primaria reagisce quantitativamente con gli esteri NHS di formare legami ammidici stabili. In questo caso, si utilizza una molecola sonda biotina cui catena laterale valerico è stato modificato con un gruppo estere NHS. Realisticamente, qualsiasi molecola sonda alla quale un gruppo estere NHS può essere aggiunto alla superficie mediante i seguenti protocolli. Inoltre, questi protocolli sono generale, e può essere utilizzato per funzionalizzare qualsiasi superficie periferica silice con biotina.
Il problema principale con questi protocolli non è effettivamente nella stessa chimica, ma piuttosto nella gestione di microsfere di silice. Si prega di notare che, nel corso dei protocolli, le microsfere devono essere gestiti da grapsing loro steli leggermente con acuminati pinzette. Ciò mantiene le pinzette ben lontano dagli stessi microsfere, e consente un facile trasporto tra i passaggi. Molti passi nel protocollo di seguito sono specificamente progettate per affrontare questo fattoo.
2. Microsfera Fabrication
- Costruire l'alloggiamento di archiviazione per le microsfere.
- Utilizzando un coltello exacto, tagliare un ¼ in grosso pezzo di cartone in un 1 in x 1 in piazza, su un nastro di questo di dimensioni regolari vetrino, e allegare un 1 nella sezione di nastro adesivo, con le sue estremità incontrano per formare un rotolo , al cartone.
- Questo crea una piattaforma su cui il microsfere può essere elevata e isolato dall'ambiente circostante, e previene i danni alla loro superficie.
- Utilizzando forbici, tagliare una sezione 3 pollici di fibra ottica da una bobina di fibra ottica.
- Utilizzo di un n-Nik fibra-stripper, spelare il rivestimento protettivo polimerico dagli ultimi 0,5 pollici dalla fine del pezzo tagliato di fibra, lasciando solo il nucleo di silice. Pulire la superficie di un polimero rimanente con un Kimwipe inumidito con metanolo strofinando delicatamente la fibra con il Kimwipe.
- Utilizzando una fibra nuda mannaia, tagliare l'estremità in modo spogliato °a solo circa 1 millimetro di fibra spogliato rimane sulla estremità della fibra.
- Posizionare l'estremità scoperta della fibra ottica nel percorso di un laser CO 2, avendo cura di allineare verticalmente la fibra in modo tale che la sua fine così estratto è rivolto verso il basso.
- Accendere il laser CO 2, e indirizzarla verso la superficie della estremità scoperta della fibra ottica. Il laser si scioglierà alla fine spogliato della fibra in una sfera con circa il 3,5% di potenza in 2 secondi.
- Con una pinzetta, accuratamente afferrare lo stelo (non-spoglia porzione della fibra ottica) della microsfera. Fissare lo stelo al rotolo di nastro sul corpo microsfere. Il vetrino può essere essa stessa immagazzinata in una capsula di Petri. Questo permette di memorizzare sicurezza della microsfera.
3. Popolare la superficie con gruppi idrossilici
- Con la soluzione di piranha:
- In un flacone in polipropilene da 60 ml con tappo a cerniera, preparare una soluzione piranha (70:30 in volume fumante H 2 SO 4: H 2 O 2 (30% in peso)) aggiungendo 5 ml di perossido di idrogeno al flacone, seguiti da 11,6 mL di acido solforico fumante. ATTENZIONE: indossare guanti resistenti agli acidi.
- Trasferire il vetrino, tenendo almeno 1 microsfere, nella fiala. La microsfera deve essere in contatto con il liquido, ma il liquido non deve toccare il cartone. Regolare il volume della soluzione, se necessario.
- Rimuovere delicatamente il vetrino dalla fiala, e inserirlo in un altro flacone di plastica contenente DDI H 2 O. Sia i campioni siedono nella soluzione per 5 minuti.
- Rimuovere delicatamente il vetrino dalla fiala, e posizionarlo un forno a 80 ° C per 10 minuti per asciugare la superficie.
- Utilizzando il trattamento di plasma di ossigeno:
- Trasferire il vetrino contenente almeno un microsfere alla camera di plasma di ossigeno.
- Impostare la pressione di ossigeno di 200 mTorr, e la potenza di 120 W. esporre il campione al plasma di ossigeno per 2 minuti.
- Rimuovere il vetrino dalla camera di plasma.
4. Collegamento agenti di accoppiamento di silano alla superficie
- Posizionare il vetrino, contenente almeno un microsfere, in un essiccatore a vuoto in una cappa aspirante.
- Anche nella cappa, aprire il flacone agente di accoppiamento silano (in questo caso, amminopropiltrimetossisilano (APTMS) è stato utilizzato), e posizionare la bottiglia aperta in un essiccatore.
- Sostituire il coperchio sulla essiccatore a vuoto, e collegare la porta di uscita ad un aspiratore o sottovuoto linea di casa.
- Accendere il vuoto casa o la linea di galleggiamento, e evacuare la essiccatore sotto vuoto. Una volta che una tenuta a vuoto è formata tra il coperchio e la base, la reazione inizia temporizzazione. Ciò depositare l'agente di accoppiamento di silano sulla superficie come una pellicola sottile.
- Dopo 15 minuti, spegnere il vuoto, e lentamente aprire la porta per far entrare aria in un essiccatore. Per questo agente di accoppiamento, 15 minuti è sufficiente per formare una uniform monostrato sulla superficie. Per gli altri agenti di accoppiamento, il tempo può essere necessario regolare.
5. Collegamento Biotin alla superficie
- Circa un'ora prima di attaccare la biotina, preparare una soluzione 10 mM di N-hydroxylsuccinimide biotina (NHS-biotina) in dimetilsolfossido anidro (DMSO) in una fiala polipropilene 60 mL con un coperchio incernierato.
- Se l'NHS-biotina è stato memorizzato bassa temperatura, lasciarla a temperatura ambiente prima di volumetrie fuori.
- Sonicare la soluzione per 1 ora per dissolvere completamente il NHS-biotina polvere con il solvente.
- Trasferire il vetrino contenente microsfere in un'altra fiala di plastica, con le microsfere in basso, e deriva in parte superiore del flacone.
- Trasferimento, usando una pipetta di plastica, un volume appropriato di NHS-biotina soluzione lungo il lato del flacone, dietro il vetrino (quindi la soluzione non tocchi la microsfera mentre viene aggiunto alla fiala). Add soluzione sufficiente a coprire la superficie delle microsfere.
- Posizionare le fiale contenenti ora le microsfere e NHS-biotina in soluzione di DMSO in un incubatore a dondolo (vassoio oscillante) per 30 minuti a temperatura ambiente, con la velocità e l'angolo di inclinazione a 5 rpm e 5 gradi, rispettivamente.
- Rimuovere delicatamente il vetrino dalla fiala, e dolcemente scivolare in un altro flacone pieno di DDI H 2 O. Posizionare il flaconcino sul vassoio oscillante per altri 10 minuti alla stessa velocità e angolo di inclinazione come prima. Ripetere questa operazione due volte con acqua fresca ogni volta. Questo aiuta a rimuovere il DMSO in eccesso dalla superficie, e rimuove qualsiasi fisicamente adsorbito biotina che non ha in realtà innesto alla superficie.
- Rimuovere il vetrino dalla fiala, e posizionarlo in un forno a 80 ° C per 10 minuti, o fino a quando tutte le goccioline d'acqua vengono rimosse dalla superficie.
6. Marcatura fluorescente di ammino-terminato silice
- Per etichettare i gruppi amminici presenti dopo il trattament con APTMS, preparare la soluzione FITC in una stanza buia, sciogliendo FITC 1 mg in 1 ml di DMSO anidro.
- Diluire la soluzione in 6,1 aggiungendo 50 pl della soluzione FITC ad 1 ml di tampone bicarbonato di sodio 0,1 M.
- Posizionare la soluzione in un flacone polipropilene 60 mL con un tappo incernierato, e far scorrere il ammino-terminato microsfere, alloggiato nuovamente sul vetrino, nel flacone.
- Porre la fiala in un bagno di ghiaccio, e lasciare che il campione di reagire con la soluzione di FITC per un minimo di 4 ore al buio.
- Rimuovere fluoroforo eccesso attraverso due risciacqui, 10 minuti di microsfere in tampone carbonato di sodio. Come prima, una cuvetta 60 mL di polipropilene con un tappo incernierato con il tampone, e far scorrere il vetrino nella soluzione, avendo cura che la soluzione copre solo il microsfere, e non l'alloggiamento cartone. Coprire la fiala con un foglio di alluminio, e posizionare il flaconcino su un vassoio tilt fissato a 5 gradi e 5 giri, come prima.
- Rimuovere delicatamente il vetrino dalla fiala, e dolcemente scivolare in un altro flacone pieno di DDI H 2 O e coperto con un foglio di alluminio. Posizionare il flaconcino sul vassoio oscillante per altri 10 minuti alla stessa velocità e angolo di inclinazione come prima. Ripetere questa operazione due volte con acqua fresca ogni volta. Questo aiuta a rimuovere il colorante in eccesso dalla superficie.
- Rimuovere delicatamente il vetrino dalla fiala, e secco in un forno a 80 ° C per 10 minuti prima di imaging.
7. Marcatura fluorescente di biotina-terminato silice
- Preparare un 10 pg / mL di soluzione Texas Red-avidina in salina tamponata con fosfato.
- Aggiungere la soluzione ad una fiala di polipropilene da 60 ml con un tappo incernierato, e far scorrere il vetrino contenente un biotina terminazione microsfere nella soluzione, in modo che la microsfera è appena coperto dalla soluzione.
- Reagire per 30 minuti a temperatura ambiente al buio.
- Rimuovere fluoroforo in eccesso attraverso due, 10 minuti risciacquares delle microsfere in tampone PBS.
- Come prima, una cuvetta 60 mL di polipropilene con un tappo incernierato con il tampone, e far scorrere il vetrino nella soluzione, avendo cura che la soluzione copre solo il microsfere, e non l'alloggiamento cartone.
- Coprire la fiala con un foglio di alluminio, e posizionare il flaconcino su un vassoio tilt fissato a 5 gradi e 5 giri, come prima.
- Rimuovere delicatamente il vetrino dalla fiala, e dolcemente scivolare in un altro flacone pieno di DDI H 2 O e coperto con un foglio di alluminio. Posizionare il flaconcino sul vassoio oscillante per altri 10 minuti alla stessa velocità e angolo di inclinazione come prima. Ripetere questa operazione due volte con acqua fresca ogni volta. Questo aiuta a rimuovere il colorante in eccesso dalla superficie.
- Rimuovere delicatamente il vetrino dalla fiala, e secco in forno a 80 ° C per 10 minuti prima di imaging.
8. Risultati rappresentativi
Microsfere correttamente funzionalizzatis possono essere identificati mediante microscopia ottica ea fluorescenza. Se la superficie funzionalizzazione viene eseguita correttamente, dovrebbe risultare in una copertura uniforme densa di molecole di biotina sulla superficie, e la superficie deve rimanere difetto-e-contaminante libero dopo funzionalizzazione al fine di mantenere la loro sensibilità elevata durante gli esperimenti di rilevamento. Microscopia ottica può essere usato per sondare quest'ultimo, mentre microscopia fluorescente può sondare la qualità e l'uniformità di superficie della copertura. Nella figura 2, mostriamo alcuni esempi di corretta funzionalizzata microsfere. Queste immagini dimostrano che non vi è alcun danno superficiale o contaminazione dovuta alla funzionalizzazione (Fig. 2a), e che le microsfere mostrano una uniforme, copertura coerente delle gruppi amminici (Fig. 2b) o gruppi biotina (Fig. 2c) sulla superficie .
Se le microsfere non sono stati funzionalizzati correttamente, il microsfere ottico immagini will presentano contaminazione superficiale, la copertura aggregazione o non uniforme, e difetti evidenti nella superficie, come crepe superficiali (Figura 3). Qui vediamo un esempio tipico di contaminazione superficiale, derivante da aggregazione dei reagenti sulla superficie.
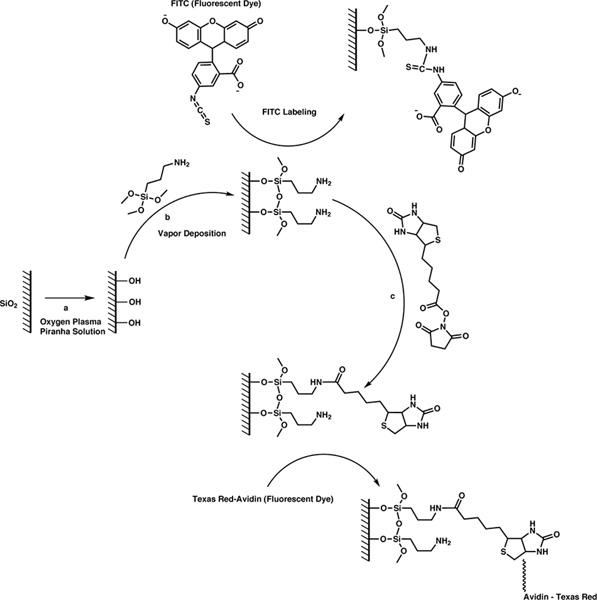
Figura 1. 3-step schema di reazione per attaccare molecole sonda sulla superficie di microsfere di silice. Clicca qui per ingrandire la figura .
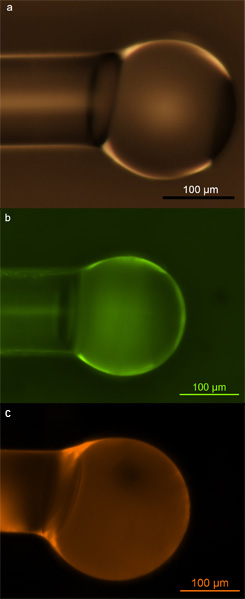
Figura 2. Microsfere di silice. a) micrografia ottica di microsfere di silice popolato con gruppi idrossilici attraverso l'esposizione al plasma di ossigeno; b) Micrografia fluorescente di microsfere di silice popolato con ammine primarie e marcato con FITC colorante; c) Micrografia fluorescente di silice microsphere popolato con biotina ed etichettate con Texas Red-avidina coniugato. Ristampato con il permesso Soteropulos, CE, Hunt, HK & Armani, AM Determinazione della cinetica di legame con sussurrano microcavità modalità galleria. Appl. Phys. Lett. 99., 103.703-103.703 (2011). Copyright 2011, American Institute of Physics 17.

Figura 3. Micrografia ottica della sfera impropriamente funzionalizzata. Qui, potete vedere la polvere sulla superficie in alto a destra, così come la contaminazione si estende dalla superficie. Inoltre, il lato destro della microsfera ottico mostra una zolla piccolo sulla superficie.
Discussione
Come descritto nei protocolli, abbiamo creato una piattaforma alloggiamento per cui il trasporto di silice microsfere dai gambi durante il processo di funzionalizzazione. Questa piattaforma alloggiamento è stato creato come una soluzione per la contaminazione superficiale e danni che il risultato della microsfera venire in contatto con le pareti dei vari contenitori utilizzati durante il processo di funzionalizzazione. Ci siamo resi conto della difficoltà principale nasce dalla sempre attaccare e staccare i singoli mi...
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Gli autori ringraziano il Prof. Andrea Armani presso la University of Southern California per il supporto durante il periodo è stato sviluppato questo protocollo. I finanziamenti per lo sviluppo iniziale di questo lavoro è stato fornito dal National Science Foundation [085281 e 1028440] e il National Institute of Health tramite il programma New Innovator Award direttore del NIH [1DP2OD007391-01]. Ulteriori informazioni sono disponibili presso http://web.missouri.edu/ hunthk ~ / .
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | Comments |
| Metanolo | Pescatore | 67-56-1 | ACS grade |
| Acido solforico | Pescatore | 8014-95-7 | Fumante |
| Perossido di idrogeno | Pescatore | 7722-84-1 | 30 wt% |
| Aminopropyltrimethoxysilane | Pescatore | 13822-56-5 | |
| NHS-biotina EZ linker | Perforare | 20217 | |
| Dimetilsulfossido | Pescatore | 67-68-5 | Anidro |
| Fluoresceina isotiocianato | Perforare | 46425 | |
| Soluzione tampone fosfato | Pescatore | 7647-14-5 | Polvere concentrato |
| Bicarbonato di Sodio Buffer | Pescatore | NC0099321 | |
| Texas Red - Avidin coniugato | Perforare | A820 | |
| Fibra Ottica | Newport | F-SC | |
| Fiber Stripper | Fibra strumento di vendita | NN-175 | No-Nik 175 um stripper |
| Kimwipes | Pescatore | 06666A | |
| Bare Fiber Cleaver | Ilsintech | Cl-03A | |
| Vetro vetrini | Pescatore | 12-550B | |
| Vials in polipropilene | Pescatore | 03-341-75A | 60 ml, tappo a cerniera |
| Incubazione Rocker | VWR | 12620-910 | |
| Vacuum Essiccatore | Pescatore | 08-594-15B |
Riferimenti
- Datar, R. Cantilever Sensors: Nanomechanical Tools for Diagnostics. MRS Bull. 34, 449-454 (2009).
- Hunt, H. K., Armani, A. M. Label-free biological and chemical sensors. Nanoscale. 2, 1544-1559 (2010).
- Sundberg, F., Karlsson, R. Rapid detection and characterization of immune responses using label-free biacore immunoassays. Immunology. 120, 46-47 (2007).
- Hermanson, G. T. . Bioconjugate Techniques. , (2008).
- Bernards, M. T., Cheng, G., Zhang, Z., Chen, S. F., Jiang, S. Y. Nonfouling polymer brushes via surface-initiated, two-component atom transfer radical polymerization. Macromolecules. 41, 4216-4219 (2008).
- Fan, X. D. Sensitive optical biosensors for unlabeled targets: A review. Anal. Chim. Acta. 620, 8-26 (2008).
- Qavi, A. J., Washburn, A. L., Byeon, J. Y., Bailey, R. C. Label-free technologies for quantitative multiparameter biological analysis. Analytical and Bioanalytical Chemistry. 394, 121-135 (2009).
- Hunt, H. K., Soteropulos, C., Armani, A. M. Bioconjugation Strategies for Microtoroidal Optical Resonators. Sensors. 10, 9317-9336 (2010).
- Kalia, J., Raines, R. T. Advances in Bioconjugation. Curr. Org. Chem. 14, 138-147 (2010).
- Matsko, A. B., Savchenkov, A. A., Strekalov, D., Ilchenko, V. S., Maleki, L. Review of Applications of Whispering-Gallery Mode Resonators in Photonics and Nonlinear Optics. IPN Progress Report. , 42-162 (2005).
- Armani, A. M., Kulkarni, R. P., Fraser, S. E., Flagan, R. C., Vahala, K. J. Label-free, single-molecule detection with optical microcavities. Science. 317, 783-787 (2007).
- Zhu, J. On-chip single nanoparticle detection and sizing by mode splitting in an ultrahigh-Q microresonator. Nat. Photon. 4, 122-122 (2010).
- Armani, D. K., Kippenberg, T. J., Spillane, S. M., Vahala, K. J. Ultra-high-Q toroid microcavity on a chip. Nature. 421, 925-928 (2003).
- Vollmer, F., Arnold, S. Whispering-gallery-mode biosensing: label-free detection down to single molecules. Nat. Methods. 5, 591-596 (2008).
- Vollmer, F., Arnold, S., Keng, D. Single virus detection from the reactive shift of a whispering gallery mode. Proc. Natl. Acad. Sci. U.S.A. 105, 20701-20704 (2008).
- Hunt, H. K., Armani, A. M. Recycling microcavity optical biosensors. Opt. Lett. 36, 1092-1094 (2011).
- Soteropulos, C. E., Hunt, H. K., Armani, A. M. Determination of binding kinetics using whispering gallery mode microcavities. Appl. Phys. Lett. 99, 103703-103703 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon