Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Dos Métodos de Formación heterocarión para descubrir los factores de restricción del VHC
En este artículo
Resumen
Se describen dos métodos para la condicional Trans-La complementación de la hepatitis C (VHC) el montaje y la realización del ciclo de vida viral, que se basan en la formación de heterocarión. Estas técnicas son adecuadas para la detección de líneas celulares que expresan los factores dominantes de restricción, lo que impide la producción de progenie infecciosa del VHC.
Resumen
La hepatitis C (VHC) es un virus hepatotropos con una gama de hospedadores limitada a los seres humanos y los chimpancés. Aunque la replicación del ARN VHC se ha observado en humanos líneas celulares no hepáticos y murino, la eficiencia fue muy baja y requeridas a largo plazo utilizando los procedimientos de selección VHC replicón construye expresar dominantes antibióticos seleccionables marcadores 1-5. VHC en la investigación in vitro se limita por tanto a humanos líneas celulares de hepatoma permisivas para la entrada del virus y la finalización del ciclo vital del virus. Debido a AVC tropismo especies de estrecho, no existe un modelo animal pequeño inmunocompetente disponible que sustenta el ciclo completo de replicación del VHC 6-8. La replicación ineficiente del VHC en células no humanas, por ejemplo de origen de ratón es probablemente debido a la falta de incompatibilidad genética de los factores esenciales de acogida de dependencia y / o expresión de los factores de restricción.
Hemos investigado si la propagación del VHC es suprimida por fa restricción dominantectors en cualquiera de las líneas celulares humanas derivadas de tejidos no hepáticos o en líneas celulares de ratón hígado. Para este fin, hemos desarrollado dos independientes condicionales trans-complementación métodos que dependen de la fusión de células somáticas. En ambos casos, la terminación del ciclo de replicación viral sólo es posible en los heterocariones. En consecuencia, el éxito trans-complementación, que se determina midiendo la producción de novo de progenie viral infecciosa, indica la ausencia de restricciones dominantes.
Específicamente, subgenómico replicones HCV que transportan un transgén luciferasa fueron transfectadas en células de hepatoma humano altamente permisivas (Huh-7.5 células). Posteriormente, estas células fueron co-cultivadas y fusionado a diversas células humanas y murinas que expresan las proteínas estructurales del núcleo del VHC, sobres 1 y 2 (E1, E2) y accesorio proteínas p7 y NS2. A condición de que la fusión celular fue iniciada por tratamiento con polietilenglicol (PEG), la cultura liberado infecciosa viral PArtículos que se infectan células de los animales de una manera dependiente del receptor.
Para evaluar la influencia de las restricciones dominantes en el ciclo vital del virus completo incluyendo entrada a la célula, la replicación del ARN de traducción, y el ensamblaje del virus, que se aprovechó de una línea de células del hígado humano (Huh-7 células Lunet N 9), que carece de expresión endógena de CD81, un factor esencial de la entrada del VHC. En ausencia de ectópica expresó CD81, estas células son esencialmente refractario a la infección por HCV 10. Es importante destacar que, cuando se co-cultivaron y se fusionan con las células que expresan CD81 humano, pero la falta al menos otro factor crucial para la entrada de células (es decir, SR-BI, CLDN1, OCLN), sólo los que resulten heterocariones mostrar el conjunto completo de factores de entrada para la infección por VHC necesarias. Por lo tanto, para analizar si los factores dominantes de restricción suprimir la terminación del ciclo de replicación del HCV, que funden Lunet N celdas con varias células de origen humano y de ratón que cumplen la crit anteriormente mencionadoEria. Cuando se co-cultivos de células se transfectaron con un proteína de la envoltura vírica altamente fusogénica mutante del virus espumoso prototipo (PFV 11) y posteriormente desafiados con partículas infecciosas de HCV (HCVcc), de la producción de novo de virus infeccioso se observó. Esto indica que el VHC completó con éxito su ciclo de replicación en heterocariones descartando así la expresión de factores de restricción dominantes en estas líneas celulares. Estos nuevos condicionales trans-complementación métodos serán útiles para examinar un amplio panel de líneas celulares y células primarias para la expresión del VHC factores específicos de restricción dominantes.
Protocolo
Fusión de la célula por PEG
1. Cultivo Celular
- Cultura Huh-7.5, HeLa y Hep56.1D líneas celulares no tratados previamente o en el envase 12 en 15 placas de cultivo de células cm en DMEM completo (DMEM cplt) medio DMEM suplementado con 2 mM L-glutamina, 1x no aminoácidos esenciales, 100 U / mL de penicilina, 100 ug / ml de estreptomicina, y 10% de suero fetal de ternero. Aplicar la selección apropiada de las líneas celulares estables, como se indica en la Tabla 1.
2. La transfección de ARN del VHC
- Lavar las células Huh-7.5 (un confluente 15 cm plato) dos veces con tampón fosfato salino (PBS), trypsinize, y resuspender en una concentración de 1.5x10 7 células / ml en Cytomix (120 mM de KCl, 0,15 mM CaCl 2, 10 mM de K 2 HPO 4 [pH 7,6], HEPES 25 mM, 2 mM EGTA, 5 mM MgCl 2, ajustado a pH 7,6 con KOH y se esterilizó por filtración) que contiene 2 mM de ATP y 5 mM de glutatión.
- Transfectar a través de electroporation de 400 l de la suspensión de células (6x10 6 células) con 10 g VHC ARN (_JFH1_dg pFKi389Luc-EI/NS3-3 '13) utilizando cubetas con una anchura de intersticio de 0,4 cm y un Gene Pulser Xcell sistema (Biorad) establece en 975 mF y V 270 como se ha descrito previamente 14.
- Inmediatamente transferir transfectadas Huh-7.5 células a 10 ml de medio DMEM cplt y semillas la suspensión entera en una sola placa de cultivo de 10 cm de diámetro. Las células de cultivo durante 24 horas a 37 ° C y 5% de CO 2.
3. La inducción de la fusión de PEG
- Cosecha células como se describe en 2,1, resuspender en medio DMEM cplt y diluir hasta 5x10 5 células / ml.
- Generar una sola célula suspensiones de Huh-7.5, HeLa y células Hep56.1D de embalaje y se diluye hasta 5x10 5 células / ml, 2x10 5 células / ml y 2x10 5 células / ml, respectivamente. Nótese que las células de envasado ectópica expresa VHC proteínas centrales, E1, E2, P7 y NS2 después de la transducción con dos endependientes de vectores lentiviral transducción de un C-E1 y E2-p7-NS2 casete de expresión, respectivamente, 13, 15.
- Preparar 6-y las placas de cultivo con 2-3 hojas de vidrio estériles de cobertura por pozo para su posterior análisis de la eficiencia de la fusión.
- Combine 1 ml de transfectadas Huh-7.5 células que albergan el replicón subgenómico con 1 ml de células de embalaje, de siembra en un pocillo de una placa de 6 pocillos y se incuba durante 24 horas a 37 ° C y 5% de CO 2.
- En este punto del tiempo, la densidad celular debe variar entre 60-80% de confluencia antes de la inducción de la fusión celular con el fin de permitir que las células que estar en estrecha proximidad de las membranas celulares para fusionar.
- Aspirar medio de co-cultivo de células y se lava una vez con 1 ml de PBS, a continuación, añadir cuidadosamente 500 l de pre-calentado 40% de PEG-1500 o PBS como control y se incuba durante 5 min a 37 ° C para inducir la formación heterocarión.
- Aspirar PEG y lave cuidadosamente 3-5 veces durante 1 minuto (min) por lavado con 2 ml de PBS para eliminar el exceso de PEG y, finalmente, añadir 2ml de medio DMEM cplt a cada pocillo y se incuba a 37 ° C y 5% de CO 2.
- Cuarenta y ocho horas después de la fusión, recoge el sobrenadante de cada filtro y el filtro a través de un m 0,45.
- Medida de la producción de partículas infecciosas en heterocariones fusionadas mediante la inoculación de ingenuo Huh-7.5 células (8x10 4 células / pocillo sembradas en una placa de 12 pocillos, 24 h antes de la inoculación) con 500 l de líquido de cultivo libre de células y posterior determinación de la luciferasa la actividad 14.
4. Inmunofluorescencia para determinar la eficiencia de fusión
- Después de recoger los sobrenadantes de cultivo celular (sección 3.8), lavar los pocillos que contienen cubierta de cristal se desliza una vez con 1 ml de PBS durante 1 min. Todos los pasos siguientes se deben realizar a temperatura ambiente (RT) y el lavado debe hacerse con 1 ml de PBS durante 1 min por lavado.
- Fijar las células con 600 l de 3% de paraformaldehído (PFA) en PBS durante 15 minutos y luego lavar 3 veces con PBS. Transfiera cuidadosamente cubreobjetosen una placa de 24 pocillos con fórceps.
- Permeabilizar las células con 500 l de 0,5% de Triton X-100 en PBS durante 5 minutos y posteriormente lavar 3 veces con PBS.
- Preparar solución de anticuerpo primario en PBS suplementado con suero de cabra al 5%. El uso de anticuerpos anti-NS5A (9E10) a una concentración de 0,5 mg / ml y humano anticuerpo monoclonal anti-E2 (CBH-23) a una concentración de 6,4 ng / ml. Aplicar 250 L a cada pocillo e incubar a temperatura ambiente durante 45 minutos.
- Lavar 3x con PBS y detectar anticuerpos primarios enlazados con 250 l secundarias de cabra anti-ratón o cabra anti-IgG humana de anticuerpos específicos conjugados con Alexa-Fluor 546 o Alexa-Fluor 488, a una concentración de 2 mg / ml en PBS suplementado con 5% de suero de cabra. Incubar durante 30 min a temperatura ambiente en la oscuridad.
- Luego, lavar con PBS 1x y posteriormente mancha núcleos de las células con 250 l DAPI (4 ', 6'-diamino-2-fenilindol dihidrocloruro) diluido 1:3000 en PBS, se incuban durante 1 min a temperatura ambiente en la oscuridad.
- Lavar 4 veces con PBS y 1x con H 2 S, a continuación, montar la cubierta se desliza hacia abajo en una gota de Fluoromount sobre un portaobjetos de microscopio, deje que se seque en la muestra oscura y evaluar mediante microscopía de fluorescencia indirecta.
Fusión por transfección transitoria de virus prototipo espumosa (PFV) glicoproteína
5. Preparación del inóculo viral
- Produce una acción de alto título de virus mediante la transfección in vitro transcritos de ARN del VHC en células Huh-7.5 y la cosecha de sobrenadante de cultivo celular después de 48 horas y 72 horas como se describió previamente 14. Determinar título viral mediante la limitación de ensayo de dilución (DICT 50) 13.
6. Cultivo celular, fusión de células por transfección de una glicoproteína fusogénica PFV
- Cultura Lunet N, HeLa y células Hep56.1D hCD81 de acuerdo con las instrucciones que aparecen en la Tabla 1 en medio DMEM cplt que contiene una selección apropiada.
- Separe las células como se describe en el punto 2.1, preparar suspensiones de células individuales en DMEM cplt medium, y co-cultivo de células con Lunet N HeLa o Hep56.1D hCD81 líneas celulares en proporciones adecuadas (por ejemplo 1:2 para Hep56.1D hCD81 o 1:1 para las células HeLa) que dan una densidad total de células de 1.5x10 5 células por 12-pocillo e incubar durante 24 horas a 37 ° C y 5% de CO 2.
- Al día siguiente, transitoriamente transfectar células con la proteína de la envoltura altamente fusogénica PFV (pczHFVenvEM066 16) mediante el uso de Lipofectamine 2000 de acuerdo con las instrucciones del fabricante.
7. La infección de ensayo
- Inocular heterocariones 30 h después de transfección con 350 l de stock de virus (MOI de ~ 2.3) durante 12 horas durante la noche, lavar una vez con PBS y se añade 1 ml de medio DMEM cplt por pocillo. Incubar durante 48 horas a 37 ° C y 5% de CO 2.
- Cosecha sobrenadante de la cultura heterocarión, el filtro a través de un filtro de 0,45 micras e inocular las células Huh-7.5, se siembran en placas de 96 pocillos (1x10 4 células / pocillo) el día anterior, en un ensayo de dilución límite 13.
- Después de 72 horas, manchas infectadas Huh-7.5 células con un anticuerpo específico de VHC (NS5A, 9E10) para cuantificar la producción de partículas infecciosas progenie.
8. Visualización de la fusión celular
- Para visualizar los eventos de fusión, preparar soluciones de 5 a 10 micras de tintes CellTracker en medio DMEM sin aditivos y completar los pasos siguientes 6 h antes de co-cultivo (que se describe en las secciones 6.2 y 6.3).
- Lavar las células adherentes una vez con 5 ml de PBS y luego se incuban las células con 4 ml de solución de tinción por placa de 10 cm durante 45 min a 37 ° C y 5% de CO 2 (mancha Lunet N células con CellTracker Naranja CMTMR y HeLa o Hep56.1D hCD81 células con CellTracker Verde CMFDA, por separado).
- Lavar las células una vez con 5 ml de PBS durante 1 min y añadir medio DMEM cplt, incubar durante 6 horas a 37 ° C y 5% de CO 2.
- Preparar la siembra y la transfección de células teñidas como se ha descrito anteriormente en las secciones 6.2 y sin embargo, añadir una hoja de cubierta para elplaca de cultivo celular antes de la siembra.
- 30 h después de la transfección, lavar las células con cuidado con 1 ml de PBS durante 1 minuto y luego se fijan las células con 250 l de 3% PFA durante 15 min a temperatura ambiente. Lave las células una vez con 1 ml de PBS durante 1 minuto, se tiñen con DAPI durante 1 minuto como se describe en la sección 4.6, se lava una vez con 1 ml de PBS durante 1 min, repita el lavado con H 2 O y se desliza de montaje de la cubierta en láminas de vidrio (ver sección 4.7 ). Analice las células con un microscopio de fluorescencia.
| Especies | La línea celular | Origen | Crecimiento a medio y selección |
| Humano | Huh-7.5 | Subclón de Huh-7 línea celular de hepatoma 17 | DMEM cplt |
| Huh-7.5 [CE1] [E2p7NS2] | Expresan de manera estable núcleo de las proteínas virales, E1, E2, p7, NS2 y, transducidas por el gen lentiviral tTRANSFERENCIA de dos casetes de genes independientes | DMEM cplt Blasticidin + 5 mg / ml | |
| Huh-7 Lunet N | Subclón de Huh-7 línea celular de hepatoma 9 | DMEM cplt | |
| HeLa | Adenocarcinoma de cuello uterino línea celular (ATCC número: CCL-2) | DMEM cplt | |
| HeLa [CE1] [E2p7NS2] | Expresan de manera estable núcleo proteínas virales, E1, E2, p7, y NS2, transducidas por la transferencia de genes lentiviral de dos casetes de genes independientes | DMEM cplt G418 + 750 mg / ml; Blasticidin 5 mg / ml | |
| Ratón | Hep56.1D | El carcinoma hepatocelular primario (especie de regalo de J. Encke) Adultos ratones C57BL/6J | DMEM cplt |
| Hep56.1D [CE1] [E2p7NS2] | Ex establepresionando núcleo proteínas virales, E1, E2, p7, y NS2, transducidas por la transferencia de genes lentiviral de dos casetes de genes independientes | DMEM cplt G418 + 750 mg / ml; Blasticidin 5 mg / ml | |
| Hep56.1D hCD81 | Expresan de manera estable CD81 humanos transduced por la transferencia de genes lentiviral | DMEM cplt Blasticidin + 5 mg / ml |
. Tabla 1 Especificaciones sobre la condición de origen y la cultura de las líneas celulares utilizadas Cplt: G418 completo: geneticina, h: humanos.
9. Los resultados representativos
En este estudio, hemos aplicado dos métodos diferentes de la fusión de células somáticas, que nos permiten investigar específicamente el impacto de los factores de restricción en la terminación del ciclo de replicación del VHC en heterocariones. Es de destacar que el diseño condicional de trans-complementación sobre la fusión de los dos tipos de células diferentes asegura quesólo en heterocariones verdaderos entre las células de hígado humano y no permisiva líneas celulares, el ensamblaje del virus (método 1) o la entrada del virus y la replicación del VHC ciclo completo (enfoque 2) se llevan a cabo.
En el primer enfoque Huh-7.5 células, muy permisiva para el VHC, fueron transfectadas transitoriamente con un replicón subgenómico expresar un transgén luciferasa y VHC proteínas no estructurales del VHC subgenómico apoyar la replicación del ARN (Huh-7.5 replicón células). Estas células fueron co-cultivadas y fusionado a líneas celulares que expresan las proteínas estructurales del núcleo del VHC, E1, E2, así como p7 accesorio proteínas, y NS2. Figure1A muestra una visión general del procedimiento experimental. Es importante destacar que, tras la fusión de PEG, todas las proteínas necesarias para el montaje de partícula debe estar presente en la heterocarión formado que se puede confirmar por inmunofluorescencia contra proteínas víricas individuales. La Figura 1B representa un caso ejemplar de fusión en el que las señales de ambos NS5A expresa en las células Huh-7.5 replicón y E2expresó en Huh-7.5 [CE1] [E2p7NS2] células empaquetadoras se detectaron en el citoplasma misma al PEG-inducida por la formación heterocarión. Cuando se co-cultivaron células fueron tratadas en vez con PBS, sin fusión fue inducida por tanto, sólo un único células positivas y no co-localización de las señales se observó. Además, para controlar la expresión del transgén, se realizó un ELISA específicos para el núcleo y E2 (ya se ha informado en detalle 15). Además de la línea de control celular de empaquetamiento Huh 7.5 [CE1] [E2p7NS2], hemos generado células HeLa y Hep56.1D de embalaje con representantes de los humanos no el hígado y las células de hígado de ratón, respectivamente. VHC eficacia de la replicación del ARN en estas últimas células es la asamblea de baja y el VHC y la liberación no ha sido demostrado. La figura 1C ilustra los resultados del ensayo de fusión. Los sobrenadantes se recogieron desde el co-cultivo a las 48 horas después de la inducción de la fusión y se utiliza para inocular ingenuo Huh-7.5 células para posteriores ensayos de luciferasa. En particular, cuando Huh-7.5 replicón células se fusionaron con cualquieralíneas celulares no tratados previamente o tratados con PBS como control, no se ha detectado infecciosidad en los fluidos del cultivo. Sin embargo, cuando la fusión celular entre Huh-7.5 replicón y las líneas de envasado de células fue inducida por el PEG, trans-complementación entre replicón y expresados constitutivamente proteínas estructurales rescató la producción de virus en los heterocariones resultantes y partículas virales infecciosas fueron liberados en los fluidos del cultivo. Por lo tanto, la conclusión de que la producción de virus requiere la fusión celular y la expresión de proteínas virales en las líneas de envasado de células. Sorprendentemente, no sólo a los heterocariones de Huh-7.5 células de hepatoma humano, sino también con heterocariones humana no del hígado (HeLa [CE1] [E2p7NS2]) y de hígado de ratón (Hep56.1D [CE1] [E2p7NS2]) la liberación células permitido virus, indicando que el montaje y la liberación no están predominantemente inhibida por factores de restricción posibles en estos tipos de células. Expresión de proteínas estructurales en líneas celulares de envasado y la entrada de auténtico en las células diana se muestra en la Frentzen Et al. 15.
Un método alternativo de la fusión celular se utilizó para analizar las posibles restricciones que afectan a la entrada de células, la traducción del ARN y las etapas de replicación del ARN del ciclo de replicación y para excluir que una alta carga viral en células transfectadas replicón Huh 7,5 impediría la detección de factores de restricción por saturación. Para este fin, hemos desarrollado un ensayo independiente, basada en la inoculación de heterocariones con HCVcc y detección de la producción de virus de novo en estas células. Como se indica en la Figura 2A, la fusión de células somáticas fue inducida por la expresión de una glicoproteína fusogénica después de co-cultivo de las células. Se eligió este método porque se aumentó la sensibilidad probablemente debido a la eficiencia de fusión aumentado. Heterocariones se visualizaron por tinción líneas separadas de células con colorantes CellTracker Antes de co-cultivo. Un heterocarión con homogéneamente distribuidos tintes dentro del citoplasma indica fusión de dos tipos de células como indicand en la Figura 2B. Sólo en heterocariones de Lunet N con células HeLa o células Hep56.1D hCD81 son todos los factores de entrada del VHC expresada de manera selectiva la prestación heterocariones susceptibles a la entrada de la celda por el VHC. Desafío con HCVcc dio lugar a la replicación del VHC en completa heterocariones que es evidente a partir de la producción de novo de la progenie viral infecciosa aproximadamente 10 veces por encima del fondo del ensayo (Fig. 2C). Como control, Lunet N celdas se fusionaron con células Lunet N. Es importante destacar que sólo los muy bajos niveles de infección por el VHC cercano al límite de detección se observaron. Resultados similares se obtuvieron cuando las células Lunet N se fusionaron con células ingenuas Hep56.1D. En ambos casos, CD81 humano estaba ausente de modo que el HCV no productiva podría infectar las heterocariones. Esta muy baja infectividad detectada en estos dos últimos casos, es probablemente atribuible a bajo nivel de infección de las células Lunet N y / o bajos niveles de entrada de virus infeccioso residual en el inóculo. En las células HeLa de contraste y Hep56.1D hCD81 células expresan CD81 humano, complementando así el factor de celda de entrada carece de los heterocariones y permitir la entrada de células del VHC. El nivel 10 veces mayor de infección por VHC detectados en el medio de heterocariones que implican estas dos líneas celulares por lo tanto, probablemente refleja la producción de novo de partículas infecciosas en heterocariones. Así, se concluyó que la realización del ciclo de replicación de HCV no se restringe con exclusión de la expresión de los factores dominantes de restricción de HCV en estas líneas celulares.
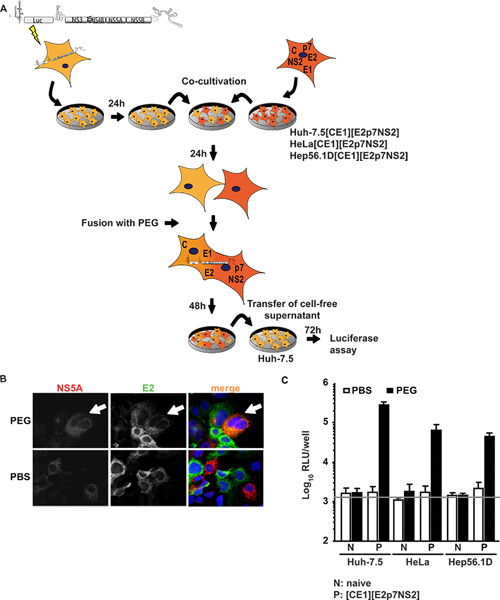
Figura 1. Trans-complementación de montaje HCV y liberación en heterocariones. (A) contorno esquemático del procedimiento experimental de fusión celular mediada por PEG. El reportero de la luciferasa JFH1 replicón Luc-NS3-5B se transfectadas en ingenuos Huh-7.5 células por electroporación. Al día siguiente, las células fueron separadas y co-cultivaron con células de los animales o envases Las células que expresan constitutivamente VHC núcleo, E1, E2, P7 y NS2. 24 h después de co-cultivo, la formación heterocarión fue inducida por tratamiento con 40% de PEG utilizando PBS como control negativo. Después de 48 horas, libre de células sobrenadante se recogió para inocular ingenuo Huh-7.5 células. La infectividad se determinó por la actividad luciferasa. (B) Para la detección de heterocariones, las células fueron immunostained utilizando anticuerpos monoclonales contra la E2 y NS5A. La expresión simultánea de ambas proteínas en las células es indicativa de la fusión celular. (C) se realizaron mediciones de luciferasa para cuantificar la infectividad viral producida a partir de heterocariones. Los valores medios de tres experimentos independientes y las desviaciones estándar de los medios se les da. La barra horizontal representa el RLU de fondo determinado en no infectados células Huh-7.5. Haga clic aquí para ver más grande la figura .
9/4029fig2.jpg "/>
Figura 2. Finalización del ciclo de replicación del VHC después de la inoculación de heterocariones. (A) Presentación esquemática del procedimiento experimental. Huh-7 Lunet las células que carecen de N CD81 fueron co-cultivadas con las líneas celulares indicadas no existen o que expresa CD81 humana. Es importante destacar que estas últimas células carecen de al menos un factor de entrada HCV y por lo tanto no pueden ser infectados productivamente. Al día siguiente, la fusión se inició mediante la transfección de una proteína de la envoltura vírica fusogénica de PFV. Treinta horas después, las células se estimularon con partículas infecciosas del VHC. Para medir la entrada de células, la replicación del ARN y virus de la producción sostenida por estos heterocariones, infectividad liberado en los fluidos de cultivo libres de células se determinó 48 horas después de la inoculación. Para este fin, no tratados previamente Huh-7.5 células se utilizaron como células diana en un ensayo de dilución limitante (TCID 50). (B) Para la detección de heterocariones, las células se tiñeron con verde o CellTracker CellTracker Orange 6 horas antes de co-cultivadasación y transfección. Treinta horas después, las células fueron fijadas y teñidas con DAPI. (C) N Lunet células fueron fusionados con las células HeLa, células ingenuas Hep56.1D o que expresan CD81 Hep56.1D humanos. Estos cultivos se inocularon con HCVcc (MOI de 2,3). Fluidos de cultivo se recogieron 48 horas más tarde y de la liberación de partículas novo a partir de heterocariones fue determinada por DICT 50 con ingenuo Huh-7.5 células diana. Valores medios de tres experimentos independientes se dan. La barra horizontal representa el límite de detección del ensayo. Haga clic aquí para ver más grande la figura .
Access restricted. Please log in or start a trial to view this content.
Discusión
Se presentan dos métodos para inducir la formación heterocarión en células cultivadas para el análisis de las restricciones dominantes negativos que impiden la replicación del HCV. El uso de estos procedimientos se excluyó la presencia de un factor dominante expresa constitutivamente o inducida por virus, en diversas humano no-hígado y en murinos líneas de células hepáticas. El primer ensayo analiza principalmente si los factores de restricción impida la colocación del VHC y la liberación de la progenie in...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
TP recibieron honorarios por consultoría de Biotest.
Agradecimientos
Estamos muy agradecidos a Takaji Wakita y Jens Bukh de JFH1 y aislados J6CF, respectivamente. Además agradecemos a Charles Rice de Huh-7.5 células y el anticuerpo 9E10, Steven Foung para el anticuerpo específico de CBH E2-23, y todos los miembros del Departamento de Virología Experimental, Twincore por sus útiles sugerencias y discusiones.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
| DMEM | Invitrogen, Karlsruhe, Alemania | 41965-039 | |
| L-glutamina | Invitrogen, Karlsruhe, Alemania | 25030-024 | |
| No aminoácidos esenciales | Invitrogen, Karlsruhe, Alemania | 11140-035 | |
| La penicilina / estreptomicina | Invitrogen, Karlsruhe, Alemania | 15140-122 | |
| Suero de ternera fetal | PAA, Cölbe, Alemania | A15151 | |
| α-E2 (CBH23) | amablemente proporcionados por Steven Foung 10 | ||
| ATP | Sigma, Steinheim, Alemania | A2833-106 | |
| El glutatión | Sigma, Steinheim, Alemania | G4251-1G | |
| Blasticidin | Invivo Gen, San Diego, EE.UU. | Ant-V-1 | |
| G418 (geneticina) | Invitrogen, Karlsruhe, Alemania | 11811-064 | |
| Polietileno-glicol-1500 | Roche, Mannheim, Alemania | 10783641001 | |
| Paraformaldehído | Roth, Karlsruhe, Alemania | 0335.3 | |
| Triton X-100 | Roth, Karlsruhe, Alemania | 3051.2 | |
| Suero de cabra | Sigma, Steinheim, Alemania | G9023-5 ml | |
| α-NS5A (9E10) | Por cortesía de Charles Rice 7 | ||
| DAPI (4 ', 6'-diamino-2-fenilindol diclorhidrato) | Invitrogen | D1306 | |
| Alexa-Fluor 546 - de cabra anti-IgG humana | Invitrogen, Karlsruhe, Alemania | A21089 | |
| Alexa-Fluor 488 - de cabra anti-IgG de ratón | Invitrogen, Karlsruhe, Alemania | A10680 | |
| Lipofectamine 2000 | Invitrogen, Karlsruhe, Alemania | 11668-019 | |
| CellTracker CMTMR | Invitrogen, Karlsruhe, Alemania | C2927 | |
| CellTracker CMFDA | Invitrogen, Karlsruhe, Alemania | C2925 | |
| Fluoromount | Sigma, Steinheim, Alemania | F4680-25ML | |
| Todos los otros productos químicos | Roth, Karlsruhe, Alemania | ||
| Materiales de cultivo celular | Sarstedt, Nümbrecht, Alemania |
Referencias
- Zhu, Q., Guo, J. T., Seeger, C. Replication of hepatitis C virus subgenomes in nonhepatic epithelial and mouse hepatoma cells. J. Virol. 77, 9204-9210 (2003).
- Kato, T. Nonhepatic cell lines HeLa and 293 support efficient replication of the hepatitis C virus genotype 2a subgenomic replicon. J. Virol. 79, 592-596 (2005).
- Ali, S., Pellerin, C., Lamarre, D., Kukolj, G. Hepatitis C virus subgenomic replicons in the human embryonic kidney 293 cell line. J. Virol. 78, 491-501 (2004).
- Date, T. Genotype 2a hepatitis C virus subgenomic replicon can replicate in HepG2 and IMY-N9 cells. J. Biol. Chem. 279, 22371-22376 (2004).
- Chang, K. S. Replication of hepatitis C virus (HCV) RNA in mouse embryonic fibroblasts: protein kinase R (PKR)-dependent and PKR-independent mechanisms for controlling HCV RNA replication and mediating interferon activities. J. Virol. 80, 7364-7374 (2006).
- Zhong, J. Robust hepatitis C virus infection in vitro. Proc. Natl. Acad. Sci. U.S.A. 102, 9294-9299 (2005).
- Lindenbach, B. D. Complete replication of hepatitis C virus in cell culture. Science. 309, 623-626 (2005).
- Wakita, T. Production of infectious hepatitis C virus in tissue culture from a cloned viral genome. Nat. Med. 11, 791-796 (2005).
- Witteveldt, J. CD81 is dispensable for hepatitis C virus cell-to-cell transmission in hepatoma cells. J. Gen. Virol. 90, 48-58 (2009).
- Bitzegeio, J. Adaptation of hepatitis C virus to mouse CD81 permits infection of mouse cells in the absence of human entry factors. PLoS Pathog. 6, e1000978(2010).
- Lindemann, D., Goepfert, P. A. The foamy virus envelope glycoproteins. Curr Top Microbiol Immunol. 277, 111-129 (2003).
- Brohm, C. Characterization of determinants important for hepatitis C virus p7 function in morphogenesis by using trans-complementation. J. Virol. 83, 11682-11693 (2009).
- Steinmann, E., Brohm, C., Kallis, S., Bartenschlager, R., Pietschmann, T. Efficient trans-encapsidation of hepatitis C virus RNAs into infectious virus-like particles. J. Virol. 82, 7034-7046 (2008).
- Koutsoudakis, G. Characterization of the early steps of hepatitis C virus infection by using luciferase reporter viruses. J. Virol. 80, 5308-5320 (2006).
- Frentzen, A. Completion of hepatitis C virus replication cycle in heterokaryons excludes dominant restrictions in human non-liver and mouse liver cell lines. PLoS Pathog. 7, e1002029(2011).
- Lindemann, D. A particle-associated glycoprotein signal peptide essential for virus maturation and infectivity. J. Virol. 75, 5762-5771 (2001).
- Blight, K. J., McKeating, J. A., Rice, C. M. Highly permissive cell lines for subgenomic and genomic hepatitis C virus RNA replication. J. Virol. 76, 13001-13014 (2002).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados