Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Zwei Methoden der Heterokaryon Formation zu entdecken HCV Restriktionsfaktoren
In diesem Artikel
Zusammenfassung
Wir beschreiben zwei Methoden für die bedingte Trans-Komplementation des Hepatitis C Virus (HCV)-Anordnung und der Abschluss des vollständigen viralen Lebenszyklus, die auf Heterokaryon Bildung verlassen. Diese Techniken eignen sich zum Screening auf Zelllinien, die dominierende Einschränkung Faktoren, die Produktion von infektiösen HCV Nachkommen ausschließt auszudrücken.
Zusammenfassung
Hepatitis C Virus (HCV) ist ein hepatotropen Virus mit einem Host-Bereich beschränkt, um Menschen und Schimpansen. Obwohl HCV-RNA-Replikation in humanen nicht-hepatische und murinen Zelllinien beobachtet, war die Effizienz sehr gering und erforderliche langfristige Auswahlverfahren mit HCV-Replikon-Konstrukten, Antibiotika-dominante selektierbare Marker 1-5. HCV-in-vitro-Forschung ist daher die menschliche Hepatom-Zelllinien permissive für das Eindringen von Viren und die Fertigstellung des viralen Lebenszyklus beschränkt. Aufgrund schmalen Arten Tropismus HCVS, gibt es keine immunkompetenten Kleintiermodell zur Verfügung, die die vollständige HCV Replikationszyklus erhält 6-8. Ineffiziente Replikation von HCV in nicht-menschlichen Zellen, z. B. von der Maus stammt wahrscheinlich wegen des Mangels an genetische Unverträglichkeit wesentlicher Host Abhängigkeit Faktoren und / oder Expression von Restriktionsfaktoren.
Wir untersuchten, ob HCV-Vermehrung durch dominante Beschränkung fa wird unterdrücktctors entweder in humanen Zelllinien von nicht-hepatischen Geweben oder in der Leber der Maus-Zelllinien abgeleitet. Zu diesem Zweck haben wir zwei unabhängige bedingten trans-Komplementierung Verfahren, die auf somatische Zellfusion. In beiden Fällen ist die Vollendung des viralen Replikationszyklus nur in den Heterokaryons. Folglich zeigt die erfolgreiche trans-Komplementierung, die durch Messung de novo Produktion von infektiösen viralen Nachkommen bestimmt wird, dass kein beherrschender Beschränkungen.
Im Einzelnen wurden subgenomischen HCV-Replikons Tragen eines Luciferase Transgens in sehr freizügigen menschlichen Hepatom-Zellen (Huh-7.5-Zellen) transfiziert. Anschließend wurden diese Zellen co-kultiviert und die mit verschiedenen humanen und murinen Zellen, die HCV-Strukturproteine Kern Hülle 1 und 2 (E1, E2) und akzessorische Proteine p7 und NS2. Vorausgesetzt, dass Zellfusion durch Behandlung mit Polyethylenglykol (PEG) initiiert wurde, veröffentlichte die Kultur infektiösen viralen partikel die naiven Zellen in einem Rezeptor-abhängigen Weise infiziert.
Um den Einfluss der beherrschenden Beschränkungen des gesamten viralen Lebenszyklus, einschließlich Eintritt in die Zelle, der RNA-Translation, Replikation und Virus-Assembly beurteilen, nutzten wir einen humanen Leberzellen (Huh-7 Zellen Lunet N 9), die endogene Expression von CD81 fehlt, ein wesentlicher Faktor der HCV-Eintrag. In Abwesenheit von CD81 ektopisch exprimiert, sind diese Zellen im Wesentlichen refraktär HCV-Infektion 10. Wichtig ist, wenn co-kultiviert und verschmolzen mit menschlichen Zellen, die CD81, aber Mangel mindestens ein weiterer entscheidender Faktor Eindringen in die Zelle (dh SR-BI, CLDN1, OCLN) zum Ausdruck bringen, zeigen nur die daraus resultierenden Heterokaryons den kompletten Satz von HCV-Eintrag Faktoren Voraussetzung für die Infektion. Daher, zu analysieren, ob beherrschenden Restriktionsfaktoren unterdrücken Vollendung des HCV-Replikationszyklus fusionierten wir Lunet N Zellen mit verschiedenen Zellen aus Mensch und Maus Ursprungs, das die oben genannten crit zu erfülleneria. Wenn co-kultivierten Zellen mit einem sehr fusogenen viralen Hüllprotein Mutante des Prototyps Foamyvirus (PFV 11) transfiziert wurden und anschließend mit infektiösen HCV-Partikel (die getesteten) herausgefordert wurde de novo Produktion von infektiösem Virus beobachtet. Dies zeigt, dass HCV erfolgreich seine Replikationszyklus in Heterokaryons so dass kein Expression von dominant Restriktionsfaktoren in diesen Zelllinien. Diese neuen bedingten trans-Komplementierung Methoden nützlich sein, einen großen Panel von Zelllinien und primäre Zellen zur Expression von HCV-spezifischen beherrschenden Restriktionsfaktoren zu screenen.
Protokoll
Cell Fusion von PEG
1. Cell Culture
- Kultur Huh-7.5, HeLa-und Hep56.1D naiv oder Verpackungs-Zelllinien 12 auf 15 cm Zellkulturschalen in DMEM komplett (zus. DMEM) Medium, ergänzt DMEM mit 2 mM L-Glutamin, 1x nicht-essentielle Aminosäuren, 100 U / ml Penicillin, 100 ug / ml Streptomycin und 10% fötales Kälberserum. Tragen Sie geeignete Auswahl zum stabilen Zelllinien, wie in Tabelle 1 angegeben.
2. Transfektion von HCV-RNA
- Waschen Huh-7.5-Zellen (eine konfluente 15 cm Schale) zweimal mit Phosphat-gepufferte Kochsalzlösung (PBS), trypsinieren und Resuspension in einer Konzentration von 1.5x10 7 Zellen / ml in Cytomix (120 mM KCl, 0,15 mM CaCl 2, 10 mM K 2 HPO 4 [pH 7,6], 25 mM HEPES, 2 mM EGTA, 5 mM MgCl 2, eingestellt auf pH 7,6 mit KOH und durch Filtration sterilisiert), enthaltend 2 mM ATP und 5 mM Glutathion.
- Transfizieren über electroporatIon 400 ul der Zellsuspension (6x10 6 Zellen) mit 10 ug HCV-RNA (pFKi389Luc-EI/NS3-3 '_JFH1_dg 13) Verwendung von Küvetten mit einer Spaltbreite von 0,4 cm und einem Gene Pulser Xcell System (Biorad) gesetzt zu 975 uF und 270 V 14, wie vorher beschrieben.
- Sofortüberweisung transfizierten Huh-Zellen 7,5 bis 10 ml DMEM Medium kplt und Saatgut die gesamte Suspension in einem einzigen Kulturschale von 10 cm Durchmesser. Kultur Zellen für 24 h bei 37 ° C und 5% CO 2.
3. Die Induktion der Fusion von PEG
- Ernten Sie die Zellen wie in 2.1 beschrieben, resuspendieren in DMEM zus. Medium verdünnt und auf 5x10 5 Zellen / ml.
- Generieren Sie Single-Zellsuspensionen von Huh-7.5, HeLa und Hep56.1D Verpackung Zellen und verdünnte bis 5x10 5 Zellen / ml, 2x10 5 Zellen / ml und 2x10 5 Zellen / ml. Beachten Sie, dass Verpackungszellen ektopisch ausdrückliche HCV-Proteine Core, E1, E2, p7 und NS2 nach Transduktion mit zweiabhängigen lentiviralen Vektoren Transduzieren einer C-E1 und E2-p7-NS2 Expressionskassette bzw. 13, 15.
- Bereiten Sie 6-well-Platten mit 2-3 sterilen Glasdeckgläschen pro Vertiefung für die weitere Analyse der Fusion Effizienz.
- Kombination auf 1 ml transfizierten Huh-7.5-Zellen, die subgenomischen Replikon mit 1 ml von Verpackungszellen, Samen in eine Vertiefung einer Platte mit 6 Vertiefungen, und Inkubieren für 24 h bei 37 ° C und 5% CO 2.
- Zu diesem Zeitpunkt sollte Zelldichte zwischen 60-80% Konfluenz vor der Induktion der Zellfusion reichen, damit Zellen in unmittelbarer Nähe für Zellmembranen zu verschmelzen.
- Absaugen von Medium co-kultivierten Zellen und waschen einmal mit 1 ml PBS, fügt dann vorsichtig 500 ul vorgewärmtes 40% PEG-1500 oder PBS als Kontrolle und Inkubation für 5 min bei 37 ° C bis Heterokaryon zu induzieren.
- Aspirieren PEG und sorgfältig zu waschen 3-5 mal für 1 Minute (min) pro Waschgang mit 2 ml PBS, um überschüssige PEG zu entfernen und schließlich fügen Sie 2ml DMEM zus. Medium in jede Vertiefung und inkubieren bei 37 ° C und 5% CO 2.
- Achtundvierzig Stunden nach der Fusion, sammeln jedem Überstand und durch ein 0,45 um Filter.
- Messen Sie die Produktion von infektiösen Partikeln in geschmolzenem Heterokaryons durch Impfung von naiven Huh-7.5-Zellen (8x10 4 Zellen / Well in einer 12-Well-Platte, 24 h vor der Inokulation ausgesät) mit 500 ul zellfreien Kulturflüssigkeit und die anschließende Bestimmung der Luciferase Aktivität 14.
4. Immunfluoreszenz zur Fusion Effizienz bestimmen
- Nach dem Sammeln Zellkulturüberständen (Abschnitt 3.8), waschen Vertiefungen mit Glasdeckgläschen einmal mit 1 mL PBS für 1 min. Alle folgenden Schritte sollten bei Raumtemperatur (RT) durchgeführt werden sollte und Waschen mit 1 ml PBS für 1 min pro Waschung durchgeführt werden.
- Fix-Zellen mit 600 ul 3% Paraformaldehyd (PFA) in PBS für 15 min und dann waschen 3x mit PBS. Sorgfältig übertragen Deckgläserin eine 24-Well-Platte mit einer Pinzette.
- Permeabilisieren Zellen mit 500 ul 0,5% Triton X-100 in PBS für 5 min waschen und anschließend mit PBS 3x.
- Planen primären Antikörper-Lösung in PBS mit 5% Ziegenserum ergänzt. Verwendung von Anti-NS5A Antikörper (9E10) in einer Konzentration von 0,5 mg / ml und humanen monoklonalen anti-E2-Antikörper (CBH-23) in einer Konzentration von 6,4 ng / ml. Tragen Sie 250 ul in jede Vertiefung und inkubieren bei RT 45 min.
- 3x Waschen mit PBS und erkennen gebundenen primären Antikörper mit 250 ul sekundären Ziege anti-Maus-oder Ziege-Anti-Human-IgG-spezifischen Antikörper, konjugiert mit Alexa-Fluor 546 oder Alexa-Fluor 488, bei einer Konzentration von 2 pg / ml in PBS, ergänzt mit 5% Ziegenserum. Inkubieren für 30 min bei RT in der Dunkelheit.
- Dann waschen 1x mit PBS und anschließend Fleck Zellkerne mit 250 ul DAPI (4 ', 6'-Diamidino-2-phenylindoldihydrochlorid) verdünnt 1:3.000 in PBS, Inkubation für 1 min bei RT im Dunkeln.
- Waschen mit PBS und 1x 4-fach mit H 2 O, und bringen dann Deckgläschen kopfüber auf einen Tropfen Fluoromount auf einen Objektträger, trocknen lassen im Dunkeln und zu bewerten Probe durch indirekte Fluoreszenz-Mikroskopie.
Fusion durch transiente Transfektion von Prototypen Foamyvirus (PFV) Glykoprotein
5. Herstellung viraler Inokulum
- Produzieren eines Virus mit hohem Titer Lager durch Transfektion in vitro transkribierte HCV RNA in Huh-7.5-Zellen und Ernten Zellkulturüberstand nach 48 h und 72 h, wie zuvor beschrieben 14. Bestimmen Sie Virustiter durch limitierende Verdünnung Assay (TCID 50) 13.
6. Cell Culture, Zellfusion durch Transfektion einer Fusogene PFV Glykoprotein
- Kultur Lunet N, HeLa und Hep56.1D hCD81 Zellen gemäß den Anweisungen in der Tabelle 1 in DMEM-Medium mit zus. eine geeignete Auswahl.
- Nehmen Zellen wie unter 2.1 beschrieben, bereiten einzelne Zellsuspensionen in DMEM zus. medium, et kultivieren Lunet N Zellen mit HeLa oder Hep56.1D hCD81 Zelllinien in geeigneten Verhältnissen (z. B. 1:2 für Hep56.1D hCD81 oder 1:1 für HeLa-Zellen), was eine Gesamtmenge Zelldichte von 1.5x10 5 Zellen pro 12-Well und Inkubation für 24 h bei 37 ° C und 5% CO 2.
- Am nächsten Tag Zellen transient zu transfizieren mit dem hoch fusogenen PFV Hüllprotein (pczHFVenvEM066 16) unter Verwendung von Lipofectamin 2000 nach den Anweisungen des Herstellers.
7. Infektionsassay
- Beimpfen Heterokaryons 30 h nach Transfektion mit 350 ul Virusstamm (MOI von ~ 2.3) für 12 h über Nacht, einmal mit PBS waschen und fügen 1 ml DMEM zus. Medium pro Vertiefung. Inkubieren für 48 h bei 37 ° C und 5% CO 2.
- Ernte-Überstand von Heterokaryon Kultur, Filter durch einen 0,45 um Filter und impfen Huh-7.5-Zellen in 96-well-Platten ausgesät (1x10 4 Zellen / Well) am Tag zuvor in einem einschränkenden Verdünnungsassay 13.
- Nach 72 h, Beize infiziert Huh-7.5-Zellen mit einem HCV-spezifischen Antikörper (NS5A, 9E10) zur Produktion einer infektiösen Nachkommenschaft Teilchen zu quantifizieren.
8. Visualisierung der Zellfusion
- Zur Fusion Ereignisse sichtbar zu machen, bereiten 5 bis 10 um Lösungen von CellTracker Farbstoffe in DMEM-Medium ohne Zusätze und füllen Sie die nachfolgenden Schritte 6 h vor der Co-Kultur (siehe Abschnitte 6.2 und 6.3).
- Waschen Sie adhärente Zellen einmal mit 5 ml PBS und dann inkubieren Zellen mit 4 ml Färbelösung pro 10 cm Schale für 45 min bei 37 ° C und 5% CO 2 (Fleck Lunet N Zellen mit CellTracker orange CMTMR und HeLa-oder Hep56.1D hCD81 Zellen mit CellTracker Grüne CMFDA, separat erhältlich).
- Waschen der Zellen einmal mit 5 ml PBS für 1 min und fügen DMEM kplt Medium für 6 h bei 37 ° C und 5% CO 2.
- Bereiten Aussaat und Transfektion von gefärbten Zellen wie oben beschrieben in den Abschnitten 6.2 und Aber, fügen Sie ein Deckglas auf dieZellkulturschale vor der Aussaat.
- 30 h nach der Transfektion, waschen Sie die Zellen vorsichtig mit 1 ml PBS für 1 min und dann fix Zellen mit 250 ul von 3% PFA für 15 min bei RT. Waschen Sie die Zellen einmal mit 1 ml PBS für 1 min, mit DAPI, 1 min färben, wie in Abschnitt 4.6 beschrieben, einmal waschen mit 1 ml PBS für 1 min, wiederholen Sie waschen mit H 2 O und Mount Deckgläschen auf Objektträgern (siehe Abschnitt 4.7 ). Analysieren Zellen mit einem Fluoreszenz-Mikroskop.
| Spezies | Zell-Linie | Herkunft | Wachstumsmedium & Auswahl |
| Mensch | Huh-7.5 | Subklon von Huh-7-Hepatom-Zelllinie 17 | DMEM zus. |
| Huh-7.5 [CE1] [E2p7NS2] | Stabil exprimierende virale Proteine Kern, transduziert E1, E2, p7, und NS2 von lentiviralen Gen transfer von zwei unabhängigen Genkassetten | DMEM + zus. Blasticidin 5 pg / ml | |
| Huh-7 Lunet N | Subklon von Huh-7-Hepatom-Zelllinie 9 | DMEM zus. | |
| HeLa | Gebärmutterkrebs Adenokarzinom-Zelllinie (ATCC-Nummer: CCL-2) | DMEM zus. | |
| HeLa-[CE1] [E2p7NS2] | Stabil exprimierende virale Proteine Kern, transduziert E1, E2, p7, und NS2 von lentiviralen Gentransfer von zwei unabhängigen Genkassetten | DMEM + zus. G418 750 pg / mL; Blasticidin 5 pg / ml | |
| Maus | Hep56.1D | Primären Leberzellkarzinom (freundliches Geschenk von J. Encke) Adult C57BL/6J-Mäuse | DMEM zus. |
| Hep56.1D [CE1] [E2p7NS2] | Stabil ExDrücken virale Proteine Kern, transduziert E1, E2, p7, und NS2 von lentiviralen Gentransfer von zwei unabhängigen Genkassetten | DMEM + zus. G418 750 pg / mL; Blasticidin 5 pg / ml | |
| Hep56.1D hCD81 | Stabil exprimieren menschliches CD81 transduzierten von lentiviralen Gentransfer | DMEM + zus. Blasticidin 5 pg / ml |
. Tabelle 1 Technische Daten über Herkunft und Kultur Zustand der verwendeten Zelllinien CPLT: alle, G418: Geneticin, h: human.
9. Repräsentative Ergebnisse
In dieser Studie verwendeten wir zwei verschiedene Methoden der somatische Zellfusion, die uns insbesondere der Untersuchung des Einflusses Restriktionsfaktoren nach Abschluss des HCV-Replikationszyklus in Heterokaryons ermöglichen. Zu beachten ist, sichert die bedingte Ausführung von trans-Komplementierung nach Fusion von den zwei verschiedenen Zelltypen, dassnur im wahren Heterokaryons zwischen menschlichen Leberzellen und nicht-permissiven Zelllinien, Virus-Assembly (Ansatz 1) oder das Eindringen von Viren und die vollständige HCV-Replikationszyklus (Ansatz 2) werden durchgeführt.
Im ersten Ansatz Huh-7.5-Zellen, stark permissiv für HCV, wurden transient mit einem subgenomischen Replikon Expression eines Transgens Luciferase und HCV nicht-strukturellen Proteine unterstützen subgenomischen HCV-RNA-Replikation (Huh-7.5-Replikon-Zellen) transfiziert. Diese Zellen wurden co-kultivierten und fusioniert an Zelllinien HCV Strukturproteine Core, E1, E2, sowie akzessorischen Proteinen p7, und NS2. Abbildung1A zeigt eine Übersicht des experimentellen Verfahrens. Wichtig ist, dass nach PEG-Fusion, sollten alle Proteine zur Montage erforderlich Teilchen vorhanden sein in dem gebildeten Heterokaryon die durch Immunfluoreszenz gegen einzelne virale Proteine bestätigt werden kann. 1B zeigt eine beispielhafte Fusion Ereignis, in dem Signale sowohl für NS5A in Huh-7.5-Replikon-Zellen exprimiert und E2ausgedrückt in Huh-7.5 [CE1] [E2p7NS2] Verpackung Zellen wurden in der gleichen Cytoplasma auf PEG-induzierte Heterokaryon Bildung nachgewiesen. Wenn co-kultivierten Zellen statt wurden mit PBS, wurde keine Fusion damit nur einzelne-positiven Zellen induziert und kein Co-Lokalisation von Signalen beobachtet. Darüber hinaus, um Transgenexpression zu kontrollieren, führten wir ELISAs spezifisch für Kern-und E2 (vorher im Detail 15 berichtete). Zusätzlich zu der Steuerung Verpackungszelllinie Huh 7,5 [CE1] [E2p7NS2], erzeugten wir HeLa und Hep56.1D Verpackungszellen als Repräsentanten für Human-Nicht-Leber und Mäuseleber-Zellen. HCV-RNA-Replikation Effizienz in diesen letzteren Zellen ist gering und HCV-Montage-und Release wurde nicht gezeigt. 1C zeigt die Ergebnisse des Assay-Fusion. Die Überstände wurden aus der Co-Kultur bei 48 h nach der Fusion Induktion gesammelt und verwendet, um naiven Huh-7.5-Zellen für eine nachfolgende Luciferaseassays inokulieren. Beachtenswert ist, dass, wenn Huh-7.5 Replikon Zellen mit entweder fusioniertnaiv Zelllinien oder mit PBS als Kontrolle behandelt wurde keine Infektiosität in den Kultur Flüssigkeiten nachgewiesen werden. Allerdings, wenn Zellfusion zwischen Huh-7.5 Replikon und Verpackungs-Zelllinien durch PEG induziert wurde, rettete trans-Komplementierung zwischen Replikon und konstitutiv exprimiert Strukturproteine Virus-Produktion in den resultierenden Heterokaryons und infektiöser Viruspartikel wurden in die Kultur Flüssigkeiten freigesetzt. Wir daher der Schluss gezogen, dass Virus-Produktion erforderlich Zellfusion und Expression von viralen Proteinen in den Verpackungs-Zelllinien. Auffallend ist, dass nicht nur die Heterokaryons von Huh-7.5 menschlichen Hepatom-Zellen, sondern auch Heterokaryons mit menschlichen nicht-Leber (HeLa [CE1] [E2p7NS2]) und Leber der Maus (Hep56.1D [CE1] [E2p7NS2]) Zellen erlaubt Virusfreisetzung, darauf hinweist, dass der Montage-und Release sind nicht dominant gehemmt durch mögliche Einschränkung Faktoren in diesen Zelltypen. Expression von Strukturproteinen in Verpackungs-Zelllinien und authentischer Einstieg in Zielzellen wurde gezeigt Frentzen Et al. 15.
Ein alternatives Verfahren zur Zellfusion verwendet werden, um mögliche Beschränkungen bei der Eingabe in die Zelle, der RNA-Translation und RNA-Replikation Phasen des Replikationszyklus analysieren und auszuschließen, dass eine hohe virale Belastung im transfiziert Huh 7,5 Replikonzellen würde Nachweis von Restriktionsfaktoren durch Sättigung entgegen. Zu diesem Zweck entwickelten wir eine unabhängige Tests basierend auf Inokulation von Heterokaryons mit HCVcc und den Nachweis von De-novo-Virus-Produktion in diesen Zellen. Wie in 2A dargestellt, somatische Zellfusion wurde durch die Expression eines fusogenen Glykoprotein nach Ko-Kultivierung der Zellen induziert. Diese Methode wurde gewählt, weil die Empfindlichkeit wurde wahrscheinlich durch erhöhte Effizienz Fusion erhöht. Heterokaryons wurden durch Färbung separaten Zelllinien mit CellTracker Farbstoffe vor der Co-Kultivierung. Ein Heterokaryon mit homogen verteilten Farbstoffe innerhalb des Zytoplasmas zeigt Fusion von zwei Zelltypen zeigend in Abbildung 2B. Nur in Heterokaryons der Lunet N Zellen mit HeLa-Zellen oder Hep56.1D hCD81 Zellen werden alle HCV-Eintrag Faktoren, ausgedrückt durch den wahlweisen Heterokaryons empfänglich für HCV Eindringen in die Zelle. Challenge mit HCVcc führte zu einer vollständigen Replikation von HCV in Heterokaryons, die sich aus de novo Produktion von infektiösen viralen Nachkommen etwa 10-fach über dem Hintergrund des Assays (2C) ist. Als Kontrolle wurden Zellen mit N Lunet Lunet N Zellen fusioniert. Wichtig ist nur eine sehr geringe Menge an infektiösen HCV in der Nähe der Nachweisgrenze beobachtet. Ähnliche Ergebnisse wurden erhalten, wenn Lunet N Zellen mit naiven Hep56.1D Zellen fusioniert wurden. In beiden Fällen war die menschliche CD81 fehlt, so dass HCV konnte nicht produktiv infizieren die Heterokaryons. Dieser sehr niedrige Infektiosität bei diesen beiden Fällen detektiert ist wahrscheinlich auf niedrigen Infektion von Lunet N Zellen und / oder geringe Restaktivität infektiösen Virus Eingabe von dem Inokulum. Im Gegensatz HeLa-Zellen und Erp56.1D hCD81 menschlichen Zellen exprimieren CD81, und ergänzt damit das Eindringen in die Zelle fehlt Faktor in den Heterokaryons und erlauben HCV Eindringen in die Zelle. Der 10-fach erhöhtes Maß an infektiösen HCV im Medium der Heterokaryons mit diesen beiden Zelllinien nachgewiesen daher wahrscheinlich spiegelt De-novo-Produktion von infektiösen Partikeln in Heterokaryons. So schlossen wir, dass der Abschluss des HCV Replikationszyklus nicht ohne die Expression von dominant HCV Einschränkung Faktoren in diesen Zelllinien beschränkt.
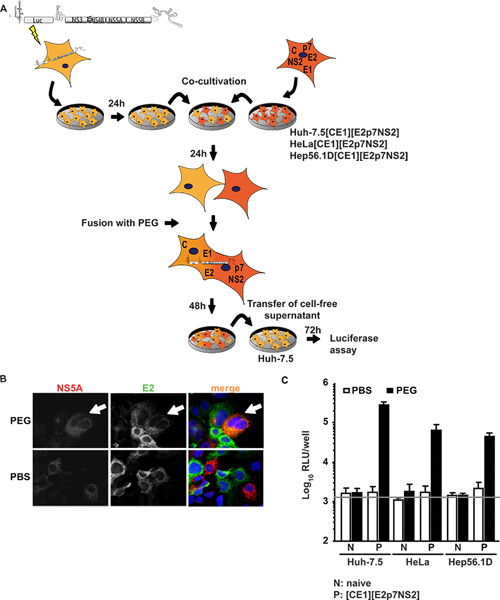
Abbildung 1. Trans-Komplementation von HCV-Montage und Freisetzung in Heterokaryons. (A) Schematische Darstellung des experimentellen Verfahren der PEG-vermittelte Zellfusion. Die Luciferase-Reporter-Replikon JFH1 Luc-NS3-5B wurde in naive Huh-7.5-Zellen durch Elektroporation transfiziert. Am nächsten Tag wurden die Zellen abgelöst und co-kultiviert mit naiven Zellen oder Verpackung Zellen, die konstitutiv HCV-Core-, E1, E2, p7 und NS2. 24 h nach der Co-Kultivierung wurde Heterokaryon-Bildung durch Behandlung mit 40% PEG unter Verwendung von PBS als negative Kontrolle induziert. Nach 48 h wurde zellfreier Überstand geerntet, um naive Huh-7.5-Zellen zu impfen. Infektiosität wurde durch Luciferase-Aktivität bestimmt. (B) zur Erkennung der Heterokaryons, wurden die Zellen immungefärbt mit monoklonalen Antikörpern gegen E2 und NS5A. Die gleichzeitige Expression beider Proteine in den Zellen anzeigt Zellfusion. (C) Luciferase-Messungen wurden durchgeführt, um die virale Infektiosität von Heterokaryons produzierten zu quantifizieren. Die Mittelwerte von drei unabhängigen Experimenten und die Standardabweichungen der Mittel gegeben werden. Der horizontale Balken stellt den Hintergrund RLU in nicht infizierten Huh-7.5-Zellen bestimmt. Klicken Sie hier für eine größere Abbildung anzuzeigen .
9/4029fig2.jpg "/>
Abbildung 2. Die Fertigstellung der HCV-Replikation Zyklus nach der Impfung von Heterokaryons. (A) Schematische Darstellung des experimentellen Verfahren. Huh-7 Zellen ohne N Lunet CD81 wurden mit den angegebenen Zelllinien fehlen oder die humanes CD81 co-kultiviert. Wichtig ist, fehlt diesen letzteren Zellen mindestens ein HCV-Eintrag Faktor und daher nicht produktiv infiziert werden. Am nächsten Tag wurde die Fusion durch Transfektion einer fusogenen viralen Hüllprotein von PFV eingeleitet. Dreißig Stunden später wurden die Zellen mit infektiöser HCV-Partikel in Frage gestellt. Zum Eindringen in die Zelle, RNA-Replikation und Virus-Produktion durch diese Heterokaryons nachhaltig zu messen, wurde freigelassen Infektiosität in den zellfreien Kultur Flüssigkeiten 48 h nach der Inokulation bestimmt. Zu diesem Zweck wurden naive Huh-7.5-Zellen als Zielzellen in einer Grenzverdünnung Assay (TCID 50) verwendet. (B) zur Erkennung der Heterokaryons, wurden die Zellen mit CellTracker Grün oder CellTracker Orange 6 h gefärbt vor Co-cultivation und Transfektion. Dreißig Stunden später wurden die Zellen fixiert und mit DAPI gefärbt. (C) Lunet N-Zellen wurden auf HeLa-Zellen, naiv oder Hep56.1D Hep56.1D Zellen, die menschliche CD81 fusioniert. Diese Kulturen wurden mit HCVcc (MOI von 2,3) inokuliert. Kultur Flüssigkeiten wurden 48 h später gesammelt und De-novo-Partikel-Freisetzung aus Heterokaryons wurde von TCID 50 ermittelt naiven Huh-7.5 Zielzellen. Die Mittelwerte von drei unabhängigen Experimenten angegeben. Der horizontale Balken repräsentiert die Nachweisgrenze des Assays. Klicken Sie hier für eine größere Abbildung anzuzeigen .
Access restricted. Please log in or start a trial to view this content.
Diskussion
Es werden zwei Verfahren zur Bildung Heterokaryon in kultivierten Zellen für die Analyse von dominant-negativen Einschränkungen, die HCV-Replikation entgegen zu induzieren. Mit diesen Verfahren haben wir das Vorhandensein einer dominanten konstitutiv exprimiert oder Virus-induzierte Faktor in verschiedenen humanen nicht-Leber und in Mäuseleber Zelllinien ausgeschlossen. Der erste Test in erster Linie analysiert, wenn Restriktionsfaktoren verhindern HCV Zusammenbau und die Freisetzung von infektiösen Nachkommen. Da i...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
TP erhielt Beratungshonorare von Biotest.
Danksagungen
Wir bedanken uns bei Takaji Wakita und Jens Bukh für JFH1 und J6CF Virusisolate wurde beobachtet. Weiterhin danken wir Charles Rice für Huh-7.5-Zellen und die Antikörper 9E10, Steven Foung für die E2-spezifischen Antikörper CBH-23, und alle Mitglieder der Abteilung für Experimentelle Virologie, Twincore für hilfreiche Anregungen und Diskussionen.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
| DMEM | Invitrogen, Karlsruhe, Deutschland | 41965-039 | |
| L-Glutamin | Invitrogen, Karlsruhe, Deutschland | 25030-024 | |
| Nicht-essentielle Aminosäuren | Invitrogen, Karlsruhe, Deutschland | 11140-035 | |
| Penicillin / Streptomycin | Invitrogen, Karlsruhe, Deutschland | 15140-122 | |
| Fötales Kälberserum | PAA, Cölbe, Deutschland | A15151 | |
| α-E2 (CBH23) | freundlicherweise von Steven Foung 10 vorgesehenen | ||
| ATP | Sigma, Steinheim, Deutschland | A2833-106 | |
| Glutathion | Sigma, Steinheim, Deutschland | G4251-1G | |
| Blasticidin | Invivo Gen, San Diego, USA | Ant-BL-1 | |
| G418 (Geneticin) | Invitrogen, Karlsruhe, Deutschland | 11811-064 | |
| Polyethylen-Glykol-1500 | Roche, Mannheim, Deutschland | 10783641001 | |
| Paraformaldehyd | Roth, Karlsruhe, Deutschland | 0.335,3 | |
| Triton X-100 | Roth, Karlsruhe, Deutschland | 3051,2 | |
| Ziegenserum | Sigma, Steinheim, Deutschland | G9023-5 ml | |
| α-NS5A (9E10) | Mit freundlicher Unterstützung von Charles Rice 7 vorgesehene | ||
| DAPI (4 ', 6'-Diamidino-2-phenylindoldihydrochlorid) | Invitrogen | D1306 | |
| Alexa-Fluor 546 - Ziege-Anti-Human-IgG | Invitrogen, Karlsruhe, Deutschland | A21089 | |
| Alexa-Fluor 488 - Ziege anti-Maus IgG | Invitrogen, Karlsruhe, Deutschland | A10680 | |
| Lipofectamine 2000 | Invitrogen, Karlsruhe, Deutschland | 11668-019 | |
| CellTracker CMTMR | Invitrogen, Karlsruhe, Deutschland | C2927 | |
| CellTracker CMFDA | Invitrogen, Karlsruhe, Deutschland | C2925 | |
| Fluoromount | Sigma, Steinheim, Deutschland | F4680-25ML | |
| Alle anderen Chemikalien | Roth, Karlsruhe, Deutschland | ||
| Zellkulturmaterialien | Sarstedt, Nümbrecht, Deutschland |
Referenzen
- Zhu, Q., Guo, J. T., Seeger, C. Replication of hepatitis C virus subgenomes in nonhepatic epithelial and mouse hepatoma cells. J. Virol. 77, 9204-9210 (2003).
- Kato, T. Nonhepatic cell lines HeLa and 293 support efficient replication of the hepatitis C virus genotype 2a subgenomic replicon. J. Virol. 79, 592-596 (2005).
- Ali, S., Pellerin, C., Lamarre, D., Kukolj, G. Hepatitis C virus subgenomic replicons in the human embryonic kidney 293 cell line. J. Virol. 78, 491-501 (2004).
- Date, T. Genotype 2a hepatitis C virus subgenomic replicon can replicate in HepG2 and IMY-N9 cells. J. Biol. Chem. 279, 22371-22376 (2004).
- Chang, K. S. Replication of hepatitis C virus (HCV) RNA in mouse embryonic fibroblasts: protein kinase R (PKR)-dependent and PKR-independent mechanisms for controlling HCV RNA replication and mediating interferon activities. J. Virol. 80, 7364-7374 (2006).
- Zhong, J. Robust hepatitis C virus infection in vitro. Proc. Natl. Acad. Sci. U.S.A. 102, 9294-9299 (2005).
- Lindenbach, B. D. Complete replication of hepatitis C virus in cell culture. Science. 309, 623-626 (2005).
- Wakita, T. Production of infectious hepatitis C virus in tissue culture from a cloned viral genome. Nat. Med. 11, 791-796 (2005).
- Witteveldt, J. CD81 is dispensable for hepatitis C virus cell-to-cell transmission in hepatoma cells. J. Gen. Virol. 90, 48-58 (2009).
- Bitzegeio, J. Adaptation of hepatitis C virus to mouse CD81 permits infection of mouse cells in the absence of human entry factors. PLoS Pathog. 6, e1000978(2010).
- Lindemann, D., Goepfert, P. A. The foamy virus envelope glycoproteins. Curr Top Microbiol Immunol. 277, 111-129 (2003).
- Brohm, C. Characterization of determinants important for hepatitis C virus p7 function in morphogenesis by using trans-complementation. J. Virol. 83, 11682-11693 (2009).
- Steinmann, E., Brohm, C., Kallis, S., Bartenschlager, R., Pietschmann, T. Efficient trans-encapsidation of hepatitis C virus RNAs into infectious virus-like particles. J. Virol. 82, 7034-7046 (2008).
- Koutsoudakis, G. Characterization of the early steps of hepatitis C virus infection by using luciferase reporter viruses. J. Virol. 80, 5308-5320 (2006).
- Frentzen, A. Completion of hepatitis C virus replication cycle in heterokaryons excludes dominant restrictions in human non-liver and mouse liver cell lines. PLoS Pathog. 7, e1002029(2011).
- Lindemann, D. A particle-associated glycoprotein signal peptide essential for virus maturation and infectivity. J. Virol. 75, 5762-5771 (2001).
- Blight, K. J., McKeating, J. A., Rice, C. M. Highly permissive cell lines for subgenomic and genomic hepatitis C virus RNA replication. J. Virol. 76, 13001-13014 (2002).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten